HPV感染与宫颈病变患者免疫调节失衡及细胞异常增殖状态的相关性
侯 颖, 李艳梅, 李秀兰, 刘 青
(首都医科大学附属北京佑安医院妇科, 北京 100069)
人乳头瘤病毒(Human papillomavirus,HPV)是一种引起皮肤和黏膜上皮增生的病毒,其主要症状包括寻常疣和生殖器疣[1]。宫颈病变是宫颈区域出现的炎症、损伤和肿瘤等病变[2]。HPV持续感染与宫颈病变的发生和发展密切相关,因为相关基因产物会干扰细胞周期的正常调节,导致细胞不断增殖,可能导致病情恶化。此外,不同类型的HPV具有不同的危险程度和危害程度。目前研究发现宫颈病变发生的直接原因是HPV导致机体免疫调节紊乱及细胞异常增殖[3],通过改变宫颈组织的免疫环境,刺激细胞无限增殖,但具体机制尚未明确。故本研究探讨HPV感染与宫颈病变患者免疫调节失衡及细胞异常增殖状态的关系,旨在了解该病患者机体免疫调节及细胞功能变化,为宫颈病变的临床治疗提供有效的理论依据。
1 资料与方法
1.1一般资料:选取2020年1月至2022年4月在我院治疗的高危HPV感染宫颈病变患者56例(高危HPV组,高危HPV指HPV16、18、31、33、35、39、45、51、52、56、58、59、68型等),低危HPV感染宫颈病变患者51例(低危HPV组,低危HPV指HPV6、11、40、42、43、44、54、61、72、81、89型等),HPV阴性宫颈病变患者57例(HPV阴性组),纳入标准:①宫颈病变均经病理学确诊CINⅠ级病变及以上;②既往无宫颈治疗史;③初次就诊者;④患者及家属知情同意。排除标准:①合并有其他系统恶性肿瘤者、肝肾功能障碍、自身免疫系统疾病等其他严重疾病;②近3个月有全身感染性疾病者。同时选取健康体检女性60例(正常组),纳入标准:①无宫颈病变及宫颈治疗史;②受试者知情同意。排除标准:①合并有其他系统恶性肿瘤者、肝肾功能障碍、自身免疫系统疾病等其他严重疾病;②近3个月有全身感染性疾病者。各组受试者临床一般资料比较见表1,具有可比性。
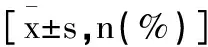
表1 各组临床一般资料比较
1.2检查方法
1.2.1外周血免疫指标检测:入院后采集患者外周空腹静脉血10mL 2管,1管1000×g离心10min,取上层血清,-20℃冰箱保存,采用免疫浊度法检测IgA、IgG、IgM水平(试剂盒购自武汉塞维尔生物科技公司)。另1管采用BD FACSCelestaTM流式细胞仪检测外周血CD3+、CD4+、CD8+百分比。
1.2.2细胞因子检测:入组即刻,获取患者宫颈组织标本,碾磨后加入PBS液、1000×g离心10min,取上清液,酶联免疫法检测外周血细胞因子IL-2、IL-4、IL-17、TGF-β水平(试剂盒选自上海森雄科技实业有限公司)。
1.2.3免疫组织化学法检测:检查或术后,采集病变组织标本,甲醛固定,石蜡包埋后制作切片,进行p16、Ki67染色,免疫组织化学染色采用SP法处理。
1.2.4增殖基因表达量检测:检查中采取可疑病灶区域宫颈组织标本,应用荧光定量PCR法检测并计算增殖相关基因Prdx4和STAT3mRNA表达量。(选自美国Sigma公司试剂盒)。
2 结 果
2.1各组细胞和体液免疫指标比较:高危HPV组、低危HPV组CD4+细胞、IgG和IgA明显低于HPV阴性组和正常组(P<0.05),且高危HPV组CD4+细胞、IgG和IgA明显低于低危HPV组(P<0.05);高危HPV组、低危HPV组、HPV阴性组和正常组CD3+细胞、CD8+细胞、IgM比较差异无统计学意义(P>0.05)。见表2。

表2 各组细胞和体液免疫指标比较
2.2各组细胞因子比较:高危HPV组、低危HPV组IL-2明显低于HPV阴性组和正常组(P<0.05),且高危HPV组IL-2明显低于低危HPV组(P<0.05);高危HPV组、低危HPV组IL-4、IL-17和TGF-β明显高于HPV阴性组和正常组(P<0.05),且高危HPV组IL-4、IL-17和TGF-β明显高于低危HPV组(P<0.05)。见表3。

表3 各组细胞因子比较
2.3各组p16、Ki67蛋白阳性率比较:高危HPV组、低危HPV组p16、Ki67蛋白阳性表达率明显高于HPV阴性组和正常组(P<0.05);HPV阴性组p16、Ki67蛋白阳性表达率明显高于正常组(P<0.05);高危HPV组和低危HPV组p16、Ki67蛋白阳性表达率比较差异无统计学意义(P>0.05)。见表4。

表4 各组p16 Ki67蛋白阳性表达率比较n(%)
2.4各组Prdx4、STAT3mRNA表达比较:高危HPV组、低危HPV组Prdx4和STAT3mRNA相对表达量明显高于HPV阴性组和正常组(P<0.05),且高危HPV组Prdx4和STAT3mRNA相对表达量明显高于低危HPV组(P<0.05)。见表5。

表5 各组Prdx4和STAT3mRNA相对表达量比较
3 讨 论
HPV是宫颈病变的主要病因[4]。HPV可在85%~95%的宫颈癌患者癌组织中检出[5]。其机制为HPV通过黏膜感染靶细胞,紊乱正常细胞周期,促使病变组织形成[6]。
T淋巴细胞介导的细胞免疫反应能使肿瘤细胞增值、控制肿瘤生长受到抑制。其中CD4+T淋巴细胞能识别抗原、激活免疫细胞及生成抗体抵抗肿瘤生长,并与CD8+T细胞协同参与机体免疫调节[7]。T细胞代表机体免疫总水平,且外周血和宫颈局部免疫情况一致。本研究结果表示,宫颈病变患者感染HPV后,CD8+无显著变化,但CD4+明显降低,与既往研究[8]报道相似,说明患者T细胞的辅助及诱导功能下降,增强抑制和杀伤作用并使细胞免疫功能造成损伤,导致患者感染程度加深。且CD4+随着HPV持续感染进一步降低,加重细胞免疫功能损伤。可能机制为:①HPV的早期蛋白过度参与机体局部免疫调节作用,进而导致免疫识别和清除功能降低;②感染过程中CD4+T细胞减少,抑制了机体抗肿瘤免疫作用,使宫颈组织局部免疫微环境失调[9,10]。
本实验结果表明HPV阳性宫颈病变患者血液IgG、IgA浓度比HPV阴性和对照组明显降低,高危感染者两项指标降低更明显,说明患者感染HPV后体液免疫功能受损,无法产生足量中和抗体将病毒清除,最终造成感染及宫颈病变发生。
IL-2由Th1分泌,主要参与细胞免疫;IL-4、IL-17由Th2分泌,主要参与体液免疫,IFN-β激活协调机体免疫系统,调控Th1/Th2平衡[11]。三者密切配合调控机体免疫功能。本实验中高危HPV组、低危HPV组IL-2明显低于HPV阴性组和正常组(P<0.05),说明患者机体Th1型细胞功能受到抑制,高危HPV组、低危HPV组IL-4、IL-17和TGF-β明显高于HPV阴性组和正常组(P<0.05),机体Th2型细胞过度兴奋,Th1/Th2失衡,免疫功能紊乱。本研究指出,持续感染增加紊乱程度。说明上述细胞功能增强与宫颈病变密切相关,且高危型HPV感染可此病变加剧、促进宫颈组织恶变产生。
p16可调控细胞周期,常见于恶性病变的分子事件。正常上皮细胞内p16表达水平极低,但病变组织中p16显著表达。本研究中高危HPV组、低危HPV组p16、Ki67蛋白阳性表达率明显高于HPV阴性组和正常组(P<0.05);HPV阴性组p16、Ki67蛋白阳性表达率明显高于正常组(P<0.05);佐证了上述观点故推测在p16高表达可促使宫颈病变。Ki67调控细胞周期蛋白,但其作用机制尚未明确,但已证实Ki67是病变细胞主要的增殖标志物。Ki67只在病变上皮细胞中增强表达。本研究中宫颈病变患者p16、Ki67蛋白呈高表达,且与患者HPV感染明显相关。说明Ki67参与了宫颈病变的发生与发展,且患者感染HPV风险随着p16、Ki67蛋白表达升高而增加,故可将p16、Ki67蛋白的动态监测结果作为宫颈病变的生物学检测指标。
免疫环境改变能使宫颈细胞增殖活性受到影响,衡量细胞恶变风险的重要方法是检测相关基因具体表达量。氧化应激诱导的Prdx4增加可导致细胞免于凋亡并促使肿瘤发生。STAT3mRNA可调控细胞增殖、分化等基因表达并参与恶性肿瘤的进展,其高表达能使细胞增殖并阻碍细胞凋亡。本次研究结果表示:与低危型HPV感染组及正常对照组比较,高危HPV组、低危HPV组Prdx4和STAT3mRNA相对表达量明显高于HPV阴性组和正常组(P<0.05),且高危HPV组Prdx4和STAT3mRNA相对表达量明显高于低危HPV组(P<0.05)。证实HPV感染显著增加宫颈细胞增殖活力,且随着病变程度与恶性程度呈逐渐增强,甚至导致肿瘤的发生。
综上所述:HPV感染加重宫颈病变患者免疫调节失衡,促进宫颈细胞异常增殖,尤其在高危型HPV感染中,上述作用更加明显。本实验存在不足:本研究仅探讨了HPV感染组免疫功能变化,未进一步将HPV感染类型的免疫功能变化进行分析,且相关机制还需进一步临床研究。

