叶酸缺乏对脑梗死责任病灶分布特征影响
余爱勇,彭亮
·论 著·
叶酸缺乏对脑梗死责任病灶分布特征影响
余爱勇1,彭亮2
1.上海市松江区中心医院[上海交通大学医学院附属松江医院(筹)]神经内科,上海 201699;2.上海市松江区中心医院[上海交通大学医学院附属松江医院(筹)]检验科,上海 201699
研究叶酸水平降低合并脑梗死患者颅内梗死灶分布特征。选取2018年10月至2022年7月在上海市松江区中心医院住院的脑梗死患者336例作为研究对象,根据叶酸水平分为叶酸降低组(=165)和叶酸正常组(=171)。比较两组患者实验室检查指标水平和脑梗死病灶分布的特点。与叶酸正常组相比,叶酸降低组的同型半胱氨酸(homocysteine,Hcy)和游离甲状腺素(free thyroxine,FT4)水平均显著升高(<0.05),分布于岛叶和放射冠的脑梗死病灶数量均显著增加(<0.05)。两组分布于其他部位的脑梗死病灶数量比较,差异均无统计学意义(>0.05)。经二元非条件Logistic回归分析,分布于岛叶和放射冠的梗死灶是叶酸降低的影响因素(<0.05)。叶酸水平降低对脑梗死病灶的分布可能存在影响,责任病灶主要集中在岛叶和放射冠。
叶酸;脑梗死;岛叶;放射冠;病变部位
叶酸通过叶酸转运系统运送至脑组织发挥作用[1]。脑部叶酸缺乏与癫痫、发育迟缓、进行性共济失调、舞蹈手足徐动症有关[2]。有研究从线粒体角度证实叶酸缺乏会对急性缺血性卒中产生有害影响[3]。但目前对于叶酸缺乏的研究大多数集中在补充叶酸治疗或基因方面,以及叶酸与癌症、精神疾病的关系等,被研究群体集中于孕妇和儿童,与成人脑梗死关联的临床研究较少。本研究旨在揭示叶酸水平降低合并脑梗死患者的梗死灶分布部位是否具有特征。
1 资料与方法
1.1 一般资料
选取2018年10月至2022年7月在上海市松江区中心医院住院的脑梗死患者336例作为研究对象,根据叶酸水平(正常参考值:3.10~34.00ng/ml)分为叶酸降低组(<3.10ng/ml,=165)和叶酸正常组(≥3.10ng/ml,=171)。纳入标准:①患者均同时合并有脑梗死急性期入院;②符合《中国急性缺血性脑卒中诊治指南2018》[4]中的脑血管病诊断;③首次罹患脑梗死;④平时未服用抗血小板药物和降脂类药物;⑤年龄>18岁。排除标准:①正在服用叶酸者;②合并贫血、炎性肠病、恶性肿瘤或血液肿瘤指标显著升高者;③弥散加权成像(diffusion weighted imaging,DWI)阴性的脑梗死患者;④接受血管内治疗(溶栓或取栓)者。脱落标准:①意识障碍或失语,无法签订知情同意书者;②各种原因导致无法完成头颅磁共振者。叶酸降低组中,男94例,女71例,平均年龄(71.30±11.72)岁。平均叶酸水平(2.19±0.62)ng/ml。叶酸正常组中,男99例,女72例,平均年龄(75.30±13.01)岁,平均叶酸水平(10.25±6.24)ng/ml。本研究经上海市松江区中心医院伦理委员会批准同意(伦理审批号:2018审085),所有患者签署知情同意书。
1.2 方法
1.2.1 资料收集 记录患者的性别、年龄,测量患者身高、体质量,计算体质量指数(body mass index,BMI)。入院后连续3d测量血压3次,计算收缩压和舒张压的平均值。通过问卷调查形式获得患者嗜烟史,必须符合以下条件:一生中吸烟>400支。根据目前是否吸烟分为两种情况:①对“你现在抽烟吗?”的问题给出了肯定的回答,被归类为“当前吸烟者”。②不再吸烟者,被归类为“前吸烟者”[5]。以健康访谈问卷形式获得饮酒史,轻度饮酒者:3杯/周;适度饮酒者:女性4~7杯/周,男性4~14杯/周;酗酒者:女性8~27杯/周,男性15~34杯/周。严重酗酒者:女性超过28杯/周,男性超过35杯/周。一生不饮酒或<20次饮酒为戒酒者[6]。
1.2.2 实验室检查 采用全自动生化分析仪(日本日立公司,型号:7600-020)测定两组患者的血糖(blood glucose,BG)、总胆固醇(total cholesterol,TC)、三酰甘油(triglyceride,TG)、高密度脂蛋白胆固醇(high density lipoprotein-cholesterol,HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein-cholesterol,LDL-C)。采用离子交换高效液相色谱法,全自动糖化血红蛋白分析仪(深圳市希莱恒医用电子有限公司,型号:H600)测定糖化血红蛋白(glycated hemoglobin,HbA1c)。使用迈瑞BS-2000M全自动生化分析,应用循环酶法测定同型半胱氨酸(homocysteine,Hcy)。应用罗氏cobas生化免疫分析仪,采用电化学发光法检测游离三碘甲腺原氨酸(free triiodothyronine,FT3)、游离甲状腺素(free thyroxine,FT4)、促甲状腺激素(thyroid- stimulating hormone,TSH)。采用电化学发光法,应用罗氏cobas e602免疫分析仪测定叶酸水平。采用全自动生化分析仪(山东博科生物产业有限公司,型号:BK600)检测尿素氮(urea,UN)、肌酐(creatinine,Cr)和尿酸(uric acid,UA)。
1.2.3 影像学检查 所有患者仰卧位,采用头颈联合线圈,行头颅磁共振扫描。1.5T双梯度磁共振(美国通用电气公司,型号:GE-SIGNA EXCITE-HD 1.5T)。矢状面扫描行FRFSE序列T1WI成像,设置层厚为6mm,间隔1mm。横断面扫描行SE序列T1WI,FRFSE序列T2WI、FRFSE序列T2FLAIR及DWI成像,设置层厚为7mm、间隔1mm。
1.3 统计学方法
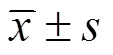
2 结果
2.1 临床基线资料比较
与叶酸正常组相比,叶酸降低组的Hcy和FT4水平显著升高(<0.05)。两组患者的人口学资料、嗜烟史、嗜酒史、血压、其余血液学指标相比,差异均无统计学意义(>0.05),见表1。
2.2 脑梗死发生部位病灶数量比较
与叶酸正常组相比,叶酸降低组患者分布于岛叶和放射冠的脑梗死病灶数量均显著增加(<0.05)。两组分布于其他部位的脑梗死病灶数量比较,差异均无统计学意义(>0.05),见表2。
2.3 叶酸降低合并脑梗死患者影响因素分析
将叶酸降低设为因变量,将FT4、Hcy、分布于岛叶的脑梗死灶和放射冠的脑梗死灶设为自变量(“无”赋值为0,“有”赋值为1;正常参考值范围内赋值为0,高于正常参考值赋值为1)。二分类非条件Logistic回归分析显示,分布于脑叶和放射冠的梗死灶是叶酸降低的影响因素(<0.05),见表3。
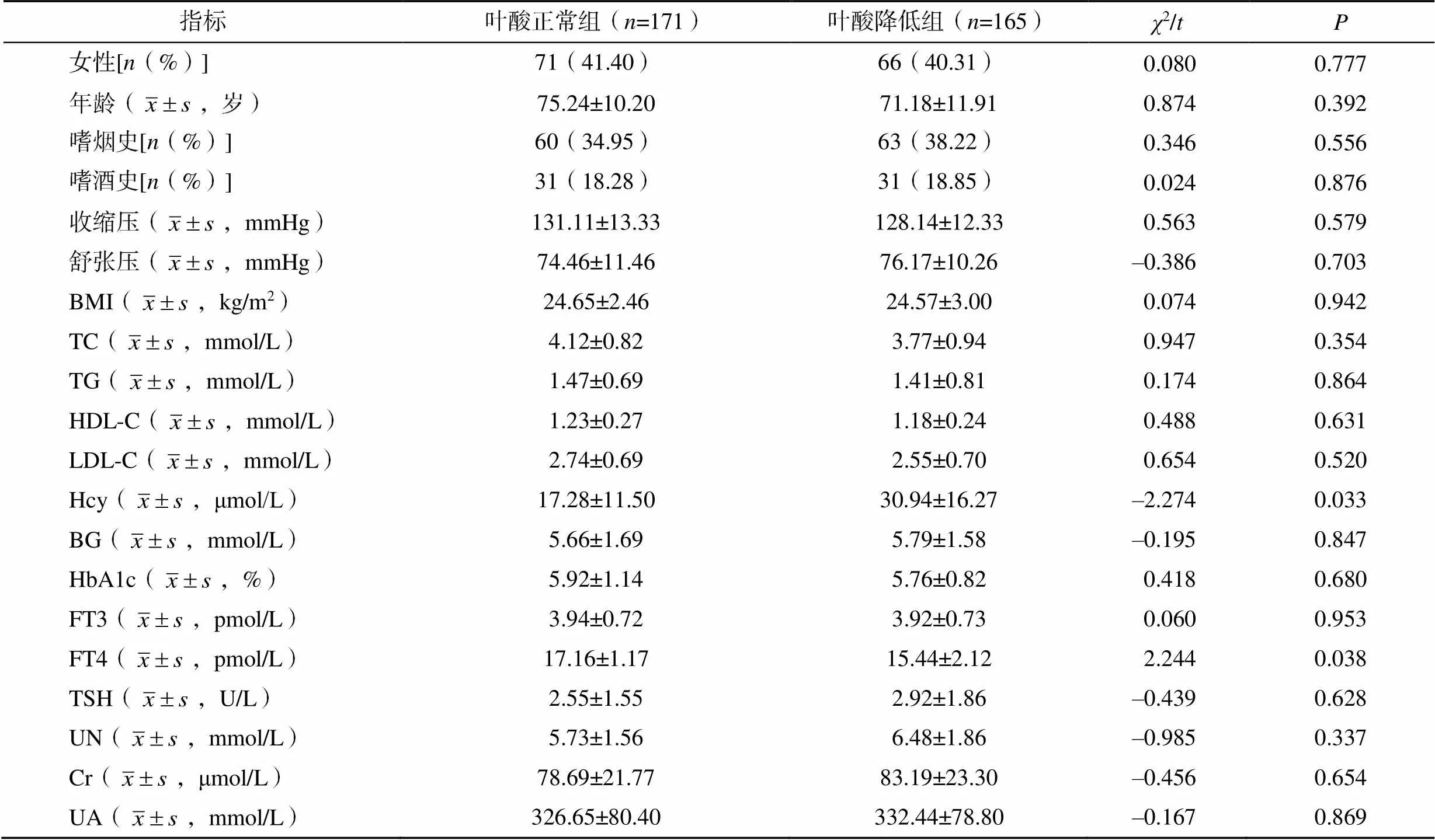
表1 两组患者临床基线资料比较
注:1mmHg=0.133kPa

表2 两组患者脑梗死发生部位病灶数量比较[n(%)]

表3 叶酸降低合并脑梗死患者影响因素分析
3 讨论
叶酸能够激活一碳单元,用于嘌呤和蛋氨酸的生物合成。相关研究显示,叶酸缺乏与缺血性卒中有密切关联,在体外可发挥缺血后神经保护作用[7],γ-氨基丁酸、赖氨酸、谷氨酸、核糖、缬氨酸等代谢均受叶酸调控,可能是叶酸对抗缺血性卒中的靶点[8],加用叶酸治疗可提高高血压患者终生无卒中生存率[9]。叶酸降低会导致视网膜静脉阻塞[10],叶酸代谢酶缺乏会影响大鼠脑梗死后恢复[11]。
本研究结果显示,叶酸降低组的Hcy水平显著高于叶酸正常组,Lydia等[12]研究显示叶酸与Hcy水平呈显著负相关,本研究结果与其相符。究其原因,叶酸缺乏时,蛋氨酸循环途径受损,引起高同型半胱氨酸血症,后者诱导血管内皮细胞功能障碍,促进了叶酸降低脑梗死的发生和发展。本研究中叶酸降低组患者的脑梗死责任病灶多分布于岛叶和放射冠,即病灶大部分集中在大脑皮质或皮质下。Zhao等[13]发现,叶酸缺乏可加重大鼠缺血再灌注损伤、升高DNA氧化应激标志物水平,这些均是发生在大脑皮质中。Kobayashi等[14]报道了1例脑叶酸缺乏症婴儿出现了皮质髓鞘不足,大脑皮质萎缩。Sato等[15]随访1名低叶酸血症女性患者,分别发现了右枕叶皮质脑梗死、右顶枕皮质脑梗死、术中额叶皮质脑梗死。孕期补充叶酸者的额叶和颞叶皮质厚度增加,颞顶叶皮质延迟变薄[16]。Abd-Ellah等[17]发现叶酸对大鼠大脑皮质神经毒性有保护作用,可以保护乙醇诱导的大鼠脑皮质神经元凋亡[18]。上述研究均认为叶酸缺乏可对大脑皮质、皮质下造成显著影响,与本研究结果一致。但目前其发生机制仍然不明,推测可能与皮质神经元代谢活跃有关。
本研究结果显示,叶酸降低组患者分布在基底节、脑干、小脑的病灶数目与叶酸正常组相比,差异无统计学意义。但是有研究在脑叶酸缺乏症婴儿和男孩病例中均发现了小脑萎缩[14,19]。Koohpeyma等[20]发现在新生大鼠中提高叶酸水平可以降低小脑谷胱甘肽过氧化物酶活性,减缓小脑脂质过氧化,减轻共济失调。本次被研究对象是成年人,而前文的研究对象是处于脑发育期的婴儿、儿童和新生大鼠,这可能是导致研究结果不一的原因之一。本研究结果显示,叶酸降低组患者的Hcy和FT4水平均显著高于叶酸正常组。Barjaktarovic等[21]发现,新生儿和母亲体内FT4与Hcy水平呈正相关,推测甲状腺激素可能通过刺激维生素B12和叶酸来干扰Hcy代谢,还有研究发现高同型半胱氨酸血症和轻度叶酸降低的狗可伴随着甲状腺功能减退[22],提示甲状腺激素可能与叶酸代谢有关。
综合上述,叶酸缺乏可导致FT4、Hcy水平升高,参与脑梗死的发生、发展,对脑梗死病灶的分布可能存在影响,责任病灶主要集中在岛叶和放射冠区。但本研究尚存在局限性,有研究显示叶酸缺乏可引起海马部位的神经元凋亡[23],但本研究未对海马病变展开探讨,未来应进一步深入。
[1] ALAM C, KONDO M, O’CONNOR D L, et al. Clinical implications of folate transport in the central nervous system[J]. Trends Pharmacol Sci, 2020, 41(5): 349–361.
[2] POPE S, ARTUCH R, HEALES S, et al. Cerebral folate deficiency: analytical tests and differential diagnosis[J]. J Inherit Metab Dis, 2019, 42(4): 655–672.
[3] DONG Z, LIANG X, ZHANG Q, et al. Folic acid deficiency enhances the Tyr705 and Ser727 phosphorylation of mitochondrial STAT3 in in vivo and in vitro models of ischemic stroke[J]. Transl Stroke Res, 2021, 12(5): 829–843.
[4] 中华医学会神经病学分会, 中华医学会神经病学分会脑血管病学组. 中国急性缺血性脑卒中诊治指南2018[J]. 中华神经科杂志, 2018, 51(9): 666–682.
[5] KAMIMURA D, CAIN L R, MENTZ R J, et al. Cigarette smoking and incident heart failure: insights from the jackson heart study[J]. Circulation, 2018, 137(24): 2572–2582.
[6] JEON C Y, WHITCOMB D C, SLIVKA A, et al. Lifetime drinking history of persons with chronic pancreatitis[J]. Alcohol Alcohol, 2019, 54(6): 615–624.
[7] DAVIS C K, NAMPOOTHIRI S S, RAJANIKANT G K. Folic acid exerts post-ischemic neuroprotection in vitro through HIF-1α stabilization[J]. Mol Neurobiol, 2018, 55(11): 8328–8345.
[8] YANG Y H, LEI L, BAO Y P, et al. An integrated metabolomic screening platform discovers the potential biomarkers of ischemic stroke and reveals the protective effect and mechanism of folic acid[J]. Front Mol Biosci, 2022, 9(5): 783793.
[9] ZHANG T, LIN T, WANG Y, et al. Estimated stroke-free survival of folic acid therapy for hypertensive adults: projection based on the CSPPT[J]. Hypertension, 2020, 75(2): 339–346.
[10] KAZANTZIS D, THEODOSSIADIS P, KROUPIS C, et al. Vitamin B12 and folate as risk factors for retinal vein occlusion: a meta-analysis[J]. Klin Monbl Augenheilkd, 2022, 239(5): 709–716.
[11] JADAVJI N M, EMMERSON J T, SHANMUGALINGAM U, et al. A genetic deficiency in folic acid metabolism impairs recovery after ischemic stroke[J]. Exp Neurol, 2018, 309(11): 14–22.
[12] LYDIA A, PRIANTONO D, HARIMURTI K, et al. The relationship between folic acid and vitamin B12 serum levels with high sensitivity C-reactive protein and homocysteine in chronic hemodialysis patients: a cross-sectional study[J]. Acta Med Indones, 2021, 53(3): 282–290.
[13] ZHAO Y, HUANG G, CHEN S, et al. Folic acid deficiency increases brain cell injury via autophagy enhancement after focal cerebral ischemia[J]. J Nutr Biochem, 2016, 38(12): 41–49.
[14] KOBAYASHI Y, TOHYAMA J, AKIYAMA T, et al. Severe leukoencephalopathy with cortical involvement and peripheral neuropathy due to FOLR1 deficiency[J]. Brain Dev, 2017, 39(3): 266–270.
[15] SATO K, MOROFUJI Y, HORIE N, et al. Hyperhomocysteinemia causes severe intraoperative thrombotic tendency in superficial temporal artery- middle cerebral artery bypass[J]. J Stroke Cerebrovasc Dis, 2020, 29(5): 104633.
[16] ERYILMAZ H, DOWLING K F, HUNTINGTON F C, et al. Association of prenatal exposure to population- wide folic acid fortification with altered cerebral cortex maturation in youths[J]. JAMA Psychiatry, 2018, 75(9): 918–928.
[17] ABD-ELLAH H F, ABOU-ZEID N R A, NASR N M, et al. The possible protective effect of N-acetyl-L-cysteine and folic acid in combination against aspartame-induced cerebral cortex neurotoxicity in adult male rats: a light and transmission electron microscopic study[J]. Ultrastruct Pathol, 2018, 42(3): 228–245.
[18] SOGUT I, UYSAL O, OGLAKCI A, et al. Prenatal alcohol-induced neuroapoptosis in rat brain cerebral cortex: protective effect of folic acid and betaine[J]. Childs Nerv Syst, 2017, 33(3): 407–417.
[19] TOELLE S P, WILLE D, SCHMITT B, et al. Sensory stimulus-sensitive drop attacks and basal ganglia calcification: new findings in a patient with FOLR1 deficiency[J]. Epileptic Disord, 2014, 16(1): 88–92.
[20] KOOHPEYMA H, GOUDARZI I, ELAHDADI S M, et al. Postnatal administration of homocysteine induces cerebellar damage in rats: protective effect of folic acid[J]. Neurotox Res, 2019, 35(3): 724–738.
[21] BARJAKTAROVIC M, STEEGERS E A P, JADDOE V W V, et al. The association of thyroid function with maternal and neonatal homocysteine concentrations[J]. J Clin Endocrinol Metab, 2017, 102(12): 4548–4556.
[22] GOŁYŃSKI M, LUTNICKI K, KRUMRYCH W, et al. Relationship between total homocysteine, folic acid, and thyroid hormones in hypothyroid dogs[J]. J Vet Intern Med, 2017, 31(5): 1403–1405.
[23] YANG Y, LI X, SUN Q W, et al. Folate deprivation induces cell cycle arrest at G0/G1 phase and apoptosis in hippocampal neuron cells through down-regulation of IGF-1 signaling pathway[J]. Int J Biochem Cell Biol, 2016, 79(10): 222–230.
Effect of folic acid deficiency on the distribution of responsible lesions in cerebral infarction
YU Aiyong, PENG Liang
1.Department of Neurology, Shanghai Songjiang District Central Hospital[Songjiang Hospital Affiliated to Shanghai Jiaotong University School of Medicine (Preparatory Stage)], Shanghai 201699,China; 2.Department of Laboratory, Shanghai Songjiang District Central Hospital[Songjiang Hospital Affiliated to Shanghai Jiaotong University School of Medicine (Preparatory Stage)], Shanghai 201699, China
To study the characteristics of intracranial lesions in patients with reduced folic acid levels and cerebral infarction.A total of 336 patients with cerebral infarction who were hospitalized at Shanghai Songjiang District Central Hospital from October 2018 to July 2022 were selected and divided into a reduced folic acid group (=165), and a normal folic acid group (=171) based on their folic acid levels. The characteristics of laboratory examination and distribution of cerebral infarction lesions were compared between the two groups.Compared with the folic acid normal group, the folic acid reduced group had significantly higher homocysteine (Hcy) and free thyroxine (FT4) levels (<0.05), and the number of cerebral infarct foci distributed in the insula and radiocorona were significantly increased (<0.05). Compared with the number of cerebral infarction lesions distributed in other parts of the brain in both groups, the difference was not statistically significant (>0.05). According to binary unconditional Logistic regression analysis, the infarct foci distributed in the insula and corona radiata were the influencing factors for folic acid reduction (<0.05).The decrease in folic acid levels may have an impact on the distribution of cerebral infarction lesions, with the responsible lesions mainly concentrated in the insula and coronal radiation.
Folic acid; Cerebral infarction; Insula; Coronal radiation; Lesion
R587.1
A
10.3969/j.issn.1673-9701.2023.23.005
上海市松江区科学技术攻关项目(22SJKJGG74)
彭亮,电子信箱:jykmianyi@163.com
(2022–09–05)
(2023–07–13)

