急性胰腺炎并发腹腔感染病原菌分布及其影响因素分析
王梦琴, 王 聪, 刘 肖, 田发明
1.首都医科大学附属北京积水潭医院 急诊科,北京 100035;2.华北理工大学公共卫生学院,河北 唐山 063210
急性胰腺炎(acute pancreatitis,AP)为临床常见急腹症,病情复杂多变[1]。重症AP患者常并发多种感染,感染发生率约40%~70%,由其所致的病死率高达50%[2]。有研究报道,AP发病期间,过量胰酶进入肠道损伤肠屏障,增加胃肠细菌位移能力,加之AP患者胰腺炎症反应导致周围组织损伤、坏死、出血等,引发腹腔积液,增加腹腔感染风险,AP并发腹腔感染是导致患者多器官功能障碍及死亡的主要原因[3-4]。目前,临床对AP并发腹腔感染的治疗尚无有效方案,早期预防控制感染风险尤为关键。有研究报道,AP并发感染与患者免疫系统紊乱有关[5-6],但关于AP与免疫相关因子间的关系尚不明确。自然杀伤细胞(natural killer cell,NK)是临床评估机体细胞免疫功能的常用指标,NK细胞参与感染性疾病的发生发展[7]。CD226分子为免疫球蛋白超家族成员之一,可介导机体自身免疫性疾病,在感染、创伤性疾病中发挥重要作用,免疫酪氨酸样抑制基序(T cell immunoglobulin and ITIM domain,TIGIT)是新发现的一种有免疫抑制作用的协同刺激分子,血小板/T细胞活化抗原1(CD226)与TIGIT相互作用影响机体T细胞功能[8-9]。国内对于AP患者并发感染的临床特点与病原菌及其NK细胞、TIGIT/CD226基因表达情况尚无统一定论。本研究旨在探讨AP并发腹腔感染病原菌分布及其影响因素,为该疾病的防治寻找新的可能性靶标。现报道如下。
1 对象与方法
1.1 研究对象 选取自2019年2月至2021年2月北京积水潭医院收治的90例AP患者为研究对象。AP符合《急性胰腺炎诊治指南》[10]诊断标准。纳入标准:发病至入院时间<24 h。排除标准:合并其他类型急腹症;合并恶性肿瘤、自身免疫性疾病、感染性疾病;伴全身炎症反应综合征或全身凝血功能障碍;长期使用激素类药物或免疫抑制剂类药物等;处于妊娠期或哺乳期女性;合并严重心脑血管疾病;艾滋病或骨髓移植等免疫功能障碍。90例AP患者中,男性49例,女性41例;年龄23~74岁,平均年龄(49.34±11.34)岁;体质量指数(body mass index,BMI)21~27 kg/m2,平均(24.31±2.11)kg/m2。根据AP患者有无腹腔感染将其分为感染组(n=29)与无感染组(n=61)。本研究经医院伦理委员会批准。所有研究对象或家属均知情同意。
1.2 研究方法 (1)感染标准:CT检查发现胰腺病灶区或胰腺内存在气泡,腹腔脓液病原菌培养结果提示阳性为腹腔感染[11]。(2)病原菌培养:采集患者腹腔液体10 ml,置于血培养瓶内,专用增菌液培养,全自动培养仪内常规培养,培养过程严格遵循仪器说明书,应用phoenix100型全自动微生物分析仪(美国BD公司)进行病原菌培养。通过Vitek Ams System微生物自动鉴定系统(法国生物梅里埃公司)及试剂鉴定病原菌分类,应用纸片扩散法进行药敏试验。(3)临床资料:收集患者性别、年龄、BMI、病因、禁食时间、机械通气、多器官功能障碍综合征、入院时急性生理学与慢性健康状况评分Ⅱ(acute physiology and chronic health status score Ⅱ,APACHEⅡ)、糖尿病史、高血压病史、低氧血症等资料。(4)外周血NK细胞总量及TIGIT/CD226基因表达:采集患者外周血适量,应用贝克曼库尔特公司提供流式细胞仪检测外周血NK细胞总量;采集患者外周血,2 ml中加10 pμl异硫氢酸荧光素标记TIGIT、CD36抗体(由荷兰SANQUIN公司提供),静置15 min后加2 ml溶解反应物裂解红细胞,离心7 min,静置15 min后以裂解细胞沉淀和分离,分离后液体以2 ml磷酸盐缓冲液清洗,离心后加0.5 ml磷酸盐缓冲液洗涤。Fabcaliar型流式细胞仪(美国D公司提供)检测外周血中TIGIT、CD36表达,采用绝对计数表示,仪器及试剂由上海信然生物技术有限公司提供。

2 结果
2.1 AP并发腹腔感染患者病原菌分布 90例患者中,29例并发腹腔感染,感染发生率为32.2%(29/90),共检出病原菌38株,以革兰阴性菌为主,共30株(79.0%),其中,大肠埃希杆菌15株(39.5%),肺炎克雷伯菌8株(21.1%),铜绿假单胞菌2株(5.3%),鲍曼不动杆菌1株(2.6%),阴沟肠杆菌3株(7.9%),嗜麦芽寡养单胞菌1株(2.6%);其次为革兰阳性菌,共7株(18.4%),其中,金黄色葡萄球菌5株(13.2%),表皮葡萄球菌1株(2.6%),粪肠球菌1株(2.6%);真菌仅有1株(2.6%),为白色假丝酵母菌。主要致病菌为大肠埃希杆菌、肺炎克雷伯菌和金黄色葡萄球菌。
2.2 AP并发腹腔感染主要病原菌耐药性分析 AP并发腹腔感染致病菌大肠埃希菌、肺炎克雷伯菌,均对亚胺培南、头孢哌酮/舒巴坦、哌拉西林/舒巴坦耐药率较高,而葡萄球菌对利奈唑胺、万古霉素、阿奇霉素、苯唑西林等耐药率较高。见表1。
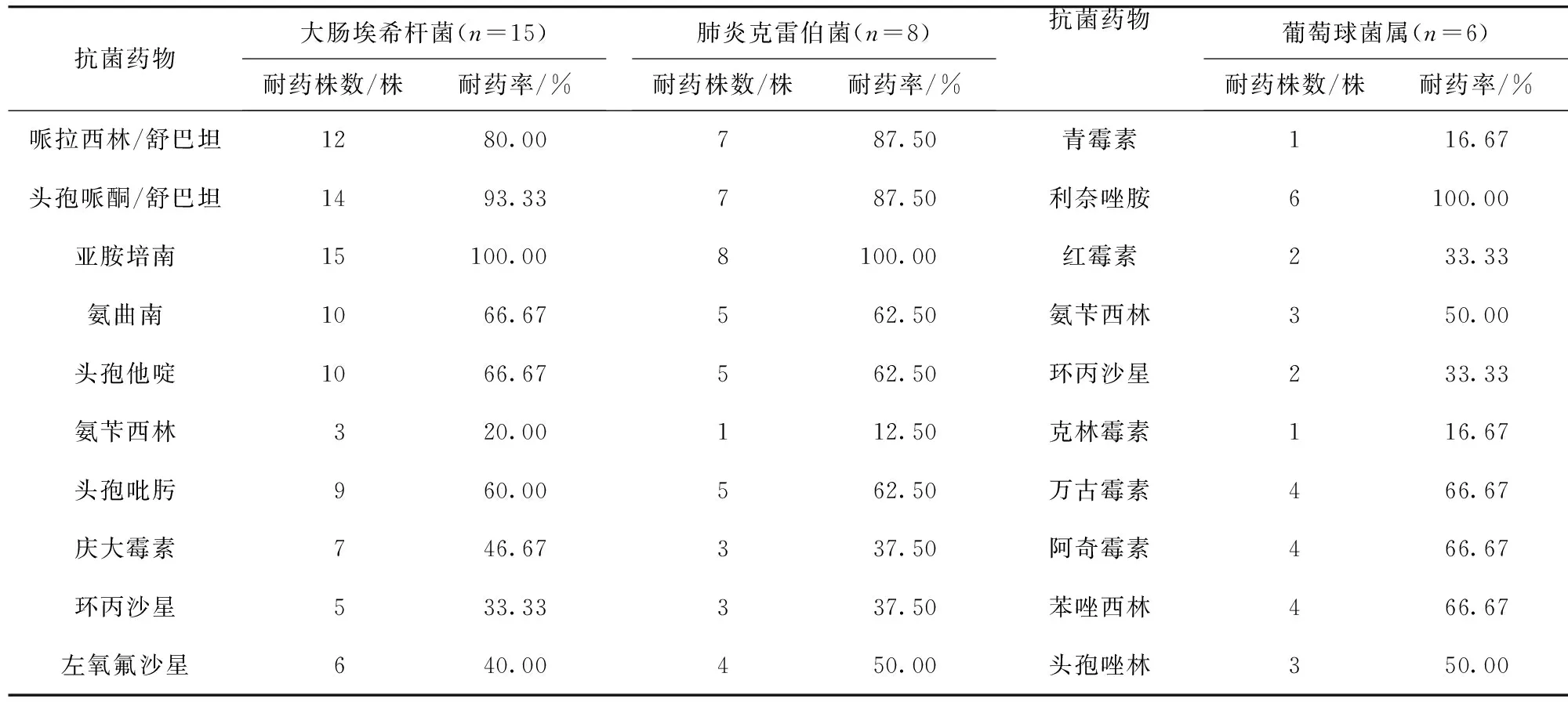
表1 AP并发腹腔感染主要病原菌耐药性分析
2.3 AP并发腹腔感染的单因素分析 感染组年龄≥60岁、胆源性AP、禁食时间>21 d、多器官功能障碍综合征、入院时APACHEⅡ评分>8分、低氧血症患者比例明显高于无感染组,差异均有统计学意义(P<0.05)。见表2。

表2 AP并发腹腔感染的单因素分析/例(百分率/%)
2.4 感染组与无感染组NK细胞、TIGIT/CD226基因表达比较 感染组NK细胞总量、CD226低于无感染组,TIGIT、TIGIT/CD226高于无感染组,差异有统计学意义(P<0.05)。见表3。

表3 感染组、无感染组NK细胞、TIGIT/CD226基因表达比较
2.5 AP并发腹腔感染的二元Logistic回归分析 二元Logistic回归分析显示,年龄≥60岁、胆源性AP、多器官功能障碍综合征、低氧血症、NK细胞总量、TIGIT/CD226是AP并发腹腔感染的危险因素(P<0.05)。见表4。

表4 AP并发腹腔感染的二元Logistic回归分析
2.6 AP并发腹腔感染Logistic危险因素的预测模型 以Logistic回归分析中各因素回归系数及常数项构建AP并发腹腔感染危险因素的预测模型,Prob=1/(e^-Y),Y=29.341-0.561×年龄-0.480×胆源性AP-0.509×多器官功能障碍综合征-0.497×低氧血症-0.511×NK细胞总量-0.411×TIGIT/CD226。经Hosmer-Lemeshow检验χ2=4.162,P>0.05,结果显示,以Prob作为检验指标,0.706为预测模型的最高概率值,模型预测AP并发腹腔感染发生的曲线下面积为0.880,敏感度为88.9%,特异度为81.0%,均优于较各指标单项检测。见图1、表5。
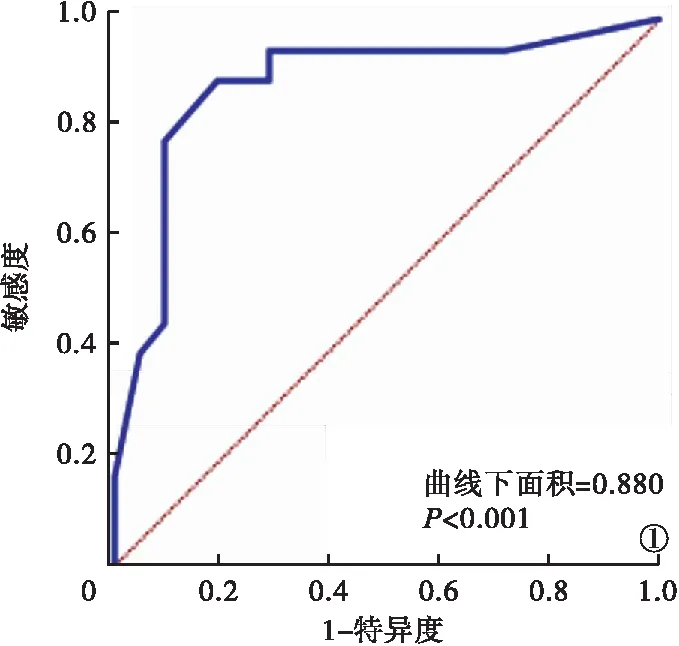
图1 AP并发腹腔感染Logistic危险因素预测模型ROC曲线
3 讨论
AP发病与胆源性、血脂过高及暴饮暴食或药物损伤等有关,疾病早期以胰腺急性炎症反应所致血容量不足、胰腺组织损伤为主,随病情进展以感染所致全身炎症和多器官功能损伤为主[12]。腹腔感染是AP的主要感染类型之一。周彬等[13]研究报道,约25.0%的AP患者出现胰腺及周围组织的继发感染;夏书香等[14]研究证实,急性重症胰腺炎患者腹腔感染发生率为51.25%。本研究结果显示,AP并发腹腔感染的发生率为32.2%(29/90),略高于周彬等[13]报道的25.0%,但低于夏书香等[14]报道的51.25%,考虑与不同研究中AP患者病情严重程度存在差异或与患者腹腔感染判断标准不一致有关。AP引发腹腔感染的可能机制有:机体血液淋巴循环和胰管功能出现障碍,致胰液进入肠道,损伤肠道屏障,胃肠道细菌位移引发机体急性炎症反应;胰酶消化自身脏器导致周围组织损伤、坏死,引发腹腔积液,增加腹腔感染风险[15-16]。
抗感染治疗是AP并发感染的主要治疗手段,目前,AP并发感染患者的耐药性问题突出,分析AP并发腹腔感染患者病原菌分布情况,有利于指导抗菌药物的合理应用[17]。本研究结果显示,29例AP并发腹腔感染患者检出病原菌38株,79.0%为革兰阴性菌,18.4%为革兰阳性菌,与殷跃文[18]报道的AP感染患者病原菌以革兰阴性菌(59.49%)为主、革兰阳性菌(40.51%)次之的观点大体趋势相符。但本研究结果显示的革兰阴性菌检出率远高于殷跃文[18]的报道,分析原因为本研究主要纳入患者为腹腔感染,而殷跃文[18]研究中感染类型多,腹腔感染患者致病菌多数为单一细菌,致病菌多数来自于腹腔的病变器官,膈下及上腹部致病菌以肠道杆菌多见,而下腹部致病菌主要为厌氧脆弱类杆菌及需氧肠道杆菌[19]。此外,本研究结果显示,AP并发腹腔感染的主要致病菌有大肠埃希杆菌(39.5%)、肺炎克雷伯菌(21.1%)、金黄色葡萄球菌(13.2%),与夏书香等[14]报道的基本一致。本研究药敏结果提示,AP并发腹腔感染患者主要致病菌对多数常见抗菌药物耐药。因此,对确诊为AP并发腹腔感染的患者需及时进行病原菌培养及药敏试验,根据药敏结果及时调整抗感染药物。
王延庆等[3]、周彬等[13]研究表明,重症AP患者并发感染的影响因素较多,如低氧血症、胆源性AP、糖尿病、多器官功能衰竭、其他脏器感染、机械通气等。本研究结果显示,胆源性AP、多器官功能障碍综合征、低氧血症是AP并发腹腔感染的危险因素,与上述报道部分相符。但是,本研究还发现,年龄≥60岁是AP并发腹腔感染的高危群体,且NK细胞总量、TIGIT/CD226与AP并发腹腔感染有关。NK细胞属于机体内重要的淋巴细胞群,是机体免疫防御系统中的重要组成部分,NK细胞活化性免疫突触形成过程是动态的,包括细胞接触识别和结合、受体配体间结合、解离传递胞内信号、细胞骨架重排等[20-21],因此,考虑NK细胞总量降低是AP并发腹腔感染发生的危险因素。CD226分子与多种免疫球蛋白家族成员存在类似的结构[22],TIGIT目前已被证实的功能包括与CD155结合后可阻断NK细胞对靶细胞的杀伤作用[23],TIGIT是CD226的一个拮抗受体分子[24],在细胞免疫发挥功能的过程中起主导作用,CD226/TIGIT可调节NK细胞及T细胞功能[25]。本研究结果也证实,CD226/TIGIT升高是AP并发腹腔感染的影响因素,为治疗AP并发腹腔感染新的靶点提供参考。
综上所述,AP并发腹腔感染风险较高,主要致病菌包括大肠埃希菌、肺炎克雷伯菌等,对常用抗菌药物耐药性均较高,建议在AP并发腹腔感染治疗中考虑联合使用抗菌药物;胆源性AP、多器官功能障碍综合征、低氧血症及NK细胞减少、TIGIT/CD226升高的AP患者需警惕腹腔感染的发生风险;危险因素构建的预测模型对AP并发腹腔感染的预测价值高,可为AP并发腹腔感染发生风险的评估和防治提供参考。

