高危型HPV E6/E7 mRNA、TCT单独检测和分子细胞联合检测在宫颈病变筛查中的应用
顾雨佳 陈妍雯 孙桂芹
宫颈癌是全球女性高发癌症中的第4 位,也是女性癌症死亡原因的第4 位[1]。研究表明大部分宫颈癌与高危人类乳头瘤病毒(HR-HPV)的持续感染相关[2],若治疗不及时,部分将发展成宫颈癌或浸润型宫颈癌。目前临床对宫颈癌主要的筛查方式有HPV、液基薄层细胞学检测(tTCT)、分子细胞联合筛查等[3]。HPV 检测中常用的有HPV DNA 检测和HPV E6/E7 mRNA 分子检测,DNA 检测仅提示宫颈细胞存在HPV 感染,但无法明确病毒活跃度[4],HPV E6/E7 mRNA 高表达则提示病毒基因与机体DNA 发生整合,细胞有恶变趋势[5]。2012 年美国阴道镜及宫颈病理学会(ASCCP)指南第一次将HR-HPV 检测与细胞学联合筛查作为首选推荐策略[6]。2021 年7 月世界卫生组织(WHO)发布的指南明确建议使用HPV DNA 检测作为初筛方法[7]。大量前瞻性、回顾性数据指出HPV 检测敏感度高,无需依赖细胞学医师,客观性好,质控水平高,适用于宫颈癌初筛[8]。本文探讨不同方法在不同程度宫颈病变筛查中的敏感度和特异性。
1 资料与方法
1.1 临床资料 收集2021 年1~12 月在浙江大学医学院附属妇产科医院行阴道镜活检的3,907 例患者临床资料,回顾性分析其HR-HPV E6/E7 mRNA 分子检测、TCT 细胞学检测及宫颈活检病理结果。
1.2 方法 (1)标本收集:采集的标本放入美国豪洛捷(Hologic)公司生产的新柏氏(ThinPrep)细胞保存瓶中,依次进行HR-HPV E6/E7 mRNA 分子检测、TCT细胞学检测。达到阴道镜活检标准的病例进行宫颈活检病理检测。(2)HR-HPV E6/E7 mRNA 分子检测:采用Hologic 公司生产的全自动核酸检测系统(HPV E6/E7 mRNA PANTHER)定性检测源自宫颈样本中14 种HR-HPV E6/E7 mRNA,但不区分具体型别。首先使用HPV 检测试剂盒(APTIMA HPV Assay test,Hologic),所得结果分为阴性和阳性。若检测结果为阳性,则继续使用HPV16 18/45 基因型检测试剂盒(APTIMA HPV 16 18/45 Genotype Assay,Hologic)进行分型。检测结果分为阴性、16 型阳性、18/45 型阳性、16 和18/45 型均阳性、其余11 型阳性共五类。(3)TCT 检测:技术员采用全自动细胞检测制备仪(ThinPrep 2000 System,美国赛迪)进行制片。病理医师按照TBS 细胞学诊断标准(2014)[9]进行诊断,诊断结果分为未见上皮内病变细胞和恶性细胞(NILM);未确定意义的非典型鳞状细胞(ASC-US);非典型鳞状细胞不能排除高级别上皮内病变(ASC-H);低级别鳞状上皮内病变(LSIL);高级别鳞状上皮内病变(HSIL);鳞状细胞癌(SCC);非典型腺细胞(AGC)包括非典型腺细胞,无具体指定(AGCNOS)和非典型腺细胞倾向瘤变(AGC-N)两类;宫颈管原位腺癌(AIS):腺癌(ADC)。(3)宫颈活检:阴道镜检查是将充分暴露的阴道和子宫光学放大5~40 倍,直接观察这些部位的血管形态和上皮结构,对可疑部位进行定点活检。病理诊断流程按照三级阅片制度进行。诊断结果为炎症、LSIL、HSIL、SCC、AIS、ADC。
1.3 统计学分析 采用SPSS 23.0 统计软件。符合正态分布计量资料以(±s)表示;计数资料以n(%)表示,采用卡方检验,P<0.05 为差异有统计学意义。
2 结果
2.1 一般资料 3,907 例患者,年龄(42.24±12.00)岁。依据宫颈活检病理结果,2,792 例病例诊断为无上皮内病变,742 例为LSIL,373 例为HSIL 及以上病变(包含HSIL、SCC、AIS、ADC),见表1。
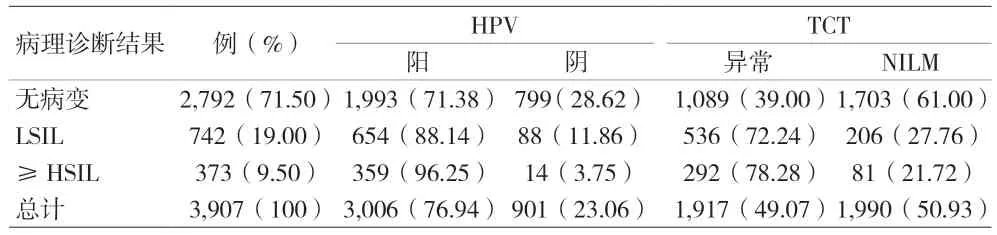
表1 3,907例患者的HR-HPV E6/E7 mRNA、TCT结果统计[n(%)]
2.2 HPV E6/E7 mRNA 分型结果 3,907 例患者中,HPV E6/E7 mRNA 总阳性率为76.94%。其中16 型阳性、18/45 型阳性、16 和18/45 型均阳性、其余11 型阳性比例分别为14.21%、5.73%、0.49%、56.51%。在病理结果为无病变、LSIL、HSIL、SCC 中,16 型阳性率随着病变级别的升高而升高,分别为10.46%、13.75%、40.88%、70.73%。见图1。
2.3 TCT 细胞学结果 3,907 例患者中,TCT 异常率为49.07%,其中ASC-US、ASC-H、LSIL 病例分别为23.50%、6.68%、15.41%。HSIL 及以上病例较少,占3.31%。在无病变、LSIL、HSIL、SCC 中TCT 的异常率随着病变级别的提高而提高,SCC 中甚至出现100%的TCT 异常率。见图2。

图2 3,907例患者各级活检病理的TCT异常率
2.4 HPV E6/E7 mRNA 分子学检测、TCT 细胞学检测和分子细胞联合筛查结果分析 在筛查LSIL 时,单独使用HPV E6/E7 mRNA 分子检测的敏感度为90.85%,特异性为28.62%。单独使用TCT 细胞学检测的敏感度为74.26%,特异性为61.00%。分子细胞联合检测的敏感度为96.68%,特异性为14.36%。分子细胞联合筛查与单独使用HPV E6/E7 mRNA 分子检测相比,差异有统计学意义(P<0.001)。HPV E6/E7 mRNA16、18/45 分型检测特异性最高(83.99%)。在筛查≥HSIL 时,单独使用HPV E6/E7 mRNA 分子检测的敏感度为96.25%,特异性为25.10%。单独使用TCT 细胞学检测的敏感度为78.28%,特异性为54.02%。分子细胞联合筛查的敏感度为97.86%,特异性为12.17%。在敏感度方面,分子细胞联合筛查与单独使用HPV E6/E7 mRNA 分子检测相比,差异无统计学意义(P>0.05)。在特异性上,以HPV16、18/45 分型检测最高(82.94%)。见表2。
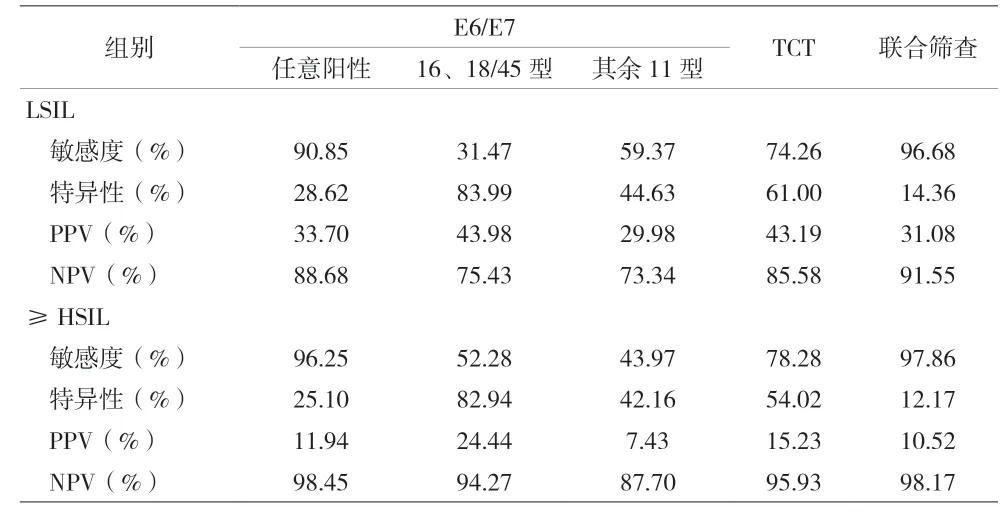
表2 高危型HPV E6/E7 mRNA、TCT单独检测和分子细胞联合筛查结果比较
3 讨论
宫颈癌是全球女性癌症死亡的最主要原因之一,而HR-HPV 的持续感染是其主要的风险因素。LSIL 首次感染通常会自行消失,而最终发展结果的严重性取决于HR-HPV 的亚型[10],其中HPV16、18 亚型,是肿瘤转化的主要促进者,协同导致70%~75%的宫颈癌[11]。HR-HPV 分子检测已被证实具有更高的敏感度和可重复性[12],可用于宫颈癌筛查与癌前诊断。
2020 年,一项基于中国宫颈癌筛查的研究表明,HR-HPV 检测作为初筛技术,具有较好的筛查效果与较低的成本[13]。有研究指出,相比于DNA 检测,使用APTIMA 方法进行HPV E6/E7 mRNA 测试对HSIL 及以上病变的敏感度和特异性更高[14-15]。HPV E6/E7 mRNA表达水平与宫颈癌进展有关,高水平表达意味着向高级别病变进展[16-17]。HPV E6/E7 mRNA 16、18/45 分型检测在筛查≥HSIL 病例方面有较好的风险预测能力[18]。本研究结果与上述文献报道基本一致,分子细胞联合筛查可提高LSIL 病变的敏感度,但对筛查≥HSIL 病变,联合检测和HPV mRNA 单独检测的敏感度差异无统计学意义,提示早期宫颈病变需开展联合筛查。与细胞学检测相比,HPV E6/E7 mRNA 分子检测敏感度高,并且对高危型16、18/45 分型检测,可帮助初筛阳性病例的分流,避免过度治疗,节约医疗资源。
HPV E6/E7 mRNA 分子检测敏感度虽高,但也存在不足。WHO 建议使用HPV 检测和p16 免疫染色来区分HPV 相关和HPV 非依赖性宫颈癌[19]。此外,PAX1 基因甲基化检测能弥补HPV 对腺癌的弱敏感度[20]。随着技术的发展,新筛查方法逐渐被应用于宫颈癌的早期或精准筛查。

