肉鸡饲料中添加不同种类淀粉酶和产淀粉酶乳酸菌效果研究
■ 艾春晓 孙晓颖 袁建敏
(中国农业大学动物科学技术学院,动物营养学国家重点实验室,北京 100193)
淀粉是肉鸡饲粮中的主要能量来源,幼龄肉鸡因消化器官发育不完善导致淀粉利用率低,提高幼龄肉鸡淀粉的利用对于肉鸡的生长发育至关重要。研究认为,添加淀粉酶能显著提高肉鸡的淀粉和能量消化率,促进葡萄糖吸收、转运和代谢,促进生长激素分泌,从而改善肉鸡生长性能[1-2]。但淀粉酶的添加效果受肉鸡日龄、玉米粒硬度及干燥温度和淀粉酶来源及添加水平等影响[3-6]。日粮中支链淀粉包含α-1,4糖苷键和α-1,6 糖苷键。α-1,4 淀粉酶仅能够水解直链淀粉和支链淀粉中的α-1,4 糖苷键;糖化酶既可以水解α-1,4 糖苷键,也可以水解α-1,6 糖苷键;普鲁兰酶能水解支链淀粉α-1,6 糖苷键[7]。此外,产淀粉酶乳酸菌能分泌淀粉酶水解淀粉[8]。因此,本研究通过在肉鸡日粮中分别添加α-淀粉酶、糖化酶和普鲁兰酶以及产α-淀粉酶乳酸菌来比较不同种类淀粉酶和产酶乳酸菌对肉鸡生长性能、淀粉消化率、内源酶活性、血清生化指标等的影响效果,以期为肉鸡日粮淀粉酶的合理设计和应用提供理论和实践指导。
1 材料与方法
1.1 试验动物及材料
AA 肉仔鸡公雏购买于北京家禽育种有限公司;α-淀粉酶(4 000 U/g,水解α-1,4 糖苷键)、普鲁兰酶(2 000 U/g,水解α-1,6 糖苷键)、糖化酶(27×105U/g,水解α-1,4 糖苷键和α-1,6 糖苷键)来源于某公司;乳酸菌(LAB1)(产α-淀粉酶,淀粉酶活性153.16 U/mL)为实验室前期筛选[9]。
1.2 试验分组与饲粮
本试验采用完全随机分组,选取4 日龄健康AA肉鸡公雏560 只,试验共分为5 个处理,每个处理8 个重复,每个重复14 只鸡。试验期为18 d,对照组为基础饲粮,不添加酶制剂;试验组为在基础饲粮的基础上分别添加600 U/kgα-淀粉酶、100 U/kg普鲁兰酶、1 000 U/kg糖化酶和2×109CFU/L产淀粉酶乳酸菌(LAB1,饮水添加)。
试验采用玉米-豆粕型基础饲粮(见表1),参照中国鸡饲养标准(NY/T 33—2004)配制,每组淀粉酶加入预混料中逐级混合后,与玉米豆粕等大料混合,蒸汽制粒。

表1 基础饲粮组成及营养水平(风干基础)
1.3 饲养管理
采用网上平养方式进行饲养,饮水器为乳头式供水,每天08:00、17:00 各饲喂一次,保证肉鸡自由采食。在7 日龄和21 日龄进行新城疫疫苗和传支二联疫苗免疫,7 日龄采用滴鼻点眼,21 日龄采用加倍量饮水免疫。环境温度、相对湿度和光照严格执行饲养手册要求。
1.4 样品采集
在21 日龄时,对肉鸡进行8 h 饥饿处理,称取每组鸡体重和剩余料重,每个重复选取三只接近平均体重的肉鸡并继续饲喂,3 h 后对其中一只肉鸡进行翅静脉采血,静置析出血清后,离心,分离血清于-20 ℃冰箱冷冻保存;对另两只肉鸡进行戊巴比妥钠麻醉屠宰,采集空肠及回肠食糜,于-80 ℃冰箱冷冻保存,用于淀粉消化率的测定。取胰腺组织,于-80 ℃冰箱冷冻保存,用于内源消化酶基因表达的测定。取空肠、回肠组织,于-80 ℃冰箱冷冻保存,用于葡萄糖转运载体及氨基酸转运载体基因表达的测定。取空肠、回肠黏膜,于-80 ℃冰箱冷冻保存,用于黏膜二糖酶活性的测定。称取肝脏、胰腺、肌胃的重量,用于器官相对重量的计算。
1.5 指标测定
1.5.1 生长性能
分别在于试验第1、11、18天时,空腹8 h后以重复为单位称重,并称量剩余饲料量,计算4~14 日龄、15~21日龄和4~21日龄的体增重、采食量、料重比(F/G)。
1.5.2 淀粉消化率
将空肠食糜和回肠食糜冷冻干燥,粉碎过40 目筛,测定酸不溶灰分、总淀粉、直链淀粉、支链淀粉、抗性淀粉含量,并以酸不溶灰分作内源指示剂,计算其消化率。酸不溶灰分测定方法参考张丽英主编《饲料分析及饲料质量检测技术》[10]。总淀粉、直链淀粉、支链淀粉、抗性淀粉采用试剂盒(试剂盒编号为K-TSTA、K-AMYL、K-RSTAR,Megazyme 公司)测定。同时,也采取同样方法测定饲料中相关物质含量。
式中:IDC——饲料养分消化率(%);
IF——饲料中指示剂含量(%);
If——回肠食糜中指示剂含量(%);
NF——饲料中营养物质含量(%);
Nf——回肠食糜中营养物质含量(%)。
1.5.3 器官相对重量
计算胰腺、肌胃和肝脏相对重量。
器官相对重量(%)=器官绝对重量(g)/活体重(g)×100
1.5.4 血清生化指标
血清甲状腺素(T4)、三碘甲状原氨素(T3)、胰岛素(INS)、胰高血糖素(GCG)含量由北京北方生科医学技术有限公司采用放免法测定;血清葡萄糖(GLU)、三酰甘油(TG)含量采用试剂盒(试剂盒编号为F006、A110-1,南京建成生物工程研究所有限公司)测定。
1.5.5 消化道酶活性
肠道二糖酶(蔗糖酶、麦芽糖酶)活性均采用试剂盒(试剂盒编号为A082-2、A082-3,南京建成生物工程研究所有限公司)测定。样品的预处理、试剂的配制和实验操作均按说明书步骤进行。
1.5.6 mRNA表达量
胰腺淀粉酶和蛋白酶基因以及肠道葡萄糖和氨基酸转运基因引物序列见表2。采用Trizol一步抽提法提取胰腺、空肠及回肠组织样的总RNA,并进行反转录,建立各样品RNA 的cDNA,以β-actin管家基因作为内标,对胰腺淀粉酶(AMY2A)和蛋白酶(PRSS2 与PRSS3)以及肠道SGLT1、GLUT2、B0AT1、EAAT3、ATB、CAT1、y+LAT1和LAT1基因表达进行相对定量分析。

表2 引物序列号
1.6 数据统计与分析
采用SPSS 21.0 统计软件,应用单因素方差分析(one-way ANOVA)进行差异显著性检验,采用Duncan’s法多重比较,结果以平均数表示,以P<0.05表示差异显著。“P”表示5个处理组之间的差异,“P酶”表示对照组与添加淀粉酶(α-淀粉酶、普鲁兰酶、糖化酶)处理组的差异,“P菌”表示对照组与添加乳酸菌组的差异。
2 结果与分析
2.1 生长性能
由表3 可知,与其他添加剂相比,外源添加产淀粉酶乳酸菌LAB1 会显著降低肉鸡4~14 日龄的采食量以及料重比(P<0.05),并降低4~21 日龄料重比(P<0.05),对肉鸡各个阶段的体重和体增重没有显著影响(P>0.05)。

表3 不同种类淀粉酶和产淀粉酶乳酸菌对肉鸡4~21 日龄生长性能的影响
2.2 营养物质消化率
由表4 可知,与无添加剂相比,添加普鲁兰酶和糖化酶显著降低了21 日龄肉鸡空肠总淀粉消化率和支链淀粉消化率(P<0.05),二者之间没有显著差异;普鲁兰酶显著降低回肠抗性淀粉消化率(P<0.05);糖化酶会显著降低肉鸡回肠直链淀粉消化率(P<0.05),但显著提高回肠抗性淀粉消化率(P<0.05)。与无添加剂相比,添加LAB1 除显著提高肉鸡回肠抗性淀粉消化率(P<0.05)外,对其他肠段淀粉消化率没有显著影响(P>0.05)。

表4 不同种类淀粉酶和产淀粉酶乳酸菌对21日龄肉鸡肠道淀粉消化率的影响(%)
2.3 消化酶活性与基因表达
由表5可知,与无添加剂相比,α-淀粉酶、糖化酶和LAB1 能够显著降低肉鸡空肠黏膜麦芽糖酶活性(P<0.05),且添加糖化酶能显著提高回肠黏膜麦芽糖酶活性(P<0.05)。除此以外,添加不同种类淀粉酶及LAB1对空肠食糜和胰腺中的淀粉酶、胰蛋白酶、蔗糖酶活性均无显著影响(P>0.05)。

表5 不同种类淀粉酶和产淀粉酶乳酸菌对21日龄肉鸡肠道消化酶活性的影响(U/mg prot.)
由表6 可知,与无添加剂相比,添加LAB1 对肉鸡内源消化酶基因表达量无显著性影响(P>0.05),但添加不同种类的淀粉酶使肉鸡胰腺淀粉酶(AMY2A)和蛋白酶Ⅰ(PRSS2)的基因表达量呈降低趋势(0.05<P<0.1),对胰腺蛋白酶Ⅱ(PRSS3)的基因表达量无显著影响(P>0.05)。

表6 不同种类淀粉酶和产淀粉酶乳酸菌对21日龄肉鸡内源消化酶基因表达量的影响
2.4 消化器官相对重量
由表7可知,与无添加剂相比,添加淀粉酶并没有对消化器官相对重量产生显著影响(P>0.05);而添加LAB1能够显著提高21日龄肉鸡肌胃和肝脏的相对重量(P<0.05)(表7)。

表7 不同种类淀粉酶和产淀粉酶乳酸菌对21日龄肉鸡消化器官相对重量的影响(%)
2.5 血清生化指标
由表8可知,与无添加剂相比,添加α-淀粉酶、糖化酶和LAB1 会显著提高肉鸡血清中T4 的含量(P<0.05),而对肉鸡血清中葡萄糖、三酰甘油、T3、胰岛素和胰高血糖素的含量均无显著影响(P>0.05)。
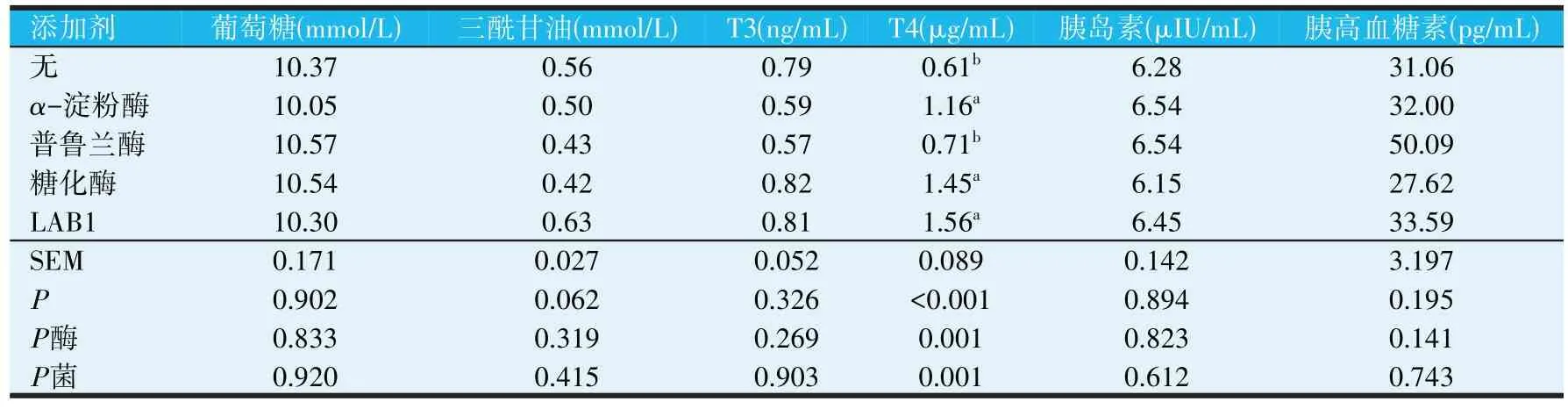
表8 不同种类淀粉酶和产淀粉酶乳酸菌对21日龄肉鸡血清生化指标的影响
2.6 营养物质转运载体基因表达
由表9 可知,与无添加剂相比,肉鸡饲料中添加α-淀粉酶会显著降低21日龄肉鸡回肠LAT1的基因表达量(P<0.05);添加普鲁兰酶能够显著提高回肠SGLT1基因表达量,并显著降低空肠SGLT1基因以及回肠LAT1基因表达量(P<0.05);添加糖化酶能够显著降低空肠GLUT2基因表达量(P<0.05),并显著提高空肠和回肠SGLT1基因以及回肠B0AT1、EAAT3和y+LAT1的基因表达量(P<0.05);而添加LAB1能够显著降低空肠和回肠的GLUT2基因表达量(P<0.05),显著提高空肠SGLT1基因表达量及回肠B0AT1和EAAT3基因表达量。而添加不同种类淀粉酶和LAB1乳酸菌对ATB0,+和CAT1的基因表达量无显著性影响(P>0.05)。

表9 不同种类淀粉酶和产淀粉酶乳酸菌对21日龄肉鸡肠道葡萄糖、氨基酸转运载体基因表达的影响
3 讨论
3.1 不同种类淀粉酶和产淀粉酶乳酸菌对肉鸡生长性能及养分消化率的影响
外源淀粉酶能在一定程度上弥补幼龄家禽因消化器官发育不完善导致的淀粉酶分泌不足。本研究结果表明与无添加剂相比,添加α-淀粉酶对21 日龄肉鸡淀粉消化率以及生长性能均无显著影响,而添加普鲁兰酶和糖化酶会显著降低21 日龄肉鸡淀粉消化率,对生长性能也无显著影响,与郭玉光[11]等研究结果一致。对于本试验中α-淀粉酶的效果,可能与淀粉酶添加水平过高有关。Zhou 等[3]研究表明补充600 U/kg 以上α-淀粉酶会抑制葡萄糖转运蛋白,不同程度地降低小肠中淀粉和有机物消化率的系数,从而限制了肉鸡的生长性能。而本试验所添加α-淀粉酶剂量为600 U/kg,因此可能限制了淀粉酶对淀粉消化率以及生长性能的有利影响。也可能与不同试验中所用玉米的蛋白质溶解度不同有关。Liu 等[12]研究表明玉米蛋白质溶解度越低,α-淀粉酶效果越好。对于普鲁兰酶和糖化酶而言,淀粉消化率下降的原因可能是因为这两种酶均能随机作用于支链淀粉上的α-1,6 糖苷键,将支链淀粉水解为直链淀粉。而直链淀粉由于葡萄糖分子的氢基和甲基聚集于螺旋中心因此具有疏水性,而这样的疏水结构更有利于脂肪酸的甲基末端进入并与之结合,生成的复合物会加强直链淀粉的疏水结构而对内源α-淀粉酶产生抗性[13],从而降低淀粉消化率并限制生长性能。
研究表明,饲喂肉鸡产α-淀粉酶的微生物能提高肉鸡的干物质消化率[14]。而本研究中与无添加剂相比,产淀粉酶乳酸菌LAB1 会显著提高21 日龄肉鸡回肠抗性淀粉消化率并会降低肉鸡前期的采食量和料重比。说明乳酸菌LAB1 能有效降解抗性淀粉,改善饲料转化效率。
3.2 不同种类淀粉酶和产淀粉酶乳酸菌对肉鸡葡萄糖消化吸收的影响
机体葡萄糖稳态主要是通过感受营养素和激素信号的胞内传导机制来调控,这一机制可以控制不同组织产生或消耗葡萄糖的速率。肝脏是葡萄糖与糖原相互转化的主要场所,在维持葡萄糖稳态中起主要作用。本试验研究结果显示与无添加剂相比,添加乳酸菌LAB1 会显著提高肌胃和肝脏的相对重量,这可能是其导致淀粉消化率提升的原因之一。
外源淀粉酶可与内源酶协同作用共同分解日粮中的淀粉,改变淀粉结构并增加消化道中底物浓度,这一信号通过消化道传递给胰腺后,胰腺调节内源酶的分泌;另一方面,外源淀粉酶的添加使葡萄糖释放速度加快,影响体内血糖和胰岛素浓度的变化,从而刺激胰腺调节消化酶mRNA 的表达[13]。本研究结果表明,与无添加剂相比,添加外源淀粉酶对肉鸡血清葡萄糖、胰岛素及胰高血糖素的水平以及空肠和胰腺淀粉酶和蛋白酶活性没有显著性影响,但胰淀粉酶和胰蛋白酶基因表达量有下降趋势,与Yuan 等[15]研究结果相似,说明本研究添加的外源淀粉酶可能剂量偏高,对胰淀粉酶和胰蛋白酶的分泌有抑制的趋势。T4 激素能够促进细胞代谢,刺激机体生长与发育,同时T4 还具有促进肠道吸收葡萄糖的功能。本研究中发现与无添加剂相比,添加α-淀粉酶、糖化酶及乳酸菌LAB1能够显著提高T4含量,但未发现血液中T4激素水平与生长性能的相关性。黏膜二糖酶在彻底分解糖类过程中起到关键作用,其活性会影响单糖的吸收及利用。而本试验中添加α-淀粉酶、糖化酶和乳酸菌LAB1 能够显著降低肉鸡空肠黏膜麦芽糖酶活性,且糖化酶能显著提高回肠黏膜麦芽糖酶活性。说明糖化酶可能在回肠中发挥更大作用,分解产生更多麦芽糖。蒋正宇等[16]发现当淀粉酶水平为1 000 U/kg和3 000 U/kg时,蔗糖酶、麦芽糖酶活性未受影响,但高剂量(9 000 U/kg)降低了蔗糖酶和麦芽糖酶活性。因此推测添加α-淀粉酶和LAB1导致麦芽糖酶活性下降也可能与剂量偏高有关。
转运载体的表达影响着小分子物质的吸收速率,对动物肠道中营养物质吸收利用起着至关重要的作用。肠道吸收葡萄糖的能力可以通过改变SGLT1的表达量来调节。有研究表明肠腔中高浓度的α-淀粉酶能够与SGLT1结合而抑制其对葡萄糖进行转运[17],而肠腔内的高浓度葡萄糖则会刺激SGLT1的表达[18]。本试验的研究结果表明,添加普鲁兰酶能够显著降低空肠SGLT1基因表达量,并显著提高回肠SGLT1基因表达量。说明普鲁兰酶可能在回肠中更能发挥作用。添加糖化酶与乳酸菌LAB1均能显著降低肠道GLUT2基因表达量,并提高肠道SGLT1以及B0AT1、EAAT3和y+LAT1等氨基酸转运载体的基因表达量,可能与T4的水平升高有关。其中乳酸菌LAB1也可能是通过促进淀粉的利用,从而生成更多的葡萄糖,刺激肠道对葡萄糖的主动吸收。
4 结论
产淀粉酶乳酸菌LAB1 能改善21 日龄肉鸡的料重比,其机制可能是通过增加肌胃和肝脏的相对重量,上调肠道葡萄糖转运载体及氨基酸转运载体,提高了回肠抗性淀粉消化率,在肉鸡产业有一定的应用前途。此外,本试验发现糖化酶和普鲁兰酶会降低空肠淀粉消化率,所添加外源α-淀粉酶可能均剂量偏高,限制了其所能发挥的作用。肉鸡饲料中糖化酶和普鲁兰酶,α-淀粉酶适宜的添加剂量需要继续摸索。

