白簕叶总多酚对Aβ25-35与AAPH诱导的PC12细胞氧化损伤和衰老的保护作用
俞佳妮 冯彩霞 刘向前 李小军 张晓丹

摘 要: 为探究中药白簕(Acanthopanx trifoliatus (L.) Merr.)能否作为高效、低毒的防治阿尔茨海默病的天然药物原料,选用大鼠肾上腺嗜铬细胞瘤株PC12作为神经细胞模型,建立Aβ25-35诱导的PC12细胞氧化损伤模型,测定白簕叶总多酚干预24 h后PC12细胞存活率;通过AAPH诱导的PC12细胞衰老模型和β-半乳糖苷酶活性染色法评估PC12细胞衰老情况。结果表明:与仅损伤处理组相比,5~60 mg/L的白簕葉总多酚能够显著提高(p<0.05)经Aβ25-35诱导的氧化损伤的PC12细胞的存活率,且能够降低AAPH诱导的细胞衰老模型中的β-半乳糖苷酶活性,表明白簕叶总多酚对PC12细胞具有显著的保护作用,能有效缓解PC12细胞氧化损伤与衰老。该研究为寻找有效防治阿尔茨海默病的天然药物的鉴定与筛选提供理论依据。
关键词:白簕叶;总多酚;抗衰老;PC12细胞;体外细胞实验
中图分类号:TS195.644
文献标志码:A
文章编号:1673-3851 (2023) 05-0353-06
引文格式:俞佳妮,冯彩霞,刘向前,等. 白簕叶总多酚对Aβ25-35与AAPH诱导的PC12细胞氧化损伤和衰老的保护作用[J]. 浙江理工大学学报(自然科学),2023,49(3):353-358.
Reference Format: YU Jiani, FENG Caixia, LIU Xiangqian, et al. Protective effects of total polyphenols from Acanthopanx trifoliatus (L.) Merr. on Aβ25-35-induced oxidative damage and AAPH-induced aging models in PC12 cells[J]. Journal of Zhejiang Sci-Tech University,2023,49(3):353-358.
Protective effects of total polyphenols from Acanthopanx trifoliatus (L.)
Merr. on Aβ25-35-induced oxidative damage and AAPH-induced aging models in PC12 cells
YU Jiani1, FENG Caixia1, LIU Xiangqian2, LI Xiaojun3, ZHANG Xiaodan1
(1a.College of Life Sciences and Medicine; 1b.Zhejiang Provincial Key Laboratory of Plant Secondary Metabolic
Regulation, Zhejiang Sci-Tech University, Hangzhou 310018, China; 2. School of Pharmacy, Hunan University of Chinese Medicine, Changsha 410208, China; 3.School of Pharmacy, Gannan Medical University, Ganzhou 341000, China)
Abstract: In order to explore the possibility of Acanthopanx trifoliatus (L.) Merr. as a highly effective and low toxic agent for the prevention and treatment of Alzheimer′s disease, PC12, a rat adrenal pheochromocytoma cell line, was selected as the nerve cell model, the oxidative damage model of PC12 cells induced by Aβ25-35was established, and the survival rate of PC12 cells was measured after 24 hours of intervention of total polyphenols of A trifoliatuscanthopanx . AAPH-induced aging model of PC12 cells and SA-β-Gal staining was used to evaluate the senescence of PC12 cells. The results show that, compared with the injury treated group, the survival rate of PC12 cells is significantly improved by adding 5~60 mg/L total polyphenols of A trifoliatuscanthopanx (L.) Merr. and the β-Galactosidase activity of PC12 cells is also reduced, indicating that total polyphenols of A trifoliatuscanthopanx (L.) Merr. has a significant protective effect on PC12 cells and can effectively alleviate the oxidative damage and aging of PC12 cells. The results of this paper provide a theoretical basis for the identification and screening of natural medicines that can effectively prevent and treat Alzheimer′s disease.
Key words:Acanthopanx trifoliatus (L.) Merr.; total polyphenols; anti-aging; PC12 cells ; in vitro cell experiment
0 引 言
白簕(Acanthopanx trifoliatus (L.) Merr.)为五加科(Araliaceae)五加属(Acanthopanax)攀援状灌木,又被稱为禾掌簕、三叶五加、三加皮等,广泛分布于中国的中部和南部,是一种民间常用的草药;味苦、涩、微寒,具有祛风除湿、舒筋活血、消肿解毒的功效,用于治疗感冒、咳嗽、风湿和坐骨神经痛等症[1]。白簕叶中富含皂苷[2]、三萜羧酸[3]、黄酮[4]、糖苷[5]等多种化学成分。
白簕总多酚具有良好的抗氧化作用,张元等[6]通过DPPH,ABTS和ORAC测定了经优化后的提取工艺提取所得白簕总多酚的抗氧化活性,发现白簕总多酚具有与Trolox相近的较高的抗氧化活性。Hamid等[7]通过建立小鼠炎症模型发现了白簕叶具有良好的抗炎效果,为白簕叶资源的深入利用和高价值的产品开发提供了理论依据。咖啡酰奎宁酸类总多酚是白簕叶的有效成分群之一,具有多种不同的生物活性,能够有效地抑制血小板聚集,并在抗血栓、抗氧化和自由基损伤和防治阿尔茨海默病[8]等方面发挥作用。盛艳梅等[9]通过建立大鼠脑缺血再灌注的损伤模型,探讨了3,5-二咖啡酰奎宁酸对于脑神经的保护作用。咖啡酰奎宁酸类化合物在大鼠模型中,能够有效改善其神经行为,进而使得脑梗死的比率显著下降[10]。
阿尔茨海默病是由大脑病理性变化引起的神经退行性疾病,表现为患者认知功能与学习功能下降,记忆功能出现障碍,且症状随患病时间加长而逐渐恶化[11]。目前阿尔茨海默病的发病机制尚未明确,市面上用于治疗阿尔茨海默病的药物大多通过抑制乙酰胆碱酶活性来减缓症状,少数药物通过靶向清除Aβ减缓病症的恶化[12]。能够低毒、高效地治疗阿尔茨海默病的药物仍待进一步找寻。
白簕叶富含咖啡酰奎宁酸类多酚,可能对脑神经具有较好的保护作用,有关白簕叶药理活性及在抗氧化、保护神经细胞方面的研究仍为空白。为了探究白簕叶总多酚是否具有保护神经细胞的作用,以及成为治疗阿尔茨海默病的药物的可能性,本文通过建立Aβ25-35诱导的大鼠肾上腺嗜铬细胞瘤株PC12氧化损伤模型以及AAPH诱导的大鼠肾上腺嗜铬细胞瘤株PC12衰老模型,加入乙醇提取、大孔树脂纯化后的白簕叶总多酚进行干预,利用MTT法检测细胞存活率,分析观察大鼠肾上腺嗜铬细胞瘤株PC12的衰老情况,探究白簕叶总多酚是否对大鼠肾上腺嗜铬细胞瘤株PC12的氧化损伤与衰老具有保护作用,为研究白簕叶总多酚是否具有保护神经效果、寻找有效治疗阿尔茨海默病的药物提供科学依据。
1 材料与方法
1.1 材料与试剂
白簕(Acanthopanx trifoliatus (L.) Merr.)采集于广东省凤凰山,大鼠肾上腺嗜铬细胞瘤株PC12购自中国科学院上海细胞库,RPMI-1640细胞培养基和胎牛血清购自GE医疗生命科学,胰蛋白酶和青链霉素混合液购自上海碧云天生物技术有限公司,二甲基亚砜购自吉诺生物医药技术公司,噻唑蓝购自上海宝曼生物科技有限公司,β-半乳糖苷酶染色试剂盒购自美国Cell Signaling Technology公司,Aβ25-35和AAPH购自美国Sigma公司,DMSO、磷酸二氢钾、磷酸氢二钠、氯化钠和氯化钾购自上海阿拉丁生化科技股份有限公司,乙醇和浓盐酸购自杭州高晶精细化工有限公司。
1.2 仪器设备
MCO-18AIC型二氧化碳培养箱(日本三洋公司)、Synergy H4型酶标仪(美国伯腾仪器有限公司)、GL124-1SCN型电子分析天平(德国赛多利斯公司)和MF53型荧光倒置显微镜(明美光电技术有限公司)。
1.3 试剂的配制
1.3.1 RPMI-1640完全培养基的配制
在超净工作台中,向RPMI-1640培养液中加入10%的胎牛血清,充分混匀后加入1%的青链霉素混合液,摇匀即为完全培养基,于4 ℃冰箱保存备用。
1.3.2 PBS缓冲液的配制
分别称取0.24 g磷酸二氢钾、1.44 g磷酸氢二钠、8.00 g氯化钠和0.20 g氯化钾至烧杯中,加入800 mL蒸馏水,玻璃棒充分搅拌使之溶解,用浓盐酸调至pH值为7.2,最后在容量瓶中加水定容至1000 mL。将配制好的PBS灭菌(121 ℃,20 min)后,置于4 ℃冰箱保存。
1.3.3 Aβ25-35母液配制
取1 mg Aβ25-35于471.5 μL ddH2O溶解,配制成2 mmol/L的母液,小管分装,避免反复冻融,在-20 ℃冰箱保存备用。使用前将分装的Aβ25-35母液于37 ℃的恒温培养箱中孵育约7 d,增加Aβ25-35的神经毒性。
1.3.4 MTT溶液的配制
称取MTT粉末500 mg于烧杯,加入100 mL配置完成的PBS缓冲液,完全溶解后,在超净工作台中用0.22 μm滤膜过滤,即为质量浓度5 mg/mL的MTT。MTT需现配现用,过滤除菌后将其放在4 ℃冰箱避光保存。
1.4 样品的制备
白簕叶总多酚的提取方法:将烘干至恒重后的白簕叶粉碎,取1 kg粉末,加入70%的乙醇,超声提取4次,每次2 h,将提取液合并浓缩,干燥后加水溶解,用石油醚萃取4次去脂,取水相浓缩干燥,得到总多酚粗提物粉末[13]。白簕叶总多酚的纯化方法:称取100 g D101大孔树脂,加入500 mL 95%的乙醇,将其充分浸泡24 h,倒入层析柱后去除杂质,然后进行酸洗和碱洗,用蒸馏水浸泡备用;称取2.8 g总多酚粗提物,配置成200 mL样品,将大孔树脂于水中湿法上柱,加入样品进行吸附,控制流速收集流出液,收集并浓缩洗脱液总多酚流段,冷冻干燥后获得白簕叶总多酚[14]。
1.5 MTT法检测细胞存活率
白簕叶总多酚处理24 h后,向每个孔加入20 μL的MTT溶液,置于含5%CO2的37 ℃培养箱中培养4 h。取出96孔板,沿着培养液上部用移液枪小心吸取上清液,充分弃去MTT。每孔加150 μL的DMSO溶解结晶,轻轻振摇15 min。使用酶标仪,在490 nm波长处检测各孔的吸光度,即OD值,计算不同质量浓度下药物对细胞增殖的抑制率,抑制率用细胞存活率表示,计算公式为:
1.6 白簕叶总多酚对PC12细胞的细胞毒性
当细胞处于对数生长期时,弃培养液,用配制好的PBS洗两次,加入1 mL的胰酶使贴壁细胞分散,消化完全后,加入培养液使贴壁细胞悬浮起来,800 r/min 离心3 min以充分去除胰酶。离心后保留细胞沉淀,加入1 mL完全培养基,用吸管轻轻吹打,吹散细胞使细胞飘浮起来,制成悬液。用血球计数板进行细胞计数,最终向96孔板每孔中加入100 μL的细胞悬液(约5000个细胞),将不含细胞的100 μL完全培养基作为空白孔,在含5% CO2的37 ℃培养箱中培养过夜,使之贴壁。将白簕叶总多酚用无血清培养基配制成240.000、120.000、60.000、30.000、15.000、7.500、3.750 mg/L和1.875 mg/L共8个质量浓度梯度的白簕叶总多酚药物组,每组分别设4个复孔。加药后将96孔板置于5% CO2,37 ℃培养箱继续培养24 h后,采用MTT法检测细胞存活率。
1.7 白簕叶总多酚对Aβ25-35诱导的PC12细胞氧化损伤的保护作用
1.7.1 Aβ25-35诱导的PC12细胞氧化损伤浓度的确定
将悬浮的PC12细胞用血球计数板进行计数,最终向96孔板每孔中加入100 μL细胞悬液(约5000个细胞),空白对照加100 μL完全培养基,放在含有5% CO2的37 ℃培养箱中培养过夜,使之贴壁。将孵育7 d后的Aβ25-35用培养基稀释,分别稀释为10、8、7、6、5、4、2 μmol/L和1 μmol/L ,向Aβ25-35损伤组中加入10 μL上述不同浓度的Aβ25-35,不加Aβ25-35为阴性对照组,加入10 μL无血清RPMI-1640培养液。每组分别设置4~6个孔,重复3次。在含5%CO2的37 ℃培养箱继续培养24 h后用MTT法检测细胞存活率,用GraphPad Prism 7软件计算Aβ25-35对PC12细胞的IC50值确定诱导浓度,具体方法参考文献[15]。
1.7.2 白簕叶总多酚对Aβ25-35诱导的PC12细胞氧化损伤模型的作用
将消化后的PC12细胞制成细胞悬液进行计数,向每孔加入90 μL 细胞悬液(约5000个细胞),设置空白组加90 μL完全培养基,放在含5% CO2的37 ℃培養箱中培养过夜,使之贴壁。在小于白簕叶总多酚的最大安全质量浓度基础上设置加入白簕叶总多酚质量浓度为5、10、20、30、40、50 mg/L和60 mg/L的白簕叶总多酚实验组,Aβ25-35模型组与阴性对照组加入10 μL无血清培养基,预处理30 min,实验组与Aβ25-35模型组加入浓度为4.141 μmol/L的Aβ25-35溶液10 μL,空白对照组和阴性对照组加入10 μL无血清培养基。每组分别设4个复孔,实验重复3次,在5% CO2、37 ℃条件下继续培养24 h后,用MTT法检测细胞存活率,具体方法参考文献[16]。
1.8 白簕叶总多酚对AAPH诱导的PC12细胞衰老的抵抗作用
1.8.1 AAPH诱导的衰老模型的建立以及给药
当细胞处于对数生长期时,吸去培养液,用PBS洗两次。加入1 mL胰酶使贴壁细胞分散,消化完全后,加入培养液使贴壁细胞悬浮起来,800 r/min 离心3 min以充分去除胰酶。离心后保留细胞沉淀,加入1 mL培养液,用吸管轻轻吹打,使细胞飘浮起来,制成悬液。然后用血球计数板进行细胞计数,最终向每孔加入2 mL 细胞悬液(约200000个细胞)到6孔板中,培养过夜使之贴壁。对照组继续培养,PC12细胞加药组和AAPH组均加入终浓度为1 mmol/L的AAPH,加药组分别另外加入15、30mg/L和60 mg/L的白簕叶总多酚,培养48 h后进行染色并检测,具体方法参考文献[17]。
1.8.2 β-半乳糖苷酶染色
按照试剂盒要求配制染色液,根据白簕叶总多酚对PC12细胞的细胞毒性实验结果,在不显著降低PC12细胞的条件下选取低,中,高共三个浓度梯度进行实验。实验组用15、30 mg/L和60 mg/L的白簕叶总多酚处理后,在超净工作台中弃去旧细胞培养液,每孔加入2 mL的PBS洗涤1次,向每孔加入1 mL预先配制好的固定液,将PC12细胞在室温条件下固定10~15 min;固定后吸去固定液,每孔加入2 mL的PBS 洗涤2次以充分去除残留的固定液,每孔加入1 mL染色液进行染色;将6孔板放入干燥的无CO2的37 ℃培养箱过夜,在倒置显微镜下观察细胞染色情况。
2 结果与分析
2.1 白簕叶总多酚的细胞毒性检测结果
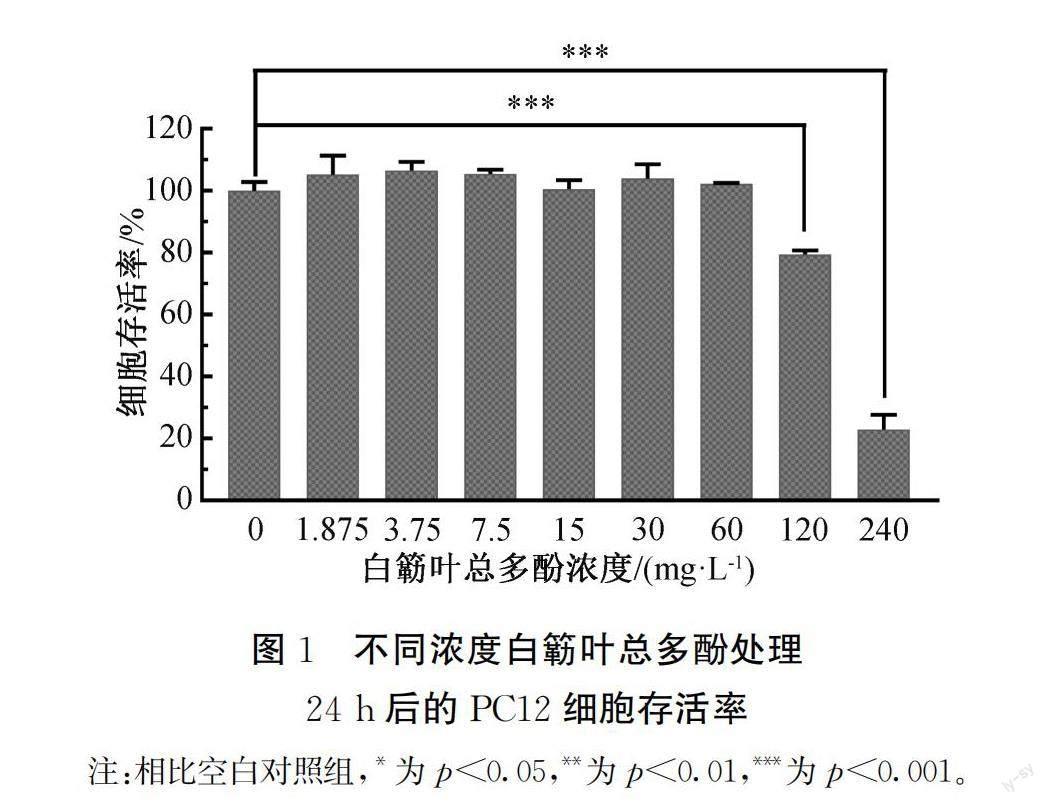
以白簕叶总多酚加药质量浓度-细胞存活率为横纵坐标作图,结果如图1所示。图1表明:当白簕叶总多酚浓度为60 mg/L以下时,PC12细胞的存活率均大于95%,与空白对照组差异不显著(p>0.05),而在质量浓度高于60 mg/L时,细胞存活率明显下降,因此,本文选取干预PC12细胞的白簕叶总多酚最大安全质量浓度为60 mg/L。
2.2 Aβ25-35对PC12细胞损伤浓度的确定
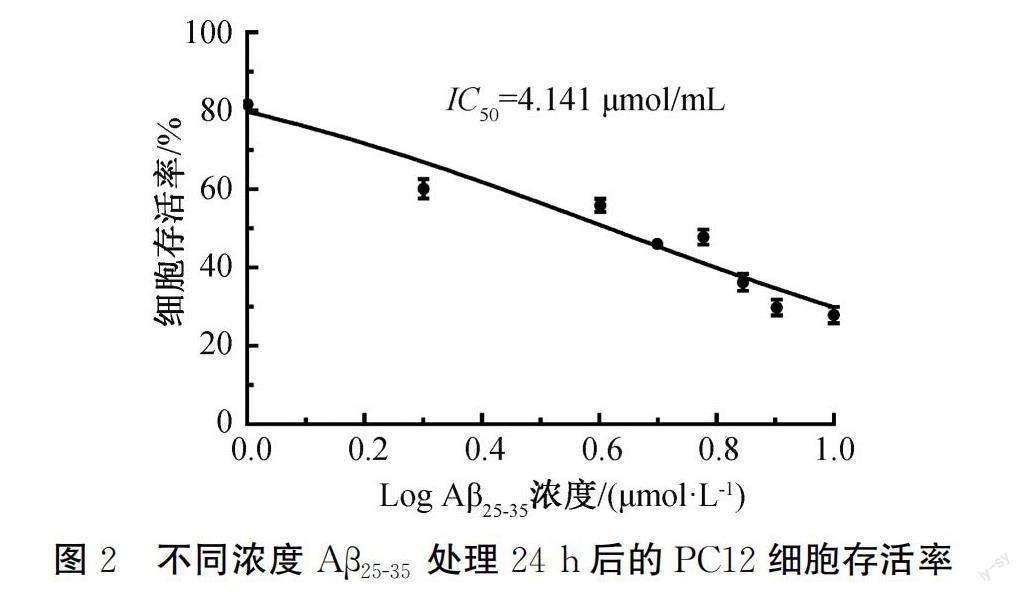
本文通过MTT实验测定不同浓度Aβ25-35处理24 h后的PC12细胞存活率,结果如图2所示。图2表明:在Aβ25-35浓度为1~10 μmol /L范围内,细胞损伤率与Aβ25-35呈浓度依赖性且为正相关。Aβ25-35对PC12细胞的IC50值为4.141 μmol/L,确定其为使用Aβ25-35建立细胞氧化损伤模型的浓度。
2.3 白簕叶总多酚对Aβ25-35诱导的PC12细胞氧化损伤模型的保护作用
为了探究白簕叶总多酚对Aβ25-35诱导的PC12细胞氧化损伤模型的作用,以4.141 μmol/L的Aβ25-35诱导PC12的氧化损伤模型。根据白簕叶总多酚对PC12细胞毒性的检测结果,白簕叶总多酚质量浓度小于60 mg/L时,对PC12细胞的增殖无显著影响,因此加入质量浓度为5、10、20、30、40、50 mg/L和60 mg/L的不同浓度白簕叶总多酚处理,MTT检测细胞存活率结果如图3所示。图3表明:加入质量浓度范围为5~60 mg/L白簕叶总多酚后,PC12细胞存活率显著高于未加入白簕叶总多酚的Aβ25-35模型组,通过白簕叶总多酚对该损伤模型的处理,显著提高了细胞的存活率(p<0.05);白簕叶总多酚对Aβ25-35诱导的PC12细胞氧化损伤具有显著的保护作用,氧化损伤模型的细胞存活率低于50%,且白簕叶总多酚药物组的质量浓度越高,细胞存活率呈现降低趋势,其原因可能是Aβ25-35是一种β淀粉样蛋白,活性受温度及孵育时间的影响,较不稳定,导致实验重复性较低。
2.4 β-半乳糖苷酶染色结果
为了验证白簕叶总多酚对Aβ25-35诱导的PC12细胞氧化损伤模型的作用结果的可靠性,选取AAPH对PC12细胞进行诱导,将不同质量浓度白簕叶总多酚处理后的损伤PC12细胞进行染色,结果如图4所示。图4表明:AAPH模型组的大部分细胞被染为蓝色,β-半乳糖苷酶活性较高,细胞处于衰老状态,未经AAPH诱导的对照组几乎未见染色阳性细胞,而各质量浓度白簕叶总多酚作用后的细胞染色阳性率均明显小于模型组,且在15~60 mg/L浓度范围内,β-半乳糖苷酶染色阳性率细胞数目随着白簕叶总多酚质量浓度增加而减少,白簕叶总多酚对PC12细胞的衰老具有保护作用,且在一定质量浓度范围内随着质量浓度的增加而提高。
3 讨 论
Aβ-淀粉样蛋白与阿尔茨海默病的防治息息相关,Aβ25-35为一种Aβ淀粉样蛋白,其聚集在阿尔茨海默病的发生和发展过程中发挥重要作用。Aβ蛋白通过减少细胞内的抗凋亡因素加速细胞凋亡,使神经元发生坏死[18]。王凯等[19]通过将不同浓度的β淀粉样蛋白Aβ25-35进行侧脑注射,发现Aβ25-35会减退大鼠的记忆能力,损伤大鼠的突出超微结构,使大鼠的海马神经元坏死。付劭静等[20]发现当阿尔茨海默病患者神经功能障碍与认知功能障碍程度加重时,患者血清中的Aβ1-42显著增加,因此通过清除Aβ-淀粉样蛋白防治阿尔茨海默病是阿尔茨海默病药物的重要研究方向之一。利用Aβ25-35诱导的PC12细胞氧化损伤模型寻找防治阿尔茨海默症药物的实验方法的应用较为广泛,王媛等[21]通过建立该模型探究了雌激素受体介导的柚皮苷抗Aβ25-35损伤PC12 细胞凋亡作用。AAPH作为一种自由基诱导剂,是一種含氮的水溶性小分子,在生理温度(37 ℃,pH值7.0)下,能够分解产生自由基。氧气能够快速地和其中含碳的自由基发生反应,生成过氧自由基,且以稳定的速率释放[22],被广泛运用于构建氧化应激模型。本文通过建立Aβ25-35诱导的PC12神经细胞损伤模型与AAPH诱导的PC12细胞氧化损伤模型探究白簕叶总多酚是否能够通过清除Aβ25-35与AAPH达到对大鼠肾上腺嗜铬细胞瘤株PC12细胞的保护效果,结果表明白簕叶总多酚能够有效保护PC12细胞不受氧化损伤,白簕叶总多酚在防治阿尔茨海默病上具有巨大潜力。
4 结 论
本文通过建立Aβ25-35诱导的PC12神经细胞损伤模型与APPH诱导的PC12神经细胞衰老模型,加入不同质量浓度的白簕叶总多酚后测定细胞存活率与β-半乳糖苷酶活性,探究白簕叶总多酚对氧化损伤的PC12细胞的保护作用,主要结论如下:
a)过高质量浓度的白簕叶总多酚对PC12具有毒性。当白簕叶总多酚质量浓度为60 mg/L以下时,PC12细胞的存活率均大于95%,而在质量浓度高于60 mg/L时,细胞存活率明显下降低于95%,因此干预PC12细胞的白簕叶总多酚最大安全质量浓度为60 mg/L。
b)Aβ25-35能够诱导PC12细胞产生氧化损伤,且氧化损伤程度随着Aβ25-35浓度的增加而增加。质量浓度为5~60 mg/L的白簕叶总多酚均可显著提高Aβ25-35诱导的氧化损伤PC12细胞的存活率,对其产生显著的保护作用。
c)AAPH能够诱导PC12细胞的衰老。在15~60 mg/L的浓度范围内,白簕叶总多酚对AAPH诱导的PC12细胞的衰老的保护作用随着白簕叶总多酚浓度的增加而提高。
参考文献:
[1]郭鑫磊, 赵雨晴, 徐汉,等. 响应面法优化超声辅助提取白簕多糖工艺研究[J]. 哈尔滨商业大学学报(自然科学版), 2020, 36(4):398-403.
[2]何冠成, 张旭红, 周露, 等. 白簕粗多糖的脱色纯化及其产物降糖活性研究[J]. 广州中医药大学学报, 2016, 33(6):840-845.
[3]杨慧文, 张旭红, 陈健媚, 等. 白簕叶不同极性部位的体外抗氧化活性分析[J]. 食品研究与开发, 2015, 36(3):14-18.
[4]许东颖, 王玉栋, 潘育方, 等. 白簕黄酮分离纯化及其体外抗氧化性能的研究[J]. 国际医药卫生导报, 2018, 24(24):3711-3716.
[5]朱沅如, 刘悦, 廖程娟, 等. 白簕多糖对1型糖尿病小鼠短链脂肪酸、炎症因子及紧密连接蛋白的影响[J]. 海峡药学, 2022, 34(3):18-23.
[6]张元, 江森, 王真史, 等. 响应面优化法提取白簕总多酚及抗氧化研究[J]. 食品工业. 2015, 36(11):118-122.
[7]Hamid R A, Kee T H, Othman F. Anti-inflammatory and anti-hyperalgesic activities of Acanthopanax trifoliatus (L) Merr leaves[J]. Pharmacognosy research, 2013, 5(2): 129-133.
[8]普元柱, 苏灿. 灯盏细辛及其活性成分防治阿尔茨海默病的药理作用研究进展[J]. 中国中药杂志, 2020, 45(23): 5650-5657.
[9]盛艳梅, 唐绍微, 张静, 等. 3,5-二咖啡酰奎宁酸体外透血脑屏障能力及抗大鼠脑缺血再灌注损伤作用研究[J]. 中药药理与临床, 2016, 32(6):26-29.
[10]Hung T M, Na M, Thuong P T, et al. Antioxidant activity of caffeoyl quinic acid derivatives from the roots of Dipsacus asper Wall[J]. Journal of Ethnopharmacology, 2006, 108(2): 188-192.
[11]Cummings J. New approaches to symptomatic treatments for Alzheimer′s disease[J]. Molecular Neurodegeneration, 2021, 16(1):2.
[12]Dhillon S. Aducanumab: First Approval [J]. Drugs, 2021, 81(12):1437-43.
[13]潘高红, 陈绍宁, 许红亮,等. 鸡血藤总黄酮超声辅助提取工艺优化[J]. 浙江理工大学学报(自然科学版), 2022, 47(4): 623-628.
[14]岑叶盛, 李小龙, 陈淑娟,等. 大孔吸附树脂纯化白簕叶总多酚的工艺优化[J]. 中草药, 2019, 50(13):3071-3076.
[15]杜艳秋, 刘彦宏, 武凤, 等. 圣草酚对β-淀粉样蛋白损伤PC12细胞的保护作用机制研究[J]. 中国临床药理学杂志, 2021, 37(22):3088-3091.
[16]陈明惠, 郑梅竹, 周密, 等. 芍药苷对1-甲基-4-苯基-吡啶离子诱导PC12细胞损伤保护作用的机制[J].中国生物制品学杂志, 2022, 35(6):685-690.
[17]Huo J Y, Ming Y Z, Li H F, et al. The protective effects of peptides from Chinese baijiu on AAPH-induced oxidative stress in HepG2 cells via Nrf2 signaling pathway[J]. Food Science and Human Wellness, 2022, 11(6):1527-1538.
[18]Jeong H, Shin H, Hong S, et al. Physiological Roles of monomeric amyloid-beta and implications for Alzheimer′s disease therapeutics[J]. Experimental neurobiology, 2022, 31(2):65-88.
[19]王凯, 李强, 孙伟明, 等. 不同浓度Aβ25-35蛋白模拟阿尔茨海默病模型学习记忆的差异[J]. 中国比较医学杂志, 2017, 27(3):14-19.
[20]付劭静, 杨月明, 周延华, 等. 阿尔茨海默症患者血清缓激肽、s100β蛋白和Aβ1-42表达水平及与患者神经功能、认知功能的关系[J]. 河北医药, 2022, 44(15): 2245-2249.
[21]王媛, 武凤, 熊辉, 等. 雌激素受体介导的柚皮苷抗Aβ25-35損伤PC12细胞凋亡作用研究[J]. 辽宁中医药大学学报, 2022, 2(8): 1-13.
[22]Noguchi N, Yamashita H, Gotoh N, et al. 2,2′-Azobis(4-methoxy-2,4-dimethylvaleronitrile), a new lipid-soluble azo initiator: application to oxidations of lipids and low-density lipoprotein in solution and in aqueous dispersions. Free Radical Biology & Medicine, 1998,24(2):259-268.
(责任编辑:张会巍)

