2-磺酸-4-硫代丁酸类抗体-药物偶联物连接子的合成
杨丽萍 曹小冬


摘 要: 设计并合成成本低廉但功能相近的Sulfo-SPDB类似物2-磺酸基-4-(三甲苯基硫代)丁酸,以降低抗体-药物偶联物(Antibody-drug conjugate, ADC)亲水性连接子2-磺酸基-4-(2-吡啶二硫代)丁酸(Sulfo-SPDB)的制备成本。以4-巯基丁酸为起始原料,通过取代、磺酰化、还原、巯基保护等四个步骤制得Sulfo-SPDB类似物。通过优化反应条件,目标产物的总产率可达85%;采用质谱、紫外、1H-NMR对产物的结构进行表征和分析,结果显示产物确为目标产物。该合成路线具有原料易得、反应条件温和、操作简便、能耗低等特点,对Sulfo-SPDB衍生物的合成具有借鉴意义。
关键词:抗体-药物偶联物;连接子;2-磺酸基-4-(2-吡啶二硫代)丁酸;2-磺酸基-4-(三甲苯基硫代)丁酸;巯基保护;磺酰化
中图分类号:O622.6
文献标志码:A
文章编号:1673-3851 (2023) 05-0374-05
引文格式:杨丽萍,曹小冬. 2-磺酸-4-硫代丁酸类抗体-药物偶联物连接子的合成[J]. 浙江理工大学学报(自然科学),2023,49(3):374-378.
Reference Format: YANG Liping,CAO Xiaodong. Synthesis of 2-sulfonic acid-4-thiobutanoic acid antibody-drug conjugate linker[J]. Journal of Zhejiang Sci-Tech University,2023,49(3):374-378.
Synthesis of 2-sulfonic acid-4-thiobutanoic acid antibody-drug conjugate linker
YANG Liping, CAO Xiaodong
(School of Science, Zhejiang Sci-Tech University, Hangzhou 310018, China)
Abstract: In order to reduce the preparation cost of antibody-drug conjugate (ADC) hydrophilic linker 2-sulfo-4-(2-pyridinyldithio)-butanoic acid (Sulfo-SPDB), we designed and synthesized the Sulfo-SPDB analogue 2-sulfo-4-trytylthio-butanoic acid with the characteristics of lower cost and similar function. The synthesis started from 4-mercaptobutyric acid, and went through substitution, sulfonylation, reduction, and then protection reaction. By optimizing the reaction conditions, the Sulfo-SPDB analogue was prepared in four steps with a total yield of 85%. The structure of the product was characterized by mass spectrometry, ultraviolet and1H-NMR. The results show that the product is the target product. The synthetic route has the characteristics of few synthetic steps, mild reaction conditions, simple operation, and low energy consumption, and has reference significance for the synthesis of Sulfo-SPDB derivatives.
Key words:ADC; linker; 2-sulfo-4-(2-pyridinyldithio)-butanoic acid; 2-sulfo-4-trytylthio-butanoic acid; mercaptyl protection; sulfonylation
0 引 言
親水性连接子在抗体-药物偶联物(Antibody drug conjugate, ADC)的合成过程中起着至关重要的作用。2-磺酸基-4-(2-吡啶二硫代)丁酸(Sulfo-SPDB)是一种可降解的ADC亲水性连接子,由单克隆抗体与细胞毒性药物共价连接形成,具稳定性和选择性高、表达精准等特点[1-3]。随着ADC开发技术的迭代和临床试验的积累,偶联连接子已被公认是整个ADC设计的关键要素[4-6]。此外,已有研究表明,在连接子中引入极性亲水性基团,是改善某些ADC药物代谢动力学的有效方法[7]。例如,以叶酸受体α(Folate receptor-α, FR-α)为靶点的ADC药物索星-米妥昔单抗,其连接子Sulfo-SPDB中含有极性亲水性磺酸基,因而可克服早期研发药物在血浆循环中不够稳定的缺点[8]。2022年11月1日,索星-米妥昔单抗作为全球首个针对FR-α阳性卵巢癌的ADC药物,获得美国食品药品监督管理局的批准,并成功上市。
2-磺酸基-4-(2-吡啶二硫代)-丁酸(3)是合成Sulfo-SPDB类似物的关键中间体,其合成收率和成本会直接影响偶联药物的成本和收率。目前大多数文献报道的Sulfo-SPDB中间体2-磺酸基-4-(2-吡啶二硫代)-丁酸(3)均以2,4-二溴丁酸甲酯为起始原料,经过两次硫代乙酸酯取代引入巯基,经过氧化氢和乙酸氧化巯基得到磺酸基,再在强碱条件下水解便可得到羧酸[9]。然而,此合成路线经过5步反应,存在很多不利因素:首先,二溴原料价格昂贵,取代溴需在-20 ℃低温下反应,且容易产生副产物,导致后处理及纯化困难;其次,引入磺酸基是通过巯基氧化实现,反应用到双氧水和乙酸,且需要过夜,存在较大的安全隐患;最后,水解反应的产物极性大、亲水性强,难以纯化。总之,该合成方法操作复杂,反应时间长,成本高,并且存在安全隐患,在放大反应中应用受限。通过重新设计Sulfo-SPDB的关键中间体2-磺酸基-4-(2-吡啶二硫代)-丁酸的合成路线,优化新路线的反应条件和工艺,并进一步衍生2-磺酸基-4-(2-吡啶二硫代)-丁酸,以制备巯基用三苯甲基保护的Sulfo-SPDB类似物,有望拓展Sulfo-SPDB衍生物在ADC药物研发中的应用。
本文以4-巯基丁酸为起始原料,通过取代、磺酰化、还原、巯基保護制得Sulfo-SPDB类似物。通过优化反应条件,得到最佳合成路线,并利用质谱、紫外和1H-NMR对所得产物的结构进行表征。该合成路线操作简便、耗时短、成本低,易于放大生产。
1 实验部分
1.1 实验主要材料
N,N-二甲基甲酰胺(DMF)、二氯甲烷(DCM)、二氯乙烷(DCE)、甲醇(MeOH)和四氢呋喃(THF)均为分析纯,购于上海炎泽化工有限公司;N,N-二异丙基乙胺(DIPEA)和氯磺酸均为分析纯,购于上海阿拉丁生化科技股份有限公司;2,2′-二硫二吡啶和4-巯基丁酸均为分析纯,购于上海毕得医药科技股份有限公司;三甲基磷(PMe3)和三苯基氯甲烷(TrtCl) 均为分析纯,购于上海麦克林生化科技股份有限公司。
1.2 实验主要仪器
AVANCE AV400 MHz型核磁共振波谱仪;Micromass Quattro Micro型液质联用质谱仪;Biotage Isolera Prime型快速制备液相色谱;UV-2600型紫外分光光度仪。
1.3 Sulfo-SPDB类似物的合成
Sulfo-SPDB类似物的合成路线如图1所示。以4-巯基丁酸为起始原料,通过取代、磺酰化制得2-磺酸基-4-(2-吡啶二硫代)-丁酸,随后经还原、巯基保护制得Sulfo-SPDB类似物2-磺酸基-4-(三甲苯基硫代)丁酸。
1.3.1 中间体(2)的合成
在100 mL的圆底烧瓶中加入11.0 g (50 mmol)2,2′-二硫二吡啶,加入MeOH (30 mL) 使2,2′-二硫二吡啶溶解,搅拌0.5 h后,加入5.0 g (41 mmol)4-巯基丁酸,将混合物在室温下搅拌12 h[10]。随后将反应溶液通过反向硅胶色谱柱纯化(CH3CN/H2O=2/3),冻干,得到7.7 g白色固体产物,经计算产率为82%。LCMS [M+H]+=230.0。
1.3.2 中间体(3)的合成
将2.7 g (11 mmol)4-(2-吡啶二硫代)-丁酸溶于DCE(40 mL)中,加入6.8 g (58 mmol) ClSO3H和3.0 g (23 mmol)DIPEA,接着将混合物在75 ℃搅拌40 min,随后将混合物浓缩并倒入冰水中,并用Na2CO3将混合物pH调至7。将浓缩后的混合物通过反向硅胶色谱柱纯化 (MeOH/5‰AcOH=1/3),得到3.4 g黄色油状产物,经计算产率为88%。LCMS [M-H]+=308.0。
1H NMR (400 MHz, D2O) δ 8.36 (d, J=5.1 Hz, 1H), 7.87 (q, J=8.1 Hz, 2H), 7.32 (t, J=6.0 Hz, 1H), 3.77 (dt, J=24.5, 12.2 Hz, 1H), 3.70-3.55 (m, 3H), 3.11 (q, J 7.4 Hz, 3H), 2.83 (dd, J=28.4, 13.8, 7.0 Hz, 2H), 2.30-2.15 (m, 2H), 1.25 (d, J=6.6 Hz, 14H).
1.3.3 中间体(4)的合成
将2.0 g (6.45 mmol) 2-磺酸基-4-(2-吡啶二硫代)-丁酸溶于THF(20 mL)中,接着加入PMe3(19 mL),并将混合物在室温下搅拌30 min直到溶液变得清澈,然后经浓缩溶液得到油状物[11],随后加入乙醚(50 mL)并洗涤3次,倒出乙醚层,烘干,便可得到1.2 g黄色油状产物,经计算产率为92%。LCMS [M-H]+ = 199.0。
1.3.4 Sulfo-SPDB类似物(5)的合成
将4-巯基-2-磺基丁酸粗品溶于DMF中,并且加入至2.9 g (10 mmol) TrtCl中,然后将混合物在室温下搅拌1.5 h。接着将反应液浓缩,通过反相硅胶色谱柱纯化(CH3CN/H2O=2/3),得到2.4 g黄色固体产物,经计算产率为85%。LCMS [M-H]+=441.0。
1H NMR (400 MHz, DMSO) δ 7.34 (s, 1H), 7.33 (d, J=1.4 Hz, 4H), 7.31 (s, 2H), 7.29 (d, J=1.8 Hz, 5H), 7.27 (t, J=1.5 Hz, 2H), 7.26-7.22 (m, 4H), 3.65-3.54 (m, 1H), 3.29 (dd, J=9.7, 4.4 Hz, 1H), 3.14 (dd, J=7.4, 4.3 Hz, 1H), 2.12-1.99 (m, 3H).
1.4 测试与表征
1.4.1 质谱法
用乙腈作为流动相,采用Micromass Quattro Micro 液质联用质谱仪测试Sulfo-SPDB类似物合成过程中中间体(2)、(3)、(4)以及目标产物Sulfo-SPDB类似物(5)的质谱。
制样方法:取待测样品5 mg于离心管中,加入乙腈1 mL,超声助溶,用滤头过滤制得滤液样品,待测试。
1.4.2 薄层层析法(TLC)
以硅胶 GF254与羧甲基纤维素钠制成薄层板。待分析样品溶解于乙腈或甲醇后用毛细管点样。以石油醚和乙酸乙酯配置一定比例的展开剂,并上行展开。在254 nm紫外灯下找出展层板上的吸收斑点。
2 结果与讨论
2.1 中间体(2)、(3)、(4)和Sulfo-SPDB类似物(5)的质谱分析
对中间体(2)、(3)、(4)和Sulfo-SPDB类似物(5)进行质谱分析测试,结果如图2所示。图2(a)展示了中间体(2)在质谱ESI正模式下测试所得的谱图;由图2(a)可知,在质谱正离子模式下中间体(2)出现较强的[M+H]+分子离子峰m/z 230.3,与中间体(2)的理论分子量229.02相吻合。图2(b)展示了中间体(3)在质谱ESI负模式下测试所得的谱图;由图2(b)可知,在质谱负离子模式下中间体(3)出现较强的[M-H]+分子离子峰m/z 308.1,与中间体(3)的理论分子量309.37相吻合。图2(c)展示了中间体(4)在质谱ESI负模式下测试所得的谱图;由图2(c)可知,在质谱负离子模式下中间体(4)出现较强的[M-H]+分子离子峰m/z 199.0,与中间体(4)的理论分子量199.98相吻合。图2(d)是Sulfo-SPDB类似物(5)在质谱ESI负模式下测试所得的谱图;由图2(d)可知,在质谱负离子模式下出现较强的[M-H]+分子离子峰m/z 441.1,与Sulfo-SPDB类似物(5)的理论分子量442.09相吻合。
2.2 Sulfo-SPDB类似物的合成过程分析
本文直接尝试在氯磺酸中进行中间体(3)的合成。待反应结束后,经冰水淬灭,采用氢氧化钠和盐酸调节合成物的pH,直至pH为5。然而,在浓缩后用反相柱层析纯化得到产物的收率仅为10%。考虑到直接在氯磺酸中进行磺酰化反应,反应过于剧烈,反应温度不易控制,会引起很多副反应,导致反应收率和纯化效率都很低,因此本文优化后的反应是在二氯乙烷溶剂、氯磺酸和DIPEA混合物中进行。这样大大降低了反应液的强酸性以及氯磺酸浓度,使得磺酰化反应更温和、更干净。反应结束后冰水淬灭,用碳酸钠调节合成物的pH为5,采用同样的柱层析纯化处理得到产物,收率为77.7%。
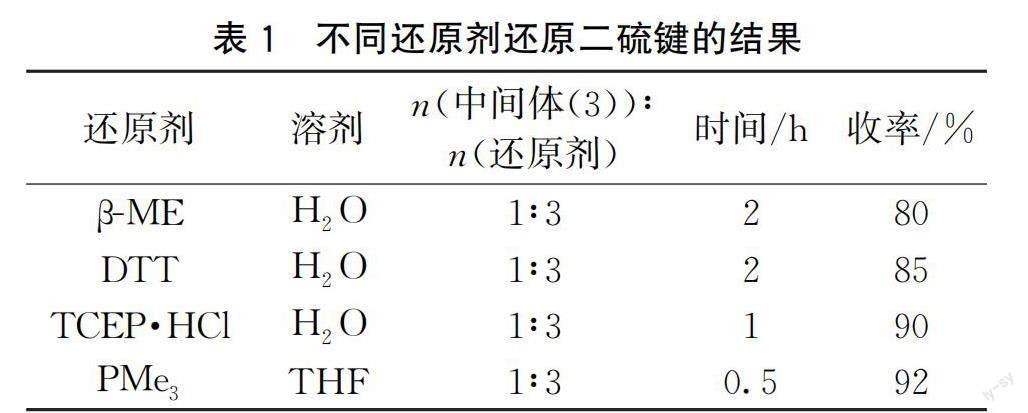
针对第三步将中间体(3)的二硫键还原为巯基,本文尝试用还原剂三(2-甲酰乙基)膦盐酸盐(TCEP·HCl)、二硫苏糖醇(DTT)、PMe3以及β-巯基乙醇(β-ME)还原二硫键,结果如表1所示。采用这几种还原剂都得到了较好的收率(80%~95%)。相比之下,β-ME还原性较差,挥发性强,且有恶臭味,稳定性也不佳,在空气中会被氧化为二硫化物,影响其还原效果;DTT的还原性强于β-ME,并且刺激性和毒性也低于β-ME,但其稳定性也较差,在空气中易被氧化;TCEP·HCl和PMe3的还原性和稳定性均强于DTT和β-ME,TCEP·HCl后处理需要将大量水相冻干,耗时耗能,不利于放大生产;PMe3作还原剂,可在有机溶剂中进行,反应时间短,后处理只需乙醚打浆后过滤即可。综合考虑,本文选择PMe3为还原剂。
为了在新型连接子中继续使用化合物(4),需要对化合物(4)中的巯基进行保护,保留羧基官能团用于后续反应。以DMF作溶剂、DIPEA作碱的条件下,用TrtCl保护巯基[12],反应经后处理纯化后,收率只有10%。通过1H-NMR和质谱分析,发现中间体(3)中还含有DIPEA。这可能是化合物(4)中的强酸基团磺酸基跟DIPEA形成了盐,影响了巯基反应,且通过后处理、纯化过程难以去除。本文尝试在无碱的条件下,DMF溶剂中只加入TrtCl进行反应。反应结束后,将反应液直接浓缩,通过反相柱层析纯化得到产品Sulfo-SPDB类似物(5),产率提高至85%。
3 结 论
本文以4-巰基丁酸为起始原料,通过取代、磺酰化制得Sulfo-SPDB连接子的关键中间体2-磺酸基-4-(2-吡啶二硫代)-丁酸,然后经还原和巯基保护后制得Sulfo-SPDB类似物,对合成工艺进行优化,并对Sulfo-SPDB类似物进行表征,得出以下主要结论:
a)合成了Sulfo-SPDB类似物,通过1H-NMR和质谱证明了目标产物的成功合成,总产率为85%,在水中有较好的溶解度,且具有很好的稳定性。
b)确定合成工艺中磺酰化的条件为二氯乙烷作溶剂、DIPEA作碱;还原二硫键的条件为以THF作溶剂、PMe3为还原剂;保护巯基的条件为以DMF作溶剂、TrtCl作保护基。
参考文献:
[1]Tarantino P, Carmagnani Pestana R, Corti C, et al. Antibody-drug conjugates: Smart chemotherapy delivery across tumor histologies[J]. CA: A Cancer Journal for Clinicians, 2022, 72(2): 165-182.
[2]Beck A, Haeuw J F, Wurch T, et al. The next generation of antibody-drug conjugates comes of age[J]. Discovery Medicine, 2010, 10(53): 329-339.
[3]Fu Z W, Li S J, Han S F, et al. Antibody drug conjugate: the “biological missile” for targeted cancer therapy[J]. Signal Transduction and Targeted Therapy, 2022, 7(4): 1066-1090.
[4]Moore K N, Martin L P, OMalley D M, et al. Safety and activity of mirvetuximab soravtansine (IMGN853), a folate receptor alpha-targeting antibody-drug conjugate, in platinum-resistant ovarian, fallopian tube, or primary peritoneal cancer: a phase I expansion study[J]. Journal of Clinical Oncology: Official Journal of the American Society of Clinical Oncology, 2017, 35(10): 1112-1118.
[5]Whiteman K R, Johnson H A, Sun X X, et al. Anti-tumor activity and pharmacokinetics of the anti-FOLR1-maytansinoid conjugate IMGN853 is maintained over a wide range of maytansinoid-to-antibody ratios[J]. Cancer Research, 2012, 72(8): 4628-4628.
[6]Salomon P L, Singh R. Sensitive ELISA method for the measurement of catabolites of antibody-drug conjugates (ADCs) in target cancer cells[J]. Molecular Pharmaceutics, 2015, 12(6): 1752-1761.
[7]Beck A, Goetsch L, Dumontet C, et al. Strategies and challenges for the next generation of antibody-drug conjugates[J]. Nature Reviews Drug Discovery, 2017, 16(5): 315-337.
[8]Ab O, Whiteman K R, Bartle L M, et al. IMGN853, a folate receptor-α (FRα)-targeting antibody-drug conjugate, exhibits potent targeted antitumor activity against FRα-expressing tumors[J]. Molecular Cancer Therapeutics, 2015, 14(7): 1605-1613.
[9]Zhao R Y, Wilhelm S D, Audette C, et al. Synthesis and evaluation of hydrophilic linkers for antibody-maytansinoid conjugates[J]. Journal of Medicinal Chemistry, 2011, 54(10): 3606-3623.
[10]Jayasinha Arachchige R M. Development of new paramagnetic tags for solid state NMR structural studies of natively diamagnetic proteins[D]. Columbus: The Ohio State University, 2014: 18-22.
[11]Jones A C, Nicholson W I, Smallman H R, et al. A robust Pd-catalyzed C-S cross-coupling process enabled by ball-milling[J]. Organic Letters, 2020, 22(19): 7433-7438.
[12]張盼盼, 郑土才, 陶仁江, 等. 三苯甲基类保护基在有机合成中的应用进展[J]. 合成化学研究, 2014(1):28-40.
(责任编辑:刘国金)

