金鱼体内吡虫啉及其代谢产物的检测方法
徐王晖,侯佳音,周忠静,俞建忠,章陆陆,3,杜晓华,陈列忠*
(1. 浙江工业大学化学工程学院,杭州 310014;2.浙江省农业科学院农产品质量安全危害因子与风险防控国家重点实验室,杭州 310021;3.宁波大学食品与药学学院,浙江宁波 315832)
吡虫啉(Imidacloprid),分子式为C9H10ClN5O2,化学名称为(E)-1-(6-氯吡啶-3-吡啶基甲基)-N-硝基亚咪唑烷-2-基胺,结构式见图1,是第一代新烟碱类杀虫剂,自1991年投放市场以来,已在120多个国家登记使用[1]。由于使用量大,使用范围广,又具有较好的水溶性和环境稳定性,吡虫啉已在世界各地的水体中形成了较为普遍的残留污染[2-3],对环境和环境生物存在潜在的危害风险。已有研究表明,吡虫啉会影响非靶标生物的健康状态,如:会引发斑马鱼肠道组织的损伤和氧化应激,轻微诱发肠道菌群失调和特定细菌改变[4];诱导雄性小鼠产生氧化应激[5];具有肝毒性,并导致大鼠雄性生殖系统受损[6-7]。

图1 吡虫啉结构式
目前,国内外关于吡虫啉在哺乳动物、植物以及昆虫中的代谢产物已有较多报道,常见代谢产物有5-羟基吡虫啉、4,5-二羟基吡虫啉、烯式吡虫啉、吡虫啉亚硝基亚胺、吡虫啉脲、6-氯烟酸等(表1),在不同生物体内的代谢途径主要有反硝化作用、硝基还原、氧化、水解等(图2)。但是关于吡虫啉在水生生物中代谢的研究仍较少。而鱼类作为水生生物中重要的一环,在研究吡虫啉在生物体中的代谢时,理应受到关注。金鱼(Carassius auratus)属于鲤科鲫属鱼类,是一种中国特色的水生生物,故本文选用金鱼作为研究生物,更能体现吡虫啉对水生生物的影响。

表1 吡虫啉在生物体内的常见代谢物
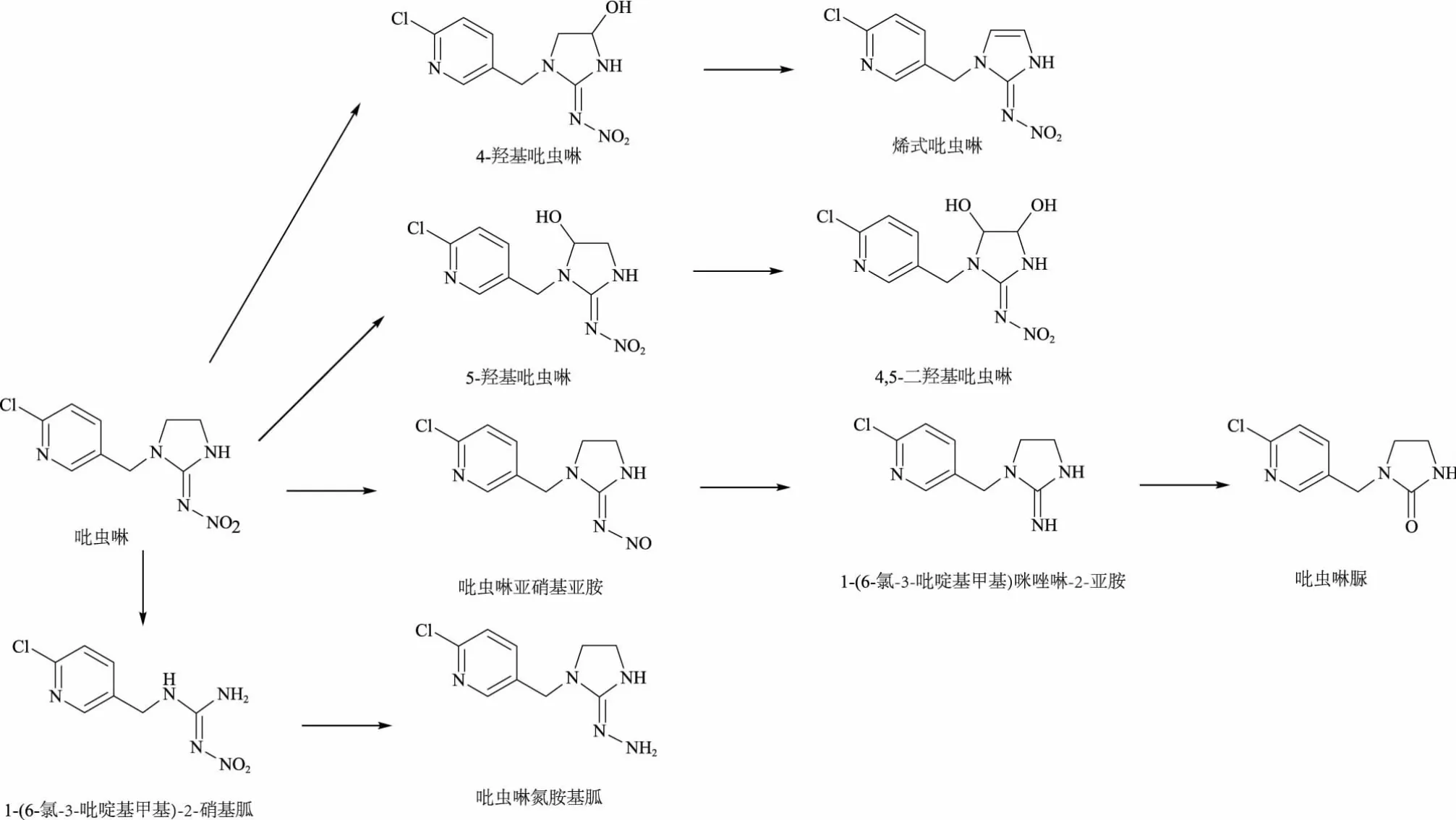
图2 生物体内吡虫啉的降解途径[1]
本研究以金鱼作为研究对象,采用高效液相色谱-质谱联用法测定了吡虫啉在金鱼体内主要的代谢产物,探究吡虫啉及代谢物含量的定量测定方法,可为后续进一步进行吡虫啉对金鱼的毒理学评估提供技术支持。
1 材料与方法
1.1 仪器与试剂
仪器:SCIEX 5500+高效液相三重四极杆串联质谱仪,美国爱博才思公司;Eclipse C18柱,美国安捷伦公司;Sartorius BSA124S万分之一天平,德国赛多利斯公司;LC-DCY-12SF水浴氮吹仪,上海力辰仪器科技有限公司。
试剂:吡虫啉(纯度95%),上海源叶生物科技有限公司;吡虫啉标准品(纯度98%),上海安谱实验科技股份有限公司;100 mg/L吡虫啉脲-甲醇标准溶液、100 mg/L烯式吡虫啉-甲醇标准溶液、100 mg/L 5-羟基吡虫啉-甲醇标准溶液、100 mg/L 6-氯烟酸-甲醇标准溶液,天津阿尔塔科技有限公司;甲醇(色谱级)、乙酸乙酯(色谱级),美国密理博公司;纯净水,屈臣氏有限公司。
1.2 试验材料与处理
金鱼(Carassius auratus)成鱼,购自杭州市凤起花鸟市场。所有金鱼在正式试验前均在实验室驯养1周以上。驯养条件如下:试验用水为曝气除氯的自来水,pH为7.0~8.5,温度为(20.9±0.4)℃,溶解氧为6.9±0.2 mg/L,养殖用水符合GB11607—1989《渔业水质标准》[13]的规定。在正式处理开始前,按1.5中的检测条件对驯化后的金鱼进行随机检测,结果为其体内没有吡虫啉及其代谢物的存在。
金鱼处理:驯化后的金鱼随机分成对照组和两个吡虫啉处理组,根据吡虫啉对金鱼的安全浓度,设置处理浓度分别为20 mg/L和40 mg/L[14]。暴露时间为28 d,在每一试验组随机放入60尾金鱼,养殖密度为4尾/L。在试验开始前以及暴露2 h、6 h、1 d、3 d、5 d、7 d、14 d和28 d从各试验组随机取出5条鱼,解剖,取每条金鱼肝脏、肠道、肌肉、鳃组织、脑组织和性腺于EP管中,样品保存于-80℃冰箱中,待分析。
1.3 样品前处理
取金鱼组织样本置于20 mL离心管中,然后加入适量乙酸乙酯溶液,涡旋混匀1 min,再加入1 g无水MgSO4和0.5 g硅藻土,涡旋混匀1 min后在室温下超声10 min,之后以4 000 r/min在4℃下离心10 min,取上层清液,氮吹至干,以甲醇定容至1 mL后过膜分析。
1.4 标准溶液的制备
用分析天平准确称取吡虫啉标准品0.010 0 g,将称好的样品放置在100 mL容量瓶中,以甲醇为溶剂,并用超声使样品溶解完全,定容至刻度线,配制成100 mg/L的储备液。分别移取吡虫啉、吡虫啉脲、烯式吡虫啉、5-羟基吡虫啉和6-氯烟酸的标准溶液各100 μL至10 mL容量瓶中,用甲醇定容至刻度,配制成1 μg/L的混标溶液,避光保存于-20℃冰箱中备用。
1.5 色谱质谱条件
1.5.1 液相色谱条件
液相色谱柱:Eclipse C18柱(1.8 μm,3.0 mm×100 mm);柱温:40℃;进样体积:2 μL;流速:5 μL/s;流动相:水相为0.1%甲酸水,有机相为甲醇,采用梯度洗脱,洗脱程序如表2。

表2 液相色谱检测吡虫啉及代谢物梯度洗脱程序
1.5.2 质谱条件
质谱离子源:电喷雾离子源ESI;离子化模式:正离子模式;扫描方式:选择离子反应监测模式(SRM);喷雾电压:4 000 V;温度:200℃;鞘气和辅助气均为高纯氮气,压力均为413.7 kPa;离子传输毛细管温度:450℃。
2 结果与分析
2.1 金鱼体内吡虫啉代谢物的定性分析
取吡虫啉处理后的金鱼组织样本进行液质分析。选择全离子扫描模式对m/z 50~1 000范围内的离子对进行全扫描。对比吡虫啉代谢物的质谱标准谱库信息可知,质荷比在256.2、212.2、254.2、223.1、171、155.9、128.1、112.1范围左右存在重合,故推测出吡虫啉在金鱼体内可能代谢成吡虫啉脲、烯式吡虫啉、5-羟基吡虫啉和6-氯烟酸,其离子碎片信息(表3)和液相色谱图如图3所示。

表3 吡虫啉及其代谢物离子碎片信息

图3 吡虫啉及其代谢物液相色谱图
2.2 前处理条件的优化
分别选择2∶1、1∶1、1∶2不同比例的乙酸乙酯-水混合溶液以及9、12 mL和18 mL不同用量的乙酸乙酯-水混合溶液,考察其在金鱼组织样品中对吡虫啉及其代谢物的提取效率,结果如图4~5所示。检测结果显示,当乙酸乙酯∶水比例为2∶1,用量为12 mL时,对金鱼组织中吡虫啉及其代谢物回收率最高。
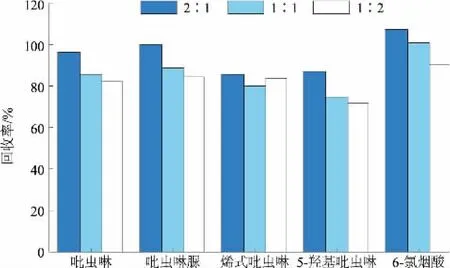
图4 不同比例的乙酸乙酯-水混合溶液对金鱼组织中吡虫啉及其代谢物的提取效果
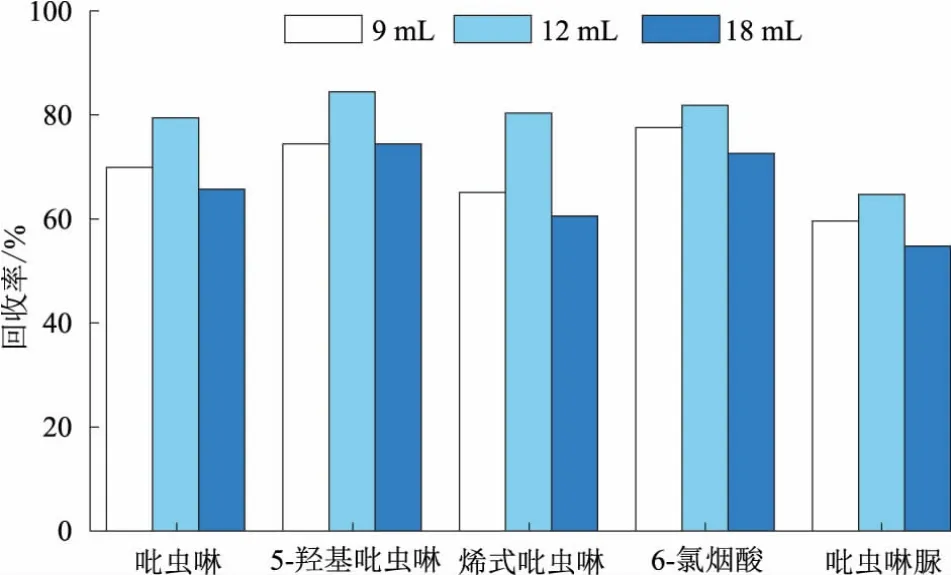
图5 不同用量的乙酸乙酯-水混合溶液对金鱼组织中的吡虫啉及其代谢物的提取效果
2.3 方法学考察
2.3.1 方法的线性关系
在0.1~100 μg/L质量浓度标准曲线范围内,吡虫啉及其代谢物峰面积与质量浓度呈现良好的线性关系,相关系数均大于0.99,线性范围和相关系数见表4。

表4 吡虫啉及其代谢物标准曲线的回归方程、线性范围和相关系数
2.3.2 方法的检测限和定量限
向空白处理的组织样本中添加待测的组分,按“信噪比”法,测定信噪比为3∶1时,添加的化合物的量为方法的检出浓度;测定信噪比为10∶1时,添加的化合物的量为方法的最低定量浓度。测得吡虫啉、吡虫啉脲、烯式吡虫啉、5-羟基吡虫啉、6-氯烟酸的检测限分别为0.001、0.009 9、0.001 1、0.006 8 μg/L和0.005 6 μg/L,定量限分别为0.003 34、0.032 907、0.003 519、0.022 718 μg/L和0.018 682 μg/L。
2.3.3 方法精密度
在选定的分析条件下,对同一个吡虫啉及其代谢物混标溶液(10 μg/L)平行测定5次,计算吡虫啉及其代谢物的标准偏差和相对标准偏差。由表5可知,吡虫啉、吡虫啉脲、烯式吡虫啉、5-羟基吡虫啉、6-氯烟酸的标准偏差分别为0.369 3、0.215 2、0.396 8、0.298 8和0.265 6,相对标准偏差分别为3.41%、1.98%、3.79%、2.84%和2.64%。所有相对标准偏差均小于4%,则该方法的重现性好、精密度高。

表5 吡虫啉及其代谢物的精密度试验结果
2.3.4 方法准确度
取空白处理的金鱼组织样本,在其中添加待测的组分,按优化后的前处理方法进行处理,按照选定的色谱条件测定样品中的吡虫啉及其代谢物的含量,计算平均回收率。吡虫啉、吡虫啉脲、烯式吡虫啉、5-羟基吡虫啉、6-氯烟酸的平均回收率分别为96.08%,99.77%,85.25%,87.24%和100.23%(表6),表明该方法的准确度满足农药残留测定的要求。

表6 吡虫啉及其代谢物的添加回收率
2.4 样品检测
染毒浓度依据吡虫啉对鲫鱼的CL50设置[14],分别用20 mg/L和40 mg/L的吡虫啉染毒,28 d后取金鱼的组织样本。按照优化后的提取方法进行提取,再进行LC/MS分析。结果测得金鱼体内吡虫啉的含量在1 000~6 500 ng/g之间,20 mg/L吡虫啉处理中残留量最高的组织是肠道。吡虫啉的主要代谢产物是吡虫啉脲和5-羟基吡虫啉,体内残留量分别为50~400 ng/g和30~300 ng/g;少量代谢成6-氯烟酸和烯式吡虫啉,含量分别为0.2~2 ng/g和0.5~5 ng/g(图6)。
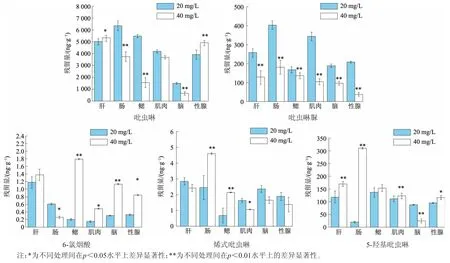
图6 金鱼体内吡虫啉及其代谢物含量
3 结论
本研究采用高效液相色谱-质谱联用法确定了吡虫啉在金鱼体内的代谢产物为吡虫啉脲、烯式吡虫啉、5-羟基吡虫啉和6-氯烟酸,并且建立了准确的测量方法。该方法的精密度和准确度较高,线性关系良好,是一种可行的分析方法,可以用于金鱼体内的吡虫啉及其代谢物的定性以及定量分析。

