响应面法优化禾谷镰刀菌产脱氧雪腐镰刀菌烯醇及其衍生物的液体培养条件
赵秀英, 黄晴雯, 曹浩杰, 王杰, 李瑞姣,聂冬霞, 韩铮, 赵志辉*
(1.上海海洋大学食品学院,上海 201306;2.上海市农业科学院,农产品质量标准与检测技术研究所,上海 201403)
脱氧雪腐镰刀菌烯醇(deoxynivalenol,DON)又称呕吐毒素,主要是由禾谷镰刀菌(Fusarium graminearum)和黄色镰刀菌(Fusarium culmorum)产生的次级有毒代谢产物[1‑2]。DON 具有细胞毒性、遗传毒性、免疫毒性等多种毒性,是世界各地谷类作物的常见污染物[3-5],已被联合国粮农组织(Food and Agriculture Organization of the United Nations,FAO)和世界卫生组织(World Health Organization,WHO)确定为较危险的自然发生食品污染物之一[6-8]。鉴于其较高的毒性和普遍污染的特性,世界各国组织都规定了谷物和谷物制品中DON 的最大容许限度,欧洲共同体委员会(European Community ,EC)确定了未加工谷物(硬粒小麦、燕麦和玉米除外)中DON 的限量为1 250 µg·kg−1,未加工的硬粒小麦和燕麦为1 750 µg·kg−1[9]。我国规定小麦、面粉、玉米和玉米粉等谷物及其制品中DON 含量均不得高于1 000 µg·kg−1[10]。
镰刀菌在适宜条件下不仅会产生原型DON,也会生成其乙酰化衍生物,DON 的乙酰化主要发生在3’和15’位点,分别为3-乙酰基脱氧雪腐镰刀菌烯醇(3-acetyldeoxynivalenol,3-ADON)和15-乙酰基脱氧雪腐镰刀菌烯醇(15-acetyldeoxyniva‑lenol,15-ADON)。不同种的镰刀菌菌株可以产生不同化学型的真菌毒素。例如,禾谷镰刀菌可同时产生DON 和15-ADON 或者DON 和3-ADON,并且它们的分布随地理位置和采样年份会发生变化[11‑12]。DON 及其衍生物在小麦等谷物中普遍存在,继而对人类和动物的安全造成严重威胁,因此,需重视DON 乙酰化产物的相关研究。乙酰化DON 是DON 生物合成的直接前体,其产生受到菌株自身特性、外界环境(如营养成分、培养条件等)的共同调节。前人关于DON 及其衍生物发生规律的研究主要集中于小麦、玉米、大米等固体培养基中[13-15]。但是,固体培养基中的主要影响因素和条件如培养基的成分、初始pH、菌丝量等难以控制和测量,因此难以精确分析各因素对菌株生长和毒素产生的影响。液体发酵可以精确调控相关影响因素,并且获得大量菌丝体或代谢产物,且培养周期短,更易于扩大培养[16‑17]。因此,研究液体基质中DON 原型和乙酰化DON 的产生规律具有重要意义,可更好地确定产毒的最佳营养和环境参数。
本研究采用液体培养法对禾谷镰刀菌的产毒条件进行优化,通过响应面法分析不同培养基组成(碳源、氮源等的含量)和不同培养条件(培养时间、培养温度、初始pH 等)对DON 及其乙酰化衍生物产生的影响,欲明确禾谷镰刀菌产毒的主要影响因素,为农产品中DON 及其衍生物的污染防控提供理论依据。
1 材料与方法
1.1 材料与仪器
试验试剂:甲醇、乙腈(色谱纯)购于美国Merck公司;乙酸铵购于美国CNW公司;葡萄糖、乙酸钠、硝酸钾(KNO3)、磷酸二氢铵(NH4H2PO4)、氯化钾(KCl)、磷酸二氢钾(KH2PO4)、七水合硫酸镁(MgSO4·7H2O)、七水合硫酸亚铁(FeSO4·7H2O)、七水合硫酸锌(ZnSO4·7H2O)(分析纯)购于上海源叶生物科技有限公司;DON、3-ADON、15-ADON标准品购于青岛普瑞邦生物工程有限公司;PDA培养基购于北京沃凯生物科技有限公司;Milli-Q超纯水购于美国Millipore公司。
试验仪器:Heraguard ECO 超净台(美国Thermo Fisher 公司)、MJ-300 霉菌培养箱(上海般诺生物科技有限公司)、CL-40L 高压灭菌锅(日本ALP 公司)、ST16R 冷冻离心机(美国Thermo Scientific 公司)、HSC-24B 氮吹仪(上海楚定分析仪器有限公司)、TH-2500 超声波清洗仪(上海安谱试验科技股份有限公司)、ST3100 pH 计(奥豪斯仪器(常州)有限公司)、ACQUITY UPLC 超高效液相色谱仪(美国Waters 公司)和TRIPLE QUADTM 5500 三重四级杆质谱仪(美国AB SCIEX公司)。
禾谷镰刀菌株1096 由上海市农业科学院农产品质量标准与检验技术研究所真菌毒素研究室提供,购自德国微生物菌种保藏中心(Deutsche Sammlung von Mikroorganismen und Zellkulturen,DSMZ)。
1.2 试验方法
1.2.1菌株的活化 将禾谷镰刀菌菌株1096 接种在PDA 平板培养基中央,置于28 ℃培养箱内,黑暗条件下培养5 d,用于后续接种。
1.2.2菌株的液体培养 在超净工作台内用直径为1 cm的打孔器取1个活化菌种的外圈菌饼,接种到灭菌后的液体培养基内,用无菌封口膜包扎好后放入恒温培养箱内静置培养。培养结束后过滤分离菌丝和滤液,菌丝于60 ℃干燥,称重。
1.2.3液体培养基配方优化 固定无机盐成分和比例(KCl 2 g·L−1,KH2PO40.5 g·L−1,MgSO4·7H2O 0.7 g·L−1,FeSO4·7H2O 15 mg·L−1,ZnSO4·7H2O 20 mg·L−1),以培养基成分中的葡萄糖、乙酸钠、KNO3、NH4H2PO4的质量浓度为单因素自变量[18‑19],考察葡萄糖质量浓度分别为10、20、30、40、50 g·L−1,乙酸钠质量浓度分别为0、0.5、1.0、1.5、2.0 g·L−1,KNO3质量浓度分别为0、0.5、1.0、1.5、2.0 g·L−1,NH4H2PO4质量浓度分别为0、0.5、1.0、1.5、2.0 g·L−1时对毒素含量及菌丝量的影响,28 ℃黑暗培养2周,每组3个平行,优化最佳的培养基成分配比。
1.2.4培养条件优化 以培养时间、培养温度、初始pH为单因素自变量[20-22],固定培养基初始pH为6,培养温度为28 ℃,考察培养时间分别为5、10、15、20、25 d 时对毒素含量及菌丝量的影响;固定培养基初始pH为6,培养时间15 d,培养温度分别为15、20、25、28、31 ℃时对毒素含量及菌丝量的影响;固定培养时间为15 d,培养温度为28 ℃,初始pH 分别为4、5、6、7、8 时对毒素含量及菌丝量的影响,每组试验重复3次。
1.2.5响应面法确定最佳培养条件 综合以上培养条件单因素试验结果,选取合适的单因素范围,以毒素的产出量为响应值,根据Box-Behnken 原理设计响应面曲面分析试验,确定最佳培养条件。使用Design Expert 8.0.6 进行试验设计和数据分析,试验因素和水平如表1所示。

表1 响应面试验因素与水平Table 1 Response surface experiment factors and levels
1.2.6样品处理及分析 样品处理:培养结束后,精确吸取5 mL 滤液于50 mL 离心管中,加入20 mL乙腈,超声提取30 min后,4 500 r·min−1离心10 min,取5 mL 上清液氮吹至近干,采用1 mL 的5 mmol·L−1乙酸铵水溶液/甲醇(体积分数50/50)溶解残渣,充分溶解后,适量稀释,过0.22 µm 滤膜,采用超高效液相色谱串联质谱(ultra-highperformance liquid chromatography-tandem mass spectrometry,UHPLC-MS/MS)测定含量。
液相色谱条件:ACQUITY UPLC BEH-C18色谱柱(2.1 mm×100 mm,1.7 µm);流动相:流动相A为甲醇,流动相B 为5 mmol·L−1乙酸铵水溶液;梯度洗脱程序:0—1 min,10% A;1—8 min,10 % A~30% A;8—9 min,30% A~90% A;9—9.1 min,90% A~10% A;9.1—11 min,90% A~10% A;流速0.3 mL·min−1;进样量3 µL;柱温40 ℃。
质谱条件:离子化模式为电喷雾电离源(electrospray ionization source, ESI);质谱扫描模式为多反应监测(multiple reaction monitoring,MRM)模式;离子源温度500.0 ℃;喷雾电压5 500 V;雾化气50 Psi;辅助气50 Psi;碰撞气8 Psi;喷雾电压气帘气35 Psi。DON、3-ADON 和15-ADON 的母离子、子离子和碰撞电压等质谱参数见表2。

表2 DON、3-ADON和15-ADON的质谱参数Table 2 MS/MS parameters for DON, 3-ADON and 15-ADON
通过测定线性、灵敏度、回收率和精密度验证分析方法。DON、3-ADON 和15-ADON 在各自浓度范围内线性关系良好,相关系数(R2)均大于0.999。以定性离子通道信噪比(signal to noise,S/N)为3 时的样品质量浓度为目标毒素的检出限(limit of detection,LOD);定量离子通道信噪比为10 时的样品质量浓度为目标毒素的定量限(limit of quantitation,LOQ);测定分析方法的灵敏度。DON的LOD为1 µg·L−1,LOQ为2 µg·L−1;3-ADON和15-ADON 的LOD 均为0.5 µg·L−1,LOQ 均为1 µg·L−1。将3种毒素按低、中、高3个水平(5、50、100 µg·L−1)进行空白基质加标,经处理后上机测定3 种毒素的实际质量浓度,将实际质量浓度与理论值的百分比计为回收率,以1 d 内测定3 次和连续3 天测定结果的相对标准偏差(relative standard deviation,RSD)分别作为日内精密度和日间精密度。DON 的加标回收率范围为81.03%~103.97%,3-ADON 的加标回收率范围为80.18%~86.06%,15-ADON 的加标回收率范围为81.34%~90.72%;该方法的精密度(RSD)范围在2.80%~11.98%之间(表3)。

表3 液体培养基中DON、3-ADON和15-ADON的回收率和精密度Table 3 Recoveries and precisions of DON, 3-ADON, and 15-ADON in liquid culture (n=3)
1.3 数据分析
使用Origin Pro 2019 作图,使用Design-Expert 8.0.6进行响应面试验设计及分析。
2 结果与分析
2.1 液体培养基配方优化结果分析
2.1.1葡萄糖添加量的影响 受试镰刀菌株在液体培养中的主要产物是DON 和15-ADON,几乎无3-ADON,标准品和培养物MRM 图谱如图1 所示。随着葡萄糖添加量的增加,菌丝量和毒素含量都随之增加,当葡萄糖增加到40 g·L−1时,DON 和15-ADON 的产量增加趋势趋于平缓(图2A)。葡萄糖是一种速效碳源,有助于菌体的生长繁殖,且随着葡萄糖含量的增多,毒素产量也逐渐增高。
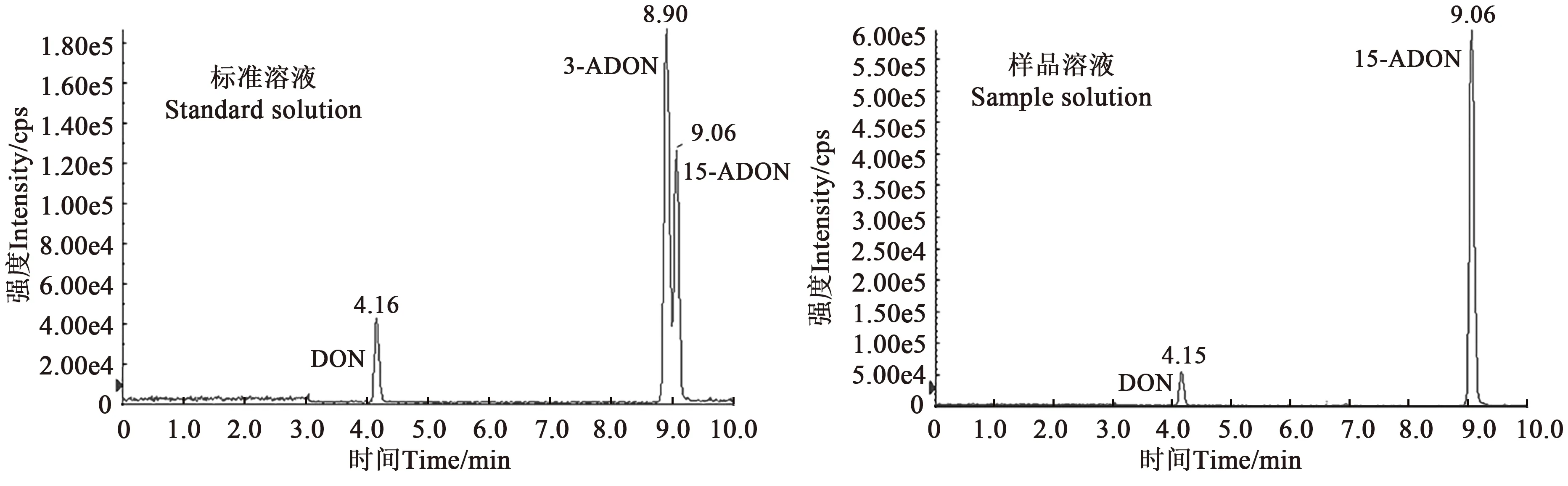
图1 标准溶液与培养物样品溶液的TIC图谱Fig. 1 TIC chromatograms of the standard solution and the sample

图2 不同培养基条件下菌株的生长及DON和15-ADON产量Fig. 2 Growth of strains and production of DON and 15-ADON under different culture mediums
2.1.2乙酸钠添加量的影响 乙酸钠作为大多数真菌毒素的合成前体,其添加量对DON和15-ADON的产量具有较大影响(图2B)。一定范围内随着乙酸盐添加量的增加,DON 和15-ADON 产量也逐渐增多,其中当乙酸钠为1.5 g·L−1时,DON 产量最高;当其添加量为1 g·L−1时,15-ADON 产量最高。继续增加乙酸盐,DON 及15-ADON 的产量均逐渐降低,但菌丝量随着乙酸钠添加量的增加呈持续增加趋势。
2.1.3KNO3添加量的影响 从图2C 可以看出,随着硝酸盐添加量的增大,菌丝量平缓增加,但DON 和15-ADON 的产量呈现下降趋势,其中不添加硝酸盐的毒素产量最高。
2.1.4NH4H2PO4添加量的影响 随着NH4H2PO4添加量的增加,DON 和15-ADON 的产量呈现先增加后降低的现象(图2D)。当铵盐为1 g·L−1时,毒素产量最高;添加铵盐也会影响菌丝的生长,但影响较小。综合单因素试验结果,得出受试菌株产DON的各营养元素的最佳质量浓度为:葡萄糖50 g·L−1,乙酸钠1.5 g·L−1,NH4H2PO41 g·L−1;产15-ADON 的最佳质量浓度为:葡萄糖50 g·L−1,乙酸钠1.0 g·L−1,NH4H2PO41 g·L−1。
2.2 培养条件优化结果分析
2.2.1初始pH 的影响 pH 是影响菌株生长和代谢的重要因素,受试菌株在不同酸碱环境下的生长和产毒情况如图3A 所示,菌丝量随着初始pH的升高而增加,说明碱性条件更利于菌株生长;DON 和15-ADON 的产量均随着pH 的升高先增加后降低,其中最佳产毒初始pH为5。
2.2.2培养温度的影响 适宜的培养温度是真菌生长繁殖及代谢产毒的必要条件,温度过高或过低均会抑制真菌生长代谢,导致菌株产毒能力下降甚至不产毒。由图3B可知,菌体的最适生长温度和最佳产毒温度不一致,其中受试菌株的最适生长温度为25 ℃;最佳产毒温度为28 ℃。

A:初始pH;B:培养温度;C:培养时间A: Initial pH; B: Incubation temperature; C: Incubation time
2.2.3培养时间的影响 随着培养时间的延长,菌丝量不断增多,DON 产量在培养第20天达到最大,此后产量相对于菌丝量不断减少,而15-ADON 的产量在培养第15 天达到最高,此后产量不断降低(图3C)。
2.3 响应面法优化液体培养条件
2.3.1DON 响应面试验结果分析 根据单因素试验结果,选择培养时间(A)、培养温度(B)和培养初始pH(C)作为自变量,以DON的产量(Y)为响应值,进行3因素3水平的Box-Behnken响应面优化试验。使用Design-Expert 8.0.6 软件对表4 的试验结果进行多元回归拟合分析,拟合方程为如下。

表4 DON 响应面试验结果Table 4 Results for response surface experiments of DON
该回归模型的相关系数R2为0.979 4,调整R2为0.952 9,表明此回归模型可以解释95.29% 响应值的变化。整体模型达到显著水平(P<0.000 1),失拟项不显著(P=0.846 6),表明该模型的拟合度较好,准确度高,试验误差小。因此可以用该模型对影响DON产量的培养条件进行预测和分析。方差分析结果表明,A、C、A2、B2、C2对DON的产量影响极显著(P<0.01),B、AC对DON的产量影响显著,其他均不显著(P>0.05)(表5)。
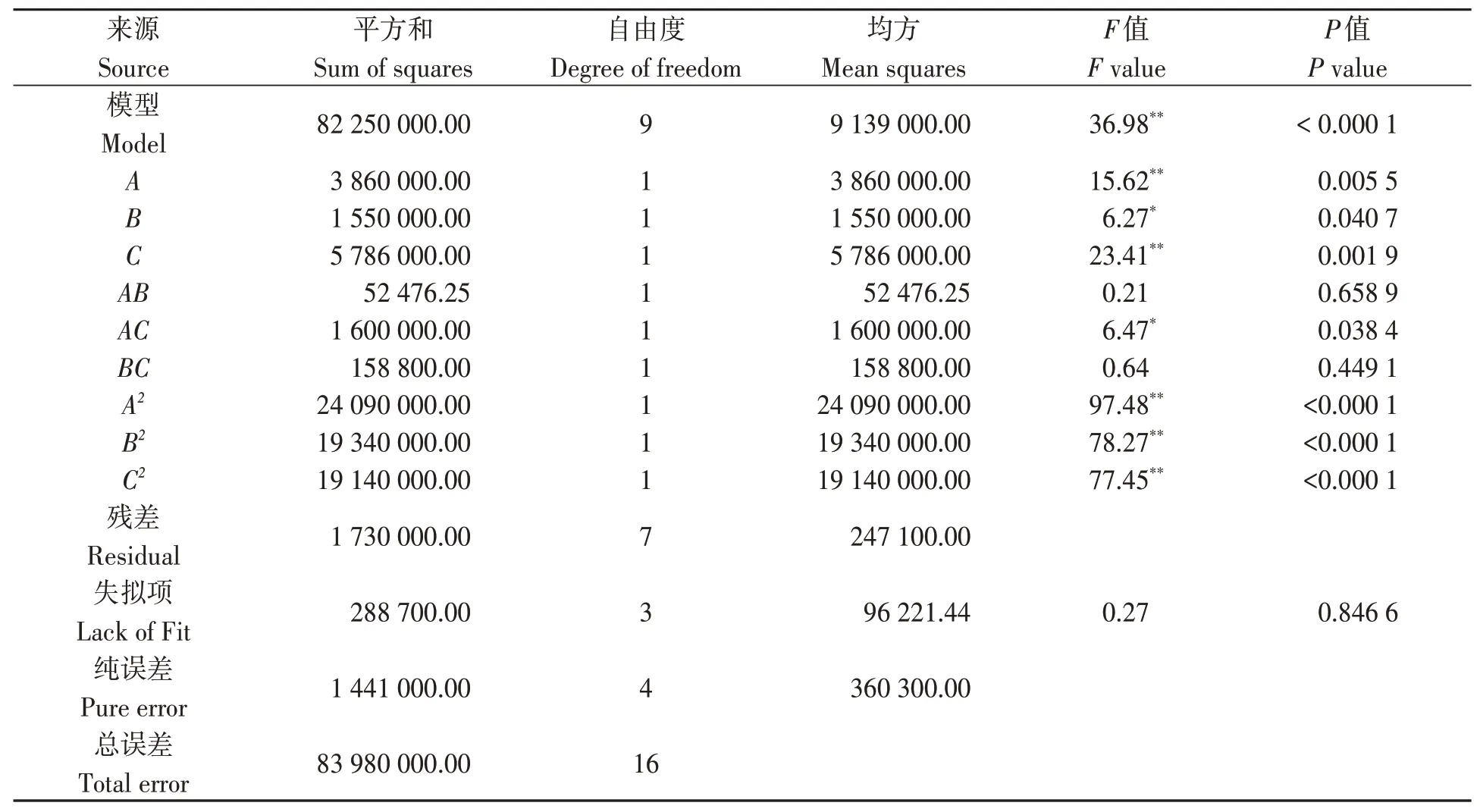
表5 DON响应面模型方差分析Table 5 Analysis of variance for quadratic regression equation of DON
通过Design-Expert 8.0 6软件对各因素及因素间的交互作用进行分析,得到相应的响应面和等高线图(图4)。培养时间的变化曲面弧度较培养温度的变化趋势更陡,说明培养时间对DON 产量的影响较培养温度更显著;培养基初始pH的变化曲面弧度较培养温度的变化趋势更陡,说明培养基初始pH对DON产量的影响较培养温度更显著。在因素间交互项作用对DON 产量的影响中,培养时间与初始pH 的等高线图呈椭圆形,说明2 因素间交互作用显著影响DON 产量,且该结果与影响DON产量的各因素显著性分析结果(表5)一致。

图4 培养时间、培养温度和初始pH交互结果对DON的产量的响应面及等高线图Fig. 4 Response surface and contour map of the interactive effects of incubation time, incubation temperature and initial pH value on the production of DON
通过模型得出液体培养产DON 的最佳条件为:培养时间21.79 d,培养温度26.26 ℃,初始pH 6.35;在此培养条件下,理论预测的DON 产量为5 860.35 µg·L−1。考虑到实际的可操作性,将液体培养产DON 的最佳条件矫正为:培养时间22 d,培养温度26.3 ℃,初始pH 6.35,实际培养后DON 的产量为5 739.69 µg·L−1,与理论预测值的相对误差为2.1%。
2.3.215-ADON 响应面试验结果分析 根据单因素试验确定的因素及范围,选择培养时间(A)、培养温度(B)和初始pH(C)作为自变量,以15-ADON 的产量(Y)为响应值,进行3 因素3 水平的Box-Behnken 响应面优化试验,结果如表6 所示。使用Design-Expert 8.0.6 软件进行多元回归拟合分析,15-ADON的拟合方程如下。

表6 15-ADON响应面试验结果Table 6 Results for response surface experiments of 15-ADON
模型的相关系数R2为0.970 5,调整R2为0.932 5,表明自变量选择合适,模型能较好的描述试验结果。整体模型达到显著水平(P<0.01),失拟项不显著(P=0.748 7),表明该模型的拟合度较好,准确度高。方差分析结果(表7)表明,A、A2、B2、C2对15-ADON 产量影响极显著(P<0.01),B、C、AB对15-ADON 产量影响显著(P<0.05),其他不显著。

表7 15-ADON响应面模型方差分析Table 7 Analysis of variance for quadratic regression equation of 15-ADON
通过Design-Expert 8.0 6 软件对影响15-ADON 产量的各因素及因素间的交互作用进行分析,得到不同因素交互作用的响应面图及等高线图(图5)。培养时间和培养温度间形成了较明显的曲面,说明15-ADON 的产量对培养时间和培养温度敏感;等高线呈椭圆形,表明2 因素间交互作用对15-ADON 产量影响显著;培养时间的变化曲面弧度较培养温度更为陡峭,说明培养时间对15-ADON 产量的影响较培养温度更显著。培养时间变化曲面弧度较初始pH更陡峭,说明培养时间对15-ADON 产量的影响较初始pH 更显著。温度与初始pH 的等高线图中2 因素形成的曲线斜率相近,表明交互作用较弱。以上结果与各影响因素对15-ADON 产量影响的显著程度分析结果(表7)一致。
图5 培养时间、培养温度和初始pH交互结果对15-ADON的产量的响应面及等高线图Fig. 5 Response surface and contour map of the interactive effect of incubation time, incubation temperature and initial pH value on the yield of 15-ADON
通过模型得出液体培养产15-ADON 的最佳条件为:培养时间21 d,培养温度25.26 ℃,初始pH 5.58,在此培养条件下,理论预测的15-ADON产量为10 163.8 µg·L−1。考虑到实际的可操作性,将最佳培养条件调整为:培养时间21 d,培养温度26.3 ℃,初始pH 5.58,此条件实际培养后15-ADON 的产量为10 453.41 µg·L−1,与理论预测值的相对误差为2.80%。
3 讨论
真菌代谢产物的生成效率与菌株自身特性有关,同时也受到培养条件的影响,因此培养基的营养成分及培养条件对禾谷镰刀菌产毒是非常重要的。
在培养基的营养成分中,对菌体生长和代谢影响最大是碳源和氮源的组成和比例。本研究使用葡萄糖作为碳源,研究其不同质量浓度对受试菌株生长和代谢的影响。葡萄糖是速效碳源,有助于菌体的生长繁殖,且随着葡萄糖添加量的增加,菌株的毒素产量增多,与甄玉萍等[23]的研究结果一致。乙酸盐是很多真菌代谢产物的合成前体,其添加量对DON和15-ADON的产量有显著影响。本研究结果表明,添加乙酸盐会影响毒素的产率,但具体是因为乙酸盐的直接作用还是因为添加乙酸盐导致pH变化的影响,还需要做进一步研究。氮素是微生物生长必不可少的营养元素,Gardiner 等[24]研究表明,硝酸盐的存在会抑制DON 的合成,而铵盐能刺激DON 的合成,与本研究结果一致。
培养条件(时间、温度和初始pH)对菌株产毒的影响较大,低初始pH 虽然能诱导DON 及乙酰化DON 的积累,但不适合真菌的生长发育[25]。本研究表明,受试菌株最佳产毒的初始pH 为5;环境温度过高或过低都可能导致代谢通路的改变、酶活力的丧失,从而影响关键基因的表达[26],菌体的最适生长温度和最佳产毒温度不一致。师雯等[27]报道,禾谷镰刀菌的最适生长温度为25 ℃,最佳产毒温度为30 ℃。本研究中受试菌株的最适生长温度为25 ℃,最佳产毒温度为28 ℃,这种差异可能是由菌株和培养基不同造成。本研究表明,随着培养时间的延长,DON 和15-ADON 的产量均先增加后降低,与徐华等[28]的研究结果一致。培养时间过长造成DON和15-ADON产量下降,推测是由于后期培养基中营养物质消耗殆尽,细菌可能将毒素作为营养物质,将其分解利用,参与其他代谢途径以保护菌体自身安全[29],其机理还需要进一步研究证实。
响应面法能够同时评估多个因素的影响,以及它们之间的相互作用。近年,Wu等[30]采用响应面法评估了初始pH、培养时间和培养温度对DON和玉米赤霉烯酮(zearalenone,ZEN)产量的影响,表明3个因素对2种毒素的产量均有显著影响,其影响大小表现为初始pH>培养时间>培养温度,且3 个影响因素间均存在交互作用。本研究结果证明,培养时间和初始pH 间的交互作用对DON产量影响显著,其他交互作用不显著,这种差异可能是由于菌株或培养基的差异造成。对于15-ADON,培养时间和培养温度间的交互作用对其产量有显著影响。本研究利用响应面法优化出产DON的最佳培养条件为:培养时间22 d,培养温度26.3 ℃,初始pH 6.35,此条件培养后DON 产量达5 739.69 µg·L−1;产15-ADON 的最佳培养条件为:培养时间21 d,培养温度26.3 ℃,初始pH 5.58,此条件培养后的15-ADON 产量达10 453.41 µg·L−1;实际培养结果均与理论预测值相近。
本研究针对目前关于DON 及衍生物的研究聚焦于复杂固体基质,难以测量菌丝生长情况、控制营养成分比例和环境酸碱度等问题,采用液体培养基通过单因素和响应面法系统研究了禾谷镰刀菌产DON和DON衍生物的主要影响因素,结果表明,培养基的营养成分(碳源和氮源:葡萄糖、乙酸盐、KNO3、NH4H2PO4)和培养条件(温度、pH 和培养时间)对禾谷镰刀菌生长和DON 及其衍生物的产生均有不同程度的影响,且不同因素之间具有显著的交互作用,研究结果可为DON 类真菌毒素的防控提供理论基础和数据支持。

