基于Cortellis数据库的mRNA技术研发管线分析
李东巧,王茜
1. 中国科学院文献情报中心,北京 100190
2. 中国科学院大学,经济与管理学院,信息资源管理系,北京 100190
引 言
mRNA 被称为信使RNA(Messenger RNA),是一种能够携带遗传物质DNA 且用于指导蛋白质合成的单链核糖核酸。与目前的治疗方法相比,mRNA 具有成本效益低、研发周期短、无基因整合风险等独特优势[1],目前主要用于肿瘤免疫治疗、传染性疾病疫苗、蛋白替代疗法、基因组编辑等研究,具有极大的医学应用潜力[2-4], 2021 年被《麻省理工科技评论》列为“十大突破性技术”榜首[5]。尤其是新冠肺炎期间,mRNA 疫苗以前所未有的速度开发和审批,刺激了mRNA 相关技术的成熟和应用,使其成为近年来广具前景的研究技术。
从发展历程来看,mRNA 从发现到首个产品上市用了近60 年的时间,主要经历了几个里程碑式阶段。第一个阶段是mRNA 分子发现阶段(20 世纪60年代至70 年代)。1960 年François Jacob 和Matthew Meselson 发现细胞核内的遗传信息能够被转移到细胞质。1961 年,François Jacob 和Jacques Monod 基于前期研究提出了mRNA 假说[6-7],随后Sydney Brenner等通过实验证实了mRNA 假说[8]。1965 年,Bangham等基于磷脂囊泡的离子透过性实验发现脂质体。1976年,Langer 等[9]首次证明核酸可以被聚合物组成的微小颗粒包装和递送,为后续mRNA 在体内的递送研究奠定基础。第二阶段是人工合成mRNA 阶段(20 世纪80 年代至90 年代)。1984 年,Melton 等[10]首次在实验室中合成mRNA。1990 年,Wolff等[11]首次发现在小鼠骨骼肌中注射mRNA 可导致编码蛋白表达的现象。随后,越来越多的研究表明mRNA 治疗的可行性,mRNA 的疗法首次被提出[12],逐渐成为生物领域与医药开发领域的研究热点。第三阶段是mRNA临床应用雏形阶段(2000—2019 年)。2001 年,离体mRNA 转染树突状细胞首次进入临床试验[13]。2005年,Karikó 等[14]首次报道利用假尿苷替换mRNA 中的尿苷,降低免疫副作用的同时增强表达蛋白水平。随后许多mRNA 应对传染病、过敏反应和癌症等疾病的临床前和临床实验研究逐渐开展[15-17]。2010 年,有研究发现假尿苷修饰的mRNA 分子可有效对细胞进行重编程[18];2012 年在小鼠体内开展了关于首个LNP-mRNA 疫苗临床实验[19];2017 年首次开展关于mRNA 的个性化癌症疫苗临床试验[20]。mRNA 临床应用范围逐渐扩大。第四阶段是mRNA 快速发展阶段(2020 年—至今)。mRNA 技术在全球性新冠疫情暴发后得到快速进展。由辉瑞/BioNTech 开发的全球首款mRNA 新冠疫苗于2020 年12 月获得FDA 的紧急使用授权[21],开启了在全球范围内的免疫接种。在新冠mRNA 疫苗开发过程中吸取的经验也被用于研制多价核苷修饰的mRNA 流感疫苗[22]。莫德纳在研制mRNA 疫苗的同时也研发“新冠与流感”混合疫苗。
除了技术突破,mRNA 的商业潜力也逐渐凸显,国际越来越多的大型药企布局mRNA 技术研发,其中Novartis 和Shire 早在2008 年分别成立mRNA疫苗研发部门和mRNA 药物研发部门。mRNA 初创企业也得到快速发展,其中专注于mRNA 疫苗、mRNA 药物和mRNA 疗法研究的CureVac、BioNtech和Moderna,虽然成立时间较晚(分别成立于2000年、2008 年和2010 年),但在新冠疫情期间凭借自身mRNA 技术优势,目前已发展成为全球mRNA 领域的三大巨头。我国企业在mRNA赛道领域也奋起直追,除了艾博生物、斯微生物、丽凡达生物、蓝鹊生物等初创企业加速布局mRNA 技术平台建设外,中国科学院、军事医学科学院等科研院所以及石药集团、沃森生物等老牌企业也加速布局mRNA 疫苗和药物研发。mRNA 产业呈井喷之势,具有巨大的发展潜力。
mRNA 技术和产业的快速发展,为新型疫苗、药物的研究和应用提供了机遇。本文基于Cortellis 数据库对mRNA 技术相关药物或疫苗的发展趋势、主要国家/地区、主要机构、作用靶点、产品类型分布、疾病适应症、临床阶段和市场情况等进行分析,力求能全面系统地反映mRNA 领域的现状,以期为我国相关领域未来的研发布局和决策提供一定的参考。
1 数据来源与方法
本文基于科睿唯安公司Cortellis 数据库对mRNA药物或疫苗进行检索和分析,检索时间为2022 年11月1 日。经人工清洗后共检索到在研mRNA 产品327个。数据下载后,利用Derwent Data Analyzer 等工具进行计量分析。
2 年度态势分布
mRNA 产品各个研发阶段的年度趋势如图1 所示。从发展趋势上,mRNA 产品研发大致分为3 个阶段。1998 年至2014 年处于萌芽期,虽然早在1998年研究人员已对mRNA 产品进行研发,但研发状态活跃度较低,相关年度研发数量均小于10 个。2015年至2019 年处于缓慢增长期,由于逐渐开始探索mRNA 临床应用,相关mRNA 产品研发也受到更多关注,该阶段mRNA 产品由2015 年11 个波动式增长至2019 年26 个,其中临床前阶段产品数量为14 个,占比最高。2020 年至今处于快速发展期,2020 年受新冠疫情影响,mRNA 技术受到研究人员的广泛关注,相关研发产品增长速度加快。截至2022 年,mRNA产品数量增长至84 个,其中上市产品数量为3 个,达到历史最高值。
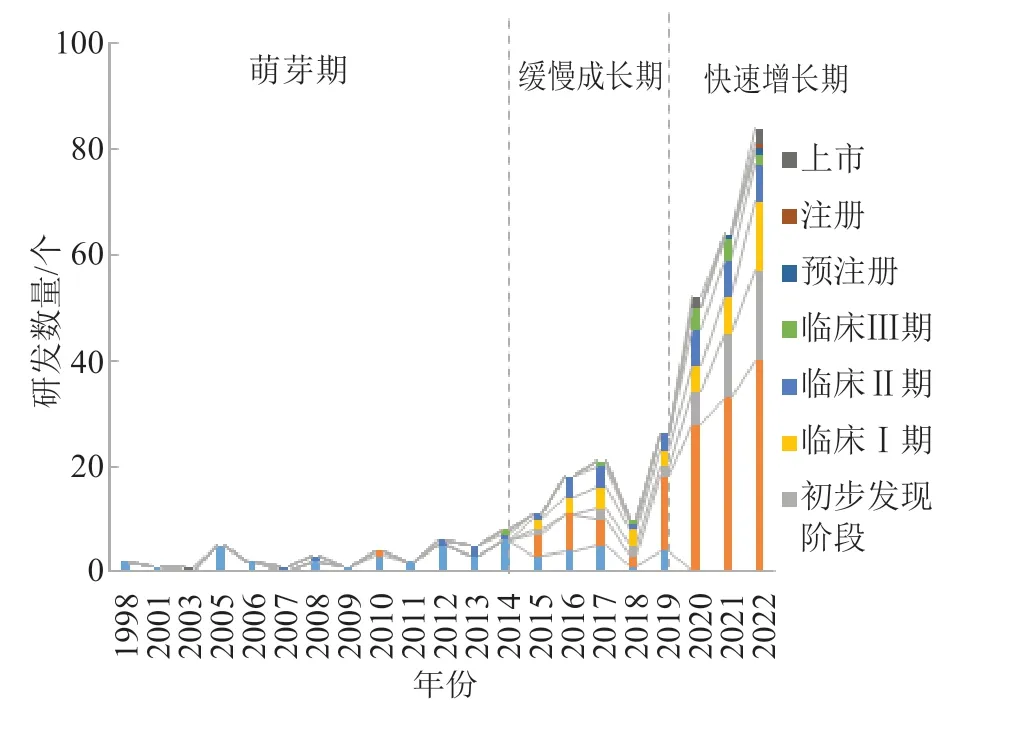
图1 mRNA 产品各临床研究阶段年度趋势分析Fig.1 Annual trend analysis of mRNA products in each clinical research stage
3 主要国家/地区分析
当前mRNA 产品主要研发国家/地区分布如图2 所示。美国以206 个mRNA 产品研发数量位居全球首位,占比63%。中国和德国的mRNA 产品研发数量均为42 个,并列全球第二位,但与美国的研发数量还存在较大差距。加拿大、澳大利亚的mRNA 产品研发数量均超过20 个,分别位居全球第四位(31 个)和第五位(20 个)。其他mRNA 产品研发数量超过10 个(含)的国家/地区依次是英国(18 个)、日本(14 个)、韩国(12 个)、新加坡(11 个)、南非(10 个)。
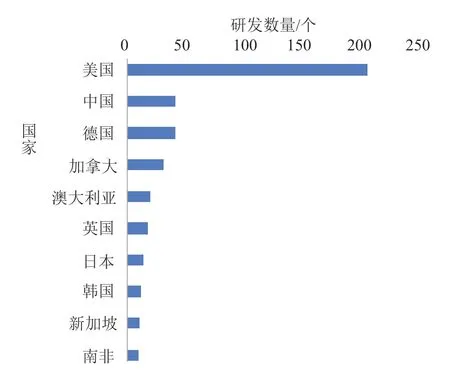
图2 mRNA 产品主要研发国家/地区分布Fig.2 Mainly R&D countries/regions of mRNA products
4 研发机构分析
全球参与mRNA 产品的研发机构约190 家,mRNA 产品的主要研发机构及其研发状态如表1 所示(mRNA 产品数量≥4,不包括无研发进展状态)。从机构所属国家来看,研发机构主要位于北美和欧洲,其中美国和加拿大的机构数量均为4 家,德国机构有2 家,中国、英国、比利时和法国的机构各为1 家。从机构类型来看,研发机构以公司为主(13 家),科研单位较少(1 家)。从研发数量来看,mRNA 产品研发数量最多的是Moderna 公司,目前已有36 个mRNA 产品进入临床阶段,3 个产品上市。Moderna 公司上市的3 个产品均是COVID-19 疫苗,即mRNA-1273/Spikevax®、mRNA-1273.214 疫苗和mRNA-1273.222 疫苗。mRNA产品研发数量位列第二位的是BioNTech 公司,有11个mRNA 产品进入临床阶段,2 个产品上市。BioNTech 公司上市的产品均为与Pfizer 公司共同推出,第一个产品是Bivalent(BNT 162b2)疫苗,第二个产品是BA.4/BA.5-adapted bivalent 二价疫苗。斯微(上海)生物科技有限公司是TOP14 机构中唯一的一家中国机构,在LPP 递送平台上具有独特优势,在一定程度上规避了国外Moderna 公司和BioNTech 公司采用的技术,进入临床III 期的mRNA 产品SW-0123 也是一款COVID-19 疫苗。
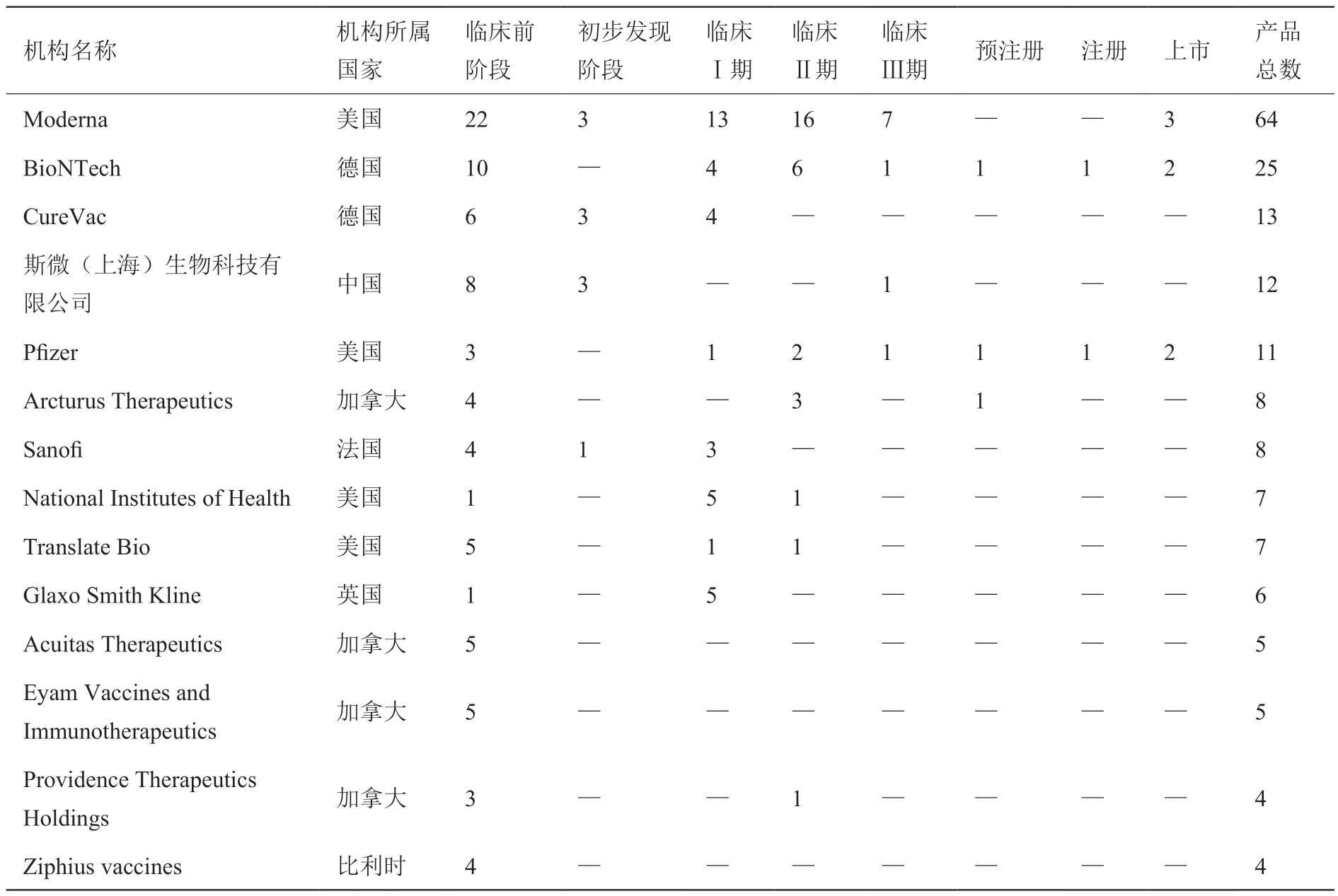
表1 mRNA 产品的主要研发公司分布及其研发状态Table 1 Mainly distribution and R&D status of mRNA products
5 作用靶点分析
mRNA 产品主要靶点分布及其研发阶段如表2所示。从靶点种类来看,mRNA 产品的靶点主要集中在以疫苗、治疗性抗体和诊断的关键靶点COVID19尖峰糖蛋白为主,相关产品数量为51 个,其他靶点分布较为分散,如CD40 配体/基因(5 个)、CFTR 基因(5 个)和血凝素(4 个)等。在作用于COVID19尖峰糖蛋白的mRNA产品中,上市产品5个,注册和预注册产品各1 个,临床Ⅲ期产品7 个,临床Ⅱ产品和临床Ⅰ期产品分别为9 个和7 个。其他进入临床Ⅲ期的mRNA 产品分别作用于人巨细胞病毒糖蛋白B、人巨细胞病毒糖蛋白H、呼吸道合胞病毒蛋白F,相关产品数量均为1 个。
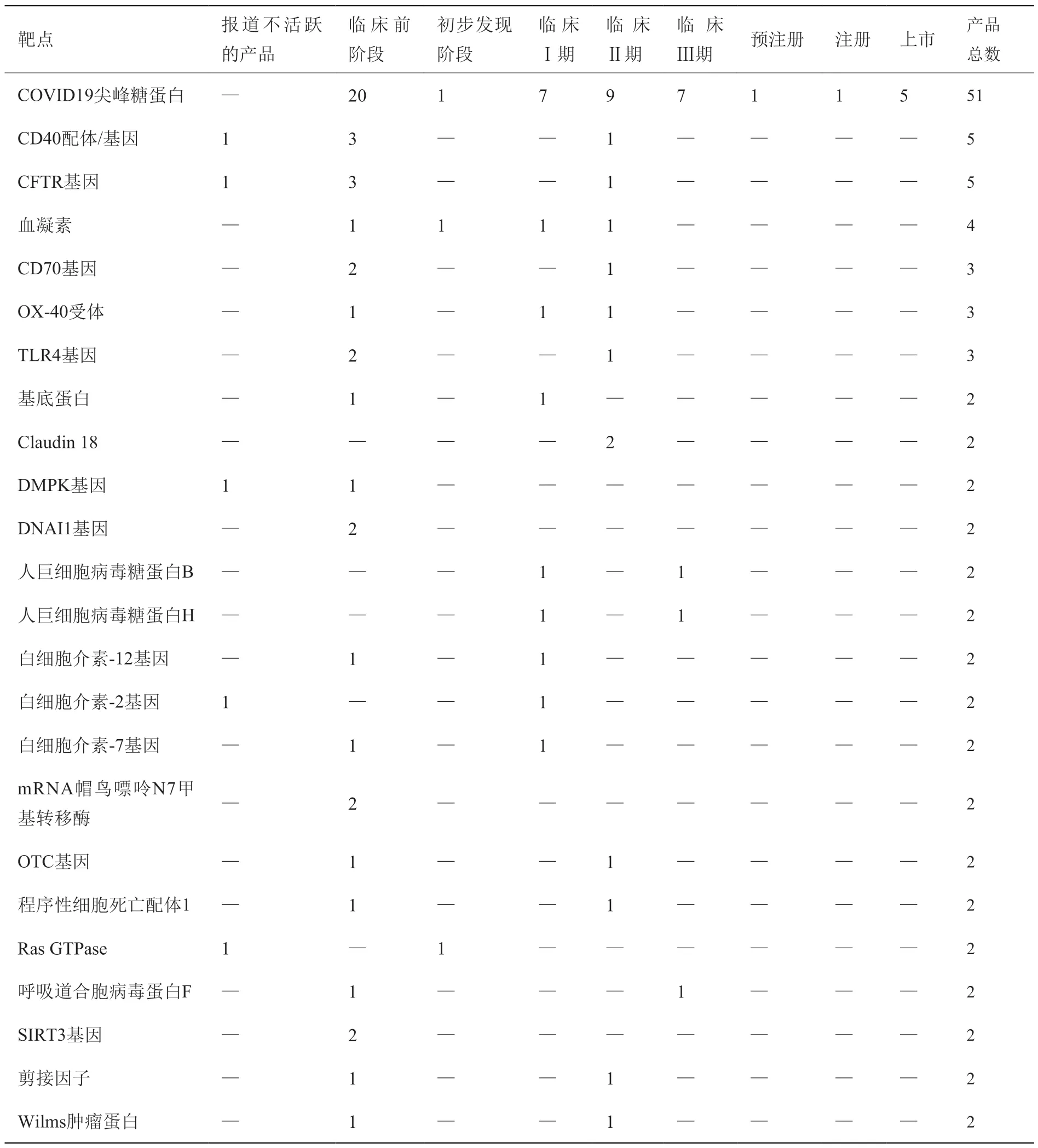
表2 mRNA 产品的主要靶点分布及其研发阶段Table 2 Mainly target distribution and development stage of mRNA products
6 产品类型分布
从产品类型分布来看,在研mRNA 产品以mRNA疫苗为主,相关产品数量为180 个,约占总数的55%,其他产品为mRNA 药物,相关产品数量为147 个,约占总数的45%。
在mRNA 疫苗中,传染性疾病的预防性疫苗数量最多(145 个),主要是针对COVID-19 病毒的mRNA 疫苗(82 个)、针对流感病毒的mRNA 疫苗(13 个)和针对HIV 病毒的mRNA 疫苗(8 个)。其他mRNA 疫苗还包括针对肿瘤治疗性的mRNA 疫苗(31 个)和针对免疫疾病治疗的mRNA 疫苗(4 个)(图3)。在mRNA 药物中,针对肿瘤领域的产品数量最多(48 个),其次是针对传染性疾病领域和内分泌/代谢疾病领域,相关产品数量均大于20 个,针对呼吸疾病领域的产品数量为13 个,其他涉及的疾病领域还包括胃肠道疾病、神经病/精神病、肌肉骨骼疾病、免疫疾病等领域(图4)。

图3 mRNA 疫苗产品类型分布Fig.3 The type distribution of mRNA vaccine products
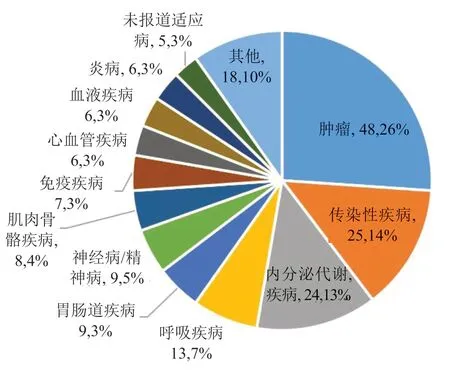
图4 mRNA 药物产品类型分布Fig.4 The type distribution of mRNA drug products
7 治疗领域分布
7.1 主要应用疾病领域和适应症分布
从mRNA 产品的疾病应用领域来看(图5),应用于传染性疾病领域的mRNA 产品数量最多,约占产品总量的一半(170 个,占比46.3%);其次是应用于肿瘤领域,相关mRNA 产品数量为79 个(占比21.5%);应用于内分泌/代谢疾病领域的mRNA产品数量位列第三位,为24 个(占比6.5%)。其他mRNA 产品研发数量超过10 个疾病领域还包括呼吸疾病(14 个,占比3.8%)和免疫疾病(14 个,占比3.0%)。

图5 mRNA 产品应用疾病领域分布Fig.5 Distribution of mRNA product application in disease fields
目前,mRNA 产品的适应症以COVID-19 感染、流感病毒感染和HIV 感染为主,相关产品数量均大于10 个(表3)。以COVID-19 感染为适应症的mRNA 产品数量最多(87 个),其中上市产品5 个,注册产品和预注册产品分别为1 个和2 个,临床Ⅲ期产品8 个,临床Ⅱ产品和临床Ⅰ期产品分别为16个和9 个。以流感病毒感染为适应症的mRNA 产品数量为18 个,其中临床Ⅲ期产品1 个,临床Ⅱ产品和临床Ⅰ期产品分别为3 个和6 个。以HIV 感染为适应症的mRNA 产品数量为10 个,其中临床Ⅱ产品和临床Ⅰ期产品分别为1 个和5 个。此外,mRNA产品的适应症还包括胰腺癌(9 个)、呼吸道合胞病毒感染(8 个)、乳腺癌(7 个)、卵巢癌(7 个)、结肠直肠癌(6 个)、转移性非小细胞肺癌(5 个)等。
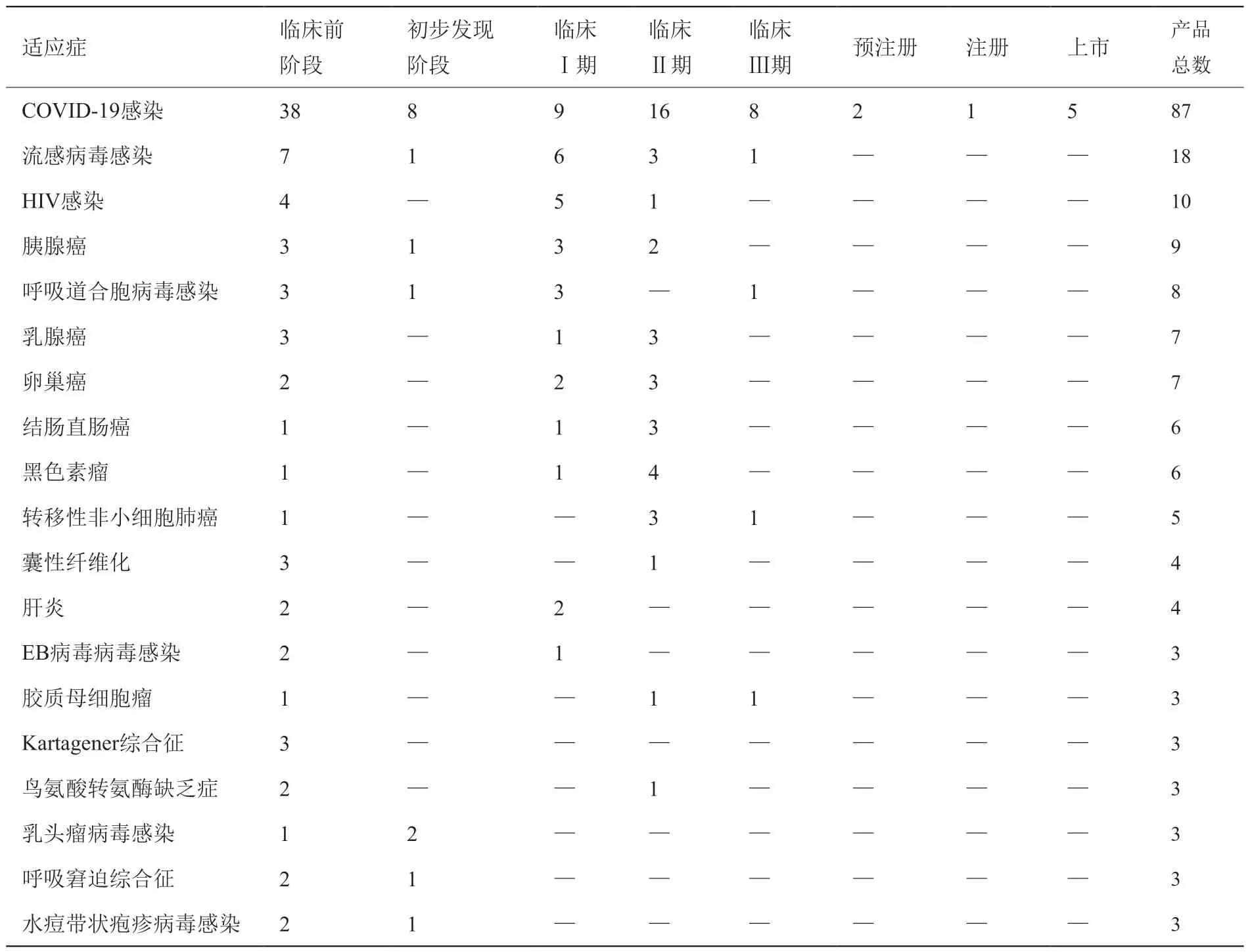
表3 mRNA 产品主要适应症及其研发状态Table 3 Mainly indications and development status of mRNA products
7.2 传染性疾病领域主要国家和机构分布
传染性疾病领域的mRNA 产品研发数量为170个,其中排名前十位的国家如图6 所示。美国在传染性疾病领域的产品研发数量高达100 个,占比超过50%。中国在传染性疾病领域的产品研发数量为29 个,约为美国研发数量的1/3。加拿大和德国在传染性疾病领域的产品研发数量均为20 个,并列第三位。其他亚洲地区进入前十位的国家还包括新加坡(10 个)、韩国(8 个)和日本(7 个)。
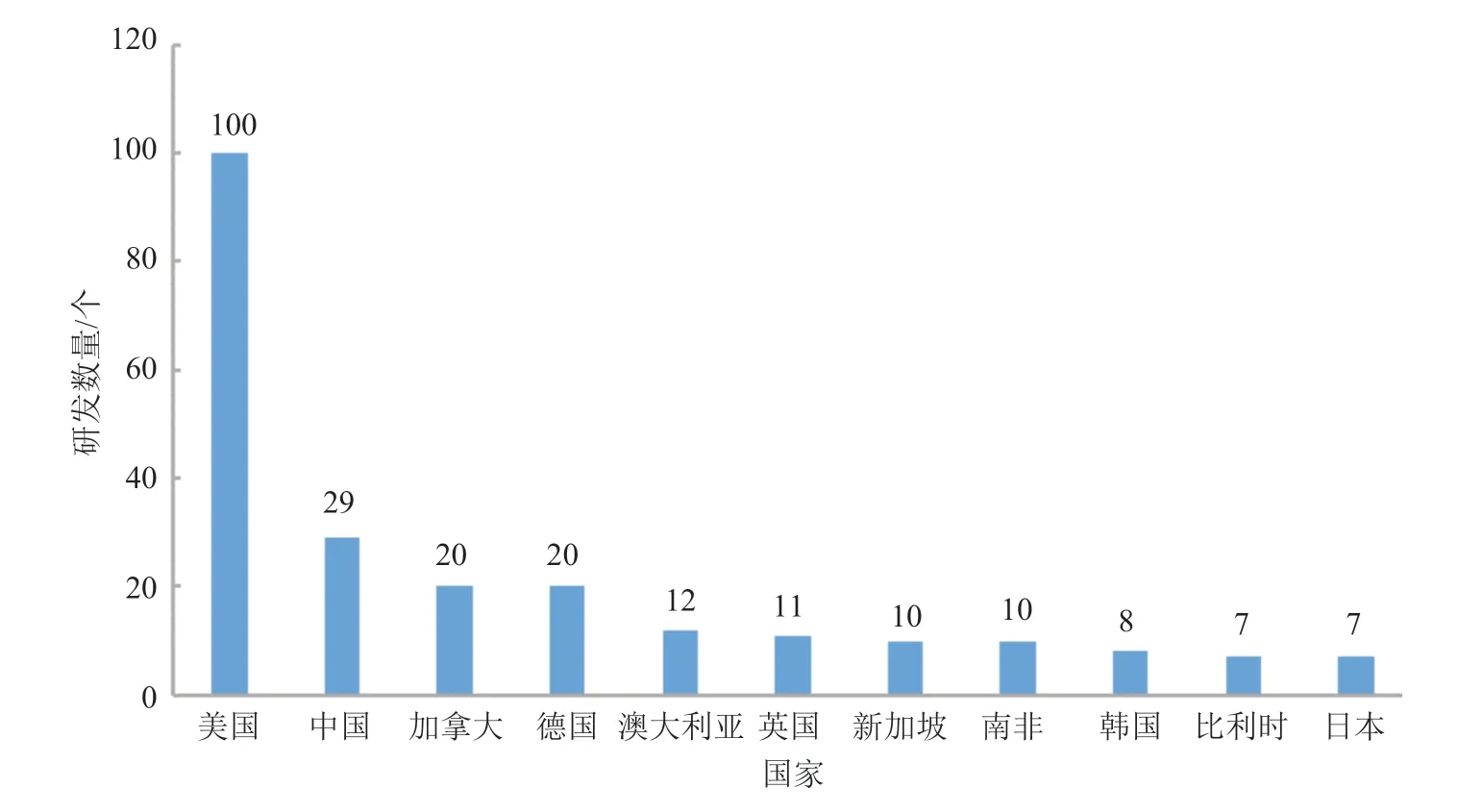
图6 传染性疾病领域的mRNA 产品主要研发国家分布Fig.6 Mainly R&D countries/regions of mRNA products in the field of infectious diseases
通过对比中美两国在传染性疾病领域的mRNA产品临床研究阶段发现(图7),美国在该领域的各阶段进程均快于中国。其中,美国处于上市的mRNA 产品研发数量为5 个,约是中国处于上市的mRNA 产品研发数量(1 个)的5 倍;美国处于临床前阶段的mRNA 产品研发数量为36 个,远大于中国处于临床前阶段的mRNA产品研发数量(15个);美国处于临床I 期的mRNA 产品研发数量为22 个,约是中国处于临床I 期的mRNA 产品研发数量(2 个)的10 倍。以上对比表明中国在传染性疾病领域的产品还需要进一步加强基础研究和临床转化水平。
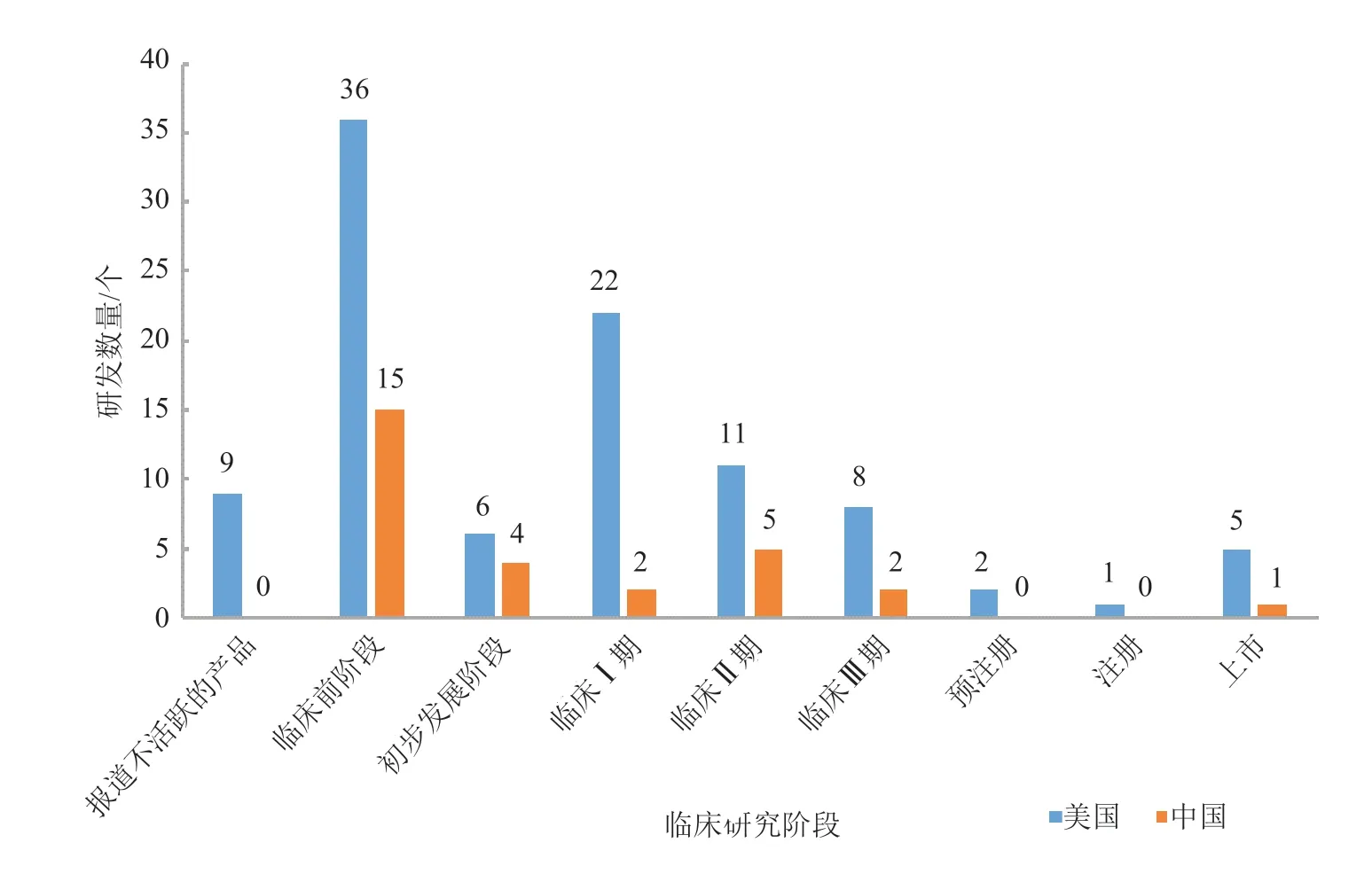
图7 中国和美国传染性疾病领域的mRNA 产品临床研究阶段Fig.7 The clinical research stages of mRNA products in field of infectious diseases in China and the United States
中国和美国在传染性疾病领域的mRNA 产品研发机构(研发数量≥2)如表4 所示,其中美国机构10 家、中国机构5 家。在美国机构中,Moderna 公司的产品数量最多(37 个),其中上市产品3 个,临床Ⅲ期产品7 个,临床Ⅱ产品和临床Ⅰ期产品分别为8 个和9 个;位列第二位的是Pfizer 公司(10 个),其中上市产品2 个,注册和预注册产品各1 个,临床Ⅲ期产品1 个,临床Ⅱ产品和临床Ⅰ期产品各1 个;National Institutes of Health 的产品数量位列第三位(6个),其中临床Ⅰ期产品5 个。在中国机构中,斯微(上海)生物科技有限公司的产品数量最多(6 个),其与西藏药业合作的mRNA 新冠病毒疫苗(SW-0123)进入临床Ⅲ期,上海复星医药与BioNTech 基于BioNTech 的mRNA 技术平台,于2021 年时推出COMIRNATY®(即BNT162b2,中文商品名:復必泰TM)成为首款获中国香港特别行政区食物及卫生局认可在香港作紧急使用的新冠疫苗。
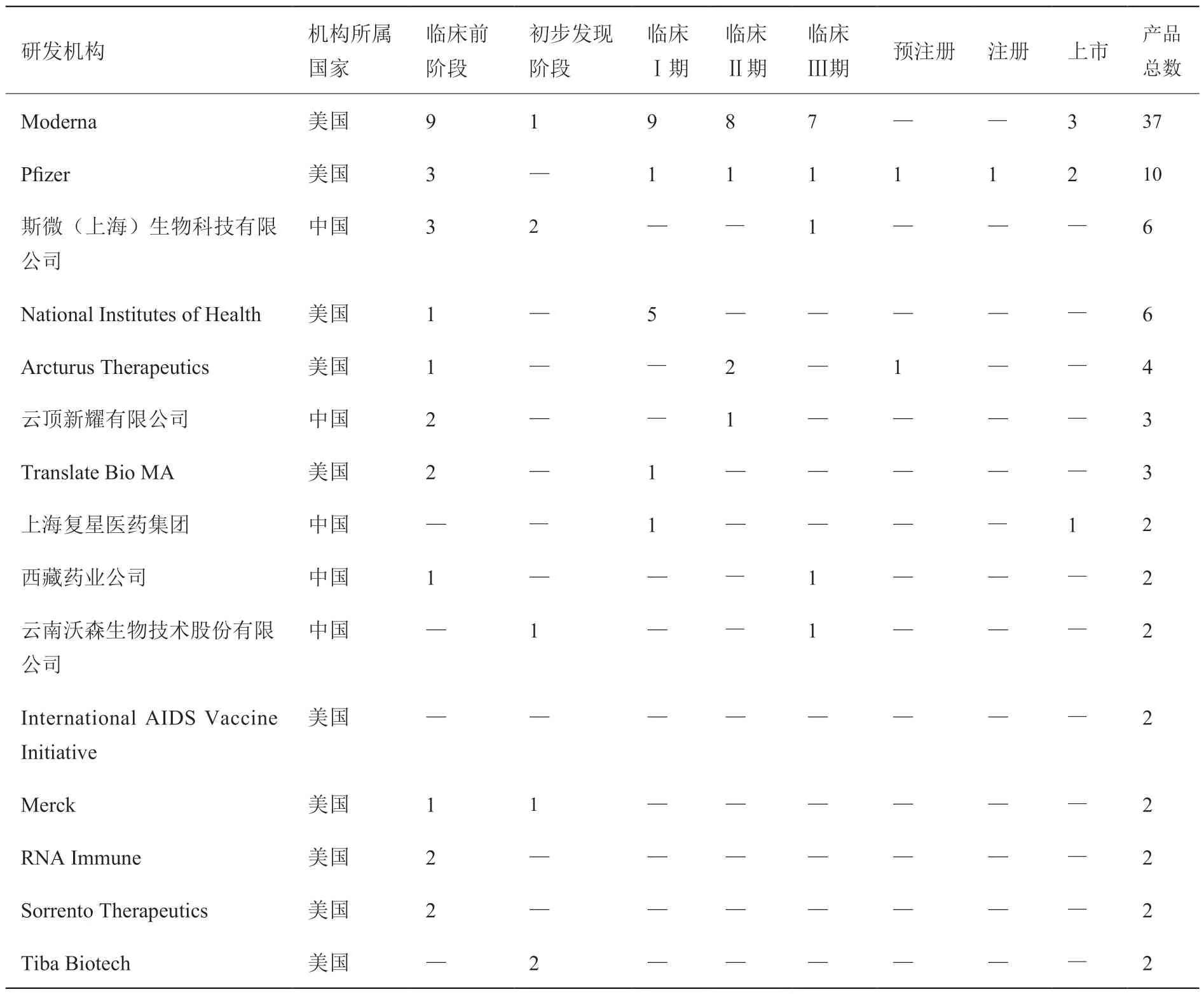
表4 中国和美国传染性疾病领域的mRNA 产品主要研发机构(研发数量≥2)Table 4 Mainly R&D institutions of mRNA products in field of infectious diseases in China and the United States (Number≥2)
7.3 肿瘤领域的主要国家和机构分布
肿瘤领域的mRNA 产品研发数量为79 个,其中排名前十位的国家如图8 所示。美国在肿瘤领域的产品研发数量为47 个,占比约为60%。中国在肿瘤领域的产品研发数量为14 个,占比约为18%,和传染性疾病领域相似,均约为美国研发数量的1/3。肿瘤领域的mRNA 产品研发数量排名前十位的国家分布与传染性疾病领域相似,不同点在于更多的欧洲国家进入此列,包括丹麦、荷兰、挪威等。

图8 肿瘤领域的mRNA 产品主要研发国家分布Fig.8 Mainly R&D countries/regions of mRNA products in the field of neoplasm
美国和中国在肿瘤领域的mRNA 产品临床研究阶段如图9 所示,二者略有不同。美国和中国处于上市的mRNA 产品为同一种产品——阿他卢仑(Ataluren),美国PTC Therapeutics 公司和中国Giddi Pharma 公司都在研究阿他卢仑对于宫内膜样癌、转移性结直肠癌的治疗效果。美国处于临床Ⅱ期、临床I 期、初步发现阶段和临床前阶段的mRNA 产品数量均为9 个,中国处于相关阶段的mRNA 产品数量分别为0 个、1 个、2 个和9 个,表明中国在肿瘤领域的产品有一定突破,但与美国相比仍有较大发展空间。

图9 中国和美国肿瘤领域的mRNA 产品研发状态Fig.9 The clinical research stages of mRNA products in field of neoplasm in China and the United States
肿瘤领域的mRNA 产品主要研发机构如表5 所示,相关产品研发数量大于等于2 的机构有8 家。从机构所属国家来看,美国机构3 家,德国机构2家,中国、法国和英国各1 家。从产品总数来看,BioNTech 公司和Moderna 公司的产品数量位列第一,数量均为9 个,其次是斯微(上海)生物科技有限公司,相关数量为6 个。从临床研究阶段来看,仅有BioNTech 公司和Moderna 公司的mRNA 产品进入临床II 期试验,斯微(上海)生物科技有限公司针对肿瘤领域的mRNA 产品均在临床前阶段,离真正转化为临床可用还存在一定发展空间。
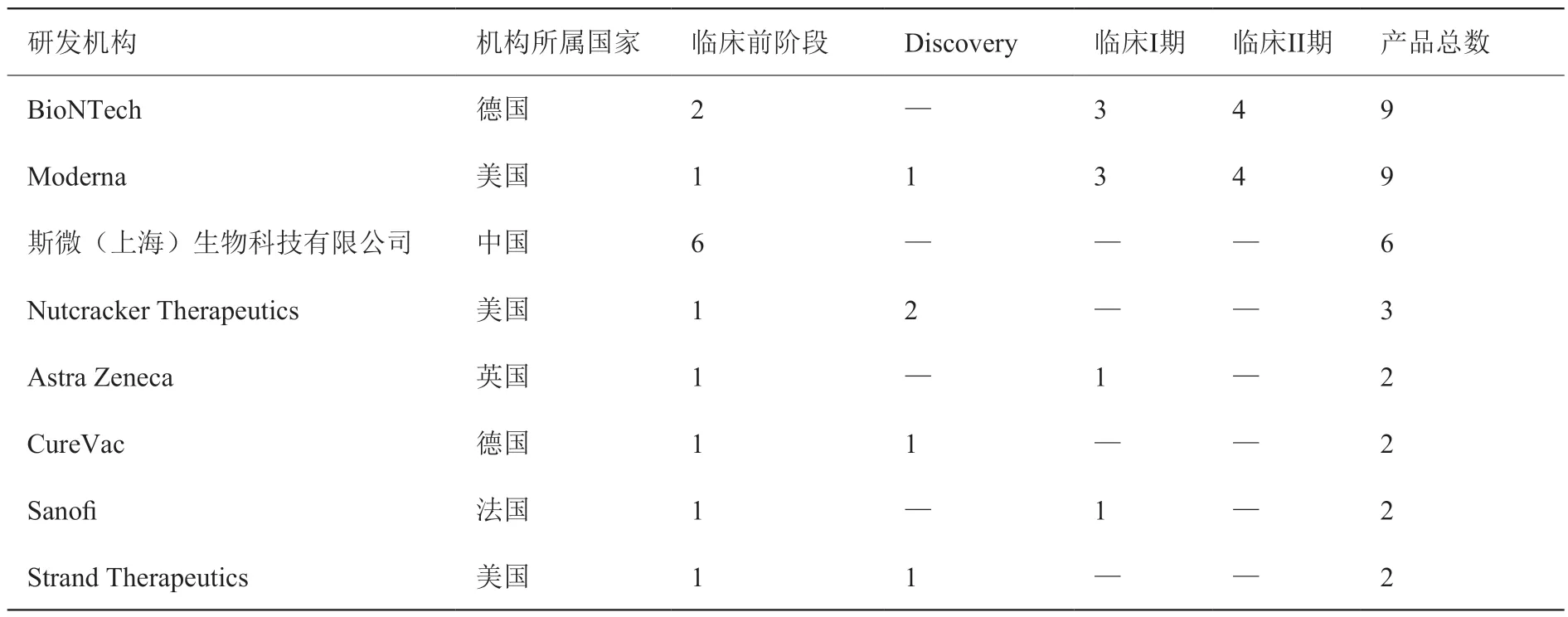
表5 肿瘤领域的mRNA 产品主要研发机构(研发数量≥2)Table 5 Mainly R&D institutions of mRNA products in field of neoplasm (Number≥2)
7.4 内分泌/代谢领域的主要国家和机构分布
内分泌/代谢领域的mRNA 产品研发数量为24个,其中排名前列的国家分布(研发数量≥2 个)如图10 所示。美国在内分泌/代谢领域的产品研发数量为22 个,参与研发数量比例高达92%。其他内分泌/代谢领域的mRNA 产品研发数量排名前列的国家主要分布在澳大利亚、北美和欧洲等国家和地区,亚洲地区国家在该领域的产品较少。
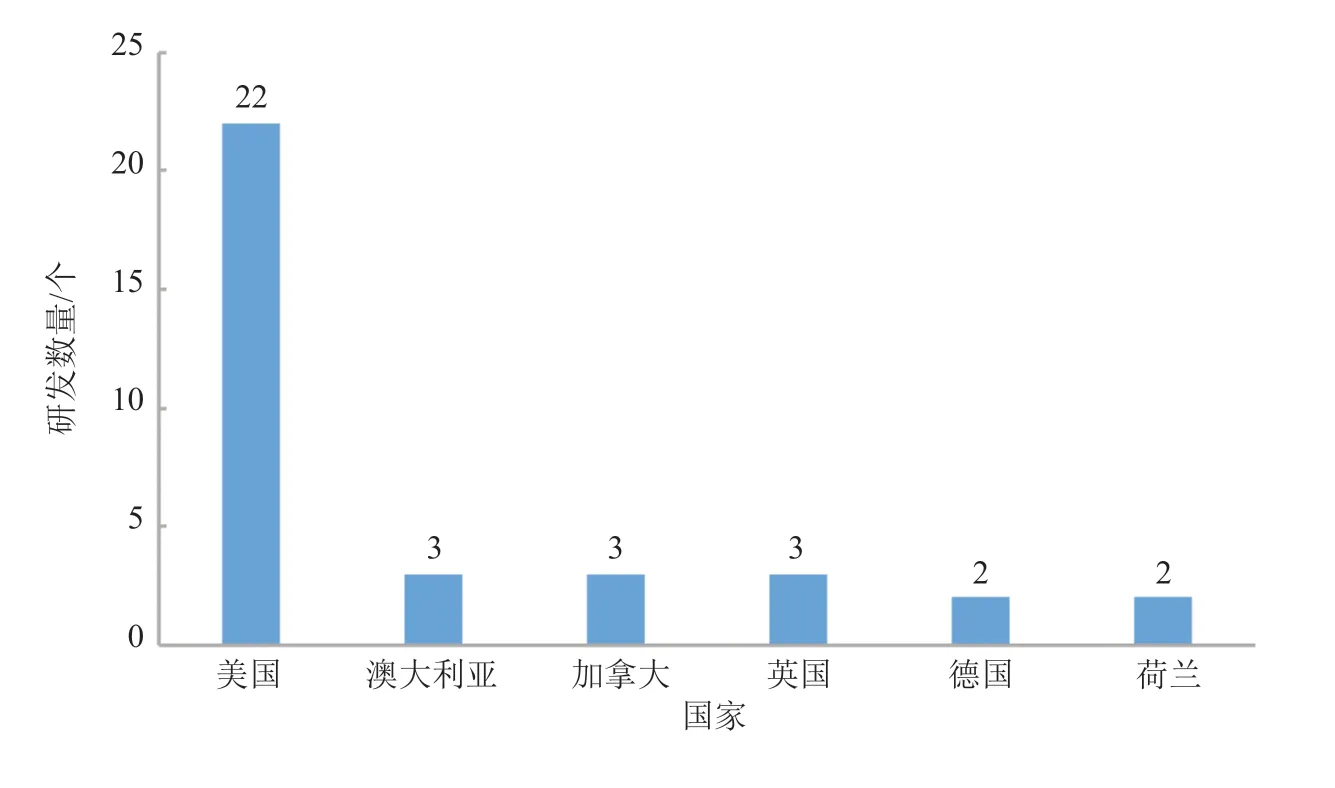
图10 内分泌/代谢领域的mRNA 产品主要研发国家分布Fig.10 Mainly R&D countries/regions of mRNA products in the field of endocrine/metabolism
美国在内分泌/代谢领域的mRNA 产品临床研究阶段如图11 所示,处于临床阶段的mRNA 产品数量共有6 个,上市产品1 个。处于临床前阶段和初步发现阶段的mRNA 产品数量分别为8 个和1 个。中国研究内分泌/代谢领域的mRNA 上市产品1 个,其他各临床研究阶段无相关产品。
内分泌/代谢领域的mRNA 产品研发机构如表6 所示。从机构所属国家来看,美国机构7 家,加拿大、荷兰、西班牙、中国和韩国各1 家,全球性组织1 家。从产品总数来看,Moderna 公司的产品数量位列第一,为10 个,其次是Arcturus Therapeutics公司,相关数量为2 个,其他公司产品数量均为1个。从临床研究阶段来看,进入临床研究阶段的产品不多,其中,Moderna 公司进入临床II 期产品3 个,Arcturus Therapeutics 公司进入临床II 期产品1 个,Giddi Pharma 公司进入上市产品1 个。

表6 内分泌/代谢领域的mRNA 产品的研发机构分布Table 6 Mainly R&D institutions of mRNA products in field of endocrine/metabolic
8 临床研究阶段分析
在研mRNA 产品所处的临床研究阶段如图12所示。mRNA 产品主要以临床前研究阶段为主,产品数量为134 个,占比41%。处于临床研究阶段的产品数量为93 个,占比28%,表明其临床研究也较为活跃。其中,处于I 期和Ⅱ期临床研究阶段的产品数量均为40 个,处于Ⅲ期临床研究的产品数量为13个。此外,目前已上市和注册类型产品数量为9 个,占比3%。其中,已上市产品数量为6 个,预注册和已注册产品数量分别为2 个和1 个。

图12 mRNA 产品临床研究阶段Fig.12 The clinical research stage of mRNA products
8.1 处于临床 II/III 期的新冠病毒mRNA疫苗
由于临床I 期阶段为初步的临床药理学及人体安全性评价试验,并不涉及目标适应症,因此该部分主要分析涉及评价药物疗效的临床Ⅱ/Ⅲ期阶段。目前进入临床Ⅱ/Ⅲ期阶段的mRNA 产品53 个,其中疫苗35 个,药物18 个。
处于临床Ⅱ/Ⅲ期阶段的mRNA 新冠病毒疫苗数量为24 个(表7)。其中Moderna 公司的疫苗数量最多,为9 个,根据mRNA-1273、mRNA-1283(包括其原型)、mRNA-1073 进行修饰改变的疫苗分别为5 个、3 个和1 个,且所有疫苗均采用LNP 递送技术。中国处于临床Ⅱ/Ⅲ期阶段的mRNA 新冠病毒疫苗为6 个,分别是LVRNA-009、SARS-CoV-2 vaccine (mRNA vaccine, COVID-19, Omicron variant)、SYS-6006、ARCoV、SW-0123、mRNA vaccine(COVID-19, delta/omicron variant),其中由中国人民解放军军事医学科学院、云南沃森生物技术股份有限公司研发的ARCoV疫苗有1款进入临床Ⅲ期阶段。当前,递送技术是限制mRNA 发展的主要瓶颈。国外机构主要采用LNP、LPX 作为mRNA 疫苗的递送技术,且Moderna 和BioNTech 等机构掌握了相关技术的专利许可。虽然国内机构现在也纷纷在LNP 技术上研发布局,并进行改良,但关键核心技术仍然掌握在国外Moderna 和BioNTech 等机构手中,我国仍然需要在相关技术领域加紧赶超。
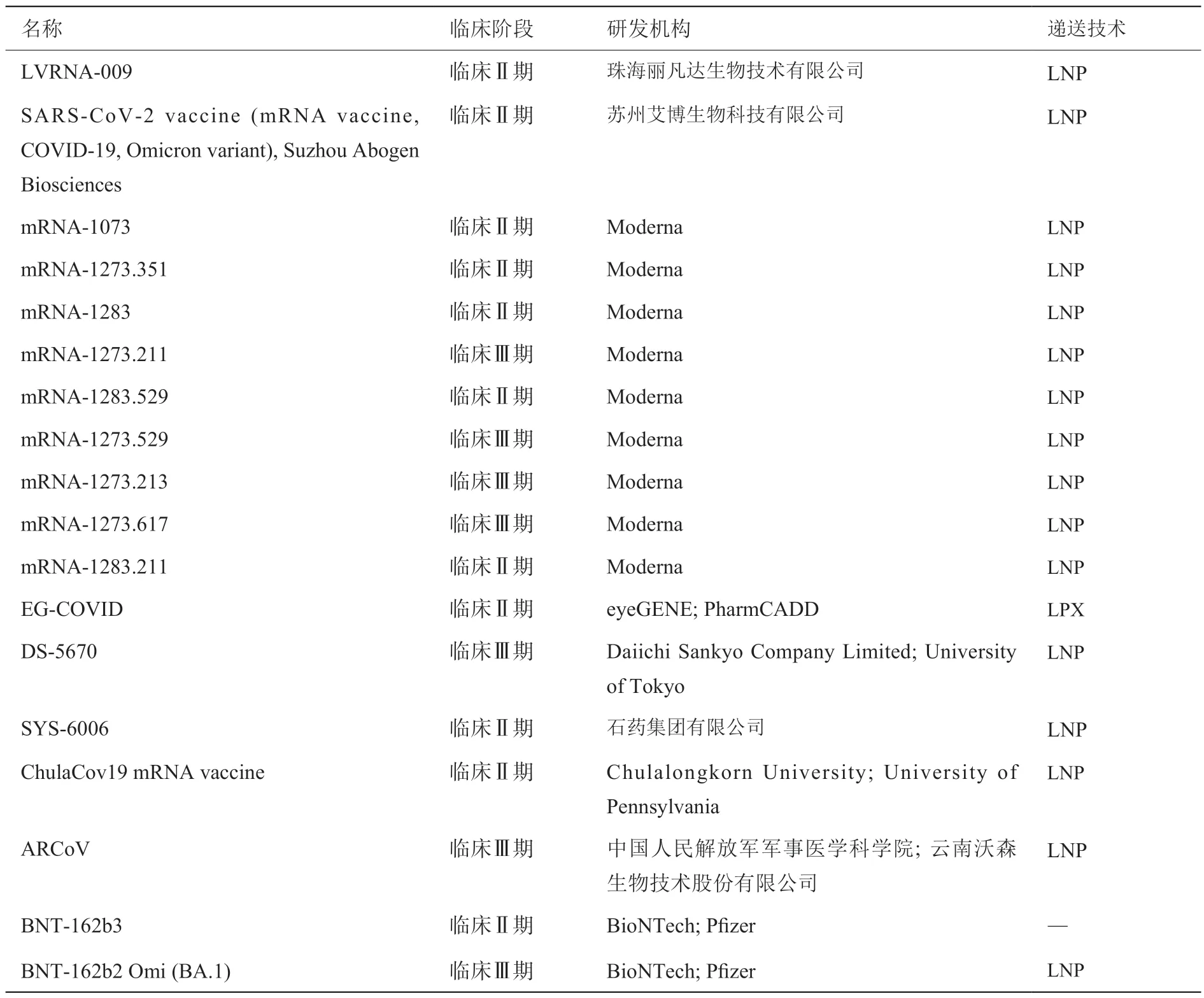
表7 处于临床II/III 期的mRNA 新冠病毒疫苗Table 7 mRNA COVID-19 vaccines in the clinical stage II/III
8.2 处于临床II / III 期的其他mRNA 预防性疫苗
处于临床Ⅱ/Ⅲ期的mRNA 预防性疫苗数量为3 个(表8)。以巨细胞病毒感染为适应症的预防性疫苗mRNA-1647 已进入临床Ⅲ期研究阶段,寨卡病毒感染和HIV 病毒感染为适应症的预防性疫苗mRNA-1893 和HIV-TriMix-mRNA vaccine,均已处于临床Ⅱ期研究阶段。
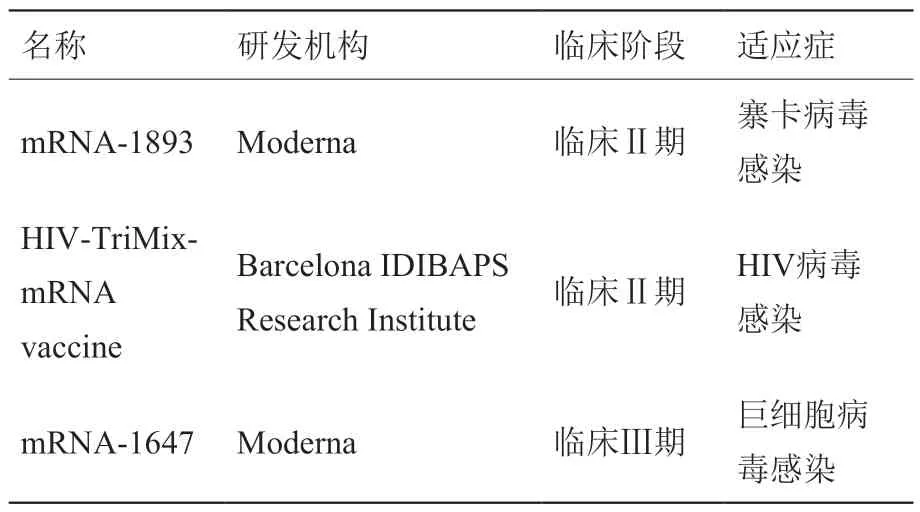
表8 处于临床II / III 期的其他mRNA 预防性疫苗Table 8 Other mRNA prophylactic vaccines in the clinical stage II / III
8.3 处于临床II / III 期的mRNA 肿瘤治疗性疫苗
处于临床Ⅱ/Ⅲ期的mRNA 肿瘤治疗性疫苗数量为8 个(表9)。以Ⅳ期黑色素瘤为适应症的mRNA疫苗较多,分别为NCI-4650、autogene cevumeran、mRNA-4359。Moderna 公司有3 款mRNA 肿瘤治疗性产品,分别为NCI-4650、mRNA-4157、mRNA-4359,其临床阶段均处于临床Ⅱ期。BioNTech 公司有2 款mRNA 肿瘤治疗性产品,分别为BNT-112、autogene cevumeran,其临床阶段也均处于临床Ⅱ期。
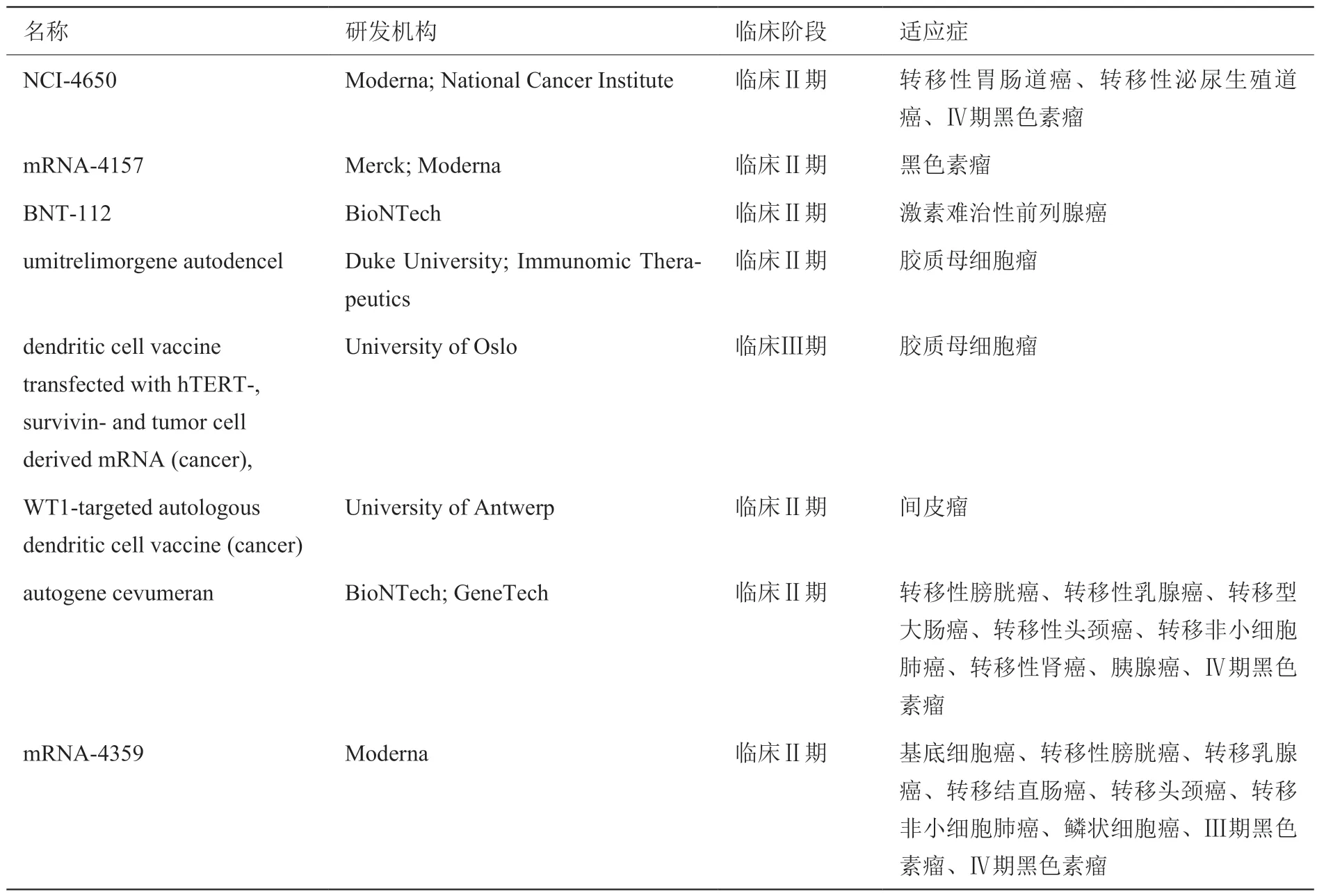
表9 处于临床II / III 期的mRNA 肿瘤治疗性疫苗Table 9 mRNA tumor therapeutic vaccines in the clinical stage II / III
8.4 处于临床II / III 期的mRNA 药物
处于临床Ⅱ/Ⅲ期的mRNA 药物数量为18 个(表10)。Moderna 公司有9 个mRNA 药物处于临床Ⅱ/Ⅲ期,主要以流感病毒感染、肿瘤以及代谢性疾病为适应症,表明Moderna 公司的mRNA 产品研发管线类别丰富,上市潜力较大。BioNTech 公司有2个mRNA 药物处于临床Ⅱ/Ⅲ期,均以癌症为适应症。上海比昂生物医药科技有限公司是中国唯一一家产品处于临床Ⅱ/Ⅲ期的研发机构,其产品mRNA-DC-CTL 是一款基于树突状细胞装载的mRNA 产品,主要以转移性非小细胞肺癌为适应症。中国研究机构在相关领域的数量较少,且集中在企业,表明产学研合作较少。
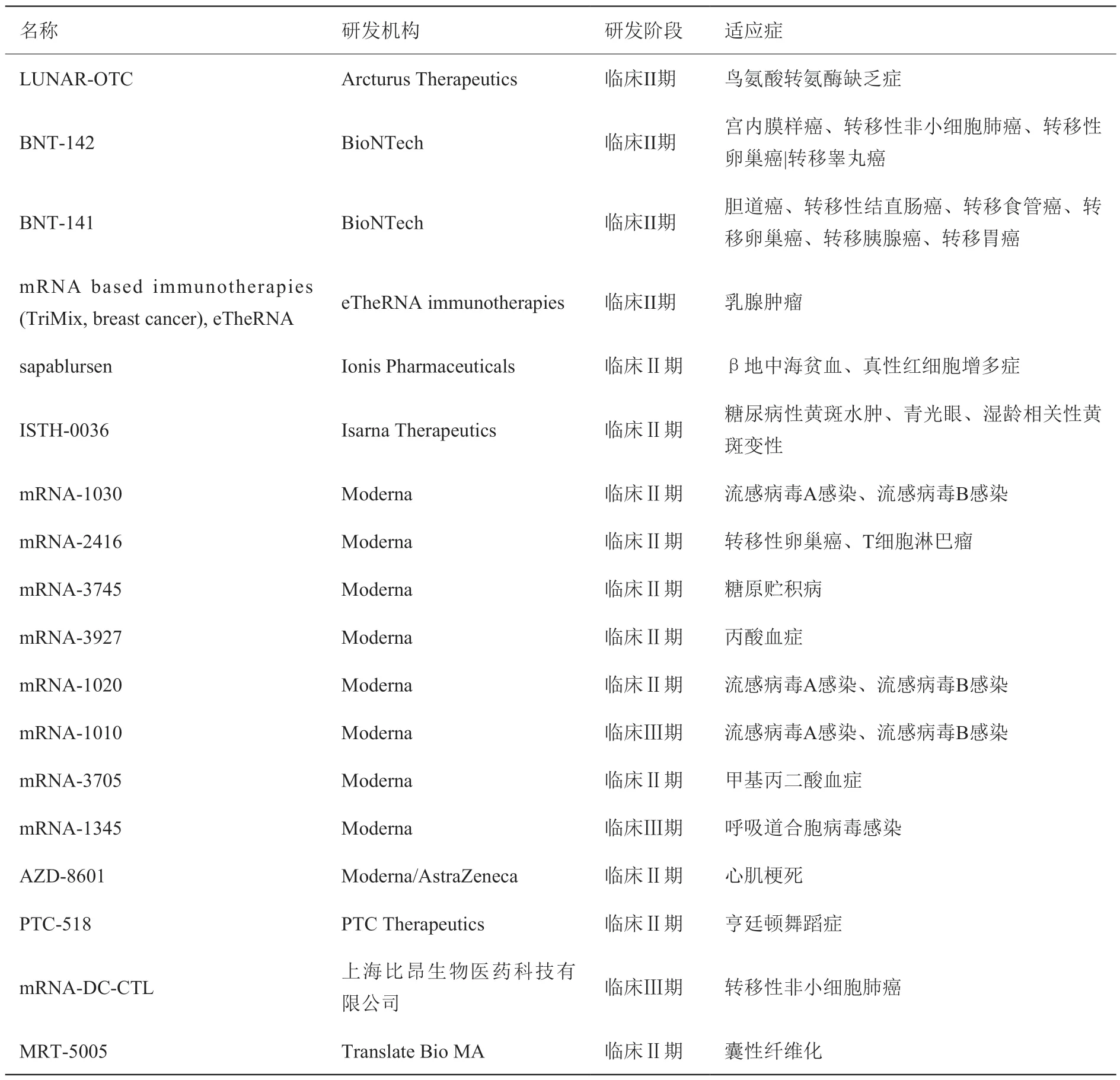
表10 处于临床II / III 期的mRNA 药物Table 10 mRNA drugs in the clinical stage II / III
8.5 中国和美国处于临床II / III 期的各类型mRNA 产品对比
中国和美国处于临床Ⅱ/Ⅲ期的各类型mRNA产品分布如表11 所示。美国机构研发的各类临床Ⅱ/Ⅲ期mRNA 产品共计37 个,其中mRNA 疫苗21 个(临床Ⅱ期15 个,临床Ⅲ期6 个),mRNA 药物16 个(临床Ⅱ期14 个,临床Ⅲ期2 个)。中国机构研发的各类临床Ⅱ/Ⅲ期mRNA 产品共计8 个,其中mRNA 疫苗7 个(临床Ⅱ期5 个,临床Ⅲ期2个),mRNA 药物1 个(临床Ⅲ期1 个)。中国处于临床Ⅱ/Ⅲ期的mRNA 产品数量低于美国,且中国尚没有进入临床Ⅱ/Ⅲ期的mRNA 肿瘤治疗性疫苗和其他预防性疫苗,表明中国在mRNA 相关技术的临床研究水平还有待进一步提高。
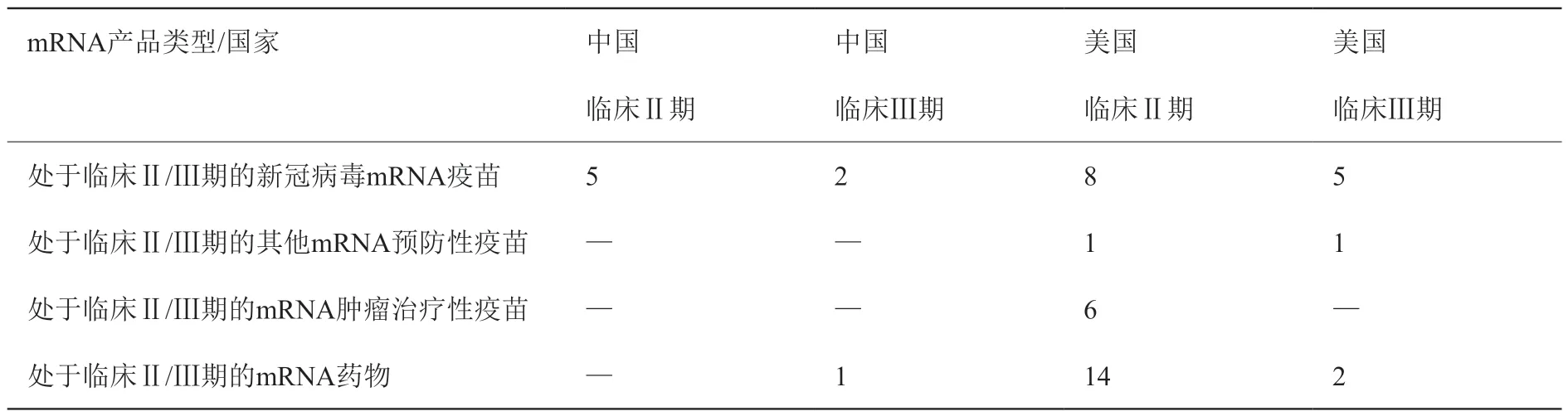
表11 中国和美国处于临床II / III 期的各类型mRNA 产品Table 11 Various types of mRNA products in clinical stage II / III in China and the United States
9 市场情况分析
基于Cortellis 数据库获得3 个上市mRNA 产品的市场数据,即新冠病毒mRNA 疫苗(mRNA-1273/Spikevax 和COMIRNATY®(COVID-19 Vaccine,mRNA),以及内分泌/代谢疾病的治疗性mRNA药物(阿他卢仑)。基于Cortellis 数据库数据,COMIRNATY®(COVID-19 Vaccine, mRNA) 市场销售额将在2022 年达到顶峰(324 亿美元),随后呈下降趋势;mRNA-1273/Spikevax 的市场销售额也在2022 年达到顶峰(212 亿美元),短暂下降后到2025年其市场销售将呈回升趋势;阿他卢仑药物的销售额从2023 年起会维持在年度3 亿美元的销售额水平(图13)。

图13 上市mRNA 产品的市场销量Fig.13 Sales of mRNA products on the market
10 结论与展望
本文通过对Cortellis 数据库中mRNA 技术相关药物或疫苗进行检索,对最终遴选的327 个在研mRNA 产品进行发展趋势、主要国家/地区、主要机构、作用靶点、产品类型分布、疾病适应症、临床研究阶段和市场情况等多个维度分析。在发展趋势方面,mRNA 产品受疫情影响,2020 年呈快速发展趋势,2022 年的产品数量增长至历史新高。在主要国家和研发机构方面,美国mRNA 产品遥遥领先于其他国家,中国和德国紧随其后,大部分研发机构位于北美和欧洲。在作用靶点和产品类型方面,mRNA 产品的靶点主要集中在以疫苗、治疗性抗体和诊断的关键靶点COVID19 尖峰糖蛋白为主,mRNA 产品以mRNA 疫苗为主(占比55%),mRNA 药物为辅(占比45%)。在治疗领域方面,应用于传染性疾病领域的mRNA 产品数量最多(占比近50%),其次是应用于肿瘤领域和内分泌/代谢疾病领域,且在这3 个领域中,美国的产品数量均位列全球首位。在临床研究阶段方面,mRNA 产品主要以临床前研究阶段为主,已上市和注册产品数量还相对较少;目前进入临床Ⅱ/Ⅲ期阶段的mRNA 产品53 个,其中疫苗35 个,药物18 个,其中Moderna 公司的mRNA新冠病毒疫苗、其他mRNA 预防性疫苗、mRNA 肿瘤治疗性疫苗、mRNA 药物的数量均最多,中国处于临床Ⅱ/Ⅲ期的mRNA 产品数量低于美国,且中国尚没有进入临床Ⅱ/Ⅲ期的mRNA 肿瘤治疗性疫苗和其他预防性疫苗,相关技术还有待加强。在市场情况方面,新冠病毒mRNA 疫苗(mRNA-1273/Spikevax 和COMIRNATY®(COVID-19 Vaccine,mRNA))和内分泌/代谢疾病的治疗性mRNA 药物(阿他卢仑)的市场销售较好,其中mRNA-1273/Spikevax 的市场销售额将在2022 年达到顶峰(212亿美元),短暂下降后到2025 年其市场销售将呈回升趋势。
总的来说,我国已处于mRNA 相关研究技术的前沿,但与美国、德国等具有mRNA 基础的国家相比还存在一定差距,未来我国应加大mRNA 技术在传染病领域、肿瘤领域、内分泌/代谢领域的项目部署,加强在LNP、LPX、LPP 等递送等关键核心技术的基础研究力度,加大产学研深度融合,对mRNA 等基础研究前沿技术进行系统布局和前瞻谋划。同时,当前进入数据爆炸时代,我国应把握时机,着重强化利用人工智能、大数据和生物信息学提高抗原设计平台技术,形成具有我国自主知识产权的mRNA 技术平台和产品。此外,我国还应加强mRNA 技术产学研融通发展,提高临床研究水平和成果转化应用,实现mRNA 技术能够真正落地见效。
利益冲突声明
所有作者声明不存在利益冲突关系。

