LPCAT1在肝细胞癌中的表达及与肿瘤免疫的相关性分析
王锃涵,王云,王雪梅,朱威威,梁红霞
(郑州大学第一附属医院 感染科,河南 郑州 450000)
原发性肝癌是全球第六大最常诊断的癌症和第三大癌症相关死因[1],2020年全球约有90万人被诊断为肝癌,83万人死于肝癌[2]。肝细胞癌(hepatocellular carcinoma,HCC)是原发性肝癌最常见的病理类型,因其症状隐匿且进展迅速,约70%的患者在确诊时已处于中晚期[3]。目前,以程序性死亡受体1(programmed cell death protein 1,PD-1)为代表的免疫治疗是中晚期HCC的主要治疗手段,也可作为HCC的辅助治疗和转化治疗手段[4],同时面临着客观应答率低、毒副作用高、适应性耐药等挑战[5]。研究表明,免疫治疗与肿瘤细胞异常的脂质代谢密切相关,后者可通过直接或间接调节免疫细胞的分化、凋亡以及细胞间相互作用等影响免疫治疗效果[6]。血磷脂酰胆碱酰基转移酶1(lysophosphatidylcholine acyltransferase 1,LPCAT1)作为脂质代谢过程中一种参与膜脂重塑的关键酶[7],已被证实在多种癌症中表达升高,且具有作为诊断和预后标志物的潜力[8-11]。在HCC中,LPCAT1被证实可通过激活Wnt/β-catenin信号通路进而促进肝癌细胞的上皮间充质转化过程,以及通过抑制信号传导转录激活因子1进而促进肝癌细胞增殖等[12-13]。然而,目前关于LPCAT1在HCC中与肿瘤免疫微环境的相互作用等尚未被阐明。
本研究基于肿瘤基因组图谱(The Cancer Genome Atlas,TCGA)等数据库,联合LPCAT1表达水平和患者的临床病理特征、预后信息等资料,探索LPCAT1在HCC中的诊断意义、预后意义和潜在功能,通过细胞学实验探究LPCAT1对HCC细胞恶性生物学行为的影响。同时,分析LPCAT1与HCC中免疫细胞浸润水平和标志物表达水平的相关性,以及LPCAT1与免疫检查点的遗传变异和表达水平的关系,以此探索LPCAT1在肿瘤免疫中的潜在功能。
1 材料与方法
1.1 LPCAT1表达情况分析
从TCGA(https://cancergenome.nih.gov)数据库下载包含374例HCC样本和50例正常样本的TCGA-LIHC数据集[14],对基因表达数据进行log2对数转换,使用R包limma分析LPCAT1在肿瘤和正常样本中的差异表达。从人类蛋白质表达数据库(Human Protein Atlas,HPA,https:/www.proteinatlas.org/)22.0中下载LPCAT1在HCC肿瘤和肝脏组织中的蛋白表达情况[15]。
1.2 LPCAT1预后意义分析
利用基因表达谱在线分析平台(gene expression profiling interactive analysis,GEPIA)2.0(http://gepia2.cancer-pku.cn)[16]和Kaplan-Meier Plotter数据库(http://kmplot.com)对LPCAT1表达水平与常见恶性肿瘤的预后信息进行Cox回归分析或log-rank秩和检验,并绘制预后生存曲线[17]。通过绘制受试者工作特征(receiver operating characteristic,ROC)曲线分析LPCAT1对于HCC预后情况的预测效能。
1.3 LPCAT1与HCC患者临床病理特征的分析
以LPCAT1mRNA表达水平的中位数为标准将样本分为高表达组(187例)和低表达组(187例),利用χ2检验分析LPCAT1的表达与临床病理信息的相关性,不符合正态分布的变量运用Wilcoxon检验。随后进行单因素和多因素Cox回归分析,并通过Nomogram列线图对多因素Cox回归分析结果进行可视化。
1.4 LPCAT1在HCC中的功能富集分析
利用Spearman秩相关性分析挑选与LPCAT1表达水平具有显著相关性的1组基因,上传至DAVID(the Database for Annotation,Visualization and Integrated Discovery,https://david.ncifcrf.)2021在线数据库进行功能富集分析,分析内容主要包括基因本体论(Gene Ontology,GO)和京都基因和基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)[18]。同时从基因集富集分析(gene set enrichment analysis,GSEA)官网(https://www.gsea-msigdb.org/)下载GSEA 4.3.0软件,对差异基因在信号通路或生理过程中的富集情况进行GSEA。
1.5 LPCAT1影响免疫细胞和免疫检查点的分析
利用肿瘤免疫浸润评估资源(Tumor Immune Estimation Resource,TIMER)2.0数据库(http://timer.comp-genomics.org/)分析LPCAT1与肿瘤微环境中免疫细胞浸润丰度的相关性[19]。应用cBioPortal数据集(V.5.3.6)(https://www.cbioportal.org/)分析HCC中LPCAT1与免疫检查点遗传变异的关系,包括扩增、缺失等[20]。应用相关性分析探索LPCAT1与免疫细胞标志物及免疫检查点的表达水平的关系。
1.6 细胞实验
1.6.1细胞和主要试剂
人类HCC细胞系和肝细胞系均购自中国细胞典藏中心。DMEM细胞培养基、胎牛血清等购自美国Gibco公司,一抗购自英国Abcam公司,蛋白定量试剂盒和EdU试剂盒购自上海碧云天公司,荧光定量SYBR Green Ⅰ试剂盒购自瑞士Roche公司。siRNA和聚合酶链反应(polymerase chain reaction,PCR)引物分别由汉恒生物公司和生工生物公司构建。
1.6.2细胞培养和细胞转染
HCC细胞系和L02细胞系分别用含10%(体积分数)胎牛血清的DMEM或RPMI 1640培养基培育于5% CO2、37 ℃的培养箱中。选取汇合度为70%~80%的Huh7和Hep3B细胞系,按照说明书配制含有适量siRNA和Lipofectamine 3000的转染体系,等量加入细胞培养孔中,8 h后更换为含血清DMEM培养基。36 h后检测LPCAT1mRNA水平,48 h后检测LPCAT1蛋白质水平。
1.6.3实时荧光定量PCR
应用Trizol、氯仿等提取总RNA并测定浓度,依据操作说明配制反转录体系,依次于25 ℃反应5 min,42 ℃反应1 h,75 ℃反应5 min。随后依据操作说明配制cDNA扩增体系。首先以95 ℃反应10 min,后按照95 ℃ 10 s,60 ℃ 15 s,72 ℃ 20 s的顺序反应40个循环,运用2-△△CT法计算相对表达量。
1.6.4Western blot
收集总蛋白后利用BCA法测定蛋白浓度并配制上样体系,97 ℃变性后于125 g·L-1聚丙稀酰胺凝胶和1×Tris-甘氨酸电泳液进行电泳,电泳条件为恒压220 V,约35 min。随后,于1×Tris-甘氨酸转膜液中构建转膜体系,转膜条件恒流0.2 A,70 min。于封闭液中进行1 h的室温封闭,清洗后分别孵育一抗和二抗(1∶5 000),随后进行蛋白显影和图像分析。
1.6.5EdU实验
按照说明书配制2×EdU工作液,选取对数生长期的细胞系加入EdU工作液孵育3 h,随后进行固定和室温通透处理,并用Click活性溶解体系和Click反应液于室温下避光孵育15 min。用Hoechst 33342溶液对细胞核进行染色。利用荧光显微镜对细胞增殖情况进行观测。
1.6.6划痕实验
选取贴壁于六孔板的汇合度85%~95%的细胞,用200 μL枪头对细胞进行垂直或水平划痕,每孔2道划痕。随后分别于0 h和36 h时用普通光学显微镜对划痕处进行观测和拍照,测量划痕的变化程度并进行后续分析。注意划痕后使用不含胎牛血清的培养基进行培养。
1.7 统计学方法
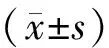
2 结果
2.1 LPCAT1 mRNA在泛癌中的表达水平和预后分析
本研究分析了TCGA数据库中33种癌症组织和正常组织中LPCAT1的表达水平。结果显示,有22种癌症组织表现出较高水平的LPCAT1,如HCC、膀胱尿路上皮癌、乳腺癌、肺鳞癌等,然而LPCAT1在肾嫌色细胞癌、甲状腺癌和胸腺瘤中的表达水平低于癌旁组织(图1A)。基于GEPIA数据库的分析显示,LPCAT1与HCC、肺鳞癌、低级别胶质瘤的总生存期(overall survival,OS)和疾病特异性生存期(disease specific survival,DSS)具有显著的相关性,LPCAT1的表达水平越高,患者的OS和DSS越短(图1B)。

A为LPCAT1在多种恶性肿瘤中显著高表达;B为LPCAT1在HCC、肺鳞癌和低级别胶质瘤患者中提示不良预后。
2.2 LPCAT1在HCC中高表达且提示不良预后
根据TCGA-LIHC数据集和HPA数据库分析LPCAT1在配对样本和非配对样本中的表达水平,结果均显示LPCAT1在HCC中的表达水平高于癌旁组织(P<0.05)(图2A~B)。对LPCAT1与HCC临床病理特征的相关性进行统计分析,结果显示,LPCAT1与较高的T分期(P=0.008)、组织学分级(P<0.001)、Edmondson-Steiner分级(P=0.002)、血清甲胎蛋白水平(P=0.019)以及发生血管侵袭(P<0.001)具有显著相关性,见图2C及表1(部分患者临床病理特征信息缺失)。通过Cox回归分析探索影响HCC预后的危险因素,单因素分析结果提示,较高的Edmondson-Steiner分级(P<0.001)、T分期(P<0.001)和LPCAT1表达水平(P<0.001)是影响HCC生存期的潜在危险因素,多因素回归分析提示高表达的LPCAT1(P<0.001)是影响HCC预后的独立因子(表2)。基于回归分析结果的Nomogram列线图显示,LPCAT1高表达的HCC样本的单项总分更高,与之对应的1、3、5 a生存率更低,高表达的LPCAT1可能是HCC患者潜在的预后预测指标(图3)。生存曲线显示,LPCAT1高表达的HCC样本具有较低的OS、DSS和无进展生存期(progression free survival,PFS)(图4A~C)。依据ROC曲线分别利用OS、DSS和PFS评价LPCAT1对HCC预后预测的效果,结果显示,曲线下面积(area under the curve,AUC)分别为0.886、0.763和0.628,具有较好的预测价值(图4D~F)。
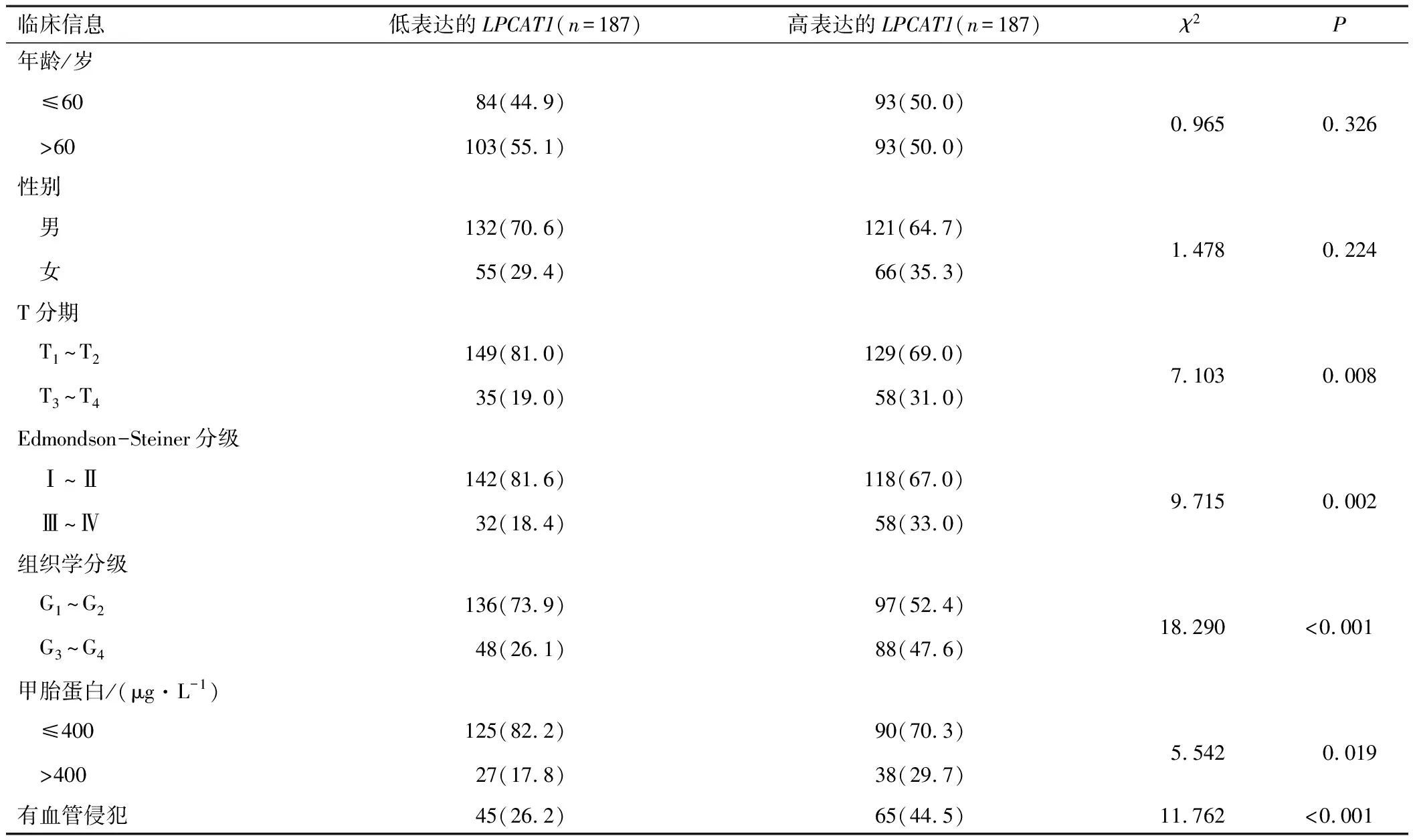
表1 LPCAT1与HCC临床病理特征的相关性[n(%)]
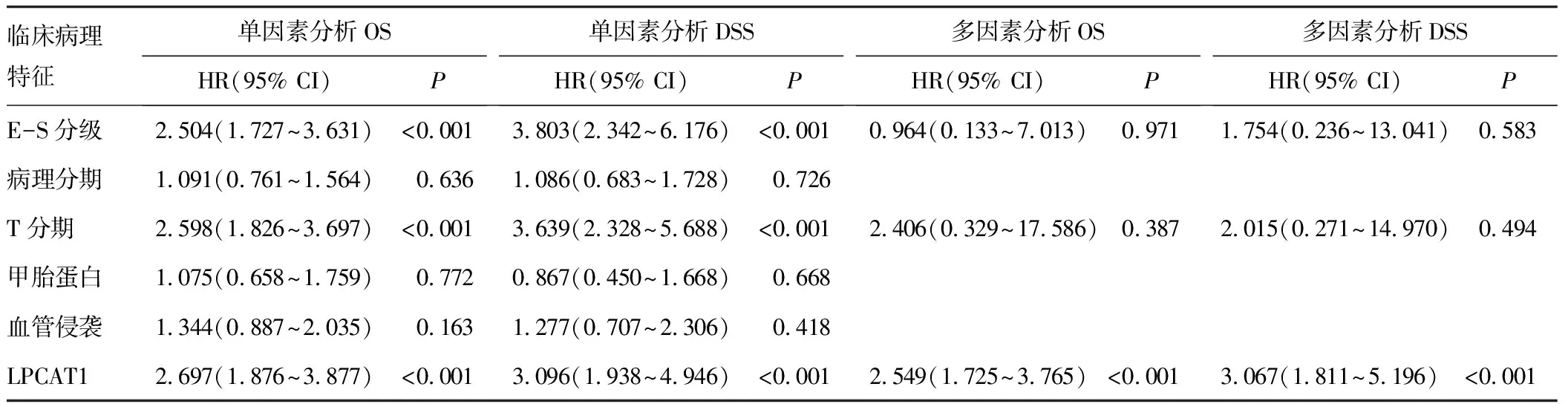
表2 HCC临床病理特征与总生存率的相关性分析
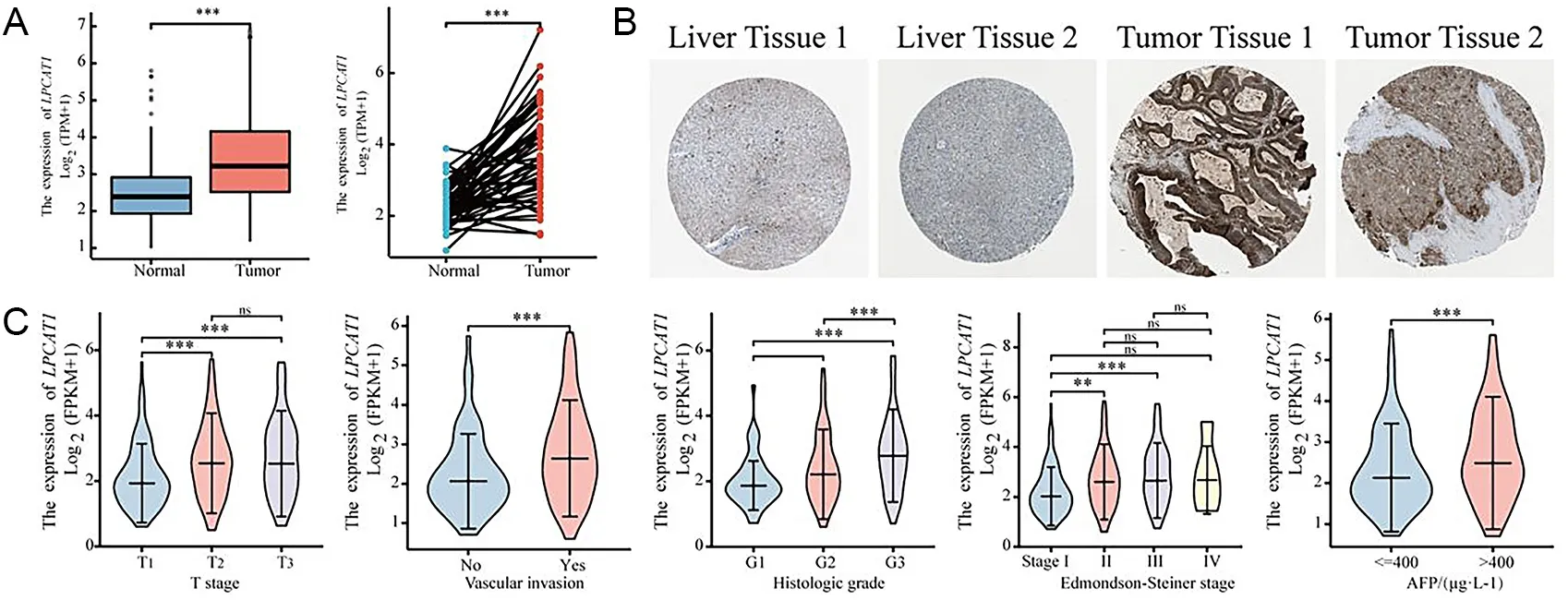
A为LPCAT1在HCC和癌旁样本中的表达水平;B为HPA数据库中LPCAT1在HCC和正常肝脏中的表达情况;C为LPCAT1与HCC样本的临床病理特征的关系;*P<0.05;**P<0.01;***P<0.001。
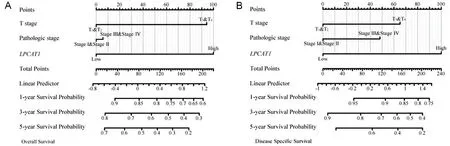
A为以OS为预后指标的Nomogram预后预测模型;B为以DSS为预后指标的Nomogram预后预测模型。
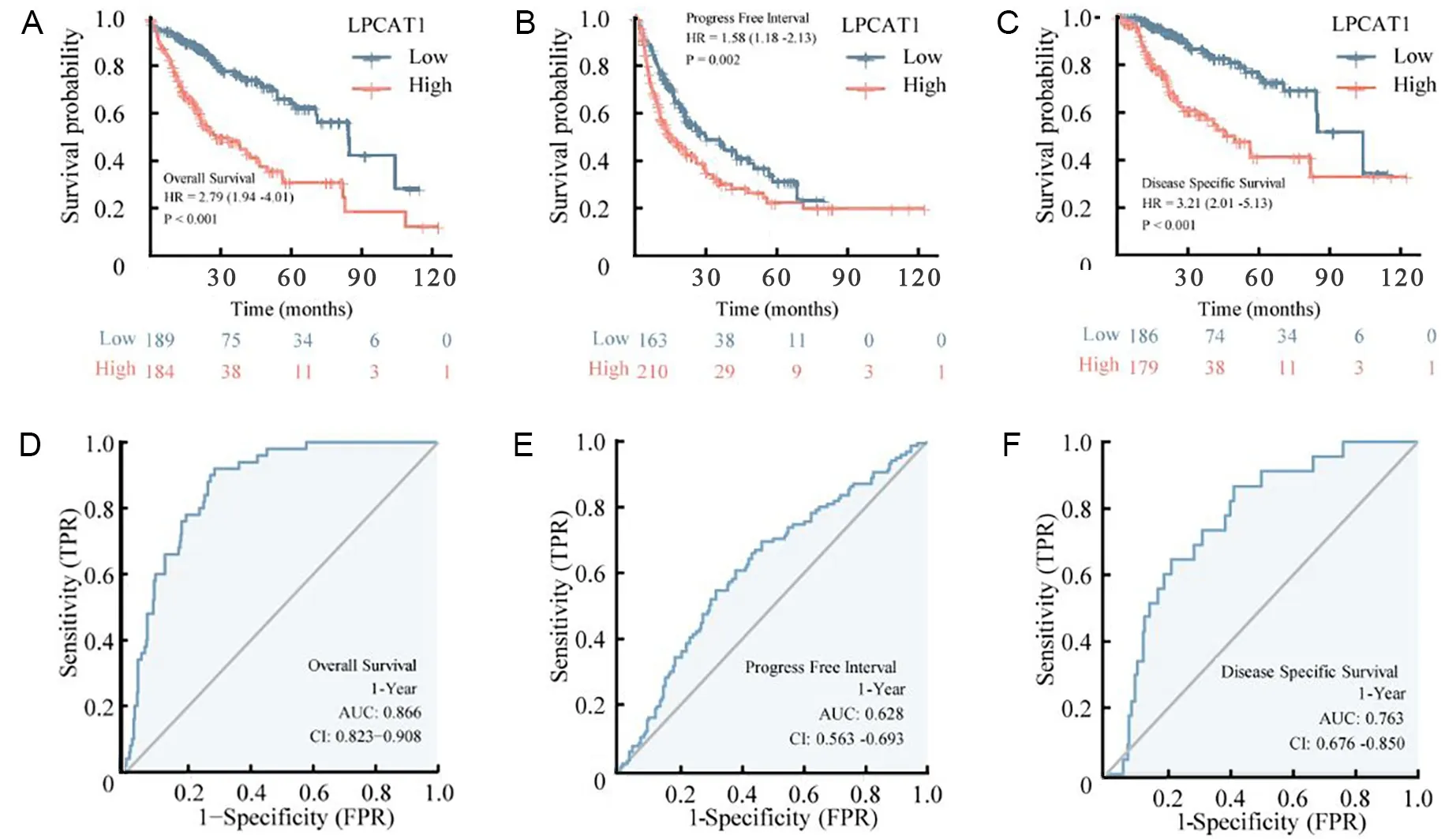
A、B、C为基于LPCAT1表达水平的生存曲线;D、E、F为基于LPCAT1表达水平的ROC曲线模型。
2.3 LPCAT1的潜在功能分析
利用相关性分析获取与LPCAT1的表达水平相关性较强的基因共5 155个(P<0.05,相关系数绝对值>0.3),以此进行GO和KEGG通路富集分析,结果显示,LPCAT1参与的生物过程主要包括中性粒细胞介导的免疫、有丝核分裂、微管细胞骨架组织等;参与的分子功能主要包括激活跨膜转运蛋白、铁离子结合、酰基转移酶活性等;LPCAT1相关的细胞组成主要为细胞-基质黏附结点、细胞微管、蛋白-脂质复合体等;KEGG通路富集分析结果提示,LPCAT1主要参与过氧化物酶体、糖酵解/糖异生等信号通路(图5)。GSEA结果显示,LPCAT1在HCC中参与初始或效应CD8+T细胞生成、辅助性T细胞1和17的上调、上皮-间充质转化等,以及KRAS、Wnt、EGFR等癌症相关信号通路(图6)。
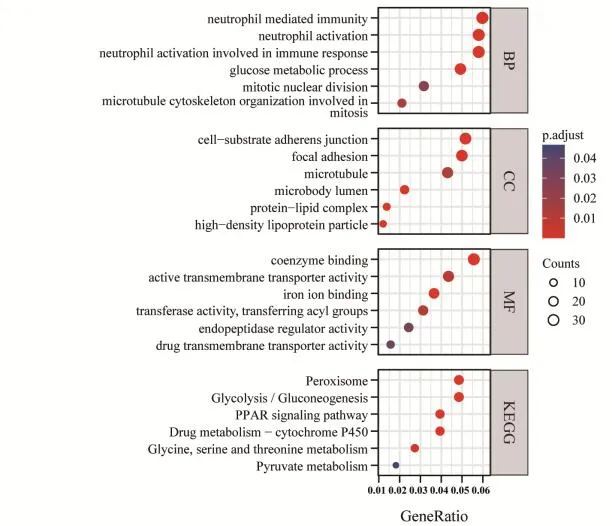
图5 HCC样本中LPCAT1的GO和KEGG功能分析
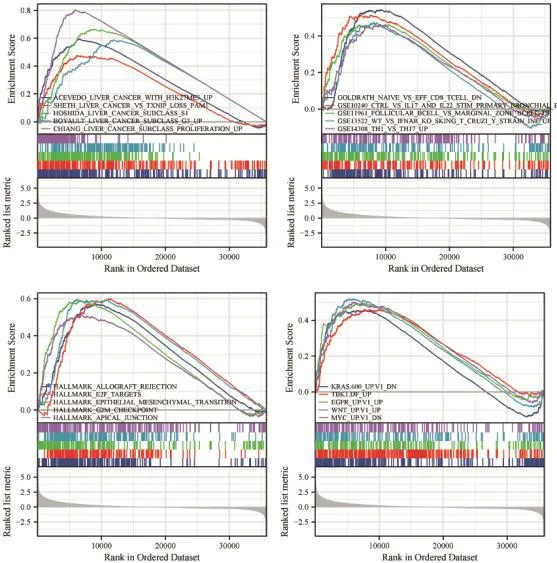
图6 HCC样本中LPCAT1的GSEA富集分析
2.4 LPCAT1与免疫细胞浸润的关系
首先利用TIMER 2.0数据库分析LPCAT1与HCC肿瘤微环境中免疫细胞浸润水平的相关性,结果显示,LPCAT1与5种免疫抑制性细胞的浸润丰度呈正相关,包括单核细胞(r=0.453,P<0.001)、M2型肿瘤相关巨噬细胞(tumor-associated macrophages,TAMs)(r=0.345,P<0.001)、肿瘤相关成纤维细胞(carcinoma-associated fibroblasts,CAFs)(r=0.300,P<0.001)、骨髓源性抑制细胞(myeloid-derived suppressor cells,MDSCs)(r=0.557,P<0.001)和调节性T细胞(regulatory T cells,Tregs)(r=0.287,P<0.001)(图7A~E)。自CellMarker 2.0数据库(http://CellMarker/index.html)查询上述免疫细胞的细胞标志基因,相关性分析提示LPCAT1与上述5种免疫抑制细胞亚群的标志基因在表达水平上呈正相关(图7F)。
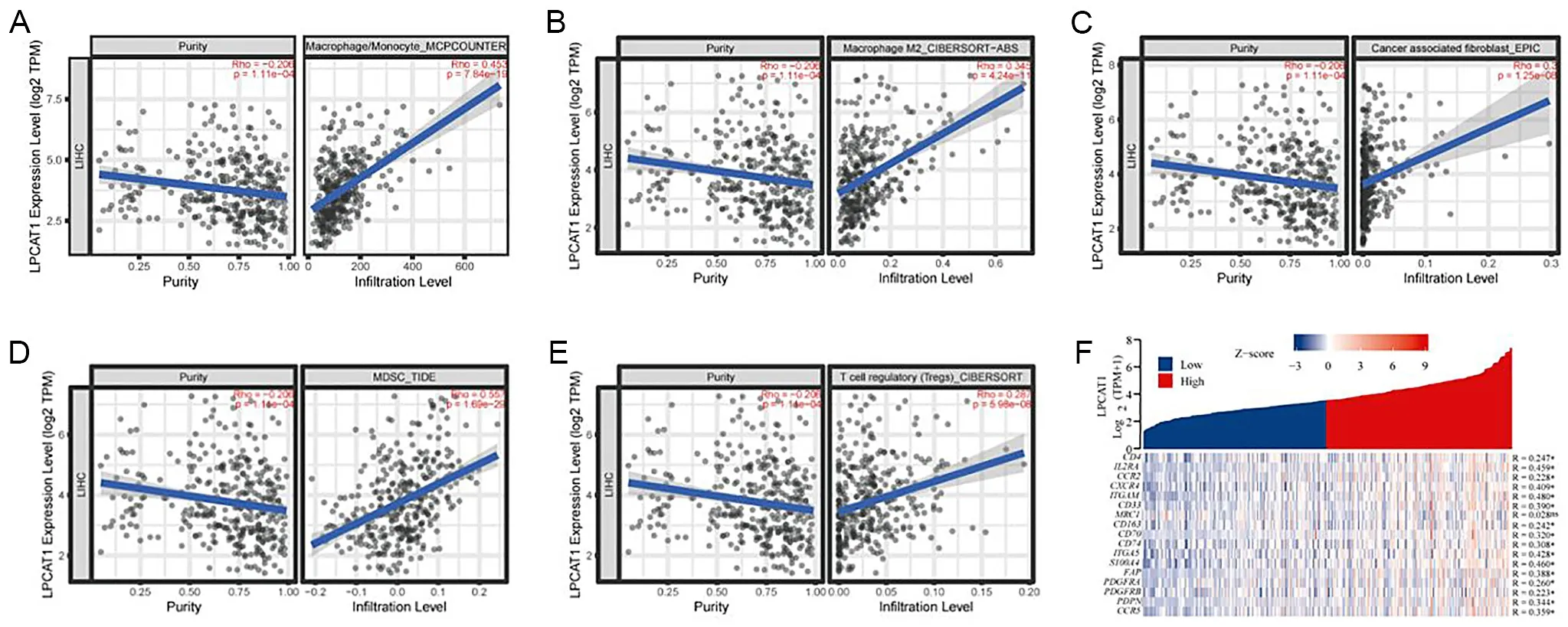
A~E为LPCAT1与免疫细胞浸润程度的相关性分析;F为LPCAT1与5种免疫抑制性细胞的标志基因表达水平的相关性分析;*P<0.05。
2.5 LPCAT1与HCC中免疫检查点的关系
为探索LPCAT1可否作为预测抗肿瘤免疫治疗效果的潜在指标,分析HCC中LPCAT1与免疫检查点的关系。首先利用cBioPortal数据库绘制LPCAT1与免疫检查点基因的共变异和互斥变异图谱,并采用Fisher精确检验进行统计学分析,结果表明,LPCAT1与CD48、CD80、HHLA2、TNFSF4和TNFSF18在同一HCC样本中存在共变异(P<0.05),变异类型按照发生频率由高到低依次为扩增、深度缺失和错义突变,提示LPCAT1与上述基因具有一定的共现性(图8A,表3)。相关性分析结果显示,LPCAT1与免疫检查点在表达水平上具有一定的正相关性(图8B)。
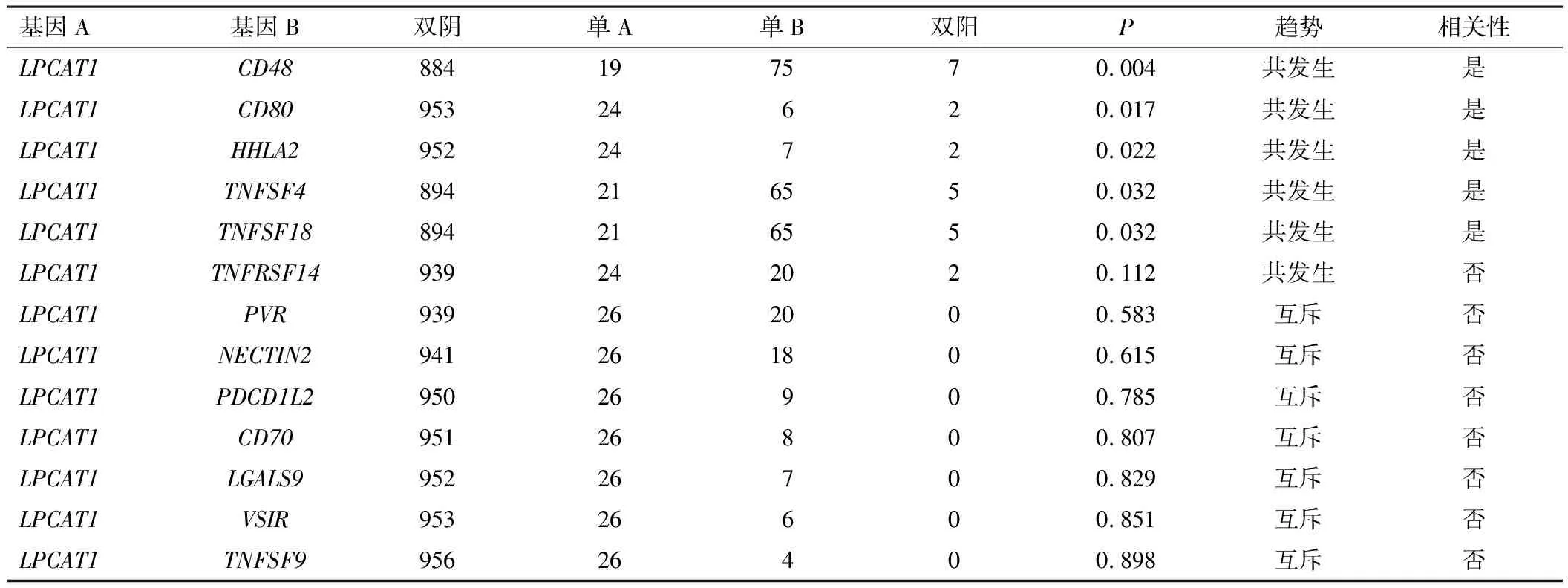
表3 HCC中LPCAT1和免疫检查点的互斥性和共现性分析

A为HCC中LPCAT1和免疫检查点基因的互斥性和共现性分析;B为LPCAT1与免疫检查点基因表达水平的相关性分析。
2.6 敲低LPCAT1抑制HCC细胞系的增殖和迁移能力
Western blot结果显示,LPCAT1在HCC细胞系中的表达高于正常肝脏细胞(图9A)。随后应用si-RNA分别转染Huh7和Hep3B两种细胞系,分别用Western blot和qRT-PCR验证LPCAT1的敲减效果,结果显示,siLPCAT1组中的LPCAT1水平降低,敲减有效(图9B~C)。EdU实验结果显示,siLPCAT1组在3 h内进行增殖的细胞比率低于对照组,敲低LPCAT1可以抑制HCC细胞的增殖能力(图9D);细胞划痕实验结果显示,siLPCAT1组在划痕36 h之后划痕宽度缩短的距离短于对照组,敲低LPCAT1可以抑制HCC细胞的迁移能力(图9E)。

A为LPCAT1在肝脏细胞系和HCC细胞系中的表达情况;B、C为在蛋白质水平和RNA水平验证LPCAT1的敲减效率;D为敲低LPCAT1对HCC细胞系增殖能力的影响;E为敲低LPCAT1对HCC细胞系迁移行为的影响;**P<0.01。
3 讨论
目前,关于HCC早期诊断和综合治疗的研究均取得了较大的突破和创新,部分中晚期患者有望在进行辅助性抗肿瘤药物治疗和局部治疗之后再进行外科切除,扩大了外科切除的治疗范围[21]。此外,围手术期可进行免疫检查点抑制剂或分子靶向药物的单药或联合治疗,有助于降低术后复发率[22]。然而,免疫治疗和分子靶向治疗仍面临着整体应答率低、毒副作用高、原发或继发性耐药等挑战[23]。迫切需要对HCC的发病和进展机制进行多学科联合研究,以获得理想的生物标志物和个体化治疗的靶点。
在癌症进展过程中,异常活跃的脂质合成、吸收和相关酶的异常表达已被证实是一种适应性代谢重排现象,又叫做脂质代谢重编程[24]。LPCAT1是磷脂酰胆碱代谢的关键调节因子,催化溶血磷脂酰胆碱转化为磷脂酰胆碱,从而调节细胞膜的结构和流动性[7]。LPCAT1在多种癌症中的表达水平升高,如乳腺癌[25]、宫颈癌[26]和前列腺癌[27]等,可以促进肿瘤细胞的增殖、侵袭和血管生成等恶性生物学行为。然而,目前关于LPCAT1在HCC中的潜在机制,尤其是对免疫微环境和抗肿瘤免疫应答的影响尚未明确。
本研究首先基于TCGA数据库分析了LPCAT1在泛癌中的表达谱以及与预后的相关性,发现LPCAT1在包括HCC、前列腺癌等在内的多种癌症中的表达水平升高,且与一些肿瘤的预后相关,证明了LPCAT1可能参与多种肿瘤的发生和进展。随后,通过分析LPCAT1与HCC临床病理特征和预后的关系,证明高表达的LPCAT1与HCC患者较高的T分期、Edmondson-Steiner分级、血清甲胎蛋白水平等具有相关性,表明LPCAT1与HCC的进展有关,进一步的Cox回归分析证实LPCAT1是HCC的独立危险因子与独立预后因子。ROC曲线显示LPCAT1对患者预后的预测具有较高的特异性和敏感性。上述结果都表明LPCAT1可能是一个对HCC具有诊断和预后评估能力的生物标志物。为探索LPCAT1潜在的致癌机制,本研究通过功能富集分析,证实了LPCAT1在HCC中主要参与多种具有促癌作用的信号通路和病理过程。随后通过细胞实验证实了LPCAT1在HCC细胞系中的表达水平升高且敲低LPCAT1对HCC细胞的增殖和迁移能力具有抑制性影响。以上结果均证实了LPCAT1影响HCC的发生和进展过程,可为基于LPCAT1的生物标志物和治疗靶点的研发提供更多理论基础。
HCC肿瘤微环境中的细胞成分主要由T淋巴细胞、B淋巴细胞、自然杀伤细胞、肥大细胞、单核细胞、TAMs、MDSCs、CAFs等组成,与肿瘤免疫逃逸和免疫耐受紧密相关[28]。以PD-1为代表的免疫检查点抑制剂的功能主要是刺激特异性免疫,打破免疫耐受,重新赋予免疫细胞识别和杀伤癌细胞的活性[23]。目前,越来越多的研究证明恶性肿瘤中异常的脂质代谢与免疫细胞和免疫检查点基因具有潜在的相互作用,可共同促进肿瘤进展[29-30]。在免疫细胞方面,研究证实,CD8+淋巴细胞表面的CD36分子可以吸收低密度脂蛋白并诱导脂质过氧化,进而导致肿瘤局部CD8+T细胞功能障碍,促进了肿瘤的免疫逃逸[31]。另有研究表明,脂质异常聚集可降低树突状细胞的抗原呈递能力,进而导致T细胞的耗竭或功能障碍[32]。在免疫检查点方面,研究表明,胆固醇合成过程的重要限速酶之一辛伐他汀可通过抑制lncRNASNHG29来降低Yes相关蛋白的磷酸化和泛素化介导的蛋白降解,从而使程序性死亡受体配体1的转录水平降低[33]。另有研究表明,由脂肪酸合成酶(fatty-acid synthase,FASN)催化的脂肪酸从头合成过程可促进Treg的成熟与分化,在FASN基因缺失的Treg中可检测到上调的PD-1表达水平,抑制Treg的脂质合成过程可以抑制肿瘤细胞生长且增强抗PD-1免疫治疗的效果[34]。以上研究均表明脂质代谢重编程可通过影响免疫细胞和免疫检查点来发挥促癌作用。基于TCGA和TIMER数据库,本研究证实了LPCAT1的高表达与5种免疫抑制细胞群即单核细胞、Tregs、TAMs、MDSCs和CAFs的浸润水平和标志基因的表达水平呈正相关,表明LPCAT1可能通过影响免疫抑制性的肿瘤微环境来促进HCC的进展。此外,本研究首次绘制了HCC中LPCAT1与免疫检查点的共变异和互斥变异图谱,证实了LPCAT1与免疫检查点的遗传变异密切相关,同时也证实了LPCAT1与免疫检查点的表达水平呈正相关,创新性地提出LPCAT1可能和免疫检查点存在相互作用,具有成为预测抗HCC免疫治疗效果的生物标志物的潜力。
4 结论
本研究初步证实了LPCAT1在包括HCC在内的多种恶性肿瘤中高表达,与HCC患者的临床病理信息和预后显著相关,是HCC的独立风险因子和独立预后因子,且LPCAT1的敲减对HCC细胞的增殖和迁移能力有抑制作用。LPCAT1与免疫抑制性细胞以及免疫检查点紧密相关,可能通过参与免疫抑制性肿瘤微环境的构建进而参与HCC进展,有望成为预测抗HCC免疫治疗效果的生物标志物。需要进一步的深入研究为LPCAT1相关的HCC治疗靶点的开发提供理论基础和临床证据。

