基于PG-SGA评分营养干预在新辅助化疗局部进展期胃癌中的应用
杜园,郭超,马迪,王岚,张慧芳,王辉
1.涿州市医院普外科,河北涿州 072750;2.涿州市医院妇科,河北涿州 072750;3.涿州市医院营养科,河北涿州 072750;4.涿州市医院内镜中心,河北涿州 072750
新辅助化疗对于提高局部进展期胃癌手术切缘率、改善预后均有一定临床价值[1],但接受手术治疗以及术后化疗均将导致患者严重应激反应,由于肿瘤性代谢产物引起机体畏食、早饱、疼痛或压迫引起的吞咽困难等,多数患者均合并有显著的营养不良[2]。研究提示针对恶性肿瘤患者进行营养支持,可有效地促进患者顺利完成新辅助化疗疗程,改善患者预后[3]。患者主观整体评估(Scored Patient Generated Subjective Global Assessment, PGSGA)以主观整体评估恶性肿瘤患者特异性营养状况[4]。本研究选择2019年4月—2022年10月涿州市医院普外科收治的新辅助化疗局部进展期胃癌患者99例作为研究对象,主要探讨基于PG-SGA评分实施个性化的营养干预,应用于新辅助化疗局部进展期胃癌中的临床价值,现报道如下。
1 资料与方法
1.1 一般资料
选择本院普外科收治的新辅助化疗局部进展期胃癌患者99例作为研究对象,依据随机数字表法分为两组。对照组50例,观察组49例。观察组:男26例,女23例;年龄26~71岁,平均(53.8±5.9)岁;诊断胃癌时间3 d~2周,平均(8.1±2.3)d。对照组:男29例,女21例;年龄25~70岁,平均(53.0±6.2)岁;诊断胃癌时间3 d~2周,平均(8.0±2.5)d。两组患者一般资料比较,差异无统计学意义(P>0.05)。具有可比性。入组前已申报本院医学理论委员会批准,并与患者签署知情同意书。
1.2 纳入与排除标准
纳入标准:①病理学诊断为胃癌,且TNM分期Ⅱ~Ⅲ期患者;②预计生存期>3个月患者。
排除标准:①有其他原发恶性肿瘤患者;②存在消化道出血或梗阻患者。
1.3 方法
所有入组者术后化疗方案均为XELOX方案,具体为奥沙利铂(国药准字H20113144,规格:0.5 g/片)130 mg/m2,静脉滴注,第1天,加卡培他滨(国药准字H20073024,规格50:mg/支)850~1 000 mg/ m2,2次/d,口服,第1~14天,每3周重复1次。
对照组患者接受常规饮食指导,如加强营养支持,高蛋白饮食,少吃多餐,合理调配饮食,不吃辛辣刺激食物,加强蔬菜、瓜果、豆类等富含多种维生素和微量元素摄入等。
观察组在对照组的基础上辅以PG-SGA个性化营养干预。观察组定期对患者进行定期PG-SGA评分,0~1分(营养状况良好)时患者仅需合理饮食,定期随诊评估即可,无需要过多措施干预;2~3分时(可疑营养不良)由医护人员或营养师行住院饮食健康教育,结合营养风险症状严重程度与生化检查制订药物干预计划;4~8分时(中度营养不良)行积极营养干预,由医师、营养师结合患者个体化病情制订营养干预方案;≥9分时(重度营养不良)进行紧急营养支持干预,以便及时改善患者营养状况。营养支持上,肠内营养以患者个体化情况为基础,单独或联合肠外营养干预,以25 kcal/(kg·d)标准给予营养支持,肠外营养为静脉输入全营养混合液;肠内营养以本院营养科配制的营养餐为主,口服或管饲,营养支持时间至少3 d。两组均连续干预1个疗程,即1周。
1.4 观察指标
①营养指标:血红蛋白(hemoglobin, Hb)、血清白蛋白(albumin, ALB)及血清前蛋白(prealbumin,PAB)变化。②免疫指标:免疫球蛋白A(immunoglobulin A, IgA)、免疫球蛋白G(immunoglobulin G,IgG)、免疫球蛋白M(immunoglobulin M, IgM)以及CD3+、CD4+变化。③统计干预期间不良反应,包括低蛋白血症、营养不良、乏力失眠和食欲下降的总比例。
1.5 统计方法
采用SPSS 20.0统计学软件对数据进行分析,计量资料经检验符合正态分布,采用(±s)表示,组间差异比较进行t检验;计数资料采用例数(n)和率表示,组间差异比较进行χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组患者干预前后血清蛋白水平比较
干预前两组血清白蛋白、前白蛋白和血红蛋白水平比较,差异无统计学意义(P>0.05)。干预后,观察组血红蛋白、血清白蛋白、血清前白蛋白水平高于对照组,差异有统计学意义(P<0.05);观察组白蛋白、前白蛋白、血红蛋白水平降低程度低于对照组,差异有统计学意义(P<0.05)。见表1。
表1 两组患者干预前后血清蛋白水平比较[(±s),g/L]
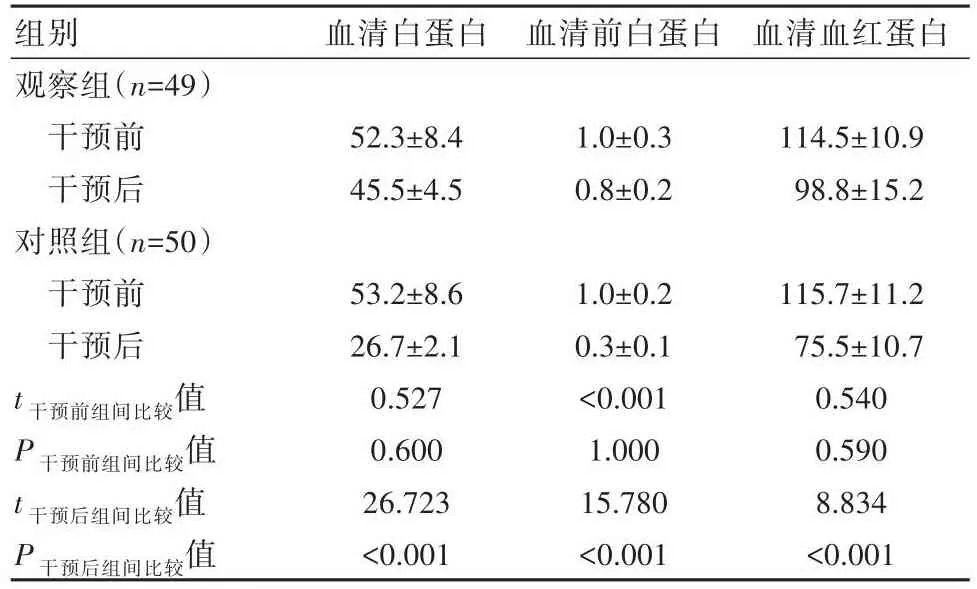
表1 两组患者干预前后血清蛋白水平比较[(±s),g/L]
组别观察组(n=49)干预前干预后对照组(n=50)干预前干预后t干预前组间比较值P干预前组间比较值t干预后组间比较值P干预后组间比较值血清白蛋白52.3±8.4 45.5±4.5 53.2±8.6 26.7±2.1 0.527 0.600 26.723<0.001血清前白蛋白1.0±0.3 0.8±0.2 1.0±0.2 0.3±0.1<0.001 1.000 15.780<0.001血清血红蛋白114.5±10.9 98.8±15.2 115.7±11.2 75.5±10.7 0.540 0.590 8.834<0.001
2.2 两组患者干预前后免疫学指标水平比较
干预后,观察组IgA、IgG、IgM、CD3+、CD4+水平均高于对照组,差异有统计学意义(P<0.05)。见表2。
表2 两组患者干预前后免疫学指标水平比较(±s)

表2 两组患者干预前后免疫学指标水平比较(±s)
组别观察组(n=49)干预前干预后对照组(n=50)干预前干预后t干预预前组间比较值P干预前组间比较值t干预后组间比较值P干预后组间比较值IgM(mg/L)0.6±0.1 1.8±0.2 0.6±0.1 1.3±0.2 0.000 1.000 12.437<0.001 IgG(mg/L)4.3±0.3 8.6±1.2 4.2±0.2 7.9±0.9 1.956 0.053 3.288<0.001 IgA(mg/L)1.7±0.4 4.1±1.2 1.8±0.3 2.1±0.4 1.409 0.162 11.170<0.001 CD3+(个/m3)1.6±0.3 1.2±0.2 1.5±0.3 0.8±0.1 1.658 0.101 12.624<0.001 CD4+(个/m3)0.9±0.1 0.7±0.1 0.9±0.1 0.4±0.1 0.000 1.000 14.924<0.001
2.3 两组患者治疗期间不良反应发生率比较
观察组不良反应发生率低于对照组,差异有统计学意义(P<0.05)。见表3。
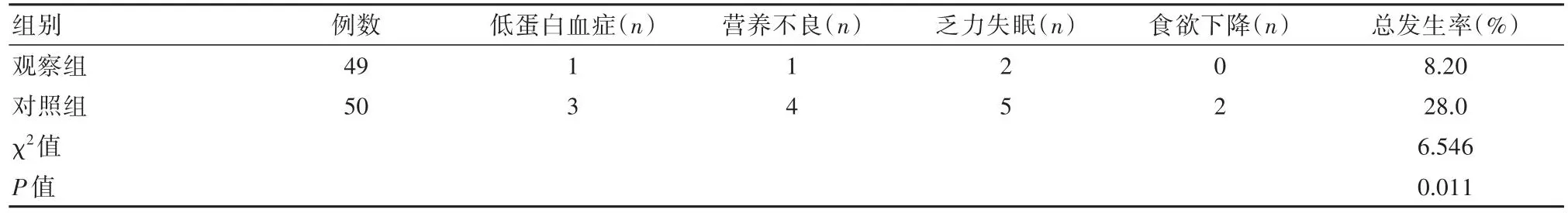
表3 两组患者治疗期间不良反应发生率比较
3 讨论
针对局部进展的早中期胃癌患者,应用新型有效的营养风险筛查工具,对于提高患者术后胃肠道功能,确保机体营养支持有积极作用[5-9]。本研究应用PG-SGA营养风险筛查,在早期筛查胃癌患者围手术期营养异常同时,对预测预后有一定价值,而术前及时、有效的营养支持能够使存在营养风险患者术后明显获益。
针对接受新辅助化疗局部进展期胃癌患者,对照组接受常规饮食指导,观察组在对照组的基础上辅以PG-SGA个性化营养干预,比较两组干预前后血清蛋白水平发现,干预后观察组蛋白水平提高,其中血清白蛋白、血清前白蛋白、血红蛋白水平分别达到(45.5±4.5)、(0.8±0.2)、(98.8±15.2)g/L,提示针对接受新辅助化疗局部进展期胃癌患者,在常规饮食指导基础上辅以PG-SGA个性化营养干预,可有效改善患者体内蛋白水平。此结果与武树箭等[10]研究中,实施PG-SGA指导下个性化营养干预,对提高机体血红蛋白水平至(45.0±4.0)mg/L、血清白蛋白水平至(1.0±0.1)mg/L、血清前蛋白水平至(100.5±15.0)mg/L的结果相一致。同时比较两组干预前后免疫学指标变化发现,干预后观察组机体体液和细胞免疫功能显著提高。说明针对接受新辅助化疗局部进展期胃癌患者,在常规饮食指导基础上辅以PG-SGA个性化营养干预,对提高机体体液免疫和细胞免疫能力均有重要价值。马甜芳[11]研究称,针对恶性肿瘤患者实施PG-SGA指导下个性化营养干预,可显著提高机体免疫力,包括体液免疫和细胞免疫两种免疫功能,其中IgM水平维持在(1.8±0.1)mg/L,CD4+水平维持在(0.8±0.1)个/m3。并且统计两组治疗期间不良反应发现,观察组发生低蛋白血症、营养不良、乏力失眠和食欲下降的总比例显著低于对照组(P<0.05)。证明针对接受新辅助化疗局部进展期胃癌患者,在常规饮食指导基础上辅以PG-SGA个性化营养干预,能减少新辅助化疗期间不良反应。以上结果与石迎迎等[12]研究中实施PG-SGA指导下个性化营养干预,可控制治疗期间不良反应总发生率为5.0%的结果相符。
本研究使用的PG-SGA营养风险筛查量表,为当前应用最广泛的恶性肿瘤营养风险筛查工具[13-15],整体过程均由患者本人完成,可进行详细的病史评估[16],而且在进行PG-SGA营养风险筛查过程中重点关注患者的营养症状与体征[17],从而针对性地对接受新辅助化疗的胃癌患者进行营养风险程度分级,并制订个性化营养支持方案[18]。
综上所述,基于PG-SGA评分营养干预可改善患者者营养与免疫功能,减轻或减少新辅助化疗不良反应,优化患者生活质量,临床上值得继续推广。

