盐酸莫托西和盐酸哌甲酯治疗注意缺陷多动障碍的疗效对比研究
时伶芳,李斌
南通市老年康复医院儿科,江苏南通 226000
注意缺陷多动障碍(attention-deficit hyperactivity disorder, ADHD)为多见的儿童神经发育障碍疾患,主要表现为注意力不集中、活动过度以及情绪冲动等,约2/3的ADHD发病于学龄前,3~4岁开始出现临床症状[1]。该疾病在男孩群体中多见,推测主要与神经生理、解剖、环境、家庭遗传等相关,极大地阻碍着儿童的身心发展[2]。临床实践指南推荐采取多模式方法治疗ADHD,药物为其一线治疗方案。在治疗ADHD的主要药物中,专家一致建议将盐酸哌甲酯作为治疗儿童以及青少年ADHD的一线用药,其通过抑制突触前多巴胺转运体,阻止多巴胺重吸收,进而促进其在大脑额叶皮层缓慢释放来改善注意力、专注力、执行力。但目前关于盐酸哌甲酯对ADHD患儿睡眠特征机制的研究报道较少见,本研究回顾性分析2020年5月—2022年5月在南通市老年康复医院儿科就诊的98例ADHD患儿的临床资料,评估不同药物的治疗效果。现报道如下。
1 资料与方法
1.1 一般资料
回顾性选取于本院儿科就诊的98例ADHD儿童的临床资料,依据使用药物的不同分为对照组(48例)和观察组(50例),观察组男25例,女25例;年龄4~10岁,平均(7.23±1.26)岁;病程10~58个月,平均(34.55±4.23)个月。对照组男26例,女22例;年龄4~10岁,平均(7.40±1.11)岁;病程10~57个月,平均(34.61±4.18)个月。两组一般资料比较,差异无统计学意义(P>0.05),具有可比性。
1.2 纳入与排除标准
纳入标准:①确诊ADHD;②韦氏儿童智力量表智商>80;③未行相关抗精神治疗。排除标准:①对研究涉及药物过敏;②伴随癫痫、抽动症;③精神发育受阻。
1.3 方法
对照组行盐酸莫托西汀(国药准字HJ20160109,规格:10 mg×7粒)治疗,若体质量<70 kg,0.5~1.2 mg/(kg·d),不能超过1.4 mg/(kg·d);体质量≥70 kg,使用40 mg/d,滴定1周后可逐步增加剂量。观察组行盐酸哌甲酯控释片(国药准字J20180025,规格:30 mg×28片)治疗,初剂量为18 mg/d,2周后依据药效以及耐受性逐渐增加剂量为27 mg/d或者36 mg/d。两组皆治疗3个月。
1.4 观察指标
①注意缺陷多动障碍SNAP-Ⅳ评定量表(Swanson Nolan and Pelham, Version Ⅳ Scale-parent form, SNAP-Ⅳ):共26个条目,各条目评分0~3分,涵盖注意缺陷(条目1~9)、多动冲动(条目10~18)、对立违抗(条目19~26),量表分值0~78分,分数与症状严重程度呈正相关。
②美国康纳简易多动症行为评价量表(Conner):本研究采用父母问卷进行评估,包括48个评估条目,各条目的评分均为0~3分,分属6个评估因子,分别为身心障碍、多动冲动、品行、焦虑、学习及多动指数等,每个因子的评分均为总分除以条目数,即评分范围为0~3分,分数越高,症状越重。
③睡眠情况:分别于治疗前(用药前1晚)、6个月后(±2 d)使用飞利浦伟康Alice系列进行多导睡眠监测记录夜间正常入睡至次日自然觉醒。包括总睡眠时间、睡眠效率、唤醒次数。
④血清指标:分别于治疗前及6个月后采集患儿空腹静脉取血5 mL,超高效液相色谱-串联质谱法测定患儿血清中胶质源性神经营养因子(glial cell line-derived neurotrophic factor, GDNF)、白介素-1β/6(interleukin-1β/6, IL-1β/6)、肿瘤坏死因子α(tumor necrosis factor-α, TNF-α)。
1.5 统计方法
使用SPSS 20.0统计学软件分析数据,符合正态分布的计量资料用(±s)表示,采用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组患儿SNAP-Ⅳ评分比较
6个月后,观察组SNAP-Ⅳ各指标评分以及总分均较对照组更低,差异有统计学意义(P<0.05)。见表1。
表1 两组患儿SNAP-Ⅳ评分比较[(±s),分]

表1 两组患儿SNAP-Ⅳ评分比较[(±s),分]
注:与同组治疗前比,*P<0.05。
组别对照组(n=48)观察组(n=50)t值P值注意缺陷治疗前18.60±2.11 18.51±2.05 0.214 0.831 6个月后(11.79±2.30)*(9.60±1.45)*5.663<0.001多动冲动治疗前14.50±3.66 14.63±3.47 0.180 0.857 6个月后(9.23±2.60)*(8.23±1.77)*2.234 0.028对立违抗治疗前8.81±2.00 9.00±1.89 0.484 0.630 6个月后(5.54±2.10)*(3.00±2.34)*5.647<0.001总分治疗前41.91±5.55 42.14±5.00 0.216 0.830 6个月后(26.56±3.00)*(21.83±2.16)*8.985<0.001
2.2 两组患儿Conner评分比较
6个月后,观察组患儿Conner量表各指标评分均较对照组更低,差异有统计学意义(P<0.05)。见表2。
表2 两组患儿Conner评分比较[(±s),分]

表2 两组患儿Conner评分比较[(±s),分]
组别对照组(n=48)观察组(n=50)t值P值品行治疗前2.60±0.51 2.56±0.55 0.373 0.710 6个月后(1.22±0.30)*(1.00±0.27)*3.819<0.001学习治疗前2.55±0.60 2.58±0.58 0.252 0.802 6个月后(1.10±0.18)*(0.70±0.06)*14.879<0.001心身治疗前2.11±0.40 2.07±0.43 0.476 0.635 6个月后(0.90±0.22)*(0.75±0.15)*3.958<0.001
续表2
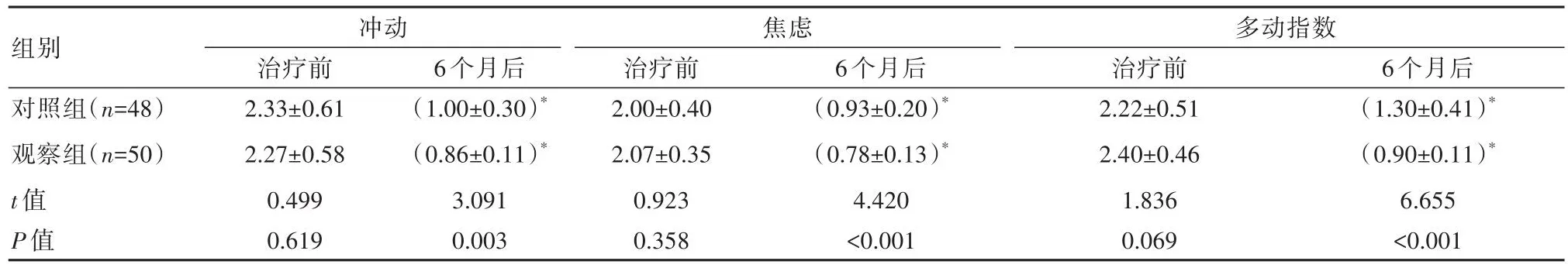
表2 两组患儿Conner评分比较[(±s),分]
注:与同组治疗前比,*P<0.05。
组别对照组(n=48)观察组(n=50)t值P值冲动治疗前2.33±0.61 2.27±0.58 0.499 0.619 6个月后(1.00±0.30)*(0.86±0.11)*3.091 0.003焦虑治疗前2.00±0.40 2.07±0.35 0.923 0.358 6个月后(0.93±0.20)*(0.78±0.13)*4.420<0.001多动指数治疗前2.22±0.51 2.40±0.46 1.836 0.069 6个月后(1.30±0.41)*(0.90±0.11)*6.655<0.001
2.3 两组患儿睡眠情况比较
6个月后,观察组睡眠效率高于对照组,其唤醒次数低于对照组,差异有统计学意义(P<0.05)。见表3。
表3 两组患儿睡眠情况比较(±s)

表3 两组患儿睡眠情况比较(±s)
注:与同组治疗前比,*P<0.05。
组别对照组(n=48)观察组(n=50)t值P值总睡眠时间(min)治疗前438.90±37.00 438.67±35.89 0.031 0.975 6个月后(457.89±25.67)*(452.77±43.00)*0.712 0.478睡眠效率(%)治疗前83.78±5.55 83.82±5.43 0.036 0.971 6个月后(87.31±4.23)*(90.90±7.54)*2.890 0.005唤醒次数(次)治疗前10.25±1.68 10.31±1.57 0.183 0.855 6个月后(8.00±1.55)*(6.00±1.09)*7.413<0.001
2.4 两组患儿血清指标比较
6个月后,观察组GDNF高于对照组,其IL-6、TNF-α均较对照组更低,差异有统计学意义(P<0.05)。见表4。
表4 两组患儿血清指标比较(±s)
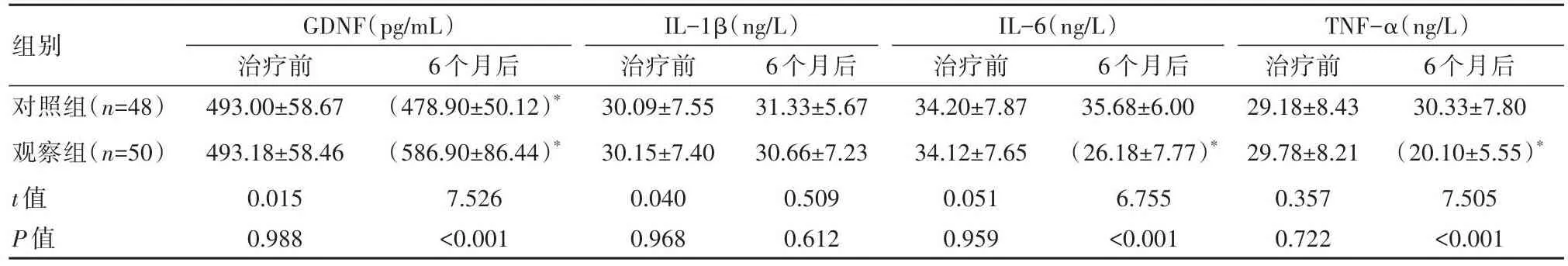
表4 两组患儿血清指标比较(±s)
注:与同组治疗前比,*P<0.05。
组别对照组(n=48)观察组(n=50)t值P值GDNF(pg/mL)治疗前493.00±58.67 493.18±58.46 0.015 0.988 6个月后(478.90±50.12)*(586.90±86.44)*7.526<0.001 IL-1β(ng/L)治疗前30.09±7.55 30.15±7.40 0.040 0.968 6个月后31.33±5.67 30.66±7.23 0.509 0.612 IL-6(ng/L)治疗前34.20±7.87 34.12±7.65 0.051 0.959 6个月后35.68±6.00(26.18±7.77)*6.755<0.001 TNF-α(ng/L)治疗前29.18±8.43 29.78±8.21 0.357 0.722 6个月后30.33±7.80(20.10±5.55)*7.505<0.001
3 讨论
ADHD患病后主要表现为冲动、多动以及注意缺陷,且约70%的患儿其症状会持续至青春期。同时也有研究点明,ADHD儿童成年后发生犯罪行为的风险较正常儿童群体更高[3]。现阶段临床对于ADHD的治疗以缓解症状为主,并同时对其行为、社会活动、情绪以及人际关系等情况予以调节。药物治疗是其主要手段[4],鉴于ADHD发病机制与烟碱能神经递质系统失调、多巴胺能有关,因此药物干预可借助影响患儿神经递质的传输途径来实现缓解核心症状这一目标[5-6]。
哌甲酯在临床ADHD的治疗中使用频次较高,其通过阻断诸如去甲肾上腺素、多巴胺等单胺类神经递质的再摄取后进入突触前神经元,方便单胺类递质的释放[7]。哌甲酯控释剂采用口服渗透泵技术,能够提供12 h的疗效,维持血药浓度[8],规避了漏服的情况。王丽琴[9]学者对ADHD患儿进行分组分型,使用盐酸哌甲酯控释片治疗2个月后发现患儿多动-冲动、注意力不集中以及对立违抗的评分分别为(11.21±1.17)分、(14.51±1.09)分、(8.51±1.05)分,而Conner's量表中学习问题、焦虑、身心障碍、平行问题、冲动-多动、多动指数的评分分别为(1.32±0.17)分、(0.25±0.05)分、(0.25±0.03)分、(0.47±0.13)分、(0.97±0.22)分、(0.83±0.05)分,SNAP-Ⅳ量表与Conner's量表中的各指标均得到有效的改善,尤其是患儿多动冲动、焦虑、对立违抗、多动指数以及注意力不集中等指标改善情况最为显著,得出盐酸哌甲酯控释片在治疗不同类型ADHD患儿中均可获得良好的效果,且安全性较高。本研究中,6个月后,观察组SNAP-Ⅳ总分为(21.83±2.16)分,对照组为(26.56±3.00)分,观察组较对照组更低(P<0.05),且观察组Conner中学习、品行、心身、冲动、焦虑以及多动指数评分分别为(1.00±0.27)分、(0.70±0.06)分、(0.75±0.15)分、(0.86±0.11)分、(0.78±0.13)分、(0.90±0.11)分,均较对照组的(1.22±0.30)分、(1.10±0.18)分、(0.90±0.22)分、(1.00±0.30)分、(0.93±0.20)分、(1.30±0.41)分更低(P<0.05),说明盐酸哌甲酯可有效改善ADHD患儿临床症状,效果较为显著,与上述研究结果较为吻合。究其原因,盐酸哌甲酯通过抑制单胺类神经递质,对多巴胺进行再摄取、去甲肾上腺素发挥阻断效果,使得觉醒中枢的兴奋度得以提高[10],减少多动、冲动症状,改善自控力,增强注意力,缓解ADHD相关症状,与上述学者的研究结果较为吻合。吴为阁等[11]学者通过对持续6周处方盐酸哌甲酯治疗的ADHD儿童,并于基线、治疗2周、治疗6周进行3次PSG,考查盐酸哌甲酯对睡眠特征的影响,发现ADHD患儿存在睡眠效率低以及入睡困难等问题,但盐酸哌甲酯持续治疗2~6周后,ADHD患儿睡眠效率、总睡眠时间以及唤醒次数均从治疗前的(83.1±15.4)%、(438.5±37.1)min、12.5次变化为(87.2±9.6)%、(457.3±41.8)min、11.9次,ADHD患儿的睡眠情况各指标均得到有效改善。在本研究中,6个月后,观察组睡眠效率均高于对照组,其唤醒次数低于对照组(P<0.05),说明盐酸哌甲酯的应用可显著改善ADHD患儿的睡眠情况,与上述研究结果保持一致。多巴胺系统缺陷为ADHD的发病基础之一[12],GDNF在神经发育中发挥营养并保护神经的功效,研究发现GDNF可能为改善ADHD的重要靶点[13]。炎症亦为ADHD重要的发病机制之一[14],中枢神经系统出现炎症后会对ADHD儿童的多巴胺系统功能造成损伤,继而造成认知障碍的出现[15]。乔娟等[16]将二十二碳六烯酸辅助盐酸哌甲酯应用于ADHD患儿的治疗中,发现ADHD患儿GDNF、IL-6、TNF-α水平分别由基线的(493.38±58.35)pg/mL、(32.31±8.14)ng/L、(31.57±9.12)ng/L调整至(586.78±86.31)pg/mL、(26.23±7.68)ng/L、(20.13±5.63)ng/L,说明盐酸哌甲酯能够提高ADHD患儿GDNF水平,并有效抑制炎症。而在本研究中6个月后,观察组GDNF高于对照组,其IL-6、TNF-α低于对照组(P<0.05),与上述研究结果相似,推测可能与盐酸哌甲酯能改善炎症环境并升高体内GDNF水平有关,使得ADHD患儿的相关症状得以改善。
综上所述,对ADHD患儿行盐酸哌甲酯治疗,能够改善其临床症状及其睡眠情况,其作用机制可能与提升GDNF水平并抑制机体内炎症反应有关。但本研究仅探究了盐酸哌甲酯对ADHD患儿症状以及睡眠情况的近期疗效作用,关于其远期预后情况还需后续延长随访时间以进一步探究明晰。

