PG-SGA评分对改善胃癌术后化疗者营养状况及不良反应的影响
郭超,杜园,马迪,王岚,张慧芳,王辉,杨金宝
1.涿州市医院普外科,河北涿州 072750;2.涿州市医院妇科,河北涿州 072750;3.涿州市医院营养科,河北涿州 072750;4.涿州市医院内镜中心,河北涿州 072750;5.涿州市医院产科,河北涿州 072750
胃癌者存在术前较长时间的营养摄入与吸收不足,同时因肿瘤的消耗性以及机体代谢的异常等[1],加重机体营养风险的发生,而且术后禁食水、手术和麻醉等的应激,机体处于负担平衡状态,蛋白消耗明显增加[2],进一步导致机体营养状况的恶化,从而增加术后恢复难度,影响术后康复,导致预后不良[3-4]。对于存在营养风险者,其手术效果及预后指标等均受到较大的负面影响,针对此类患者给予及时确切且有效的营养干预,对于提升患者营养状态[5],改善机体代谢,促进早期康复等均有重要意义[6]。
临床上如何以一种特异性和敏感性均较理想的营养评定方法,快速、简便地发现患者营养风险,以便指导临床进行营养支持[7]。患者主观整体营养状况评估量表(Patient Generated Subjective Global Assessment, PG-SGA)则为目前临床应用较为广泛,且满足特异性和敏感性均较理想等要求的营养风险筛查工具[8]。本研究选取2019年4月—2022年10月涿州市医院普外科收治的99例限期胃癌根治术患者为研究对象,主要探讨PG-SGA评分指导对改善胃癌术后化疗患者营养状况及化疗不良反应的影响,现报道如下。
1 资料与方法
1.1 一般资料
选取本院普外科收治的99例限期胃癌根治术患者为研究对象,采用随机数表法分为观察组和对照组。入组前均申报本院医学伦理委员会批准,并与患者签署知情同意书。观察组(50例)中男23例,女27例;年龄26~71岁,平均(53.8±5.9)岁;诊断胃癌时间3~14 d,平均(8.1±2.3)d。对照组(49例)中男21例,女28例;年龄25~70岁,平均(53.0±6.2)岁;诊断胃癌时间3~14 d,平均(8.0±2.5)d。两组一般资料比较,差异无统计学意义(P>0.05),具有可比性。
1.2 纳入与排除标准
纳入标准:术前经胃镜取活体组织病理活检确诊胃部恶性肿瘤,签署手术同意书;术后接受辅助放化疗等综合治疗;意识及精神状况正常,听力与语言表达能力正常;能正确且顺利完成问卷调查内容。
排除标准:合并其他部位恶性肿瘤者;严重肝肾心肺功能不全者;术前接受规律化放疗治疗者;精神状况异常者。
1.3 方法
所有入组者术后化疗方案均为SOX方案,具体为奥沙利铂加替吉奥化疗,其中替吉奥(国药准字H20140137;规格:每片含替加氟20 mg,吉美嘧啶5.8 mg,奥替拉西钾19.6 mg)40 mg/次,口服2次/d,奥沙利铂(国药准字H20113144;规格:注射液100 mg/100 mL)85 mg/m2,1次/周期。
对照组患者接受常规饮食指导,即患者注意加强营养,以高蛋白、高纤维素、高能量饮食为主,做好一日三餐饮食均衡管理等。
观察组在对照组的基础上辅以PG-SGA评分指导下进行个性化营养干预,其中针对PG-SGA评分4~8分者,加强营养支持干预,其中肠内营养管理上,视患者实际情况合理选择单独应用肠外营养,以25 kcal/(kg·d)标准给予营养支持,肠内营养以本院营养科配制的营养餐为主,口服或管饲,营养支持时间至少3 d。针对PG-SGA评分≥9分者,联合肠外营养,即输入全营养混合液(内含葡萄糖、氨基酸和脂肪乳),加强静脉营养补充;并对患者进行定期PG-SGA评分,控制其PG-SGA评分保持在4分以内。
1.4 观察指标
比较两组血清蛋白水平(血红蛋白、前白蛋白和白蛋白水平,均采用ELISA法,成人正常值分别为90~145 g/L、0.28~0.65 g/L、35~50 g/L),热量摄入量情况(针对机体所需能量物质总量进行统计)及体质指数情况(使用上海伊沐医疗器械有限公司提供的IOI353 人体成分分析仪进行检查和数据获取);对比两组人体成分(包括体脂含量、体蛋白质量、体骨骼肌量、体水分量),并统计两组饮食干预过程中不良反应发生情况(消化道不适、贫血、食欲下降及严重感染)。PG-SGA评分依据,包括体质量、进食情况、影响进食原因、机体活动能力以及整体身体状况等,分别获得A、B、C和D评分,各项总分之和为PG-SGA总分,0~1分为营养状况良好,2~3分为可疑营养不良,4~8分为中度营养不良,≥9分提示为重度营养不良,其分值越高提示受试者营养状况越不理想。
1.5 统计方法
使用SPSS 20.0统计学软件处理数据,符合正态分布的计量资料以(±s)表示,组间差异比较以t检验,计数资料以频数(n)及率表示,组间差异比较以χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组患者干预前后血清蛋白水平比较
干预前,两组血红蛋白、血清白蛋白及前清蛋白比较,差异无统计学意义(P>0.05),饮食干预后,观察组血红蛋白、血清白蛋白及前清蛋白值均高于对照组,差异有统计学意义(P<0.05)。见表1。
表1 两组患者营养干预前后血清蛋白水平比较[(±s),g/L]

表1 两组患者营养干预前后血清蛋白水平比较[(±s),g/L]
组别观察组(n=50)对照组(n=49)t干预前组间比较值P干预前组间比较值t干预后组间比较值P干预后组间比较值时间干预前干预后干预前干预后白蛋白52.3±8.4 45.5±4.5 53.2±8.6 26.7±2.1 0.527 0.600 26.547<0.001前白蛋白1.0±0.3 0.8±0.2 1.0±0.2 0.3±0.1 0.000 1.000 15.683<0.001血红蛋白114.5±10.9 98.8±15.2 115.7±11.2 75.5±10.7 0.540 0.590 8.803<0.001
2.2 两组患者化疗后热量摄入量情况及体质指数比较
观察组热量摄入量情况及体质指数均高于对照组,差异有统计学意义(P<0.05)。见表2。
表2 两组化疗后热量摄入量情况及体质指数比较(±s)

表2 两组化疗后热量摄入量情况及体质指数比较(±s)
组别观察组(n=50)对照组(n=49)t值P值热量摄入量[kJ/(kg·d)]107.9±20.1 88.1±12.7 5.846<0.001体质指数(kg/m2)24.8±2.2 21.7±1.3 8.514<0.001
2.3 两组患者干预前后人体成分比较
干预前,两组体脂含量、体蛋白质量、体骨骼肌量和体水分量比较,差异无统计学意义(P>0.05),饮食干预后,观察组体脂含量、体蛋白质量、体骨骼肌量水平、体水分量均高于对照组,差异有统计学意义(P<0.05)。见表3。
表3 两组患者干预前后人体成分指标比较(±s)
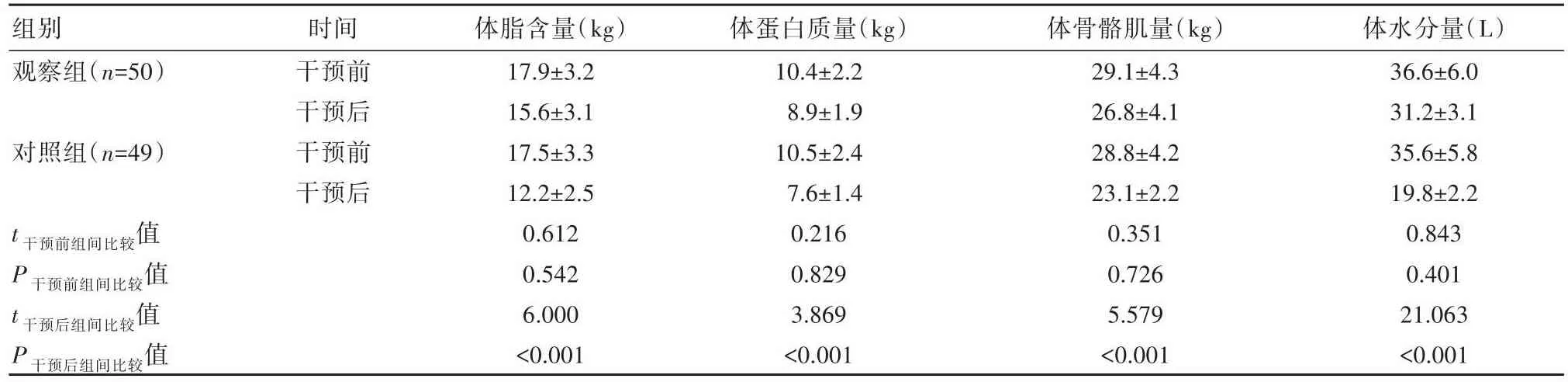
表3 两组患者干预前后人体成分指标比较(±s)
组别观察组(n=50)对照组(n=49)t干预前组间比较值P干预前组间比较值t干预后组间比较值P干预后组间比较值时间干预前干预后干预前干预后体脂含量(kg)17.9±3.2 15.6±3.1 17.5±3.3 12.2±2.5 0.612 0.542 6.000<0.001体蛋白质量(kg)10.4±2.2 8.9±1.9 10.5±2.4 7.6±1.4 0.216 0.829 3.869<0.001体骨骼肌量(kg)29.1±4.3 26.8±4.1 28.8±4.2 23.1±2.2 0.351 0.726 5.579<0.001体水分量(L)36.6±6.0 31.2±3.1 35.6±5.8 19.8±2.2 0.843 0.401 21.063<0.001
2.4 两组患者化疗不良反应比较
观察组发生消化道不适、贫血、食欲下降及严重感染等不良反应发生率显著低于对照组,差异有统计学意义(P<0.05)。见表4。

表4 两组患者化疗不良反应比较
3 讨论
营养不良临床定义为能量物质的摄入不足和(或)吸收障碍和(或)丢失过多,属于特异性营养缺乏症状与体征[9]。胃癌患者一旦出现营养不良,则将直接影响患者预后[10]。及时有效地针对胃癌接受手术治疗者进行营养状况评估,同时采取积极干预措施对于改善患者预后有重要意义[11]。PG-SGA为目前临床上针对恶性肿瘤患者进行的特异性营养评估手段,其具有简单易行、内容综合、特异性和敏感性均较高等特点,可有效评价患者机体营养状况,被国内肿瘤营养专家推荐为评估恶性肿瘤患者营养状况的首选工具。
本研究比较两组化疗前和血清蛋白水平发现,化疗后观察组血红蛋白、血清白蛋白及前清蛋白值高于对照组(P<0.05)。说明针对接受新辅助化疗局部进展期胃癌患者,在常规饮食指导基础上辅以PG-SGA个性化营养干预,可显著提高机体蛋白水平。此结果与于玲等[12]研究证明针对恶性肿瘤患者,以PG-SGA为基础的营养干预,对提高机体蛋白水平,尤其是总蛋白水平至(43.46±3.42)g/L的结果相符。同时观察组热量摄入量情况及体质指数分别为(107.9±20.1)kJ/(kg·d)和(24.8±2.2)kg/m2,均高于对照组(P<0.05)。证明针对接受新辅助化疗局部进展期胃癌患者,在常规饮食指导基础上辅以PG-SGA个性化营养干预,对改善机体热量摄入量有积极意义。以上结果与魏彧潼等[13]研究提示以PG-SGA个性化营养干预后,恶性肿瘤患者热量摄入量基本恢复正常,达到(110±20.0)kJ/(kg·d)左右的标准相一致。
另外发现化疗后观察组体脂含量、体蛋白质量、体骨骼肌量水平高于对照组,化疗后观察组体水分量显著高于对照组(P<0.05)。说明在常规饮食指导基础上辅以PG-SGA个性化营养干预,可有效调节人体成分分析指标中体脂含量、体蛋白质量、体骨骼肌量和水分含量水平,减少机体水肿,可能与恶性肿瘤导致的机体水肿等,肿瘤消耗机体蛋白和营养不良等存在密切相关性。最后发现观察组发生消化道不适、贫血、食欲下降及严重感染等化疗不良反应概率低于对照组(P<0.05)。进一步说明在常规饮食指导基础上辅以PG-SGA个性化营养干预,可显著减少化疗不良反应。肖霞等[14]研究称以PG-SGA个性化营养干预,能有效的调节恶性肿瘤患者人体成分组成促使体脂含量控制在15.0 g左右,提高机体蛋白质量水平,促使其达到9.0 kg左右,同时还在一定程度上减少化疗不良反应。
国内营养治疗专家共识指出:PG-SGA营养风险筛查量表是当前应用最广泛的恶性肿瘤营养风险筛查工具之一[15],营养PG-SGA营养筛查过程中,由患者本人参与完成病史评估,既保证了病史的准确性又节省了时间,且PG-SGA营养风险筛查包含更多营养相关症状和体征,这对恶性肿瘤患者的营养状况评估至关重要,同时PG-SGA还可根据评分结果针对性地进行患者营养风险程度的分级,从而制订更为个性化的营养支持方案[16]。
综上所述,在PG-SGA评分指导下进行个性化营养干预,对改善胃癌术后化疗患者营养状况有重要的指导意义,还可改善化疗不良反应。

