水系钠离子电池负极材料NaTi2(PO4)3的研究进展
刘晓娟, 王春香, 吴永麟, 钟晓辉, 廖斯民, 李之锋
(江西理工大学,a. 材料冶金化学学部;b. 江西省动力电池及材料重点实验室,江西 赣州 341000)
随着社会和经济的不断发展,人们对能源的需求日益增加。然而,随着化石燃料的大量消耗而产生的环境问题以及能源危机问题,迫使人们急需找到绿色可持续发展的替代能源。尤其是近年来“碳达峰”和“碳中和”两大目标的提出,将绿色可再生能源的开发再次推向了研发高潮。目前,风能、太阳能、地热能和潮汐能等绿色可再生能源不论是在产业界还是学术界都备受关注[1-3],然而,这些间歇性或区域性可再生能源的高效转化与存储都离不开储能技术[4-5]。二次离子电池由于其能量转换效率高、成本低廉、应用灵活等优点而被认为是最具潜力的规模化储能装置。
原则上,二次离子电池技术在大规模储能系统中的应用应满足:①高安全性;②低成本和充足的原材料;③环境友好;④长循环寿命及高能量密度。然而,现有的二次离子电池技术总是难以兼顾以上要求。有机可充电电池体系因其高能量密度而引起了广泛关注,然而有机电解液是可燃的,影响了电池使用的安全性。表1 列举了锂离子电池电解液里常用的有机溶剂。常温下DME 与空气混合后就易发生闪火,其他所有溶剂的闪点也都在160 ℃及以下,在超过160 ℃的情况下均有助燃的作用。铅酸、镍铬和镍氢传统的水系可充电电池中含有有害的重金属元素,对环境造成严重污染。此外,镍氢和全钒液流电池的发展受到高成本的限制[6]。
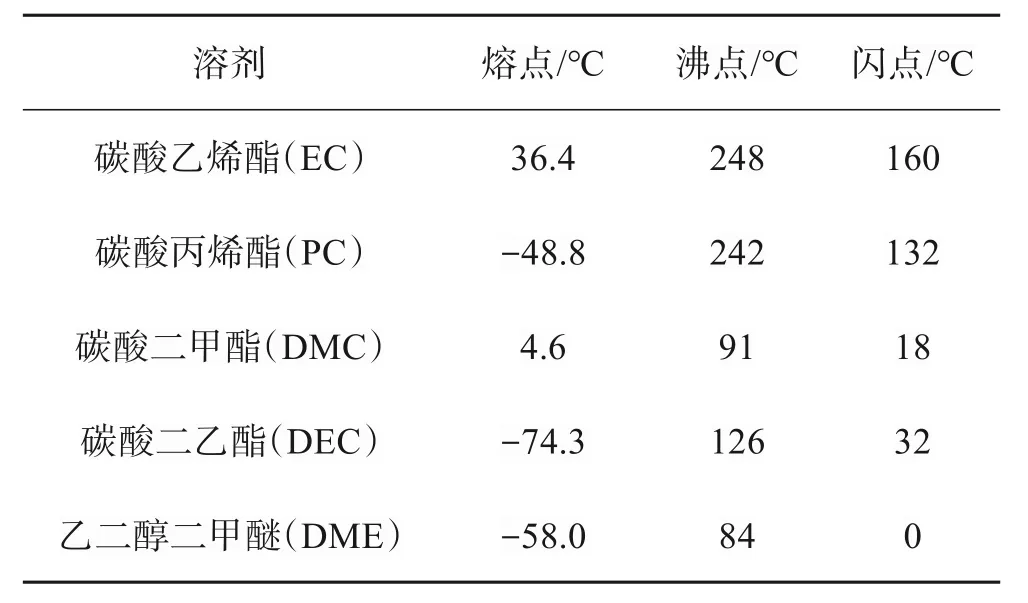
表1 锂离子电池常用的有机溶剂[7]Table 1 Organic solvents commonly used in lithium-ion batteries[7]
水系钠离子电池以水作为电解液溶剂,不仅具有生物相容性和优良的安全性,还避免了有机电解液可燃性和毒性所引起的环境问题[8]。另外,钠元素储量丰富,如图1[9]所示,钠的储量比锂高出约3~4 个数量级,加之水系钠离子电池的开发成本较低,因此,被学术界和产业界认为是一种极具前景的大规模储能技术。

图1 地球上不同化学元素质量百分比示意[9]Fig.1 Schematic diagram of mass percentages of different chemical elements on the earth[9]
近年来,尽管水系钠离子电池一再被广泛报道,但大多数产品仍然不适合实际应用,主要是因为Na+的半径相对更大,更难嵌入电极材料而导致电极材料利用率较低,且Na+嵌入电极材料后使得电极材料严重膨胀,容易导致结构坍塌,从而降低了电极材料的循环稳定性[8-9]。另外,水系电解液的电化学稳定窗口较窄,只有1.23 V,考虑动力学因素后,电压窗口不超过1.5 V,以及水的强极性更是限制了很多电极材料的应用[10]。为了克服这些问题,推动水系钠离子电池的商业化,需要开发先进的电极材料,特别是低成本、高安全性和空气稳定性,以及长寿命和高容量的电极材料。
迄今为止,研究较多的水系钠离子电池负极材料主要包括聚阴离子化合物,如NTP[11];有机材料,如聚吡咯[12-14];普鲁士蓝类似物,如铁氰化锰钠[15]和AC 等[16],表2 列出了常用的水系钠离子电池负极材料及其电化学性能参数。其中,NTP 具有合适的脱嵌钠反应电势,氧化还原电位处在水的析氢和析氧电位之间(中性时2.297 V 和3.527 Vvs. Na+/Na)[17],另外,NTP 开放稳定的三维框架结构为Na+提供了快速的可逆离子通道,属于“零应变”材料,并且具有较高的理论比容量132.8 mAh/g,这使得NTP 成为水系钠离子电池最具代表性的聚阴离子负极材料[18-19]。然而,NTP 固有的差的电子导电性,限制了其直接使用。另外,NTP 在水系电解液中具有不可逆的“溶解-沉淀”行为,也极大地影响了水系钠离子电池的循环稳定性。近年来,科研工作者通过表面修饰、形貌调控和离子掺杂等改性方法,制备了各种综合性能优越的NTP 基负极材料,有效地改善了这些问题。本文主要综述了NTP 的晶体结构、嵌钠反应机理、合成方法,详细阐述了增强NTP 基负极材料电化学性能和稳定性的材料复合策略与特殊结构设计,最后对NTP 作为水系钠离子电池负极材料的应用前景进行了总结与展望。

表2 常用的水系钠离子电池负极材料及其电化学性能参数Table 2 Commonly used cathode materials and their electrochemical performance parameters of aqueous sodium-ion battery
1 NTP负极材料概述
1.1 NTP晶体结构及电化学储能机理
NTP 的晶体结构为斜方六面体,空间群为R¯3c(167),晶胞参数分别为a(8.491 3 Å)、b(8.491 3 Å)和c(21.785 8 Å)(其中:1 Å=0.1 nm),晶体结构如图2 所示,由相互孤立的TiO6八面体和PO4四面体通过角氧相互连接,建立的[Ti2(PO4)3]-阴离子基团框架,框架中的TiO6八面体被3 个PO4四面体隔开,共享所有的顶点,但没有共边和共面[30]。这种离子基团中存在2 种间隙位点M1 和M2,没有发生反应时,Na+完全占据着M1 位;发生反应时,NaTi2(PO4)3相转变为Na3Ti2(PO4)3相,Na+嵌入M2 位。这种开放的三维框架结构有效地促进了Na+的传输,提高了NTP的离子迁移率,因此NTP 具有离子迁移速度快、放电比容量大的特点[30-33]。但是,TiO6八面体的相互分离导致Ti4+/Ti3+氧化还原反应时,电子需经过Ti-O-P-O-Ti进行传输。因此,Ti-O-P-O-Ti 的绝缘性直接降低了NTP 材料的导电性,从而导致材料容量难以完全发挥,同时也降低了材料的循环稳定性。为了提高NTP 导电性,进而获得优异的电化学性能,研究者对NTP 的合成工艺、表面包覆和体相掺杂取代作了较多的研究[34]。

图2 NTP晶体结构[36]Fig.2 Crystal structure of NTP [36]
在充放电过程中,NaTi2(PO4)3相和Na3Ti2(PO4)3相随着Na+的嵌入和脱出相互转换。充电时,Na+从Na3Ti2(PO4)3相中脱出进入电解液变成NaTi2(PO4)3相,而电子则从外电路到达负极,与此同时,Ti3+被氧化成Ti4+[35]。放电时过程相反,具体反应过程如式(1)所示:
1.2 NTP的制备方法
目前,NTP 的主要制备方法有:高温固相法、溶胶-凝胶法、溶剂热法、微波合成法和机械球磨法[36-43]。表3详细列出各种制备方法及其优缺点和电化学性能。

表3 NTP常用制备方法及其优缺点和电化学性能Table 3 Common methods of NTP preparation, advantages, disadvantages and electrochemical performance
除以上合成方法外,喷雾干燥法[44-45]、静电纺丝法[46-48]和Pechini 法[35]等也被应用于NTP 的合成中。目前,由于溶剂热法和溶胶-凝胶法在材料合成和改性实验中,具有合成方法简单、可靠、灵活等优势,成为了研究者最常采用的合成方法,如进行碳包覆时,既可在合成原材料时进行原位包覆,也可在合成后再进行包覆。以上每种合成方法都存在一定的优势和缺陷。因此,需要研究者充分利用各种合成方法的优缺点不断改进和开发新的制备方法,才能推动NTP 材料不断发展。同时,开发新的制备方法对合成其他材料也具有非常重要的价值和意义。
2 NTP的改性方法
如前所述,NTP 因其稳定、开放的三维框架结构等优势成为最具发展前景的水系钠离子电池负极材料。但是,因NTP 固有的电子导电性差,导致其在充放电过程中电池极化增大,使得电极材料容量难以发挥,严重影响其电化学性能。另外,NTP 在水系电解液中具有不可逆的“溶解-沉淀”行为,也极大地影响了水系钠离子电池的循环稳定性。目前,提高NTP 材料表面电导率的主要方法有表面修饰和形貌调控,而提高其材料内部电导率的主要方法为掺杂取代,通过离子的不等价掺杂提高材料内部缺陷,进而提高材料电导率。
2.1 表面修饰
NTP 固有的较低的电导率限制了其直接应用,为了解决这一问题,研究者提出多种策略对其进行改性研究。表面修饰是指通过一定的手段将导电材料或快离子导体等包覆在材料表面,从而提高材料表面的电子或者离子传导速率,减小极化,提高材料电化学性能的一种方法,同时也可以保护电极材料不被电解液侵蚀。
2011年,PARK等[35]首次证明了NTP在水溶液体系中的电化学活性,为提高其导电性,在氮气气氛下热解碳对NTP 进行了碳包覆处理,在2 mol/L Na2SO4溶液中NTP 可以提供123 mAh/g 的可逆比容量。WU 等[22,49]分别以Na2NiFe(CN)6和Na2CuFe(CN)6为正极,以NTP@C 为负极,对水系钠离子全电池进行了深入研究,分别提供了42.5、48.0 Wh/kg 的能量密度。至此,对提高NTP 导电性的改性措施一直停留在热解碳包覆上。2014年,LI等[32]用石墨烯对NTP进行包覆,其中石墨烯包覆量为6.84%的样品在20 C的高倍率下仍可提高63.5 mAh/g 的容量。2015 年,MOHAMED等[50]通过高能球磨工艺将聚吡咯包覆在NTP表面,对比未包覆聚吡咯的NTP在循环50圈后容量保留率从10%提高到50%,说明导电聚合物涂层也是提高NTP导电性的一种策略。2017年,HU 等[51]首次合成氮掺杂石墨烯@NTP,以Na为对电极组装了有机系半电池,在0.1 C倍率下可提供129.3 mAh/g的比容量。
随后,研究者对各种导电材料包覆NTP 的方法进行了大量的研究。2018 年,LIU 等[23]通过溶剂热方法和随后的氮化工艺成功合成了高电导率的TiN包覆NTP(NTP-N)电极材料,极大地提高了材料的导电性。以1 mol/L Na2SO4溶液为电解液,在三电极体系中对样品进行了电化学测试,初始容量可达131.9 mAh/g,在2 C 倍率下循环100 圈后,仍保持92.0 mAh/g 的容量,远高于未进行氮化处理的原始样品58.0 mAh/g。2019 年,LUO 等[24]采用简单的溶胶-凝胶法制备了石墨烯NTP/C复合材料(NTP/C-G)。从TEM 图像(图3(a))可以看出,该复合材料由锚定在石墨烯纳米片上的NTP/C 颗粒组成,这个三维石墨烯导电网络大大提升了NTP 的电子导电能力。在三电极体系中测试了NTP/C-G 的电化学性能,如图3(b)所示,对比NTP/C-G和原始NTP在不同电流密度下的倍率性能,显然,当电流由100.0 mA/g 增加到500.0 mA/g 时,原始NTP 样品几乎已经没有可逆容量,这是由于电子电导率较低引起的反应动力学迟缓而导致的;而NTP/C-G 在500.0 mA/g 时可逆容量为90.9 mAh/g,在2000.0 mA/g 时可逆容量仍有88.0 mAh/g,展示了优异的倍率性能。如图3(c)所示,在100.0 mA/g 的电流密度下循环100 圈后,NTP/C-G 样品仍有92.0%的容量保持率,而原始NTP 样品则只有21.5%的容量保持率。2021 年,HE等[52]采用溶剂热法合成了中空NTP 纳米颗粒(HNTP),然后通过静电纺丝技术将其均匀嵌入聚丙烯腈(PAN)聚合物纤维中,最后经过碳化处理,将HNTP 纳米颗粒均匀封装在交联多孔的N 掺杂碳纳米纤维中,从而制得HNTP@PNC 电极材料。HNTP 独特的中空结构和连续的导电网络组合产生良好的协同效应。在三电极体系下(1 mol/L NaClO4为电解液)测试了HNTP@PNC 电极材料的电化学性能,在5.5 A/g 的电流密度下循环,显示出108.3 mAh/g 的高比容量,在3000 圈循环后仍有97.2%的容量保持率。同年,PLEČKAITYTĖ 等[53]采用溶剂热和高温固相法相结合的方法制备了NTP/C,然后在NTP/C 电极表面直接沉积氧化铝纳米层,成功合成了氧化铝修饰的NTP(Al2O3@NTP)。为了研究氧化铝保护层对电极的保护作用,分别对Al2O3@NTP 和NTP 在1 C 和10 C 倍率下进行100 圈GCD 循环测试,并在100 圈循环后收集电解液,分析电解液中溶解的P 含量。如图3(f)所示,纳米氧化铝层的存在有效阻止了电极材料的溶解,NTP 电极P 的溶解量约是Al2O3@NTP 电极的2.5 倍。如图3(d)和图3(e)所示,纳米氧化铝层的存在明显减缓了电极材料容量的衰减。以上结果表明,在电极表面沉积纳米氧化铝层可以保护材料免受电解液中溶解氧的攻击,减缓化学溶解等副反应的发生,从而显著降低了NTP 的自放电和降解速率。

图3 NTP/C-G的形貌及NTP/C-G和Al2O3@NTP的电化学性能[24,53]:(a) NTP/C-G的TEM图;(b) 不同电流密度下NTP/C-G和NTP的循环性能;(c) 100 mA/g电流密度下NTP/C-G和NTP的循环曲线;(d) Al2O3@NTP和NTP在1 C和(e) 10 C倍率下的循环性能;(f) Al2O3@NTP和NTP在不同倍率下循环100圈后电解液中P的溶解量Fig.3 Morphology of NTP/C-G and electrochemical performances of NTP/C-G and Al2O3@NTP [24,53]: (a) TEM image of NTP/C-G; (b) cycle performance at various current densities of NTP/C-G and NTP; (c) cycle curves of NTP/C-G and NTP at 100 mA/g; (d) cycle performance of Al2O3@NTP and NTP at 1 C and (e) 10 C; (f) the amount of dissolved P in electrolyte of Al2O3@NTP and NTP after 100 cycles at various current densities
总之,NTP 与碳质材料以及一些导电氧化物复合可以有效防止纳米颗粒团聚,促进电子传递,能够有效改善NTP 的导电性,同时也可以减缓电极材料在电解液中的“溶解-沉淀”行为。其中,碳包覆由于成本低、操作简单,加之包覆方法比较灵活,可以在材料合成过程中进行原位包覆,也可在材料合成后再进行包覆。因此,NTP 与碳质材料的复合被认为是最有效的方法之一。
2.2 形貌调控
形貌调控主要包括尺寸优化和结构优化,其最根本的目的都是增大材料的比表面积,增加电化学反应活性位点。一般情况下,减小材料颗粒尺寸可以增大材料的比表面积,增加活性位点,缩短电子和离子的传输路径,减小极化,并且能够有效地适应电化学反应过程中的结构变化。另外,许多研究者通过设计一些核壳、中空、多孔等结构,也可以有效增大比表面积,减小极化,从而减轻Na+脱嵌过程中产生的应力,在一定程度上保证了材料结构的稳定性,提高了材料的电化学性能。
NTP 的分子结构较大,一般情况下比较难以制备颗粒尺寸较小的材料,不利于Na+的快速扩散。因此,通过开发新的制备方法减小材料颗粒尺寸,能够有效地提高材料比表面积,缩短电子和离子的扩散距离。2018 年,FU 等[54]用原位碳涂层溶剂热反应,并用尿素作为冒泡剂成功合成了分散性良好的NTP/C-U 纳米复合材料。相比之下,未添加尿素的NTP/C 则存在明显的团聚现象,粒径约是NTP/C-U颗粒的2 倍,且比表面积仅为NTP/C-U 的12.0%。以1 mol/L 硫酸钠作为电解液,采用三电极体系测试电化学性能,在1 C 倍率下NTP/C-U 的初始放电容量为84.0 mAh/g,循环300 圈后的容量保持率为94.3%,表现出了优异的倍率性能和较长的循环寿命。减小材料颗粒尺寸是增加材料比表面积、缩短电子和离子扩散距离、提升材料电化学性能的一种有效策略。
通过构造多孔、核壳、微米花等结构,控制合成具有特殊形貌的电极材料,增加活性位点,缩短Na+传输距离,也能够有效改善材料的电化学性能。2016 年,XU 等[55]采用溶剂热法和退火处理成功合成了微米花状NTP(NTP/C-F),如图4(a)和图4(b)所示,其独特的介孔纳米片层结构有效提高了电极-电解液接触面积,缩短了Na+和电子扩散路径。NTP 作为有机系钠离子电池电极材料表现出优异的倍率能力和超长循环稳定性,NTP/C-F 和NTP/C-P(正常形貌的NTP/C)的倍率性能如图4(c)所示,显然,NTP/C-F 在每个倍率下都比NTP/C-P 更高、更稳定,即使在100 C的超高倍率下,可逆容量仍然达到95 mAh/g。在20 C 的倍率下进行10 000 次循环后,容量保留率高达77.3%(85 mAh/g)。随后,对样品进行了阻抗测试,如图4(d)所示,NTP/C-F 的Rct(对应于高频半圆区,电解质和电极之间的电荷转移电阻)远小于NTP/C-P。以上结果表明,微米花独特的三维分层结构有效增加了材料的比表面积,降低极化,有利于离子/电子在电极和电解质之间的传递,从而有效提高电池的电化学性能。2022 年,HOU 等[56]采用水热法合成了中空NTP@C(HNTP@C),形貌如图4(e)和图4(f)所示。由于HNTP 晶体的中空结构使得Na+扩散距离缩短,HNTP 表现出较高的扩散速率,如图4(h)所示,HNTP@C 的Na+扩散系数明显大于NTP@C。采用三电极体系测试电极材料的电化学性能,如图4(g)所示,比较了HNTP@C和NTP@C从0.2 C 到60 C 的倍率性能,显然HNTP@C 比NTP@C的电极容量显著提升,即使在60 C 的高倍率下,HNTP@C也有较大的容量,表明其良好的倍率性能。最后,研究了HNTP@C||Na0.44MnO2水系全电池的电化学性能,在0.2 C 倍率下循环时显示了50.0 Wh/kg的高能量密度,循环100 圈后,容量仍有初始容量的90.0%。在5C 下循环3500 圈后,电池的容量保持率高达90.0%,连续循环时的库仑效率接近100.0%,显示了其优越的循环和倍率性能。

图4 NTP/C-F和HNTP@C的形貌及电化学性能[55-56]:(a) NTP/C-F的示意图和(b) SEM图像;(c) NTP/C-F和NTP/C-P在不同倍率下的循环性能和(d) EIS图;(e) HNTP@C的SEM图和(f) TEM图;(g) HNTP@C和BNTP@C在不同倍率下的循环性能;(h) Na+扩散速率Fig.4 Morphology and electrochemical performances of NTP/C-F and HNTP@C[ 55-56]:( a) schematic illustration and( b)SEM image of NTP/C-F;( c) cycle performance at different rates and( d) EIS image of NTP/C-F and NTP/C-P;( e) SEM image and( f) TEM image of HNTP@C;( g) cycle performance at different rates of HNTP@C and BNTP@C;(h) Na+ diffusion coefficients
以上研究结果表明,通过减小材料颗粒尺寸可在一定程度上提升材料电化学性能,但随着颗粒尺寸的减小,材料比表面积增大,团聚显现也愈加明显,故仅通过尺寸调控来提升,材料电化学性能作用有限。合成诸如中空、核壳及微米花等特殊结构的电极材料,可极大地提高材料的比表面积,使得电极材料具有良好的动力学因素、理想的孔隙度和表面渗透性。因此,控制合成具有特殊形貌的结构优化措施,与尺寸优化措施制备的常规结构材料相比,具有更优的电化学性能。另外,材料的微纳米化和特殊形貌虽然能够在一定程度上降低极化,提高电池的电化学性能,但同时也存在诸多缺点,如材料比表面积增大使得相应的电极/电解液副反应增加,导致自放电现象更加严重,有时也会因为纳米材料的团聚而使电池容量严重衰减,故研究者通常采用表面包覆和形貌调控两种策略协同作用对材料进行改性。
2.3 掺杂取代
通过表面修饰及形貌调控等方法合成的具有特殊结构的微纳米材料,虽然在很大程度上增大了材料比表面积,提高了材料表面的电导率,但是对于提高材料内部本身的电子导电性和Na+迁移速度却是非常困难的。在这方面,掺杂取代可以有效改善材料的内在特性,通过引入外来离子进行调节,可以诱导改善其导电性,提高材料内部的载流子浓度和霍尔迁移率,从而提高材料颗粒内部的电导率。目前,已有多种离子掺杂的研究应用于水系锂离子电池和有机系钠离子电池中,而离子掺杂在水系钠离子电池中的应用则鲜有报道。后续可参考离子掺杂改性在水系锂离子电池和有机系钠离子电池中的研究进展,进一步应用在水系钠离子电池中,从而提升其电化学性能。
离子掺杂NTP 在水系钠离子电池中的应用方面,2019 年,QIU 等[11]采用简单的溶剂热法成功合成了Na1.5Ti1.2Fe0.5(PO4)3负极材料,随后采用化学气相沉积法包覆了碳涂层。采用XRD、XPS 及EDS 等手段证明Fe 已成功掺入,形貌的变化也是铁取代钛的宏观有力证明,由图5(a)和图5(b)可见,表明NTFP 具有更倾斜的六面体形状,而不像NTP 的形态近似于一个立方体,这是由于在样品颗粒基于金属原子为形核中心的生长方式中Fe 和Ti 不同的择优取向造成的。 随后以Na0.66Mn0.66Ti0.34O2(NMTO)作为正极,分别以NTP/C和Na1.5Ti1.2Fe0.5(PO4)3/C(NTFP/C)作为负极,并以5 mol/L NaClO4溶液作为电解液,组装了水系钠离子全电池。进行了一系列电化学测试,其中NMTO-NTP/C||NMTO-NTFP/C 水系全电池充放电曲线如图5(c)所示,NMTO-NTP/C 全电池的库仑效率93.5%远低于NMTO-NTFP/C 电池的库仑效率99.7%。对两种水系全电池倍率性能进行了测试,如图5(d)所示,NMTO-NTFP/C 全电池在不同倍率下提供了较高的比容量,在2 C 的倍率下提供了105.6 mAh/g 的高容量,在20 C 时仍提供了64.7 mAh/g 的容量。

图5 NTP/C和NTFP/C的形貌及电化学性能[11]:(a) NTP/C和(b) NTFP/C的SEM像;(c) 2 C倍率下的充放电曲线;(d) 不同倍率下的循环性能Fig.5 Morphology and electrochemical performance of NTP/C and NTFP/C [11]: SEM images of (a) NTP/C and(b) NTFP/C; (c) charge/discharge curves at 2 C; (d) cycle performance at different rates
离子掺杂NTP 在水系锂离子电池(ALIB)中的应用方面,2018 年,HUANG 等[57]采用溶胶-凝胶法合成了Fe掺杂NTP@C,其中Fe掺杂量10%的NTP@C(NC-Fe-10)电化学性能最优。以LiMn2O4为正极,NC-Fe-10为负极组装了水系全电池,在5 C时的放电容量为103.1 mAh/g,循环300 圈后容量保持率仍有94.4%,表现出优异的循环性能。2021 年,ZHANG等[58]采用溶胶-凝胶法成功合成了一系列Fe-F共掺杂的NTP/C 复合材料(NTP-Fex-Fy/C,x=0,0.1;y=0,0.1,0.2,0.3,0.4),并将其作为ALIB的负极材料。研究发现,当Fe 和F 的掺杂量均为0.1 时,所得到的NTPFe0.1-F0.1/C 复合材料表现出最佳的电化学性能。LiMn2O4||NTP-Fe0.1-F0.1/C 全电池在0.5 C 倍率下提供了112.8 mAh/g 的高放电比容量, 在5 C 时提供了103.2 mAh/g的高放电比容量。如图6(a)所示,在5 C和10 C 的高倍率下循环2000 圈后,容量衰减分别为0.8%和14.9%,库仑效率接近100%,展示了高倍率下的循环稳定性。为了进一步研究离子掺杂对NTPFex-Fy/C 电极的电化学界面行为和电子/离子转移动力学的影响,进行了EIS 测试,如图6(b)所示,所有进行了离子掺杂的样品的Rct(高频半圆区对应于电极和电解液界面相关的电荷转移电阻)均远小于未掺杂的NTP/C样品,与NTP-Fe0.1/C相比,F的掺杂进一步降低了Rct。在所有制备的样品中,NTP-Fe0.1-F0.1/C 的Rct最低,说明适量的Fe和F掺杂可以显著降低电荷转移电阻,提高电极材料的电化学性能。
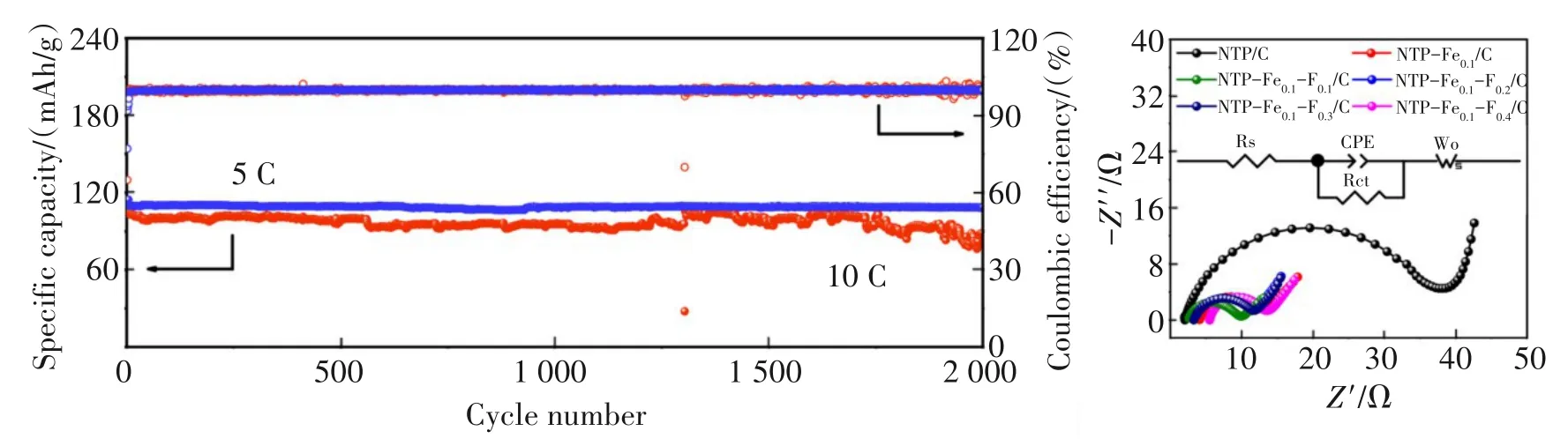
图6 NTP/C和NTP-Fex-Fy/C的电化学性能[58]:(a) x=0.1,y=0.1时的长循环性能;(b) x=0.1,y=0、0.1、0.2、0.3、0.4时的EIS图Fig.6 Electrochemical performance of NTP/C and NTP-Fex-Fy/C[58]: (a) long cycle performance for x=0.1,y=0.1; (b) EIS images for x=0.1,y=0,0.1,0.2,0.3,0.4
离子掺杂NTP 在有机系钠离子电池中的应用方面,2018 年,WEI 等[59]首次用阴离子掺杂NTP,采用溶胶-凝胶法成功合成了Na1-2xTi2(PO4)3-xFx(x=0,0.02,0.05,0.10),其中Na0.9Ti2(PO4)2.95F0.05的电化学性能最优,在0.2 C 下提供了121 mAh/g的容量,明显高于未掺杂NTP@C 的比容量108 mAh/g。结果表明,适当掺杂氟提高了离子传递速度,提高了材料的电化学性能。2022 年,YAN 等[60]采用简单的溶剂凝胶法和高温固态反应合成了Gd3+掺杂的NTP@C 复合材料。导电碳涂层促进了材料表层电导率,而Gd3+掺杂有效地提高了本征电导率。如图7(a)所示,Gd3+掺杂的NaTi2-xGdx(PO4)3@C(x=0%、1%、3%、5%、7%)负极材料在0.1 C 下的初始放电容量和循环性能。其中,Gd3+掺杂量5%的NaTi1.95Gd0.05(PO4)3@C 复合材料具有最为优越的电化学性能。为了更好地解释NaTi1.95Gd0.05(PO4)3@C 负极材料的储钠特性,对材料进行了阻抗测试,如图7(b)所示,电化学阻抗谱中2个电极的阻抗谱具有相似的轮廓,但NaTi1.95Gd0.05(PO4)3@C电极比未掺杂的电极材料具有较小的电荷转移电阻,其根本原因是Gd3+不等价取代Ti4+所导致的Na+或Ti4+空位,从而导致材料电导率提高。此外,如图7(c)所示,该负极材料在20 C 下循环超过500 圈后仍显示出95.2%的高容量保留率,显示了良好的循环稳定性。

图7 NaTi2-xGdx(PO4)3@C(x=0%,1%,3%,5%,7%)电化学性能[60]:(a) 0.1 C下的循环性能;(b) EIS图;(c) 20 C高倍率下的长循环性能Fig.7 Electrochemical performance of NaTi2-xGdx(PO4)3@C (x=0%,1%,3%,5%,7%) [60]:(a) cycling performance at 0.1 C; (b) EIS image; (c) long cycle performance at 20 C
表面修饰将导电材料或者快离子导体直接包覆在材料表面,能在很大程度上提高材料表面的导电性,同时,也能在一定程度上保护电极材料不被电解液侵蚀。形貌调控则是通过减小材料颗粒尺寸及构造特殊形貌提高材料的比表面积,增加活性位点,缩短Na+传输路径,从而提升材料的电化学性能,但是,形貌调控在增大了材料比表面积的同时也会使纳米材料产生不同程度的团聚和“溶解-沉淀”等副反应,从而影响材料的电化学性能。因此,研究者在形貌调控的同时通常都会进行包覆改性,两种改性方法协同作用能够更好地提高材料的电化学性能。离子掺杂取代是通过在过渡金属层中引入其他金属阳离子或者引入F-和Cl-等强极性阴离子,在晶体内部产生空位缺陷,提高晶体内部的载流子浓度和离子迁移速度,从而提高材料颗粒内部的电导率。众多研究结果表明,由离子掺杂和具有高导电性的纳米修饰材料所构成的多级纳米复合材料是同时提高离子和电子传输速率及缩短传输路径的理想策略。
3 总结与展望
水系钠离子电池是一种应用前景非常广阔的大规模电化学储能技术。但是,现阶段众多水系钠离子电池的能量密度偏低,循环稳定性不足,极大地限制了其实际应用。电极材料是二次离子电池中最关键部件之一,在很大程度上决定了电池使用寿命和能量密度。因此,现有电极材料的优化和新型电极材料的开发是进一步探索水系钠离子电池的重要研究方向。近年来,研究者通过对现有电极材料的改性,在一定程度上提高了NTP 材料的导电性能,改善了电极材料的电化学性能。开发新型电极的合成方法首先要尽可能地拓宽电解液的电化学稳定窗口,降低水的析氢电位并提高析氧电位,以便寻找更加适合的低电压负极材料和高电压正极材料,从而提高水系钠离子电池的能量密度。另外,由于副反应(H2/O2演化反应、电极与水或O2的反应、电极在水系电解液中的溶解等)引起的电极材料容量衰减机理的解释和表征手段并不成熟,因此结合新型的表征手段探究材料的衰减机理,进而优化电极材料的设计和制备方法也是推进水系钠离子电池广泛应用的重要手段。
综上,水系钠离子电池具有的安全性、环境友好性和地壳中丰富的钠储量等优点,使得水系钠离子电池在大规模储能系统中占据优势,只要兼顾能量密度和循环寿命,相信在不久的将来,随着电极材料和电解液电化学性能的不断提升,电池技术的不断成熟,水系钠离子电池一定可以在大规模储能系统中广泛应用。

