碳酸锂热分解工艺研究现状及发展
保雪凡, 邓志敢*,b, 魏昶,b, 樊刚,b, 李兴彬,b, 李旻廷,b
(昆明理工大学,a. 冶金与能源工程学院;b. 省部共建复杂有色金属资源清洁利用国家重点实验室,昆明 650093)
Li2O 是一种性能优良的非水电解质,高纯Li2O是生产氧化铁锂的主要原料之一[1],电池级Li2O 主要用作固体锂电池电解质材料和锂离子动力电池的正极材料,用它制成的电池除了具有一般锂电池的特性外,且具有成本低,无污染等优点[2]。Li2O 除了在锂电池产业中有应用外,还是制备陶瓷、药物、光谱纯试剂、特种玻璃等物质的重要原料,同时还广泛应用于化工、原子能工业、冶金等领域[3-4]。近年来,随着“碳达峰”“碳中和”等目标的提出,新能源产业得到了蓬勃发展,锂离子电池也逐渐普及到生产生活的各个领域[5-7],而以Li2CO3为原料制备锂电正极材料时,制备过程均会涉及Li2CO3的分解,因此对Li2CO3热分解进行系统研究具有实际意义。
目前制备Li2O 的方法有:①将金属Li 在真空加热到熔融状态,直接通入氧气O2生成Li2O;②将高纯Li2CO3在真空条件下,于700 ℃加热50 h 制得Li2O[8];③用LiOH·H2O与H2O2反应,首先生成Li2O2,在真空条件下加热分解Li2O2制得Li2O[9-11]。
对以上方法进行比较,发现第1 种方法工艺简单,容易操作,但由于金属Li 活动性较强,极其不稳定,导致此法在工业化中的产率很低,且纯度较低;第2 种方法反应时间较长,成本较高,实际情况加热至1 000 ℃也很难分解完全,难以工业化;第3 种方法相对于传统的方法设备投资较少,获得的产品纯度高,产率高,质量稳定,但是工艺流程较长。因此,寻找一条经济化、资源化且具有社会效益的Li2O 制备工艺路线是很有必要的。
Li2CO3在工业中具有多种用途,也是作为制备二次锂盐的主要原料[12-15],最常见的制备Li2O 的原料为Li2CO3。目前对碳酸盐(MgCO3、CaCO3)煅烧分解制备氧化物已有广泛的研究[16-18],但是,Li2CO3与其他碳酸盐相比,分解过程较为复杂,分解条件较为苛刻,产率低。因此,以Li2CO3为原料制备Li2O 大有可为,并且对Li2CO3在真空条件下热分解进行系统地研究,获取Li2CO3真空热分解的基本规律和基础数据,具有重要意义。
1 Li2CO3热分解的基础理论
1.1 常压下Li2CO3的热分解原理
Li2CO3分解是个比较复杂的过程,分解过程包括Li2CO3的分解、熔化以及Li2O 对CO2的吸附等[19]。常压下Li2CO3的热分解如式(1)所示,为式(2)和式(3)的组合:
根据无机物热力学手册[20]可以得到式(2)自由能变化:
得到式(3)自由能变化:
由式(4)、式(5)可得式(1)自由能变化为:
由式(6)求得Li2CO3常压分解温度为T=1 556.3 K(即1 283.15 ℃)。Li2CO3的熔点为 723 ℃,分解温度为1 283.3 ℃[21],Li2CO3在分解温度下呈液态,由于Li2CO3的饱和蒸汽压较大,导致物料挥发损失较多,直接煅烧难以获得较好的分解效果。
此外ČANČAREVIČ 等[22-23]和KAPLAN 等[24-26]通过计算研究了碱金属氧化物和碳酸盐的相平衡,研究结果表明,碱金属的氧化物会与对应的碱金属的碳酸盐发生反应,其反应方程式如式(7):
因此,在Li2CO3的分解过程中,生成的Li2O 会与未反应的Li2CO3形成新的熔体,即Li2O·Li2CO3,由于Li2O 对CO2的吸附作用,会使得CO2的扩散变得不利。此外DUAN 等[27]、KAPLAN 等[28]以及MOSQUEDA 等[29]研究表明,Li2CO3的热分解过程释放CO2,但由于Li2O 的存在,其对CO2的吸附效果尤为显著,1 g Li2O 理论上可以吸收1.46 g CO2,吸附时Li2O 会与CO2发生如式(8)反应,对分解反应具有阻碍作用。
1.2 真空对Li2CO3热分解的影响
在真空条件下,系统的压强较低,可取P系=P(CO2),设P系=1.013×10-n+5Pa(n=0,1,2,…),根据反应式(1)可得其等温方程:
分别取n=3,4,5,即系统压力分别为100、10、1 Pa 下,在600~1 000 ℃范围内计算出反应的ΔGT,作出了不同压强下反应的ΔGT-T关系图,如图1所示。
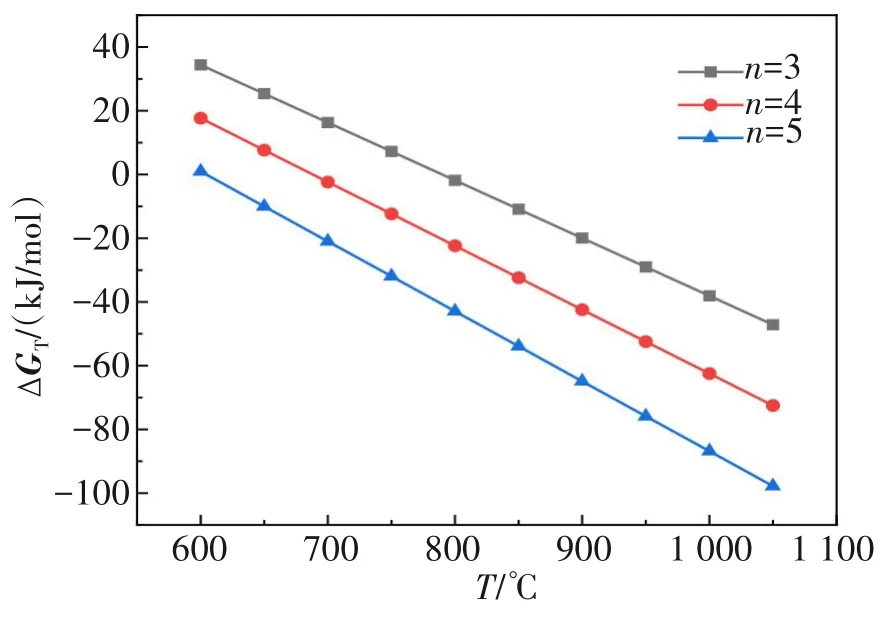
图1 Li2CO3分解反应的自由能(ΔGT)与温度(T)和压强(n)的关系Fig.1 Relationship between (ΔGT) of Li2CO3 decomposition and temperature (T) at different system pressures (n)
由图1 可得出Li2CO3在不同的系统压力下的初始反应温度,见表1。

表1 Li2CO3在不同压力下的初始反应温度Table 1 Initial reaction temperature of Li2CO3 at different system pressures
由图1 和表1 可知,随着系统压力升高,Li2CO3分解反应的ΔGT逐渐升高,反应进行的初始温度也随之升高。当系统压力分别为1、10、100 Pa 时,Li2CO3分解的初始反应温度分别为877.57、961.43、1 063.01 K。在系统压强较低(1~100 Pa)时,605 ℃以上Li2CO3即可分解,比在常压下的分解降低近680 ℃。这说明降低系统压力能有效降低Li2CO3的初始分解温度。此外,在分解过程中由于CO2的生成,CO2的扩散效果和与Li2O 发生的副反应对Li2CO3的分解造成负面影响,而真空有利于降低反应CO2的分压,一定程度上促进了反应向正方向进行。因此,Li2CO3在真空中分解比在常压下优越,能显著降低反应温度,降低能耗。
1.3 Al2O3作用下Li2CO3的热分解与转化
1.3.1 常压下Al2O3促进Li2CO3热分解的热力学分析
当Li2CO3分解过程中加入了Al2O3时,Al2O3会与Li2CO3发生化学反应转化成分解温度低的铝锂复合氧化物以促进Li2CO3分解,反应的生成物可以参考Li2O-Al2O3相图。根据图2[30]的Li2O-Al2O3相图可知,当Li2CO3与Al2O3的配料比不同时,可生成LiAlO2、Li5AlO4以及LiAl5O83 种稳定的化合物,且理论反应温度不同,其生成物也不同。其中LiAl5O4存在α 型、β 型2 种晶型[31]。LiAlO2有3 种晶型, 即α型、 β型、 γ型,α-LiAlO2在750 ℃时转变为γ-LiAlO2,γ-LiAlO21 035 ℃时转变为β-LiAlO2,α-LiAlO2的结构稳定性较差, 通常需要在高压等极端条件下得到;γ-LiAlO2型的稳定性较好,常压高温生成的主要是该晶型[19];LiAl5O8也有2 种晶型,即α 型、β 型,转变温度为1 269 ℃。

图2 Li2O-Al2O3相图[30]Fig.2 Phase diagram of Li2O-Al2O3[30]
Li2CO3与Al2O3的混合煅烧过程中,由于配料比不同,会发生式(10)、式(11)和式(12)3 种反应。经热力学计算表明,Li2CO3与Al2O3反应生成Li5AlO4的理论反应温度在1 046 ℃以上,而实际反应温度会更高,此温度下Li2CO3还未反应就大量挥发,难以获得较好的分解效果。Li2CO3与Al2O3反应生成LiAlO2的理论温度低于400 ℃(如式(11)所示),Li2CO3在低于熔点的温度下就能发生反应。当Al2O3的配入量较大时会与LiAlO2再次发生反应生成LiAl5O8(如式(12)所示)。当生成LiAl5O8时,由于Al2O3的配入量较大,物料中Li2O含量降低,会增加煅烧过程及后续工艺的能耗,因此,最好是生成LiAlO2。Li2CO3与Al2O3煅烧过程发生的反应及初始反应温度见表2,不同反应的ΔGT-T如图3所示。

表2 Li2CO3与Al2O3煅烧过程发生的反应及初始反应温度Table 2 Reactions and initial reaction temperature during calcination of Li2CO3 and Al2O3

图3 不同反应的ΔGT-T图Fig.3 ΔGT-T diagram of different reactions
由表2 及图3 可知,Li2CO3与Al2O3反应生成Li5AlO4的理论反应温度为1 319.77 K,此温度下Li2CO3未发生反应而大量挥发,易造成物料损失。Li2CO3与Al2O3反应生成LiAlO2的理论反应温度为636.73 K,此温度下 Li2CO3不易挥发,用制备LiAlO2的方法来促进Li2CO3分解在热力学上是可行的。
1.3.2 真空下Al2O3促进Li2CO3热分解的热力学分析
真空条件下,取P系=P(CO2),设P系=1.013×10-n+5Pa(n=0,1,2,…),根据反应式(11)可得其等温方程:
分别取n=3,4,5,即系统压力分别为100、10、1 Pa下,在600~1 000 ℃范围内计算出反应的ΔGT,绘制了不同压强下反应的ΔGT-T图,如图4所示。

图4 反应式(11)在不同压强下的ΔGT-T图Fig.4 ΔGT-T diagram of reaction (11) at different pressures
由图4 可得出反应式(11)在不同压力下的反应初始温度,如表3所示。

表3 LiAlO2在不同压力下的反应初始温度Table 3 Initial reaction temperature of LiAlO2 at different pressures
由图4 和表3 可知,随着系统压力升高,Li2CO3分解反应的ΔGT会逐渐升高,反应进行的初始温度也随之升高。当系统压力P分别为1、10、100 Pa时,Li2CO3分解的初始反应温度分别为371.82、405.56、446.05 K。在Li2CO3中加入Al2O3,系统压强较低(1~100 Pa)时,反应温度高于446.05 K分解即可进行,比在常压下加入Al2O3的反应初始分解温度降低了近190 K。这说明降低系统压力能有效降低Li2CO3与Al2O3混合后Li2CO3的分解温度。因此,真空条件下,向Li2CO3中加入Al2O3能够有效改善Li2CO3煅烧分解过程中挥发量大的问题,提高分解率的同时降低能耗。
由式(1)、式(11)可得Li2CO3分解率计算如下:
式(14)中:η为Li2CO3的分解率的值,单位%;m0为参加反应的Li2CO3的质量数值, 单位g;m(CO2)为生成CO2的质量数值,单位g;m(Li2CO3)为物料中Li2CO3的总质量数值,单位g。
2 Li2CO3热分解的工艺研究现状
2.1 Li2CO3真空热分解
狄跃忠等[21]发现在常压下,温度低于800 ℃时,Li2CO3几乎不分解;当温度升高到900 ℃时开始分解,在1 100 ℃左右时其分解率可达90%以上,在接近1 300 ℃时分解率接近100%。
常压下Li2CO3的实际分解温度比理论分解温度低,但受CO2的扩散问题导致整个分解过程极其漫长。实际上Li2CO3分解率与反应温度和反应时间呈正相关,而在系统压强较低(1~100 Pa)时,理论上在605 ℃以上反应即可进行,比在常压下反应进行所需温度降低了近300 ℃。Li2CO3在真空条件下分解更具有优势,一定程度上改善了受CO2的扩散问题导致的反应时间长及能耗高的问题。
2.2 常压下Al2O3促进Li2CO3热分解
尤晶等[32]研究在常压下,将Li2CO3粉与工业Al2O3粉按照摩尔比为1∶1 配比混合均匀,在反应温度为800 ℃,反应时间为2 h条件下制团煅烧,Li2CO3的分解率为96%~97%,进一步延长煅烧时间其分解率增长并不明显。煅烧温度、时间以及物料配比均会影响Li2CO3的分解,其中煅烧温度对Li2CO3的分解率影响最大,煅烧温度较低导致Li2CO3分解不完全,煅烧温度过高使Li2CO3的挥发量增加。当煅烧温度超过900 ℃时,Li2CO3挥发明显。
煅烧过程中的物料配比不仅对Li2CO3的分解率有影响,对煅烧过程和以后工序的能耗也有影响。煅烧过程Al2O3配入量越少,物料中的Li2CO3的含量就越高,煅烧过程及后续过程的能耗就越少。向Li2CO3中加入Al2O3能够有效降低Li2CO3的分解温度,且改善物料大量挥发和分解效果不好的问题。
2.3 真空下Al2O3促进Li2CO3热分解
施磊等[19]发现在系统压力为10 Pa 时,Al2O3与Li2CO3反应生成LiAlO2的实际温度比理论反应温度要高,当温度达到523 K 时产物中才出现LiAlO2,比理论温度高116 K。
制团压力、反应温度和保温时间对Li2CO3的分解均有影响。在一定范围内随着制团压力的增大,能够让反应物间的接触更加紧密,有利于原料的传热传质和Li2CO3的分解。但球团成型压力过大会使反应生成的CO2不能迅速地扩散出来,使体系压力变大,阻碍反应正向进行。反应温度越高,越有利于分解反应的进行,且反应温度对分解效果起主导作用。当系统压力为10 Pa,分解温度为723 K 时,随着保温时间的延长,分解率可接近100%。
尤晶等[33]和狄跃忠等[21]发现Li2CO3与Al2O3混合煅烧后产物中存在Li2CO3、Al2O3、Li2O 以及LiAlO2等物质,对后续提纯Li2O 造成影响。对于制备高纯度Li2O而言,煅烧产物除杂提纯是亟待解决的问题。
3 结论与展望
常压条件下,Li2CO3的熔点为723 ℃,分解温度为1 283.3 ℃,由于Li2CO3的饱和蒸汽压较大,导致Li2CO3在分解温度下呈液态,挥发严重,物料损失较多,直接煅烧难以获得较好的分解效果。真空条件下,Li2CO3在605 ℃以上分解即可进行,比在常压下反应进行所需温度降低了近300 ℃,降低系统压力能有效降低Li2CO3的初始分解温度。真空条件能降低其初始分解温度,对Li2CO3的分解影响较小,反应温度和保温时间是影响Li2CO3分解的主要因素。
在Li2CO3煅烧过程中添加骨料Al2O3,将反应物转化成分解温度低的铝锂复合氧化物以促进Li2CO3分解,考虑后续工艺能耗,改变物料配比制得LiAlO2,此化合物的理论反应温度为636.73 K,此温度下 Li2CO3不易挥发,理论上比真空煅烧Li2CO3所需分解温度降低了约241 ℃,且Li2CO3的分解率可达98%以上。
真空条件下向Li2CO3中添加骨料Al2O3进行煅烧,分解率可达99.92%,随着保温时间的延长,分解率接近100%。可见真空条件下向Li2CO3中添加一定配比的Al2O3进行煅烧可以有效降低Li2CO3分解温度,解决Li2CO3挥发量大的问题,相较于常压体系能有效缩短反应时间,降低能耗成本,可操作性强。该法能够有效改善Li2CO3单独煅烧挥发量大且分解效果不佳的问题,其研究前景较为广阔,但后续除杂提纯困难等问题仍需解决。

