木兰溪感潮河段沉积物耗氧速率及其相关影响因素研究
周佳男,方梦园,雷啟焘,侯国庆,赵天慧,张思远,赵晓丽,汤 智
1. 北京科技大学能源与环境工程学院,北京 100083
2. 中国环境科学研究院,环境基准与风险评估国家重点实验室,北京 100012
溶解氧(DO)是指溶解在水体中的分子态氧,是水环境质量的重要参数[1-2],适宜的DO 浓度是维持水体自净能力和水生生物生命活动的必要条件[3-5]. 水体中DO 浓度通常保持动态平衡,一方面通过大气复氧和浮游植物的光合作用得到补充,同时水体和沉积物中的有机质和还原性物质又会不断消耗DO[6]. 近年来,由于水体热分层和富营养化等原因,全世界范围内的诸多水域均被DO 浓度偏低等问题所困扰,其中入海口感潮河段的缺氧问题尤为严重[7-9]. 感潮河段水体DO 浓度偏低是物理、化学、生物等多种因素共同作用的结果. 一方面,感潮河段受到潮汐、径流冲淡水和全球气候变暖等物理因素的影响,使水文动力条件复杂,水体层化现象严重,容易造成缺氧[10-11];另外,沿海地区经济水平和工业化程度更高,人类生活和工业活动产生的大量污水排入河流,水体中有机污染物的降解、无机物的氧化、浮游植物的呼吸作用以及底泥耗氧等生物化学过程也将加剧DO 的消耗[12].
木兰溪位于福建省莆田市,两岸是莆田市主要的人口聚居区,承担着重要的水生态功能,其综合治理被写入《中华人民共和国国民经济和社会发展第十四个五年规划和2035 年远景目标纲要》. 木兰溪感潮河段约为20 km,近年来其水环境质量大幅提高,但该区域水体DO 浓度偏低问题严重阻碍了向“生态之河”的迈进. 除了受到潮汐和人类活动的影响,沉积物也是造成DO 浓度偏低的重要因素. 研究表明,部分河流中的沉积物耗氧对总耗氧量的贡献率达到50%[13],在较浅的移动床河流中,甚至超过了90%[14].
通常用沉积物耗氧速率(SOD)表征沉积物耗氧水平,SOD 是指底部沉积物对上覆水体中DO 的消耗速率,一般以单位表面积沉积物在单位时间内消耗的DO 量表示[15]. 一般认为,沉积物耗氧包括生物耗氧和化学耗氧两个过程,生物耗氧包括底栖生物和微生物的呼吸作用耗氧,化学耗氧则主要是一些无机还原性物质Fe2+、Mn2+、S2——和氨氮(NH4+-N)等被氧化过程中的耗氧[16]. 已有研究[17]表明,SOD 的影响因素较多,根本因素是沉积物自身的组成和性质,其他因素包括水温、上覆水流速和水质等. 水温的升高将提高微生物活性和化学反应速率,进而增加对氧气的消耗;上覆水流速的增加会减小扩散边界层的厚度,使传输的氧气增多,增加耗氧量;水体中较多的有机质可为底泥生物活动提供养分,促进生物对氧气的消耗,从而使SOD 升高[18-19].
目前,国内外有关沉积物中耗氧物质对SOD 的影响已有部分研究,发现生物耗氧和化学耗氧对SOD的贡献在不同水体中存在差异,如Hartwell 湖沉积物中生物耗氧占SOD 的91%,耗氧过程主要是由于细菌的呼吸作用[20],而子牙河沉积物的化学耗氧对SOD 的贡献较大,达58.87%,其中Fe2+的贡献最大,其次是S2——和Mn2+[21]. 我国河口及近岸水体的沉积物耗氧研究主要集中在长江口[22]和珠江口[23]等海口低氧区域,而针对木兰溪这类感潮河段的相关研究仍然较少. 因此,研究木兰溪感潮河段沉积物SOD 以及相关影响因素对于科学判断感潮河段沉积物对水体影响具有重要意义.
该研究以木兰溪感潮河段沉积物为研究对象,分析了不同温度条件下沉积物的耗氧速率变化以及主要耗氧物质对SOD 的影响. 通过研究不同区域沉积物中有机质、总氮(TN)、NH4+-N、重金属污染物(Fe、Mn)和硫(S)等因素变化,明确各因素对SOD 的影响及其机理,采用Pearson 相关分析检验了沉积物中各耗氧物质的含量以及上覆水DO 浓度与SOD 的相关性,以期为科学评估木兰溪沉积物耗氧速率提供数据基础,为感潮河段水质提升提供理论依据.
1 材料与方法
1.1 研究区域概况
木兰溪是福建省东部独流入海的河流,发源于戴云山脉,流经莆田市仙游县和市区,至三江口经兴化湾流入台湾海峡. 干流全长105 km,流域面积1 732 km2,天然落差784 m,被称为莆田的“母亲河”. 气候属于亚热带海洋性季风气候,日照充足,雨量充沛,温度适宜,年均气温16~21 ℃,年均降水量1 000~2 300 mm. 自木兰陂以下至入海口为感潮河段,水深约为3~5 m,河面宽度达到50~150 m,受潮水影响较大,并且沿岸有村庄、工业区及码头,受人类活动影响也较大.
1.2 样点设置
木兰溪感潮河段采样点如图1 所示. 根据木兰溪感潮河段的情况,以宁海大桥西侧为起点,沿入海的方向依次设置了13 个采样点,其中S11、S12、S13 采样点为近海养殖区. 由于木兰溪感潮河段河面宽度较大,且两岸植被、自然条件存在一定的差异性,因此在S1~S10 采样点横断面沿着入海方向设置了左、中、右3 个采样点比较不同区域沉积物的差异. 其中S3、S6 和S8 采样点河道中间为沙质底,未采集到沉积物样品. S10 采样点接近入海口,只采集了左岸的沉积物.
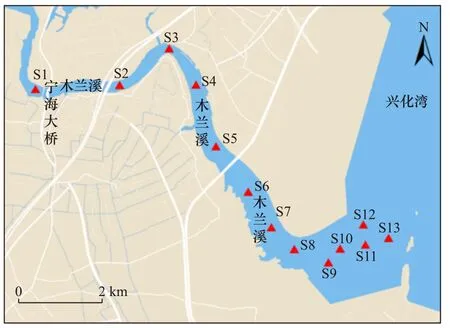
图1 木兰溪感潮河段沉积物采样点示意Fig.1 Schematic diagram of sampling points of sediments in the tidal reach of Mulan River
1.3 样品采集与分析方法
样品的采集时间为2022 年3 月,采用抓泥斗采集木兰溪感潮河段0~5 cm 的沉积物样品,将采集到的样品放入密闭的自封袋内,置于4 ℃冰箱中冷藏保存并尽快运到实验室,然后放到——20 ℃冰箱中冷冻保存. 新鲜沉积物样品用于测定SOD 和NH4+-N 含量,NH4+-N 含量采用《土壤氨氮、亚硝酸盐氮、硝酸盐氮的测定 氯化钾溶液提取-分光光度法》(HJ 634——2012)测定. 还有一部分沉积物样品经冷冻干燥后研磨过筛测定总有机碳(TOC)、TN、Fe、Mn 和S 含量,其中TOC 含量采用《土壤有机碳的测定 重铬酸钾氧化-分光光度法》(HJ 615——2011)测定;TN 含量采用《土壤全氮测定法(半微量开氏法)》(NY/T 53——1987)测定;Fe 和Mn 含量采用电感耦合等离子体质谱仪(iCAP RQ型,美国赛默飞世尔科技公司)测定;S 含量采用元素分析仪(Elemantar: Vario EL cube 型,德国元素分析系统公司)测定.
1.4 SOD 的测定方法
目前国内外关于SOD 的测定方法主要分为原位和实验室模拟测定,原位测定对沉积物的扰动小,更接近水体实际环境,而实验室模拟测定更容易控制环境条件,能够更好地反映不同因素对SOD 的影响[24].因此,为了研究温度对SOD 的影响,采用较为成熟的实验室柱培养法测定木兰溪沉积物SOD. 试验装置为高32 cm、内径6 cm 的带底座有机玻璃管. 试验开始前,将混合均匀的沉积物放入有机玻璃管中,使沉积物厚度达到8 cm,保证沉积物表面平整,沿管壁缓慢注入超纯水,水柱高度约为22 cm,注入过程中避免引起沉积物的再悬浮,有机玻璃管顶端用橡胶塞密封. DO 探头位于上覆水的一半,确保装置内没有气泡,保持整个装置的密封性. 为减少上覆水中初始DO 浓度对SOD 测定结果的误差,将超纯水的起始DO 浓度控制在7.5~8.5 mg/L 之间. 在恒温水浴锅中于22 和30 ℃ (试验温度的选取依照木兰溪春秋季和夏季的水温)下避光培养,待水温达到目标温度并稳定后,记录此时的DO 浓度,即为起始DO 浓度,每隔1 h 记录DO 仪读数,直至培养到12 h(由于此河段为感潮河段,且为半日潮,故选取一次涨落潮的时间). SOD 的计算公式如下:
式中:SOD 为任意温度下的沉积物耗氧速率,mg/(m2·h);S为测得的时间(t)-DO 曲线的斜率,mg/(L·h);V为封闭容器内上覆水的体积,L;A为封闭容器内所截沉积物的表面积,m2.
对高职学生而言,文化自信是其社会责任感与使命感的集中体现,是正确价值观形成的基础,是养成文明行为,提高道德水准的重要源泉。高校辅导员是学生思想政治教育、价值引领、日常管理的重要力量,在学生成长成才过程中扮演十分重要的角色。高职辅导员理应在学生文化自信培育中发挥重要作用。
1.5 数据处理
采样点分布图使用ArcGIS 10.5 软件结合现场样点位置进行绘制,SOD 拟合曲线、沉积物SOD、TOC、TN、NH4+-N、Fe、Mn、S 含量分布图使用Origin 软件绘制,各耗氧物质的含量以及上覆水DO 浓度与SOD的相关性使用SPSS 22.0 软件进行分析.
2 结果与讨论
2.1 SOD 空间变化
木兰溪感潮河段沉积物SOD 拟合曲线如图2 所示,经计算后的不同点位沉积物SOD 值见表1. 各采样点沉积物SOD 拟合曲线的R2均大于0.96,表明线性拟合可以较好地表征沉积物的耗氧速率. 已有研究[25]表明,温度会极大地影响沉积物SOD,因此该研究分别选择22 和30 ℃,研究温度对沉积物SOD 的影响. 22 ℃时,不同采样点沉积物SOD 为3.06~16.64 mg/(m2·h),平均值为8.63 mg/(m2·h);30 ℃时,不同采样点沉积物SOD 为14.02~52.44 mg/(m2·h),平均值为29.08 mg/(m2·h),这表明30 ℃时SOD 的平均值是22 ℃时的3.37 倍. 因此,温度对木兰溪沉积物SOD 有很大影响,夏季水温较高时沉积物耗氧应尤为引起重视,这也与以往研究较为相似. 如Liu[26]发现基隆河的SOD 值随季节变化波动,夏季由于受到高温影响SOD 值更高;张敬旺等[27]发现家鱼池塘底泥耗氧率与温度呈极显著相关;Lee 等[28]发现韩国四大河流堰筑物上游沉积物的夏季耗氧速率明显高于秋季,这归因于不同季节温度的差异. 温度对SOD 的影响主要是由于温度升高,沉积物中微生物的活性增大,新陈代谢加快,从而使耗氧量增加,另外,一些化学氧化反应速率的加快也会增加沉积物耗氧量[17].
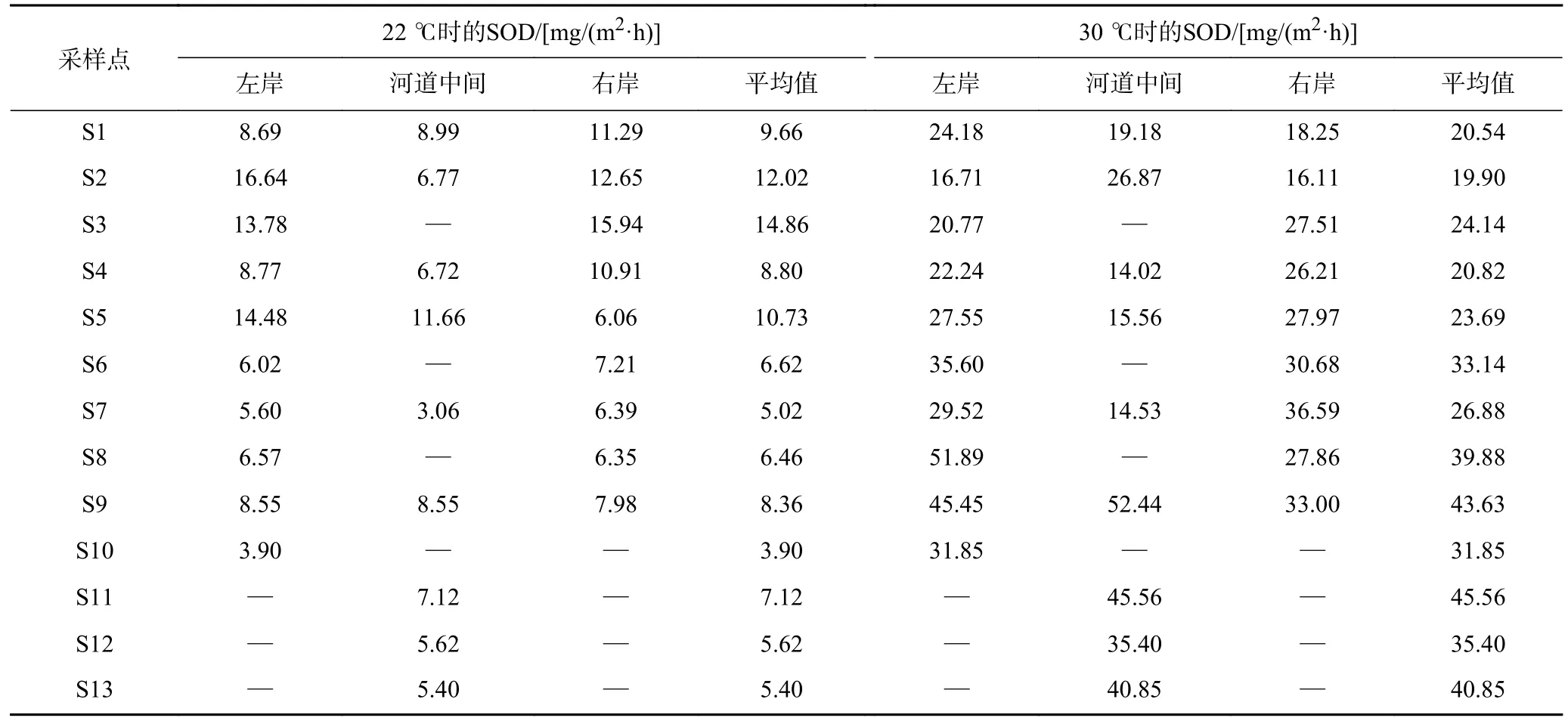
表1 不同采样点沉积物22 和30 ℃时的SODTable 1 SOD in sediments of different points at 22 and 30 ℃
木兰溪感潮河段沉积物SOD 分布如图3 所示.从图3(a)可以看出,22 ℃时,左岸SOD 从上游到下游逐渐减小,最大值和最小值分别出现在S2 采样点〔16.64 mg/(m2·h)〕和S10 采样点〔3.90 mg/(m2·h)〕,平均值为9.30 mg/(m2·h);30 ℃时,SOD 的变化趋势与22 ℃相反,从上游到下游逐渐增加,最大值和最小值分别出现在S8 采样点〔51.89 mg/(m2·h)〕和S2 采样点〔16.71 mg/(m2·h)〕,平均值为22 ℃时的3.3 倍〔30.58 mg/(m2·h)〕. 右岸沉积物SOD 平均值和变化趋势与左岸相似〔见图3(b)〕,22 ℃时,沉积物SOD 在6.06~15.94 mg/(m2·h)之间,平均值为9.42 mg/(m2·h),SOD从上游到下游逐渐减小最后趋于稳定;30 ℃时,SOD 在16.11~36.59 mg/(m2·h)之间,平均值为27.13 mg/(m2·h),SOD 最小值和最大值分别出现在S2 和S7 采样点.
木兰溪感潮河段河道中间和养殖区沉积物SOD变化如图3(c)所示. 22 ℃时,河道中间SOD 在3.06~11.66 mg/(m2·h)之间,平均值为7.63 mg/(m2·h),SOD从上游到下游呈减小趋势;30 ℃时,SOD 在14.02~52.44 mg/(m2·h)之间,平均值为23.77 mg/(m2·h),最大值出现在S9 采样点,主要是由于S9 采样点河道变宽,流速减慢,有利于污染物的沉降,从而增加了对氧气的消耗. 通过与左岸、右岸比较,不同温度条件下河道中间沉积物SOD 都明显低于两岸,这一方面主要是由于木兰溪两岸沉积物相比于河道中间,存在大量底栖动物和沉水植物,呼吸作用将消耗大量氧气;另一方面人类活动产生的污染物和垃圾在地表径流等因素的影响下,将更多地在两岸沉积物中赋存并消耗DO. 同时,在水力冲刷和摩擦的作用下,河道中间的沉积物含沙量较高,吸附的有机质以及可耗氧的生物和还原性物质较少,从而造成SOD 偏小[29]. 对于养殖区S11、S12、S13 采样点,在相同温度条件下,SOD 变化较小,但是温度对SOD 的影响较为明显,30 ℃时的SOD 平均值〔40.60 mg/(m2·h)〕是 22 ℃时〔6.05 mg/(m2·h)〕的6.7 倍. 其主要原因是养殖区域沉积物相比于河道含沙量更低,沉积物中赋存的有机质等耗氧物质更多,同时还有更多微生物在温度较高时生物呼吸作用增强,使SOD 大幅提升,该结果在萨旺尼河上游沉积物中也有相似发现,SOD 与含沙量成反比关系[30-31].
不同温度条件下,木兰溪沉积物SOD 的空间变化规律差异较大. 在温度较低时,由于上游采样点两岸存在钢材厂、铸造厂等重金属加工工厂,生产废水排入河流,将增加沉积物中Fe 和Mn 的含量,并且附近还有大型码头,大量船舶停靠在此,在海水腐蚀的作用下,Fe 和Mn 等重金属也会沉降到沉积物中,Fe和Mn 等构成的化学耗氧占据主导优势,因此上游采样点沉积物SOD 较大;而在温度较高时,靠近海口的沉积物中含有更多的微生物,温度升高导致其活性增大,新陈代谢加快,生物耗氧占据主导优势,从而使耗氧量增加,因此更靠近海口的沉积物SOD 更大[32].
2.2 国内外河流沉积物SOD 比较
已有研究表明不同地区河流沉积物SOD 差异较大,由于河口海湾处于陆海交汇地带,通过河流径流和污水排放,接收了大量陆源输入污染物[33-34],造成河口海湾处沉积物污染严重,因此河口海湾等区域SOD 比河流湖泊高. 木兰溪感潮河段沉积物SOD 与国内外河流比较如表2 所示.
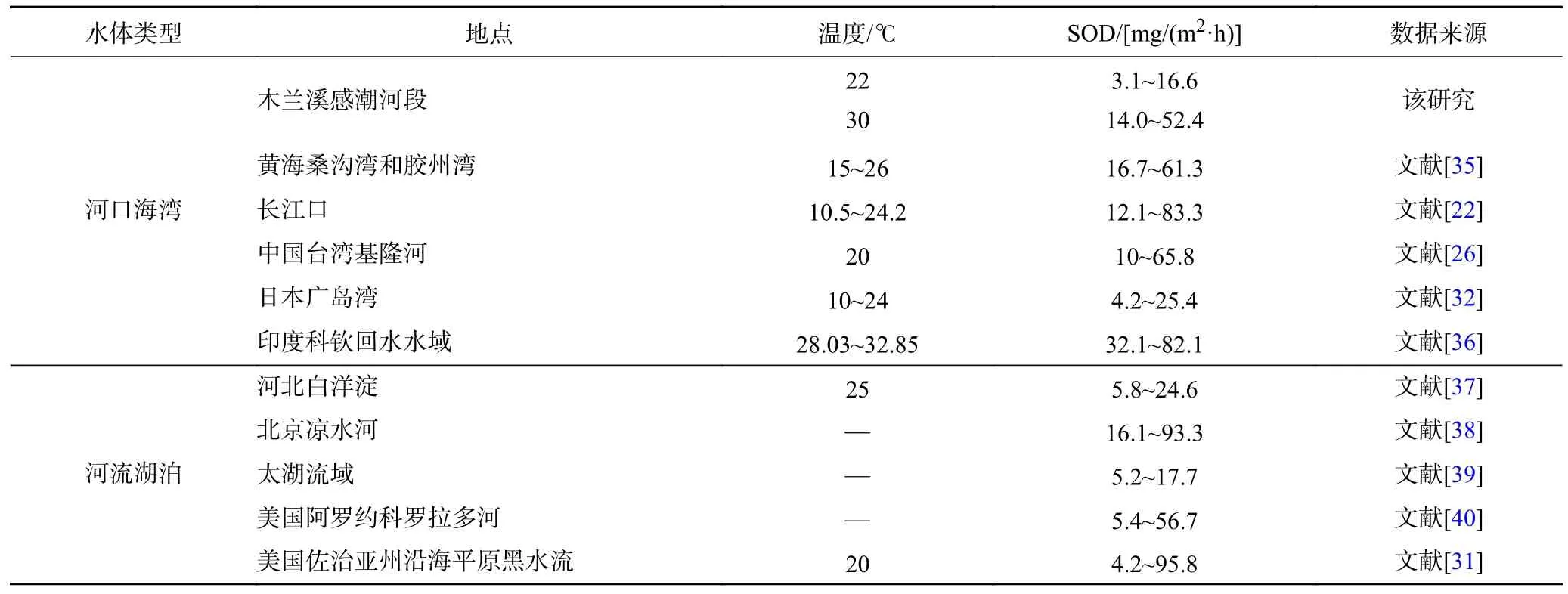
表2 国内外不同水域沉积物耗氧速率对比Table 2 Comparison of sediment oxygen demand in different waters at home and abroad
22 ℃时,木兰溪感潮河段沉积物SOD 处在较低水平,与太湖流域、河北白洋淀和日本广岛湾相近,但远低于长江口、中国台湾基隆河等区域;而30 ℃时,沉积物SOD 低于温度相近的印度科钦回水水域、黄海桑沟湾和胶州湾,但明显高于其他区域. 荣楠[41]在对海河流域SOD 进行研究时,确定了其评价标准,即SOD<20.8 mg/(m2·h)时,SOD 处在较低水平,SOD>20.8 mg/(m2·h)时,处在较高水平. 该研究中,木兰溪感潮河段22 ℃时的SOD 均处在较低水平,而30 ℃时的SOD 有71.4%处于较高水平,因此温度对木兰溪感潮河段沉积物SOD 的影响较为显著,温度较高时木兰溪感潮河段的沉积物耗氧严重,在温度较高的夏季,木兰溪感潮河段沉积物耗氧显著升高,会极大地影响水体DO 浓度,造成木兰溪感潮河段水体DO浓度偏低.
2.3 Pearson 相关性分析结果
S1~S13 采样点左岸、河道中间、右岸全部沉积物中主要耗氧物质与SOD 的Pearson 相关性分析结果见表3. 沉积物中的Mn 含量与22 ℃时的SOD 存在显著的正相关关系,表明Mn 在温度较低的季节对木兰溪沉积物耗氧具有重要贡献,这主要是由于Mn的氧化过程属于化学耗氧,相比于生物耗氧,受温度影响较小,低温时对SOD 的影响更大[32,42]. 而沉积物中的NH4+-N、S 含量与30 ℃时的SOD 均存在极显著的正相关关系,表明NH4+-N 和S 可能是夏季温度较高时木兰溪沉积物耗氧的重要贡献者,这主要是由于NH4+-N 和S 的氧化过程需要硝化细菌和硫氧化细菌的参与,温度升高,细菌活性变大,促进了硝化作用和硫化作用,从而增加了对耗氧速率的贡献[43-44].此外,沉积物中的TOC 含量与TN 含量、Fe 含量与Mn 含量均存在极显著的正相关关系,表明沉积物中的TOC 和TN 具有相同或相近的污染物质来源和输入途径,Fe 和Mn 可能来自同一污染源. 因此,判断和追溯这些污染物质的来源,可以有效减少沉积物中的耗氧物质,从而降低沉积物耗氧对水体DO 浓度偏低的贡献.

表3 沉积物中耗氧物质与SOD 的Pearson 相关性分析Table 3 Pearson correlation analysis of SOD and oxygen-consuming substances in sediments

表4 沉积物SOD 与上覆水DO 浓度的Pearson 相关性分析Table 4 Pearson correlation analysis of SOD and DO of the overlying water
2.4 沉积物中主要耗氧物质对SOD 的影响
2.4.1 沉积物中TOC 含量对SOD 的影响
沉积物SOD 受到水利条件、沉积物理化性质和赋存化合物等多种因素的影响,其中耗氧化合物对DO 的消耗更为直接,沉积物中的还原性物质可直接消耗水体中的DO,而类似有机质等化合物可通过微生物的降解作用间接消耗水体中的DO[46-47]. 已有研究表明有机质含量对沉积物SOD 有较强的影响作用,在黄海桑沟湾和胶州湾[35]、美国东南部沿海平原黑水流域[48]、地中海西北部罗讷河[49]等区域沉积物SOD 与TOC 含量均呈正相关,而在河北白洋淀[37]和北京凉水河[38]等区域,由于其他因素的影响,沉积物SOD 与TOC 含量的相关性较弱.
木兰溪感潮河段沉积物中TOC 含量分布如图4所示. 由图4 可见,不同区域沉积物中TOC 含量由河流到河口呈现波动变化,整体上呈现一定的下降趋势. TOC 平均含量表现为左岸(9.25×104mg/kg)>养殖区(8.80×104mg/kg)>河道中间(8.45×104mg/kg)>右岸(8.21×104mg/kg),其中木兰溪左岸、河道中间、右岸 沉 积 物中TOC 含 量 分 别 为6.57×104~1.18×105、3.94×104~1.13×105和2.78×104~1.23×105mg/kg,养殖区沉积物中TOC 含量为5.19×104~1.12×105mg/kg. 沉积物中TOC 含量最低点出现在S7 采样点. 通过与图3 比较,发现在22 ℃条件下,木兰溪沉积物中TOC 含量对SOD 的影响较小,而在30 ℃条件下,沉积物SOD 与TOC 含量呈现一定的相关性,尤其是左岸趋势更为明显,从S4 采样点开始,SOD 随TOC 含量的升高而升高,因此在温度较高时,沉积物中TOC含量极大地影响着SOD. 主要是由于温度升高,微生物活性增大,能够促进沉积物中有机质的降解,从而更多地消耗水体中的DO,造成沉积物SOD 与TOC含量变化趋势较为一致. 沉积物SOD 与TOC 含量的关系在左岸、河道中间、右岸也表现出一定的差异性. 右岸沉积物中的TOC 含量与SOD 的变化趋势相关性较低,一方面,这可能是由于右岸沉积物中TOC平均含量是最低的,对SOD 的影响较小;另一方面,TOC 只能表示沉积物中有机质的含量,而不能完整表征有机质的组分,相比于有机质含量,有机质组成才是影响底栖生物呼吸耗氧的关键[50].
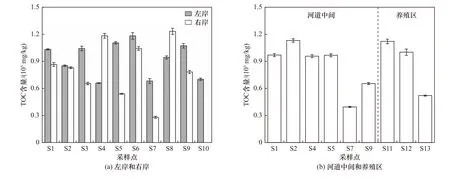
图4 木兰溪感潮河段沉积物中TOC 含量分布Fig.4 TOC content distribution in sediments of Mulan River tidal reach
2.4.2 沉积物中TN 含量对SOD 的影响
在人类活动的影响下,生物所需的含氮营养物质大量进入水体,并在沉积物中不断积累. 在一定条件下,沉积物中的含氮营养物质在物理、化学及生物的作用下将重新释放到水体中,造成水体富营养化,进而导致水体DO 浓度下降[51-52]. 木兰溪感潮河段沉积物中TN 含量分布如图5 所示. 由河流到海口,沉积物中TN 含量呈波动减小的趋势,与TOC 含量的变化有一定的相似性. 同一断面沉积物中TN 平均含量表现为河道中间(1.22×103mg/kg)>左岸(1.20×103mg/kg)>养 殖 区 (1.05×103mg/kg)>右 岸 (1.01×103mg/kg),其中木兰溪左岸、河道中间、右岸沉积物中TN 含量分别为7.90×102~1.51×103、9.60×102~1.5×103和2.20×102~1.44×103mg/kg,养殖区沉积物中TN 含量为9.90×102~1.13×103mg/kg.

图5 木兰溪感潮河段沉积物中TN 含量分布Fig.5 TN content distribution in sediments of Mulan River tidal reach
在不同温度条件下,木兰溪感潮河段沉积物SOD 与TN 含量未呈现出明显的相关性,一方面说明木兰溪沉积物耗氧受多种因素的影响,除TN 外还包括有机质、重金属、温度和盐度等水质理化要素;另外,TN 包括有机氮、硝态氮和NH4+-N,各组分对SOD 的影响具有一定的差异性,其中有机氮部分会在微生物的作用下被降解而消耗氧气[53],亚硝态氮氧化和NH4+-N 硝化过程中也会耗氧[41]. 本研究中只分析了TN 和NH4+-N 含量,有机氮作为重要的耗氧物质,可能与SOD 相关性更好,因此在后续研究中应注重有机氮对SOD 的影响研究.
2.4.3 沉积物中NH4+-N 含量对SOD 的影响
沉积物剖面从上到下分别是好氧层、亚氧层、厌氧层和甲烷环境. 在沉积物好氧层以下,含氮有机物矿化过程中发生氨化反应,释放出大量氨. NH4+通过梯度扩散从缺氧层向好氧层扩散,在好氧环境中被氧化为NO3——,通常硝化反应是严格的好氧过程. 在亚硝化细菌的作用下,NH4+-N 首先被氧化为亚硝酸盐,然后在硝化细菌的作用下,亚硝酸盐被氧化为硝酸盐,在此过程中,1 mol NH4+-N 转换为硝酸盐需要消耗2 mol 氧气[54]. 因此,NH4+-N 耗氧也是沉积物耗氧过程中的重要因素.
木兰溪感潮河段沉积物中NH4+-N 含量分布如图6 所示. 左、右两岸NH4+-N 含量由河流至海口逐渐增加,NH4+-N 平均含量表现为养殖区(8.38 mg/kg)>右岸(8.32 mg/kg)>左岸(8.02 mg/kg)>河道中间(6.19 mg/kg),养殖区由于受到人类活动的影响,沉积物中NH4+-N 含量大于木兰溪河道,对于木兰溪左岸、河道中间、右岸而言,两岸沉积物中NH4+-N 含量明显大于河道中间,这主要是由于污染物随地表径流等途径进入水体后,更多地汇聚到左、右两岸沉积物中,这也与木兰溪感潮河段沉积物SOD 的变化趋势一致.
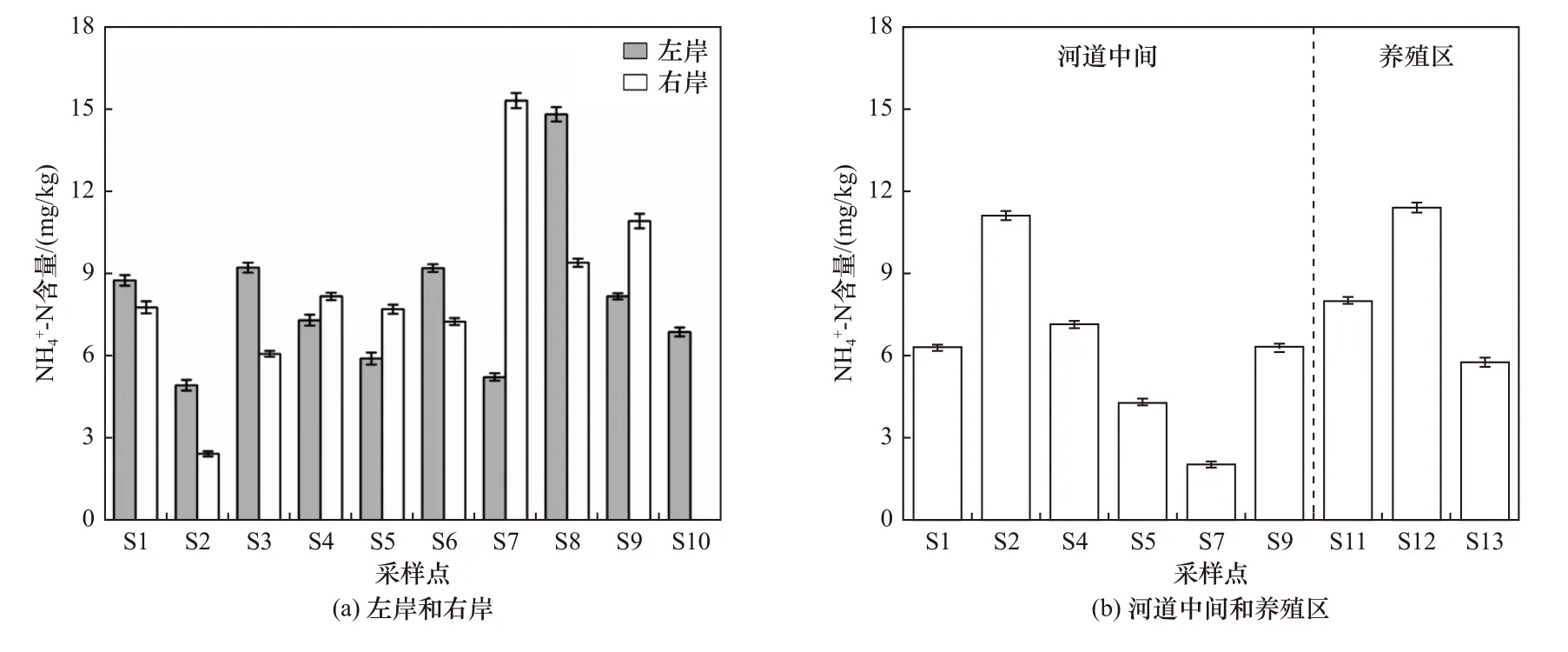
图6 木兰溪感潮河段沉积物中NH4+-N 含量分布Fig.6 NH4+-N content distribution in sediments of Mulan River tidal reach
当温度为22 ℃时,沉积物SOD 与NH4+-N 含量相关性较差,说明温度较低时NH4+-N 含量不是沉积物SOD 的主要影响因素;当温度为30 ℃时,NH4+-N含量与SOD 呈现出明显的相关性,不同点位的变化趋势非常相似,对于NH4+-N 含量较高的左、右两岸沉积物,其SOD 和NH4+-N 含量的最小值和最大值基本都出现在相同区域,均在S2 采样点达到最小值,左岸沉积物SOD 和NH4+-N 含量在S8 采样点达到最大值,而右岸则是S7 采样点. 不同温度条件下,NH4+-N含量对沉积物SOD 的影响表现出较大的差异,主要原因是随着温度的升高,沉积物中硝化细菌的活性增大,促进了NH4+-N 硝化过程[43],从而加大了对耗氧速率的贡献. 因此,在高温条件下,沉积物中NH4+-N 含量对沉积物SOD 的影响不容忽视,应加强高温季节NH4+-N 等污染物的控制.
2.4.4 沉积物中Fe 含量对SOD 的影响
Fe 和Mn 是氧化还原敏感性元素,在沉积物中会发生价态和组分的转换. 在较深层的沉积物中,可能会与CO32-和S2-结合形成矿物,而当沉积物中的Fe2+和Mn2+向表层扩散的过程中会被氧化,从而消耗水体中的DO,构成沉积物化学耗氧[55-56]. 木兰溪感潮河段沉积物中Fe 含量分布如图7 所示. Fe 平均含量表现为右岸(38 999 mg/kg)>左岸(38 399 mg/kg)>养殖区(34 874 mg/kg)>河道中间(32 353 mg/kg),其中木兰溪左岸、河道中间、右岸沉积物中Fe 含量分别为34 532~40 938、9 368~44 747 和32 298~44 163 mg/kg,养殖区沉积物中Fe 含量为32 816~36 659 mg/kg. 两岸沉积物的Fe 含量大于养殖区和河道中间,主要是由于两岸沉积物为Fe 的赋存提供了更好的条件.
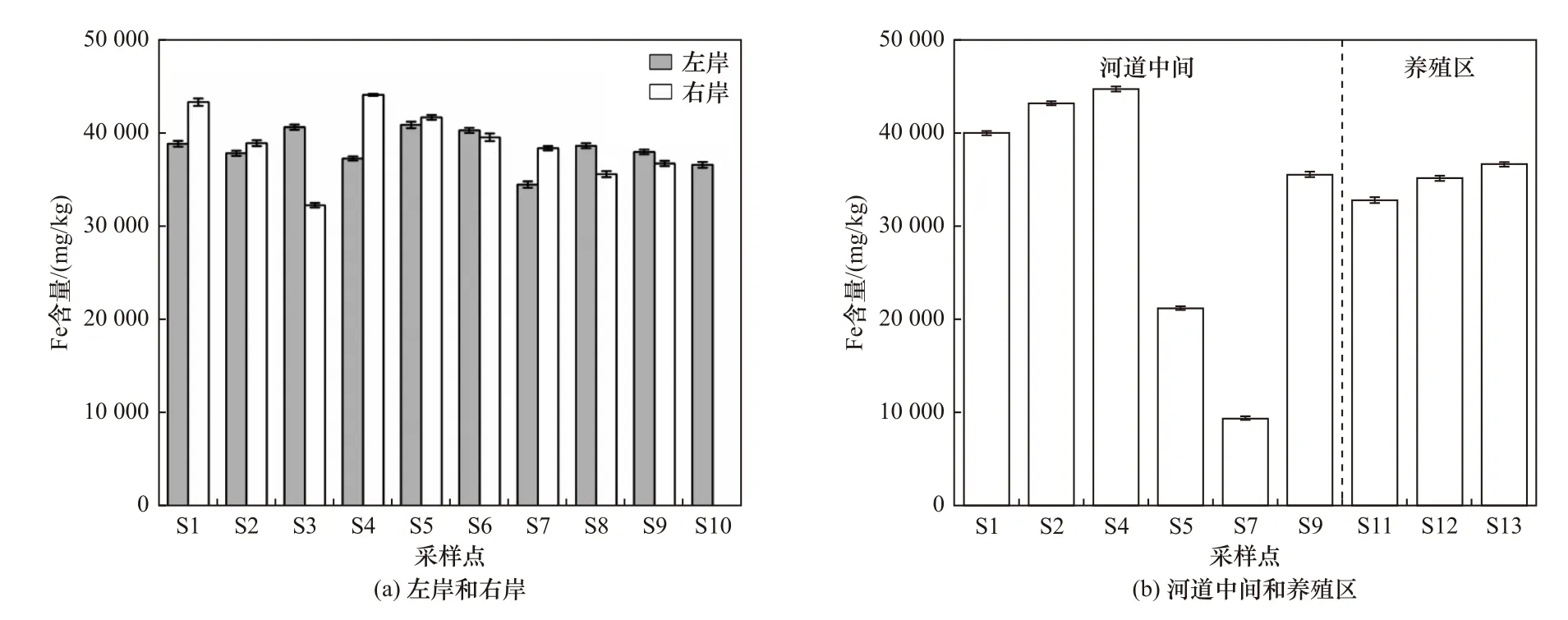
图7 木兰溪感潮河段沉积物中Fe 含量分布Fig.7 Fe content distribution in sediments of Mulan River tidal reach
在温度22 ℃条件下,不同区域沉积物SOD 与Fe 含量都呈现出由河流向海口逐渐减小的趋势,而在温度30 ℃条件下,沉积物SOD 与Fe 含量的相关性均较差. 一方面是因为该研究测定的是沉积物中的总Fe 含量,包括各种形态和价态的Fe,而耗氧过程主要是Fe2+的氧化作用. 因此,Fe2+对沉积物SOD 的影响还需进一步研究;另一方面是由于高温条件下,沉积物中微生物呼吸、硝化细菌硝化等作用的增强,对SOD 的影响相对更显著,造成木兰溪感潮河段沉积物SOD 在温度较低时与Fe 含量的相关性更显著[32].
2.4.5 沉积物中Mn 含量对SOD 的影响
木兰溪感潮河段沉积物中Mn 含量分布如图8所示. 从河流到海口,沉积物中Mn 含量呈逐渐减小的变化趋势. Mn 平均含量表现为右岸(1 425 mg/kg)>左岸(1 390 mg/kg)>河道中间(1 259 mg/kg)>养殖区(1 236 mg/kg),其中木兰溪左岸、河道中间、右岸沉积物中Mn 含量分别为1 040~1 593、760~1 587 和1 216~1 570 mg/kg,养殖区沉积物中Mn 含量为1 203~1 267 mg/kg.
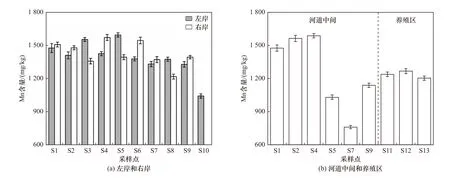
图8 木兰溪感潮河段沉积物中Mn 含量分布Fig.8 Mn content distribution in sediments of Mulan River tidal reach
木兰溪沉积物中Mn 含量对沉积物SOD 的影响与Fe 相似. 当温度为22 ℃时,沉积物SOD 与Mn 含量呈现一定的相关性,从S3 采样点到入海口,左岸沉积物SOD 与Mn 含量的变化趋势基本一致,并且SOD 与Mn 含量的最低点都出现在S10 采样点. 从S4 采样点到入海口,右岸沉积物SOD 与Mn 含量的变化趋势基本一致. 与22 ℃相比,30 ℃时沉积物SOD 与Mn 含量的相关性较差. 这主要是由于温度较低时,底栖生物和微生物的活性较弱,此时Mn2+作为还原性物质耗氧对沉积物总耗氧量的贡献较大,当温度升高后,底栖生物和微生物活性增大,新陈代谢和呼吸作用增强,此时生物耗氧变成了沉积物总耗氧量的主要贡献者,而Mn2+的氧化作用受温度的影响相对较小,其对沉积物总耗氧量的贡献变小[42].
2.4.6 沉积物中S 含量对SOD 的影响
在较深层的沉积物中,含硫有机物的厌氧矿化过程中会生成H2S. 此外,在沉积物剖面上,根据孔隙水中的自由能变化顺序,从上到下形成了O2、NO3——、锰铁氧化物、SO42——和CO2氧化还原序列,在硫酸盐还原层中,SO42——作为电子受体被还原,进一步发生H2S 的累积[57]. H2S 向表层扩散的过程中被氧化,构成沉积物化学耗氧.
木兰溪感潮河段沉积物中S 含量分布如图9 所示. 从河流到海口,沉积物中S 含量呈增加趋势. S 平均含量表现为左岸(3.50×103mg/kg)>河道中间(3.34×103mg/kg)>养 殖 区 (3.34×103mg/kg)>右 岸(3.28×103mg/kg),其中木兰溪左岸、河道中间、右岸沉积物中S 含量分别为2.12×103~4.76×103、1.94×103~6.06×103和2.74×103~3.99×103mg/kg,养殖区沉积物中S 含量为2.75×103~4.08×103mg/kg. 同一断面不同位置沉积物中S 的含量变化较小. 当温度为22 ℃时,沉积物SOD 与S 含量的相关性不明显,而当温度为30 ℃时,沉积物SOD 与S 含量呈一定的相关性,左岸沉积物SOD 与S 含量均在S8 采样点达到最大值,河道中间沉积物SOD 与S 含量在S9 采样点达到最大值,右岸沉积物SOD 与S 含量在S2 采样点达到最小值. 与22 ℃相比,30 ℃时沉积物SOD 与S 含量的相关性更好. 这主要是由于硫氧化细菌在将还原性硫化物氧化为硫酸的过程中消耗大量氧气,30 ℃时硫氧化细菌活性更高[44],从而加大了对SOD的贡献.

图9 木兰溪感潮河段沉积物中S 含量分布Fig.9 S content distribution in sediments of Mulan River tidal reach
3 结论
a) 木兰溪感潮河段沉积物SOD 具有明显的时空分布特征. 高温季节沉积物耗氧严重,夏季沉积物SOD 平均值是春秋季的3.37 倍;上游河流SOD 受化学耗氧影响较大,导致低温季节SOD 由河流到海口呈下降趋势,而海口SOD 受到生物耗氧的影响,高温季节耗氧显著升高,且明显高于上游河流区域;左、右岸沉积物SOD 显著大于河道中间,养殖区的沉积物由于含沙量低且有大量生物,高温季节耗氧速率明显高于其他区域.
b) 木兰溪感潮河段沉积物中耗氧物质分布具有较大差异性. 由河流到海口沉积物中TOC、TN、Fe和Mn 含量呈波动减小的变化趋势,而NH4+-N 和S含量总体上呈增大趋势. SOD 受到耗氧物质分布的影响,低温时Fe 和Mn 对SOD 的影响较大,而高温时TOC、NH4+-N 和S 对SOD 的影响更大.
c) 相关性分析表明,木兰溪感潮河段沉积物SOD 与沉积物中的TOC、TN 和Fe 含量均没有显著的相关关系,22 ℃时的SOD 与沉积物中的Mn 含量存在显著的正相关关系,表明低温季节Mn 对沉积物耗氧具有重要贡献;而30 ℃时的SOD 与沉积物中的NH4+-N 和S 含量存在极显著的正相关关系,表明高温季节NH4+-N 和S 对沉积物耗氧具有重要贡献.
d) 夏季DO 浓度与30 ℃时的SOD 呈显著负相关,表明高温条件下沉积物耗氧对木兰溪感潮河段DO 浓度偏低具有重要影响,但感潮河段DO 浓度偏低问题复杂,除了受到沉积物耗氧影响以外,还受到来水水质、水动力条件等多种因素影响,其影响过程和机制仍需进一步研究.

