超临界CO2 萃取羊肉油脂及其脂肪酸组成的变化
张朵朵, 牛鹏飞, 葛鑫禹, 古明辉, 刘永峰
(陕西师范大学 食品工程与营养科学学院,陕西 西安 710119)
超临界流体萃取 (supercritical fluid extraction,SFE)是以超临界流体(supercritical fluid, SCF)作为萃取剂,在超临界条件下萃取固体或液体中高沸点或热敏性成分的一项新型提取技术[1];其中SCF 是处于超临界温度及压力状态下介于气体与液体之间的流体(常用CO2气体),此时的流体具有气液两重性、高渗透能力、低黏度、低密度及优良的溶解能力。同时,SFE 技术具有操作温度低、工艺简单、高效且无污染的优点,能最大程度保留食品的营养成分[2-3]。 目前,超临界CO2萃取技术已经广泛应用于啤酒生产、蜂产品生产以及色素分离等方面,在油脂提取的生产中主要用于植物油脂的提取,在大豆油、核桃油提取方面已经相对成熟;在动物油脂提取中主要应用于萃取不饱和脂肪酸质量分数较高的油脂,例如深海鱼油等[4-5]。 总之,超临界CO2萃取技术目前主要应用于植物油脂及深海鱼油的提取,鲜少在其他动物油脂中应用。
动物油脂以甘油三酯的形式存在,相较植物油脂有不可替代的香味,能提供极高的热量且含有多种脂肪酸,进入人体后在小肠被分解为甘油和脂肪酸进行消化吸收[6],脂肪酸的质量分数和组成是影响油脂在人体内消化吸收的关键。 动物油脂中的脂肪酸分为3 大类:饱和脂肪酸(satisfied fatty acids,SFA)、 单不饱和脂肪酸 (mono-unsaturated fatty acids, MUFA)和多不饱和脂肪酸(poly-unsaturated fatty acids, PUFA),SFA 质量分数最高可达62.50%,其次是MUFA (质量分数31.25%),PUFA 质量分数仅为6.25%[7]。脂肪酸作为衡量动物油脂品质的一个重要指标,提取方法对其组成和质量分数有很大影响[8],提取温度过高会增加反式脂肪酸质量分数、降低不饱和脂肪酸质量分数,而超临界CO2萃取技术不仅能克服温度过高的问题,也能避免溶剂提取法中有机溶剂残留的问题[9]。 王静等对蚕蛹油脂的超临界CO2萃取工艺进行了优化,在最佳条件下油脂萃取率可达30.53%, 且所得油样中游离脂肪酸较少,不饱和脂肪酸质量分数高[10]。刘俊渤等研究了超临界CO2萃取条件对鹿油萃取率的影响,在最佳萃取条件下,油脂的理化指标和脂肪酸组成的测定结果表明,超临界CO2萃取的鹿油酸价低,含有多种脂肪酸,其中不饱和脂肪酸总质量分数为41.94%[11]。刘程惠等将超临界CO2萃取技术应用于大马哈鱼籽中DHA 和EPA 的提取, 结果表明,DHA 和EPA的提取率可达50%以上[12]。可见,超临界CO2萃取技术有利于保持动物油脂的不饱和脂肪酸质量分数以及营养品质。
超临界CO2萃取在动物油脂提取方面效果明显,且对油脂品质有不同程度的提高。 鉴于此,作者以羊肉为实验材料,采用超临界CO2萃取法提取羊肉油脂, 对比萃取前后羊肉中脂肪质量分数的变化, 主要以脂肪酸的质量分数及组成作为评价指标,探究了超临界CO2萃取法获得的羊肉样品和羊肉油脂的品质,旨在拓展超临界CO2萃取技术在动物油脂提取方面的应用,为实际生产提供理论参考。
1 材料与方法
1.1 材料与试剂
横山羊肉:购自西安市朱雀农贸市场;氯仿、石油醚、三氟化硼、甲醇、正己烷、甲醇、氢氧化钠、氯化钠等分析纯试剂:西安晶博有限公司产品。
1.2 仪器与设备
SFE-2 超临界CO2萃取装置:美国应用分离公司产品;2010 ultra 气质联用仪-单四极杆: 日本岛津公司产品;SZC-D 脂肪测定仪: 上海纤检仪器有限公司产品;RE-52AA 旋转蒸发器: 上海亚荣生化仪器厂产品;HH-4 数显恒温水浴锅:金坛市岸头仪都仪器厂产品。
1.3 样品处理
取冷冻羊肉置于冰箱冷藏室 (3±1) ℃中解冻12 h, 取出后置于室温下完全解冻, 将解冻好的100 g 羊肉用捣碎机捣碎至肉糜状, 取30 g 捣碎肉样,平均分为3 组,用于超临界CO2萃取,其余肉样用于脂肪质量分数和脂肪酸质量分数测定。
1.4 超临界CO2 萃取处理方法
样品分为3 类:未处理肉即未经超临界CO2萃取的羊肉样品;超临界萃取肉即经过超临界CO2萃取后的羊肉样品;超临界萃取油即未处理肉经萃取后收集的羊肉油脂。 采用超临界CO2萃取装置对羊肉脂肪进行萃取, 取10 g 未处理肉放入萃取釜中,密封系统,采用动态萃取方法,萃取温度为40 ℃,压力为25 MPa,萃取时间为120 min,在出口处用锥形瓶接取油脂,即为超临界萃取油;超临界萃取结束后,将萃取釜中的肉取出即为超临界萃取肉。 将超临界萃取肉和超临界萃取油分别称量,并密封于4 ℃保存。 按公式(1)计算羊肉油脂萃取率。
式中:p 为羊肉油脂萃取率,%;m1为超临界萃取油质量,g;m2为未处理肉质量,g。
1.5 脂肪测定方法
1)浸泡、提取 称取3 g 样品置于滤纸筒,用脱脂棉压住样品, 将滤纸筒放入烘好的抽提筒内,加入30 mL 石油醚, 然后将抽提筒移至加热板上,打开冷凝管,调节脂肪提取仪温度为55 ℃,使样品完全置于抽提筒内浸泡2 h,然后将抽提筒升高5 cm,抽提1 h。
2)回收溶剂 抽提结束后将滤纸筒完全提升,同时调节旋塞将冷凝管完全关闭, 进行溶剂回收,回收30 min。
3)烘干、称量 将抽提筒从加热板上取出,置于(105±1) ℃烘箱中烘至恒重,冷却后称取脂肪和抽提筒质量,按公式(2)计算脂肪质量分数。
式中:ω 为样品中脂肪质量分数,g/hg;m0为烘干抽提筒的质量,g;m1为样品质量,g;m2为恒重后脂肪和抽提筒的质量,g。
1.6 脂肪酸的测定
1.6.1 粗脂肪的提取 称取未处理肉、超临界萃取肉各3 g,超临界萃取油0.3 g,分别放入150 mL 锥形瓶,加入60 mL 氯仿-甲醇溶液,充分搅拌,用保鲜膜封口后置于摇床振荡5 h, 振荡结束后放入40 ℃水浴30 min,再加入15 mL 饱和NaCl 溶液,待分层后取上层有机溶剂置于圆底烧瓶中旋转蒸干,每个样品重复3 次。
1.6.2 脂肪的皂化、 甲酯化 向烧瓶中加入6 mL 0.5 mol/L 氢氧化钠-甲醇溶液, 上端连接冷凝管,67 ℃下皂化30 min,当溶液中有油滴漂浮时,加入沸石,从冷凝管上端口加入含有体积分数15%三氟化硼的甲醇溶液5 mL,15 min 后加入3 mL 甲醇,再15 min 后加入2 mL 正己烷,取下烧瓶,加入20 mL 饱和NaCl 溶液,剧烈振荡15 s,继续加饱和NaCl 溶液至瓶颈,待分层后吸取上层溶液放入1.5 mL离心管中,封存于-20 ℃。
1.6.3 脂肪酸气相色谱分析 升温程序:初始温度120 ℃, 保持1 min,8 ℃/min 升到310 ℃, 保持5 min,汽化室温度为260 ℃;进样方式:不分流;载气:氢气[13]。脂肪酸甲酯的相对含量采用面积归一法计算,通过测定相应峰面积占所有峰面积的百分数来计算样品中某个脂肪酸占总脂肪酸的百分比,计算公式如下:
式中: Yi为试样中某个脂肪酸的相对含量,%;Si为测定液中脂肪酸甲酯i 的峰面积;FFAi为脂肪酸甲酯i 转化成脂肪酸的系数;∑Si为测定液中各脂肪酸甲酯的峰面积之和。
1.7 数据处理
所有数据采用Excel 2010 软件对数据进行处理及分析。 采用SPSS 19.0 软件中Duncan’s 多重检验进行差异显著性分析。 利用OriginPro 2015 软件进行相关性分析, 用微生信绘图网站(http://www.bioinformatics.com.cn/plot_basic_corrplot_corrlation_plot_082)绘制相关系数矩阵图。
2 结果与分析
2.1 粗脂肪的测定结果
未处理肉及超临界萃取肉中脂肪质量分数及羊肉油脂萃取率测定结果见表1。 与未处理肉中脂肪质量分数相比,超临界萃取肉中脂肪质量分数减少了19.25%。 此外,根据未处理肉质量和超临界萃取油质量可知,超临界萃取技术对羊肉油脂萃取率可达22.04%。

表1 未处理肉、超临界萃取肉中脂肪质量分数及羊肉油脂萃取率测定结果Table 1 Results of fat mass fraction and extraction rate of mutton fat in untreated meat and SFE-meat
2.2 SFA、MUFA、PUFA 相对含量的测定结果
未处理肉、 超临界萃取肉和超临界萃取油中SFA、MUFA、PUFA 相对含量的测定结果见图1。 未处理肉中SFA 相对含量为48.99%,MUFA 相对含量为50.50%,PUFA 相对含量仅为0.52%。超临界萃取肉中SFA 相对含量较未处理肉显著降低 (P<0.05)了11.37%,超临界萃取油中SFA 相对含量与未处理肉无显著差异 (P>0.05)。 超临界萃取肉的MUFA 相对含量显著高于未处理肉(P<0.05),提高了9.20%,而超临界萃取油中MUFA 相对含量与未处理肉无显著差异(P>0.05)。未处理肉、超临界萃取肉和超临界萃取油之间PUFA 相对含量无显著差异(P>0.05)。 说明超临界萃取处理可显著降低超临界萃取肉中SFA 的相对含量,也可显著提高MUFA 相对含量,对PUFA 相对含量无明显影响。
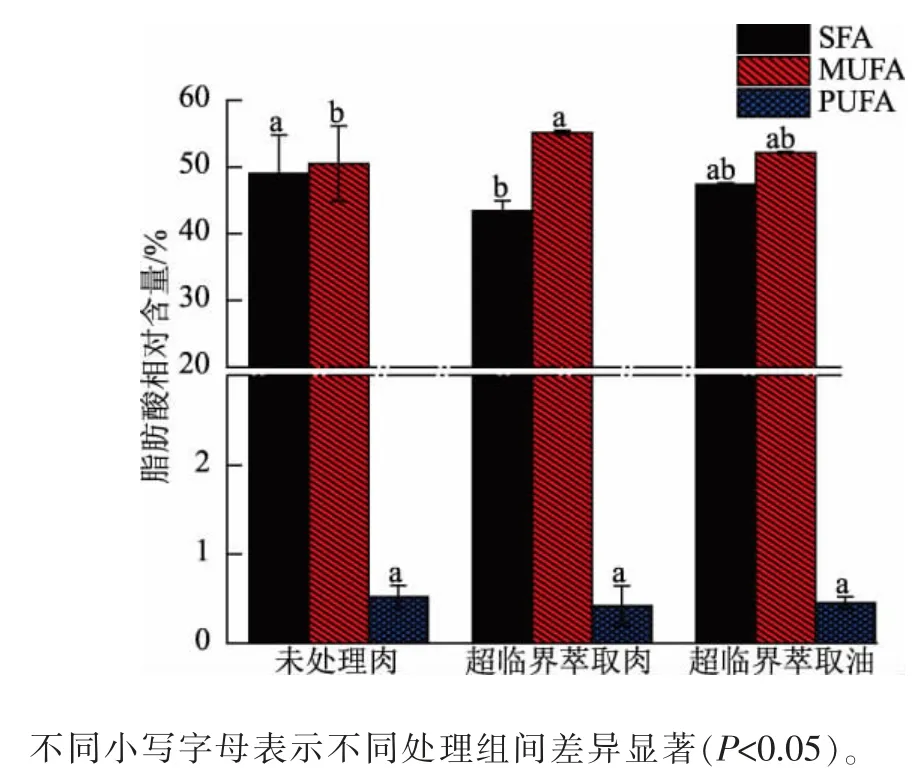
图1 未处理肉、 超临界萃取肉和超临界萃取油中脂肪酸的相对含量Fig. 1 Mass fraction of fatty acids in untreated meat,SFE-meat and SFE-fat
未处理肉、超临界萃取肉和超临界萃取油中各脂肪酸相对含量比值见图2。 未处理肉中P/S 为0.01,M/S 为1.03; 且3 个样品P/S 值无显著差异(P>0.05), 比值均远小于膳食指南建议的比值1[13]。超临界萃取肉的M/S 值显著高于未处理肉 (P<0.05),且其M/S 值最接近膳食指南的4∶3[14];超临界萃取油的M/S 值与未处理肉无显著差异(P>0.05)。
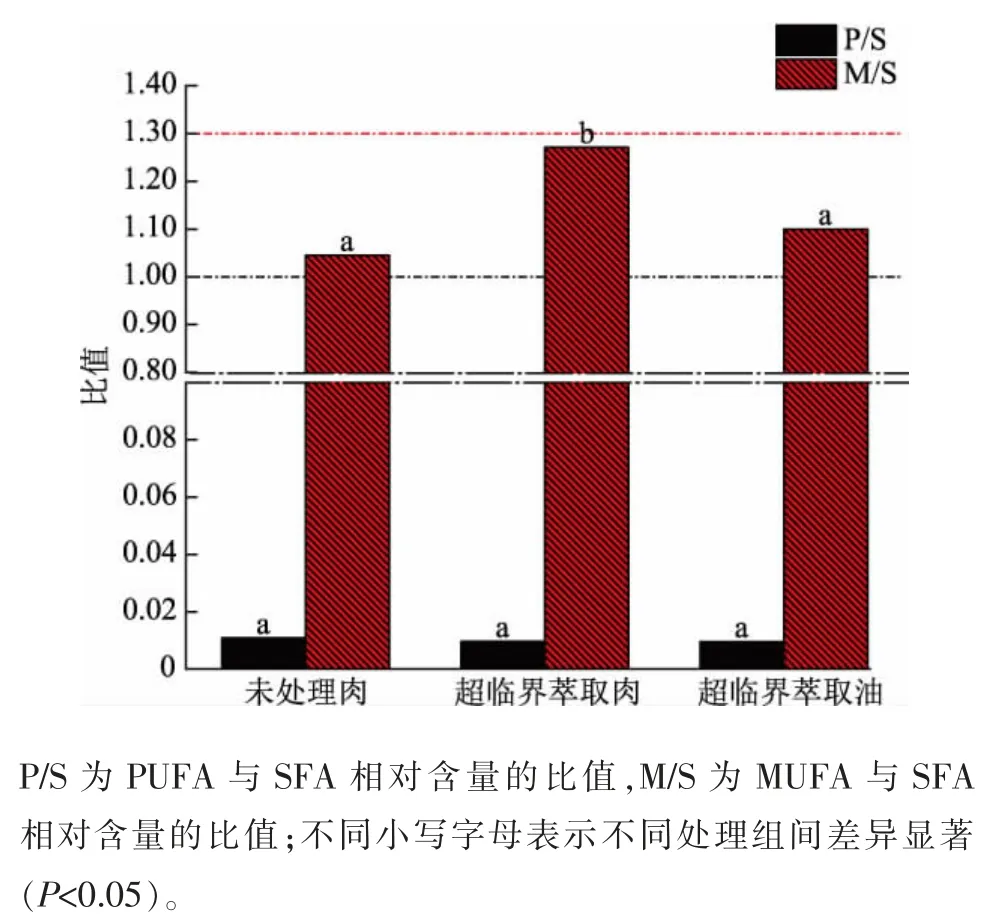
图2 未处理肉、 超临界萃取肉和超临界萃取油中的脂肪酸比值Fig. 2 Proportion of fatty acids in untreated meat, SFEmeat and SFE-fat
2.3 脂肪酸相对含量的测定结果
在相同的GC-MS 条件下,未处理肉、超临界萃取肉及超临界萃取油中脂肪酸种类相同,分别是羊蜡酸(C10∶0)、月桂酸(C12∶0)、十三烷酸(C13∶0)、肉 豆蔻油酸(C14∶0)、十五烷酸(C15∶0)、棕榈酸(C16∶0)、珠 光脂酸(C17∶0)、硬脂酸(C18∶0)、棕榈油酸(C16∶1cis-9)、十七烯酸(C17∶1cis-10)、油酸(C18∶1cis-9)、亚油酸(C18∶2cis-9,12)和共轭亚油酸(C18∶2cis-9,trans-11),其中SFA 为8 种,MUFA 为3种,PUFA 为2 种。 并且,在未处理肉、超临界萃取肉、超临界萃取油中检测出的脂肪酸种类与高天丽[15]、古明辉[16]等在羊肉中的检测结果基本一致。
未处理肉、超临界萃取肉及油中SFA 测定结果见表2。8 种SFA 中棕榈酸相对含量最高,超临界萃取肉和油的棕榈酸相对含量显著高于未处理肉(P<0.05), 超临界萃取肉中棕榈酸相对含量最高,为54.18%。 除棕榈酸外,硬脂酸相对含量最高,且两个处理组硬脂酸相对含量显著高于未处理肉(P<0.05),超临界萃取油中硬脂酸相对含量最高, 为23.94%。SFA 中十三烷酸相对含量最低,且3 组之间无显著差异(P>0.05)。与未处理肉相比,超临界萃取能够显著增加肉和油中棕榈酸和硬脂酸的相对含量。
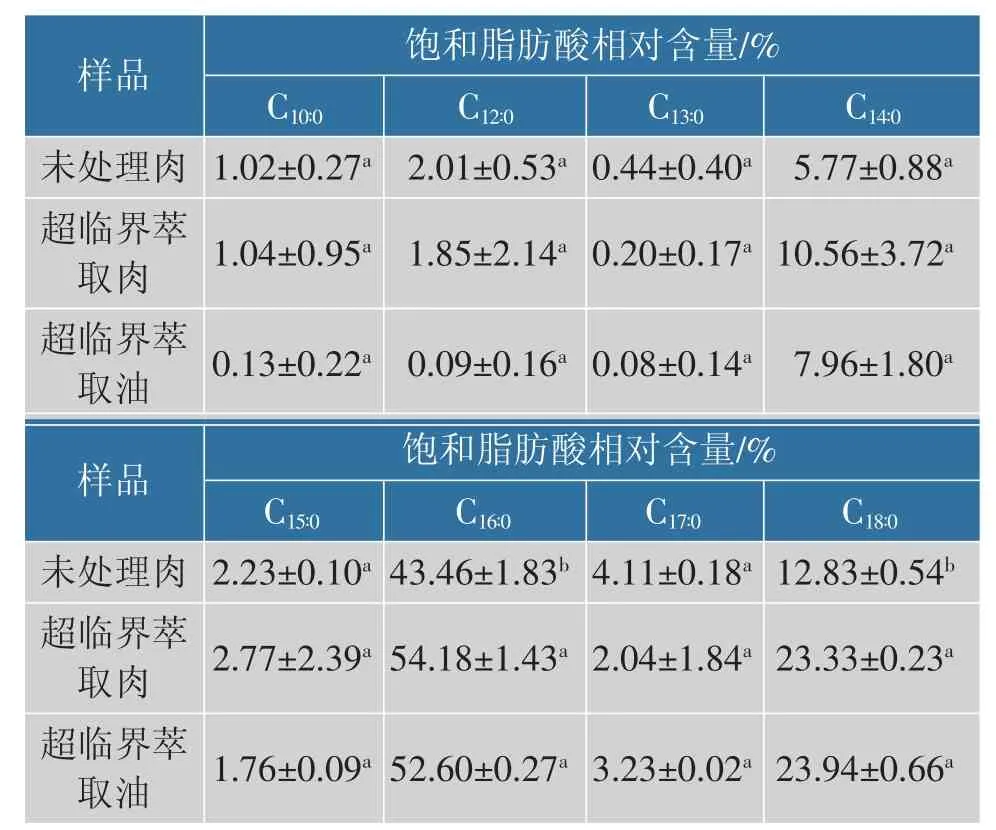
表2 未处理肉、 超临界萃取肉和超临界萃取油中饱和脂肪酸的相对含量Table 2 Relative content of saturated fatty acids in untreated meat, SFE-meat and SFE-fat
未处理肉、 超临界萃取肉及超临界萃取油中MUFA 测定结果见表3。 在未处理肉中油酸相对含量最高,为19.53%,而经过超临界处理后油酸相对含量显著降低(P<0.05),在超临界萃取肉和超临界萃取油中相对含量仅为1%以下。 与未处理肉相比,超临界萃取肉和超临界萃取油中棕榈油酸相对含量显著提高(P<0.05),与未处理肉相比分别提高了61.00%和70.10%。 与未处理肉相比,超临界萃取肉和油中十七烯酸的相对含量显著降低(P<0.05)。 以上结果说明超临界处理对各种MUFA 的相对含量都有显著影响,并且超临界萃取肉和超临界萃取油中均未检测到反式油酸(C18:1trans-9),这说明超临界萃取不会增加反式脂肪酸。
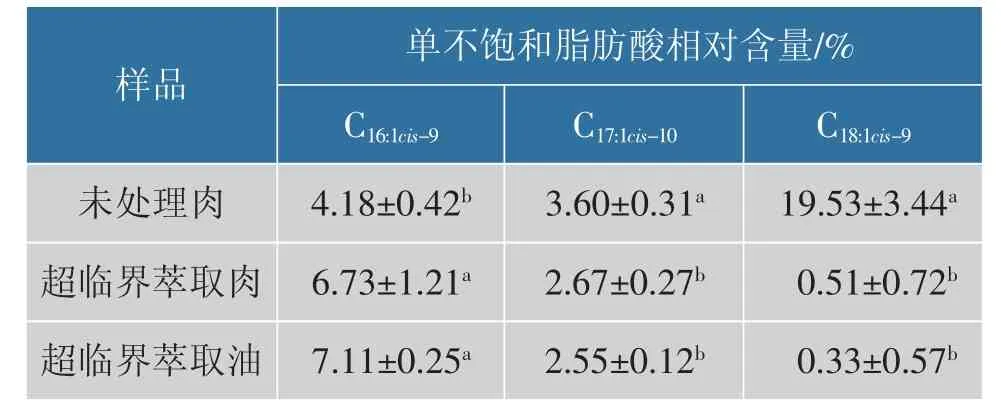
表3 未处理肉、 超临界萃取肉和超临界萃取油中单不饱和脂肪酸的相对含量Table 3 Relative content of monounsaturated fatty acids in untreated meat, SFE-meat and SFE-fat
未处理肉、 超临界萃取肉及超临界萃取油中PUFA 的测定结果见表4。 在超临界萃取肉和超临界萃取油中均未能检测出亚油酸,但与未处理肉相比,亚油酸相对含量无显著差异(P>0.05)。 3 组间共轭亚油酸相对含量无显著差异(P>0.05),说明超临界处理对共轭亚油酸相对含量无显著影响。 此外,在脂肪酸相对含量测定中,粗脂肪提取本身就是一种提取脂肪的方法,因此在测定超临界萃取肉中脂肪酸时已经是第二次提取脂肪。 CO2在超临界状态下进入羊肉组织中将脂肪提取出来,此时羊肉内部结构可能会变得不紧致,排列松散,测定脂肪酸时再对羊肉中的脂肪进行提取,由于羊肉内部结构的变化可能会使羊肉脂肪提取更完全,这可能是造成超临界萃取肉和未处理肉中SFA、MUFA 相对含量差异较大的原因。
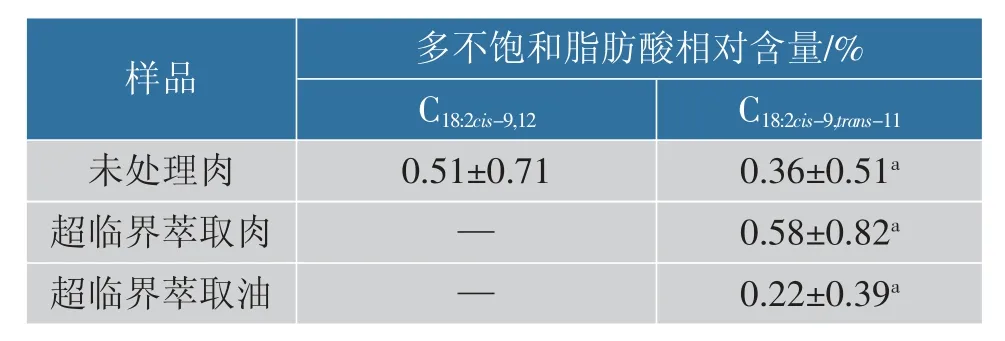
表4 未处理肉、 超临界萃取肉和超临界萃取油中多不饱和脂肪酸的相对含量Table 4 Relative content of polyunsaturated fatty acid in untreated meat, SFE-meat and SFE-fat
2.4 脂肪酸相关性分析
13 种脂肪酸之间的相关性分析如图3 所示。图中圆的不同颜色代表各脂肪酸间相关系数从-1 到1,圆的大小代表相关系数的绝对值大小,圆越大相关系数的绝对值越大,即越接近1,代表各脂肪酸间相关性越大,每个圆上的数字表示两种脂肪酸间的相关系数,正值代表正相关,负值代表负相关。 肉豆蔻油酸(C14:0)、棕榈酸(C16:0)、硬脂酸(C18:0)和棕榈油酸(C16:1cis-9)中任意两种呈正相关;十七烯酸(C17:1cis-10)、油酸(C18:1cis-9)和共轭亚油酸(C18:2cis-9,trans-11)中任意两种呈正相关;肉豆蔻油酸(C14:0)、棕榈酸(C16:0)、硬脂酸(C18:0)和棕榈油酸(C16:1cis-9)中的任意一种与十七烯酸(C17:1cis-10)、油酸(C18:1cis-9)和 共 轭亚油酸(C18:2cis-9,trans-11) 中的任意一种呈负相关; 十五烷酸(C15:0)和亚油酸(C18:2cis-9,12)呈正相关,而这两种脂肪酸与上述所说的7 种脂肪酸均无明显相关性,这说明在超临界CO2萃取过程中这两种脂肪酸相对含量稳定,即超临界处理对十五烷酸(C15:0)和亚油酸(C18:2cis-9,12)不会产生影响,这与显著性分析的结果相一致。
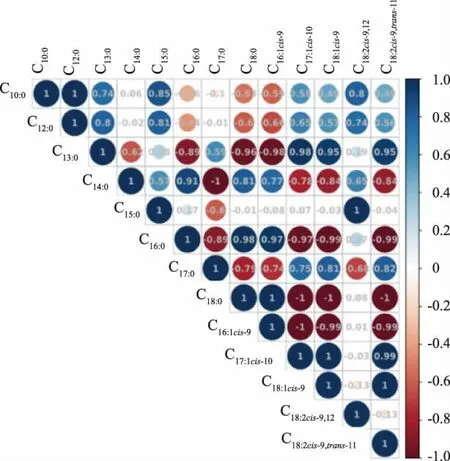
图3 未处理肉、超临界萃取肉和超临界萃取油中13 种脂肪酸相对含量的相关性分析Fig. 3 Correlation analysis of the relative content of 13 fatty acids in untreated meat, SFE -meat, and SFE-fat
2.5 讨论
传统提取动物油脂的方法有蒸煮法、溶剂法和索氏提取法等。 目前关于超临界萃取技术应用于羊肉脂肪提取的研究鲜有报道,该研究所获的提取率对于肉类以及动物组织脂肪的提取具有一定的参考价值。 陈颖娣等分别用索氏提取法、 超临界CO2萃取法和微波提取法对蚕蛹油进行提取,并对比了3 种方法下的蚕蛹油提取率及油脂品质, 结果发现超临界CO2萃取法的萃取率最高, 可达31.43%,且萃取的油脂不会有溶剂残留[17]。 林春梅等探究了超临界CO2萃取蚕蛹油的最佳工艺条件,结果发现在最佳萃取条件下蚕蛹油的萃取率为19.20%[18]。 该研究中羊肉油脂萃取率与陈颖娣、林春梅等的蚕蛹油萃取率有差异,这可能是由于样品本身的差异造成的,但总体上萃取率相差不大,这进一步说明了超临界CO2萃取在羊肉油脂提取中具有可行性。
通过进一步的脂肪酸分析发现,超临界萃取肉中SFA 较未处理肉变化明显,棕榈酸、硬脂酸的相对含量显著提高, 但整体SFA 相对含量显著下降。有研究表明,棕榈酸和硬脂酸为羊肉中相对含量较高的SFA[19-20],SFA 在人体中具有潜在的生理功能,但一般认为摄入过多的SFA 会使血液中胆固醇含量升高,而硬脂酸是SFA 中一个特殊的存在,硬脂酸在体内可以转换为油酸,不会影响血液中胆固醇的含量[20-21]。 研究发现膳食中棕榈酸能降低血清中胆固醇的含量[22]。 因此,与未处理肉相比,超临界萃取肉中SFA 的质量分数和组成更符合营养健康需求。
超临界萃取肉中MUFA 相对含量较未处理肉显著提高,虽然超临界萃取油中MUFA 相对含量无显著变化,但其中棕榈油酸相对含量显著提高。 近年来已经有研究证实MUFA 具有与PUFA 相同的降低血液中胆固醇的效果[23],并且流行病调查显示,日常膳食摄入MUFA 相对含量较高的人群患冠心病概率较低[14],且其中棕榈油酸已经被证实具有改善肥胖症、糖尿病和抗炎等多种生理功能[24]。高温是产生反式脂肪酸的重要原因[25],超临界CO2萃取的温度远低于产生反式脂肪酸的温度,相较于其他提取油脂的方法,萃取温度低是超临界CO2萃取的一大优势, 可以减少萃取过程中反式脂肪酸的生成。已有研究发现反式脂肪酸与心血管疾病的关联性要远大于SFA[26-28],反式脂肪酸不仅会导致心血管疾病,还会诱发阿尔兹海默症,影响肝组织结构,增加患糖尿病的风险[29-30]。 因此,与未处理肉相比,超临界萃取肉和超临界萃取油的品质都得到了提高,且可降低有害物质的产生。
超临界萃取肉和油中均未检测出亚油酸,这可能是由于亚油酸中的不饱和双键不稳定,在超临界状态下亚油酸转变成共轭亚油酸。 共轭亚油酸是另一类重要的脂肪酸,同时含有共轭双键和反式双键[31],使其具有抗肿瘤、抗动脉粥样硬化、预防糖尿病等作用[32]。 超临界CO2萃取技术并没有显著降低超临界萃取肉和油中PUFA 相对含量,这表明超临界CO2萃取技术不会破坏羊肉中的PUFA。
3 结 语
通过超临界CO2萃取技术对羊肉进行处理并对其脂肪质量分数及脂肪酸组成进行研究。 结果表明羊肉油脂的萃取率可达22.04%,未处理肉中SFA和MUFA 的相对含量接近,远大于PUFA。超临界萃取肉和超临界萃取油与未处理肉中脂肪酸差异较大,超临界处理可改变羊肉中部分脂肪酸组分的相对含量, 使超临界萃取肉中SFA 相对含量显著降低,MUFA 相对含量显著升高,对PUFA 相对含量无明显影响。 而超临界萃取对油中SFA、MUFA 和PUFA 三者的相对含量无显著影响, 但其中棕榈油酸的相对含量显著增加;且超临界处理不会增加反式脂肪酸。 因此,超临界CO2萃取技术可以应用于羊肉油脂的提取,并且对羊肉和羊肉油脂的脂肪酸相对含量及组成有改善作用。 该研究对于超临界CO2萃取技术在动物油脂中的应用具有一定的指导意义。

