肝硬化胃食管静脉曲张内镜治疗后3 年内发生再出血事件的危险因素分析与风险预测模型的建立研究
程浩,周金池,刘喜,康林,范阿慧,窦维佳*,刘震雄*
胃食管静脉曲张是肝硬化患者常见的并发症之一,一旦破裂出血病情进展迅猛,出血量大,死亡率高,所以要对曲张的静脉进行及时干预。内镜治疗因其创伤小、疗效明显等优势已成为诸多患者首选的治疗方式,并被国内外指南和共识推荐为一线方案[1-4],但是内镜治疗后仍有较高概率发生再出血事件,且再出血量更大,死亡率更高,严重影响患者生存期[5-8]。所以探明内镜治疗后再出血的相关危险因素,对于再出血的预防、鉴别高危患者、提升生存率很有必要。目前大部分学者对再出血危险因素的探索多聚焦于早期的再出血[9-14],关于晚(后)期的再出血研究较少,研究时间多局限于治疗后1 年内,且一些结论存在差异和矛盾[15-18],本课题组在临床上发现此类患者在治疗后的3 年中仍有概率发生再出血事件。所以,本研究采用回顾性分析的方法对多中心内镜治疗后3 年内发生再出血事件的患者进行病例数据搜集和整理分析,探索肝硬化胃食管静脉曲张内镜治疗后晚(后)期出现再出血事件的独立危险因素,并构建Nomogram 风险预测模型,以期为我国肝硬化胃食管静脉曲张患者接受内镜治疗后减少再出血事件的发生提供研究数据和基础。
1 对象与方法
1.1 纳入与排除标准 纳入标准:(1)年龄16~85 周岁;(2)肝硬化诊断明确(诊断依据见1.3);(3)本次或既往内镜检查确诊胃底和/或食管静脉曲张;(4)急诊或择期接受内镜治疗;(5)患者内镜治疗后复查提示静脉曲张达到治疗显效或以上程度(即复查内镜发现处理的曲张静脉形态在中度以下,且红色征阴性以上的程度)。排除标准:(1)年龄<16 岁或>85 岁;(2)非肝硬化导致的胃食管静脉曲张(如单纯布加综合征、门静脉海绵样变性等);(3)伴有严重感染,如高热、腹膜炎、重症肺炎、菌血症、败血症等;(4)患者在接受内镜治疗前已行其他治疗,如手术、介入等;(5)合并血液系统疾病、恶性肿瘤等对观察指标存在影响的疾病;(6)全身多器官功能衰竭。
1.2 研究对象 收集中国人民解放军空军军医大学唐都医院、中国人民解放军空军军医大学西京医院消化内科2011—2022 年因肝硬化胃食管静脉曲张行内镜下治疗的患者病例资料,最终纳入403 例患者资料进行回顾性分析。其中男274 例,女129 例;年龄17~85 岁,平均年龄(51.1±11.3)岁。根据患者接受内镜治疗后3年内是否发生再出血事件,分为再出血组(n=151)和对照组(n=252)。
1.3 肝硬化诊断依据[19]满足下列4 条之一:(1)病理活检结果符合肝硬化改变。(2)内镜显示胃食管静脉曲张或消化道异位静脉曲张,除外非肝硬化性门脉高压。(3)B 超、肝脏硬度测定(liver stiffness measurement,LSM)或CT 等影像学检查提示肝硬化或门脉高压特征:如脾大、门静脉内径≥1.3 cm,LSM测定符合不同病因的肝硬化诊断界值。(4)无病理学、内镜或影像学结果的患者,以下检查指标异常提示存在肝硬化(需符合4 条中2 条):①血小板计数<100×109/L,且无其他原因可以解释;②血清白蛋白<35 g/L,排除营养不良或肾脏疾病等其他原因;③国际标准化比值>1.3 或凝血酶原时间延长(停用溶栓或抗凝药7 d 以上);④天冬氨酸氨基转移酶/血小板计数比率指数(APRI)评分>2 分。
1.4 再出血标准 患者在接受内镜治疗后出现有临床意义的活动性出血事件〔包括呕血、黑便或便血或收缩压降低>20 mmHg(1 mmHg=0.133 kPa)或心率增加>20 次/min;在没有输血的情况下血红蛋白下降>30 g/L〕[3]或内镜下能观察到的活动性出血、白色血栓或凝附在曲张静脉上的血凝块。
1.5 观察指标 利用医院病历系统翻阅并记录肝硬化患者首次接受内镜治疗之前最近一次的实验室检查指标:包括血红蛋白、血小板计数、血清白蛋白、白球比、血清钠离子、血清总胆红素、凝血酶原时间、国际标准化比值等。整理患者接受内镜治疗前的基本情况:包括性别、年龄、肝硬化病因、合并高血压、糖尿病情况、吸烟情况(吸烟定义为:患者既往有吸烟史,且在接受第一次内镜治疗时仍在吸烟)。记录患者接受治疗前的各项辅助检查:包括CT 或腹部超声明确的腹腔积液、门静脉内径以及门静脉血栓情况。记录患者接受内镜治疗时的具体信息:包括治疗时间、治疗方法、镜下红色征情况、镜下表现等。记录患者住院号或ID 号方便日后随访和查找。
1.6 统计学方法 利用SPSS 20.0 统计软件对两组数据进行统计分析。符合正态分布的计量资料以(±s)表示,两组间比较采用独立样本t 检验;不符合正态分布的计量资料以M(P25,P75)表示,两组间比较采用非参数检验;计数资料以相对数表示,组间比较采用χ2检验。根据以上统计学方法,对纳入的两组病例数据进行单因素差异分析,有统计学意义的观察指标即可能为事件的相关因素(以P<0.05 为差异有统计学意义)。再将这些可能的相关因素进行非条件多因素Logistic 回归分析(酌情将纳入变量的P 值放宽至0.1,避免漏掉重要变量),寻找肝硬化胃食管静脉曲张内镜治疗3 年内发生再出血事件的独立危险因素。
1.7 Nomogram 预测模型建立方法 采用R 4.0.3(https://www.r-project.org/,The R Foundation)进行数据分析。在数据集中建立逻辑回归模型(lrm 模型,rms包)评价模型性能,包括受试者工作特征(ROC)曲线下面积(AUC)、灵敏度、特异度等,并绘制列线图展示模型结果。一般认为AUC 0.70~0.80 区分度中等,AUC>0.80 区分度较高;模型验证内容包括校准度和区分度验证。模型校准度验证采用校准曲线,校准曲线图横坐标代表预测值,纵坐标代表实际值,图中对角线为参考线(apparent),代表预测值=实际值,校准曲线1(ideal)为实际校准曲线,校准曲线2(Bias-corrected)为经BS 1 000 次矫正所得。如果校准曲线1 和校准曲线2 接近对角线,说明预测值和实际值接近,校准度较好;模型区分度验证采用ROC 曲线。
2 结果
2.1 肝硬化胃食管静脉曲张患者接受内镜治疗后3 年内发生再出血危险因素的单因素分析 再出血组和对照组性别、年龄、高血压、糖尿病、肝硬化病因、血小板计数、白球比、凝血酶原时间比较,差异均无统计学意义(P>0.05);两组吸烟、腹腔积液、镜下红色征阳性、门静脉血栓、门静脉内径、血红蛋白、白蛋白、总胆红素、钠离子水平、D-二聚体、国际标准化比值比较,差异均有统计学意义(P<0.05),见表1。
2.2 肝硬化胃食管静脉曲张患者接受内镜治疗后3 年内发生再出血的多因素Logistic 回归分析 利用Logistic回归模型纳入单因素分析中P<0.1 的因素进行多因素分析,即纳入吸烟情况(赋值:否=0,是=1)、门静脉血栓(赋值:阴性=0,阳性=1)、门静脉内径(赋值:实测值)、腹腔积液(赋值:阳性=1,阴性=0)、血红蛋白水平(赋值:实测值)、血清白蛋白水平(赋值:实测值)、白球比(赋值:实测值)、总胆红素(赋值:实测值)、血小板计数(赋值:实测值)、血清钠离子水平(赋值:实测值)、D-二聚体(赋值:实测值)、国际标准化比值(赋值:实测值)、镜下红色征表现(赋值:阴性=0,阳性=1)为自变量,以是否发生再出血为因变量(赋值:对照组=0,再出血组=1)进行多因素分析,结果显示,吸烟、门静脉内径、血清钠离子水平、镜下红色征是肝硬化胃食管静脉曲张接受内镜治疗后3 年内发生再出血的影响因素(P<0.05)。D-二聚体的结局指标亦有统计学意义,但其OR 值接近于1(OR=1.001),暂不将其定为相关因素。本次构建的Logistic 回归模型经Hosmer-Lemeshow 检验,P=0.850>0.05(表2)。
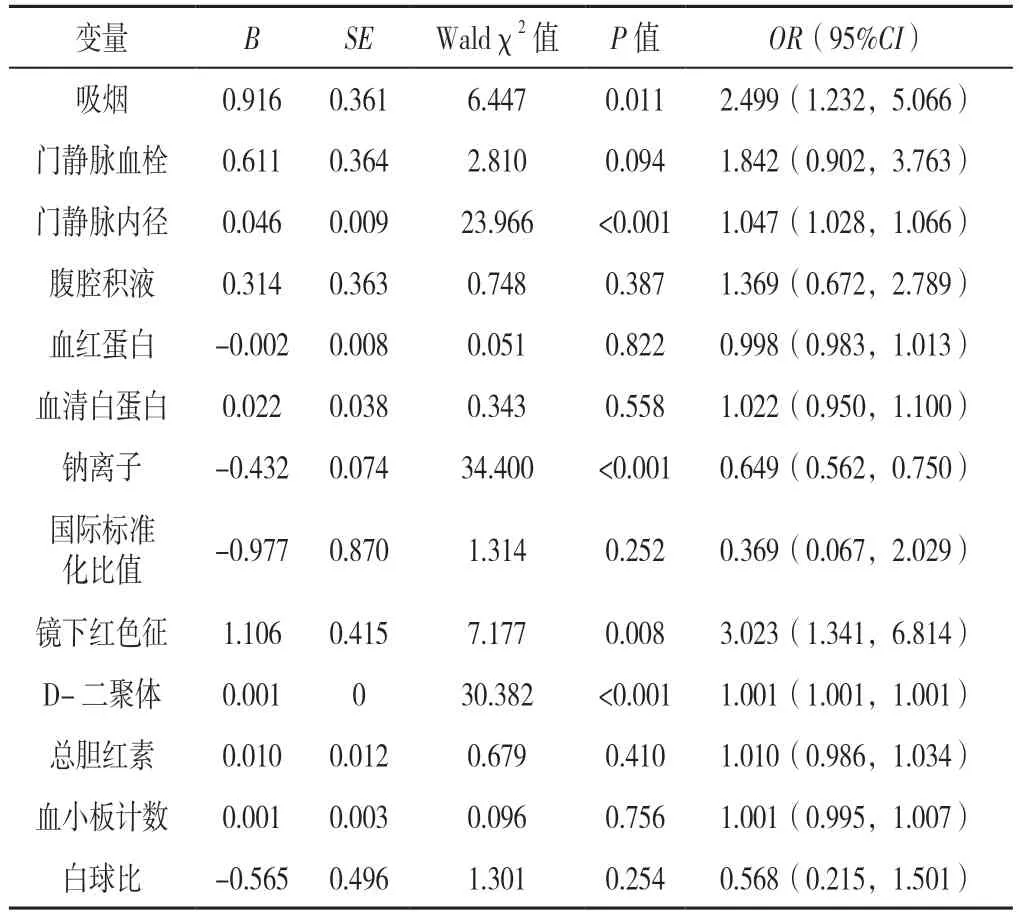
表2 肝硬化胃食管静脉曲张患者接受内镜治疗后3 年内发生再出血危险因素的多因素Logistic 回归分析Table 2 Multivariate Logistic regression analysis of risk factors associated with rebleeding within 3 years after endoscopic treatment in cirrhotic patients with gastroesophageal variceal hemorrhage
2.3 肝硬化胃食管静脉曲张患者接受内镜治疗后3 年内发生再出血的Nomogram 预测模型的建立与评估 将多因素Logistic 回归分析得到的独立影响因素数据导入R 软件,输入相应的R 语言代码,构建Nomogram 列线图风险预测模型(图1),提示:构建的肝硬化胃食管静脉曲张患者接受内镜治疗后3 年内发生再出血的列线图预测模型拟合优度良好。预测模型的AUC 为0.900〔95%CI(0.876,0.929)〕,灵敏度为0.927,特异度为0.750(图2)。校准曲线1 和2(BS 1 000 次)与对角线接近,校准度较好(图3)。表明模型的预测价值较高。

图1 肝硬化胃食管静脉曲张患者接受内镜治疗后3 年内发生再出血的Nomogram 列线图Figure 1 Nomogram risk prediction model of rebleeding within 3 years after endoscopic treatment in cirrhotic patients with gastroesophageal variceal hemorrhage

图2 肝硬化胃食管静脉曲张患者接受内镜治疗后3 年内发生再出血列线图预测模型的ROC 曲线Figure 2 ROC curve of the nomogram risk prediction model of rebleeding within 3 years after endoscopic treatment in cirrhotic patients with gastroesophageal variceal hemorrhage

图3 肝硬化胃食管静脉曲张患者接受内镜治疗后3 年内发生再出血列线图预测模型的校准曲线Figure 3 Calibration curve of the nomogram risk prediction model of rebleeding within 3 years after endoscopic treatment in cirrhotic patients with gastroesophageal variceal hemorrhage
3 讨论
在失代偿期肝硬化中,由于患者门静脉压力升高而导致的胃食管静脉曲张是临床上常见的并发症。胃食管静脉曲张在60%~90%的失代偿性肝硬化病例中发现,其中30%的病例会发生急性破裂出血事件,出血量大,且死亡率高,所以积极干预和控制肝硬化患者的静脉曲张很有必要。目前在临床上,医疗人员可以选择药物干预、内镜下操作、介入以及手术等治疗方案。内镜治疗因为其创伤小、便于开展、疗效显著等优势,已经成为大部分肝硬化胃食管静脉曲张患者的首选治疗方案,国内外指南也将内镜治疗推荐为一线治疗方案[1-4,19-20]。近些年,内镜下各项治疗方法的发展和创新,衍生出内镜下套扎术(EVL)、内镜下硬化剂注射术(EIS)等基础治疗方案以及球囊导管逆行静脉闭塞术(BRTO)、透明帽辅助EIS 等新兴治疗方案和联合序贯治疗等,均有各自的优势。尽管内镜治疗肝硬化患者的静脉曲张有很多优势,患者在接受内镜治疗后仍会发生不可避免的再次出血[4]。KIM 等[21]观察到采用内窥镜下治疗静脉曲张的患者,有17.8%和26%在其接受内镜治疗后的1 年内和3 年内发生再出血。同时EVL 作为国内外指南推荐的一线治疗方案,有研究发现患者治疗后仍有17%~25%发生再次出血(随访34 个月)[22]。所以内镜治疗肝硬化胃食管静脉曲张不论是早期或是晚期均有发生再次出血的可能,而内镜治疗后的再出血常伴随更高的死亡率[19]及更差的预后,所以各指南在静脉曲张治疗后强调再出血的二级预防。探究内镜治疗后再出血的危险因素对提升患者的生存率和预后有重要作用。
血清钠离子水平降低在晚期硬化患者中常见,尤其是并发严重腹腔积液的患者。KIM 等[23]研究显示,约有47.9%的失代偿期肝硬化患者会出现低钠血症,同时他们发现与血清钠离子水平≥136 mmol/L 的患者相比,低钠血症的严重程度更高,尤其是降至130 mmol/L 以下时,患者发生大量胸腹腔积液、肝肾综合征等严重并发症的概率更高。有许多国内外科研人员[24-26]对失代偿期肝硬化患者出现的钠离子水平的波动进行病理生理学的探索。国外学者[25-26]更倾向于用高容量低渗性低钠血症来解释,其在诱导门静脉高压症的动物实验中发现,一氧化氮(NO)的浓度增加,其具有强大的血管扩张作用;门静脉高压症患者的NO 也增加。由于NO增加的血管扩张作用和这些患者的有效循环血量较低,尽管存在低渗环境,但在气压感受器的调解下,抗利尿激素的分泌得到了促进。抗利尿激素水平的增加降低了水的排泄,导致了高容量低渗性低钠血症的发生。截至目前,尚未发现有研究探索血清钠离子水平对发生再出血影响机制。笔者经过讨论认为钠离子作为Na+-K+-ATP 酶的底物,其水平的变化会对血小板的Na+-K+-ATP 酶活性产生影响,而有研究证明Na+-K+-ATP 酶参与了血小板的促凝血反应的过程[27],故笔者猜测血清钠离子水平可能通过影响Na+-K+-ATP 酶的活性而影响血小板的凝血功能,进而影响患者的再出血事件的发展。同时凝血因子Ⅶa 和Ⅸa 上存在钠离子的即结合位点,通过与钠离子结合发挥凝血作用[28-29],而血清中钠离子水平的下降会下调两种凝血因子的功能,进而会对患者的再出血事件发挥一定的促进作用。失代偿期肝硬化患者低钠血症的治疗仍然是一个挑战。这一过程多是慢性的,血清钠随着肝硬化的发展而逐渐下降,所以在早期再出血的影响不明显[30]。血清钠离子水平的急性下降通常由急性失血的低血容量状态导致,故低血容量性低钠血症可以通过适当的容量复苏和利尿剂来治疗。慢性低钠血症患者应考虑接受治疗的血清钠离子临界浓度尚不清楚,但是AHLUWALIA 等[31]发现,不仅对再出血有所影响,血清钠离子的下降与肝硬化患者认知能力受损和健康相关的生活质量不佳也有关。低钠血症甚至会对中枢神经系统产生影响,血清钠离子的下降会造成神经细胞的细胞外液晶体渗透压下降,使水向神经细胞内移动,导致脑细胞水肿,加重肝昏迷患者的病情。作为晚(后)期的独立危险因素,及时纠正降低血清钠离子水平非常必要。也提醒医务人员在救治这类患者的过程中要把握好晶体液和胶体液的用量,在应用利尿剂和进行腹腔抽液时要密切关注血清钠离子水平的变化。
当失代偿期肝硬化患者门静脉压力持续升高时,消化道黏膜下部分曲张的小静脉丛其管壁所承受的压力亦随之升高,导致管壁的上皮结构发生破坏,管壁变薄,但尚未破裂出血,即形成镜下红色征。我国的专家共识将镜下红色征表现明确为急性破裂出血事件发生的主要危险因素,考虑到镜下红色征的出现是门静脉高压的结果,故红色征可从侧面反映门静脉压力的情况,镜下红色征的颜色愈深、范围愈广,代表门脉高压愈严重[4]。本课题组认为初次治疗时红色征阳性代表门静脉压力已升高到一定程度,而肝硬化患者的门静脉压力会随时间成进行性恶化,所以将红色征纳入为独立的危险因素,有助于临床医生及时辨别再出血的高危患者,及时采取措施,加强这一类患者的管理,有助于降低患者的死亡风险。研究人员通常用肝静脉楔入压和游离压之差,即肝静脉压力梯度(HVPG)来反映门静脉压力情况,用以明确肝硬化的进展程度。但作为一项有创性检查,患者易出现感染,且所需费用不低,导致HVPG 监测很难在基层医疗单位开展[32],所以可以从临床上易得到的一些检查指标来推测门静脉压力情况。相对于内镜下红色征表现等,门静脉内径宽度在反映门静脉压力上更加直观,因为随着门静脉压力的升高,门静脉内径也会随之增宽,所以作为内镜治疗后3 年内发生再出血事件的独立危险因素,门静脉内径增宽的患者应更加注意,其不仅是反映再出血的风险,在预测门静脉压力,评估失代偿肝硬化病情方面也有一定意义。
在日常生活中,烟草仍然被广泛使用。石颖等[33]发现吸烟与经皮冠状动脉介入(PCI)术后患者的出血时间明显相关。一项纳入99 359 人的前瞻性队列研究发现吸烟者发生任何大出血以及颅内、气道、胃肠道和泌尿系统出血的风险均会增加,同时吸烟强度的增加也与大出血的风险增加有关[34]。从机制上讲,吸烟可能导致脆弱的血管容易破裂,从而导致出血,烟草中含有数千种化学物质,其中包括大量的毒素[35]。这些毒素可以通过促进自由基的发展对血管壁造成结构性损伤,这种损伤可能是短暂的,也可能是长期的。同时,吸烟已被证明会导致损害内皮细胞的NO 产生,导致血管破裂和出血。本研究发现吸烟是患者接受内镜治疗后3 年内发生再出血的独立危险因素,而多数关于早期再出血的研究[9,13,36-38]未发现吸烟的影响。本课题组认为不同的时间段,吸烟对再出血的影响有所不同,经过讨论认为吸烟对侧支循环管腔壁的损害是一个慢性的过程,吸烟随着时间的积累,烟草中的各种毒素会逐渐积累,而所产生的自由基和NO 也会随着吸烟而增加,并不断对静脉的管壁和内皮细胞产生刺激性伤害,而患者也会随着吸烟时间的延长,其再出血的风险随之增高,所以在患者接受内镜治疗后的晚期,吸烟成为其再出血事件发生的独立危险因素。故在临床上,应建议吸烟的患者戒烟,可以降低其内镜治疗后中晚期的再出血率,在后期的二级预防中,戒烟显得极为重要。
本研究存在一定的局限性,首先,本研究收集的样本数据取材于医院,样本量有限,存在一定的选择偏倚;其次,本研究采用的回顾性分析,其他可能与结局相关的因素如生活方式等未被纳入;再次,构建的Nomogram 预测模型虽指标较好,但属于内部验证,故本课题组计划下一步扩充样本量,增加自变量因素,并进行前瞻性研究,同时在另一中心对模型进行外部验证。
综上所述,吸烟、血清钠离子水平、门静脉内径宽度以及镜下红色征表现为肝硬化胃食管静脉曲张内镜治疗后3 年内发生再出血事件的独立影响因素,应针对以上因素及时发现和干预,最终降低此类患者的再出血率,提升患者的生存期,使患者受益。
作者贡献:程浩、周金池、范阿慧、窦维佳、刘震雄进行文章的构思与设计,研究的实施与可行性分析,论文的修订审校;程浩、刘喜、康林负责研究的统计学处理,结果的分析与解释;程浩、周金池、范阿慧负责数据收集及患者随访;程浩、周金池负责撰写论文;程浩、周金池、窦维佳、刘震雄对文章整体负责,监督管理。
本文无利益冲突。

