探讨安罗替尼维持治疗放化疗后晚期非小细胞肺癌的临床效果及安全性研究
沈春雪
[内蒙古民族大学第二临床医学院(内蒙古林业总医院)血液肿瘤科,内蒙古 呼伦贝尔 022150]
非小细胞肺癌(non-small-cell lung carcinoma, NSCLC)是起源于肺部支气管黏膜、腺体或肺泡上皮的恶性肿瘤,晚期不可手术的NSCLC患者以放化疗治疗为主,辅以免疫疗法、靶向药物治疗等,经治疗后病情稳定的患者仍然存在疾病进展的风险,因此,患者需定期复查,必要时再次进行放化疗治疗。虽然NSCLC的治疗方法不断优化,但能够实现长期生存的患者仍然较少,患者的预后一直未有实质性改善[1]。安罗替尼属于新型多靶点络氨酸激酶抑制剂,有抑制肿瘤细胞生长、增殖及抗肿瘤血管生成的作用。研究报道,安罗替尼治疗可以提高晚期NSCLC的近期疗效,改善患者的预后[2]。但安罗替尼在放化疗后病情稳定的晚期NSCLC患者维持治疗中的研究报道较少,且该药物上市时间及临床应用时间尚短,基于此,本研究旨在探讨安罗替尼维持治疗放化疗后晚期NSCLC患者的疗效与安全性,现报道如下。
1 资料与方法
1.1 一般资料 选取内蒙古民族大学第二临床医学院(内蒙古林业总医院)2020年1月至2021年1月收治的60例晚期NSCLC患者,采用随机数字表法分为对照组与研究组,每组30例。对照组患者中男性16例,女性14例;年龄45~73岁,平均(57.96±4.39)岁;美国东部肿瘤协作组(ECOG)[3]评分1~2分,平均(1.09±0.06)分;病理类型:腺癌10例,鳞癌20例;疾病控制情况:完全缓解1例,部分缓解20例,稳定9例。研究组患者中男性17例,女性13例;年龄47~74岁,平均(57.23±5.22)岁;ECOG评分0~2分,平均(1.08±0.07)分;病理类型:腺癌11例,鳞癌19例;疾病控制情况:完全缓解1例,部分缓解21例,稳定8例。两组患者一般资料比较,差异无统计学意义(P>0.05),组间可比。纳入标准:①符合《中华医学会肺癌临床诊疗指南(2018版)》[4]中相关标准,经组织病理学诊断为NSCLC者;②化疗治疗结束1个月后达到完全缓解、部分缓解、稳定的患者,进入随访观察阶段,未继续放化疗者;③临床分期[5]初治Ⅲ期者;④均接受含铂同步放化疗方案治疗,未应用靶向药物治疗者;⑤基因检测显示驱动基因突变阴性者等。排除标准:①混合型肺癌者;②血压异常者,即收缩压 > 140 mmHg(1 mmHg = 0.133 kPa)或< 90 mmHg,舒张压 > 90 mmHg或 < 60 mmHg;③正在服用溶栓药物、抗凝药物、抗精神类药物者等。本研究经院内医学伦理委员会批准,且患者均已签署知情同意书。
1.2 治疗方法 给予对照组患者安慰剂(含淀粉的胶囊颗粒)口服,1粒/次,1次/d。给予研究组患者盐酸安罗替尼胶囊(正大天晴药业集团股份有限公司,国药准字H20180004,规格:12 mg/粒)口服,12 mg/次,1次/d,若患者不耐受则减至8~10 mg(正大天晴药业集团股份有限公司,国药准字H20180003,规格:10 mg/粒;正大天晴药业集团股份有限公司,国药准字H20180002,规格:8 mg/粒),剂量减至8 mg/d仍不能耐受的患者不再继续治疗。两组患者均治疗2周后休息1周,21 d为1个周期,连续治疗直至患者出现病情进展或严重不良反应。同时定期复查,患者每3个月到院复查1次,若出现复发则继续进行安罗替尼治疗。两组患者均随访至2022年12月31日。
1.3 观察指标 ①血清肿瘤标志物水平。分别于治疗前与治疗4个周期后采集两组患者外周静脉血3 mL,以3000 r/min转速(离心半径为10 cm)离心10 min,分离血清,采用电化学发光免疫分析法检测血清癌胚抗原(CEA)、糖类抗原125(CA125)、细胞角蛋白19片段抗原(Cyfra21-1)水平。②无进展生存时间、总生存时间。无进展生存时间:患者接受治疗至发现疾病进展或因任何原因死亡的时间;总生存时间:患者入组当天至因任何原因死亡的时间,仍然存活的患者记录至随访结束当天。③ECOG评分。比较两组患者入组时及随访3、6个月的ECOG评分,评分范围为0~5分,0分:活动能力无异常;1分:能自由活动及做轻体力活动;2分:能自由活动及生活自理;3分:生活部分自理;4:生活不能自理;5分:死亡。④不良反应发生情况。根据美国国立癌症研究院常见不良反应事件评价标准(CTCAE)5.0版[6]记录研究组患者不良反应发生情况。
1.4 统计学方法 采用SPSS 25.0统计学软件分析数据,计数资料以[ 例(%)]表示,采用χ2检验;计量资料经S-W法检验符合正态分布,以(±s)表示,采用t检验,多时间点计量资料比较,采用重复测量方差分析,两两比较采用SNK-q检验。以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者血清肿瘤标志物水平比较 与治疗前比,治疗4个周期后两组患者血清CEA、CA125、Cyfra21-1水平均升高,但研究组患者血清肿瘤标志物水平更低,差异均有统计学意义(均P<0.05);研究组患者治疗前后血清肿瘤标志物水平比较,差异均无统计学意义(均P>0.05),见表1。
表1 两组患者血清肿瘤标志物水平比较( ±s)
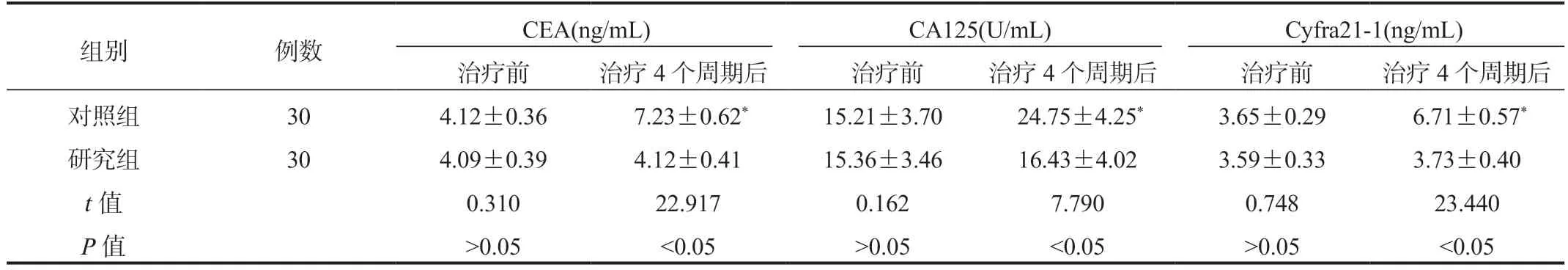
表1 两组患者血清肿瘤标志物水平比较( ±s)
注:与治疗前比,*P<0.05。CEA:癌胚抗原;CA125:糖类抗原125;Cyfra21-1:细胞角蛋白19片段抗原。
组别例数CEA(ng/mL)CA125(U/mL)Cyfra21-1(ng/mL)治疗前治疗4个周期后治疗前治疗4个周期后治疗前治疗4个周期后对照组304.12±0.367.23±0.62*15.21±3.7024.75±4.25*3.65±0.296.71±0.57*研究组304.09±0.394.12±0.4115.36±3.4616.43±4.023.59±0.333.73±0.40 t值0.31022.9170.1627.7900.74823.440 P值>0.05<0.05>0.05<0.05>0.05<0.05
2.2 两组患者无进展生存时间与总生存时间比较 对照组患者无进展生存时间与总生存时间分别为(6.97±1.96)个月、(11.34±2.09)个月;研究组患者无进展生存时间与总生存时间分别为(9.02±2.39)个月、(14.30±3.72)个月。与对照组比,研究组患者无进展生存时间与总生存时间均显著延长,差异均有统计学意义(t= 3.633、3.800,均P<0.05)。
2.3 两组患者ECOG评分比较 与治疗前比,随访3、6个月两组患者ECOG评分均呈显著升高趋势,且研究组患者ECOG评分升高幅度较小,差异均有统计学意义(均P<0.05),见表2。
表2 两组患者ECOG评分比较(分,±s )

表2 两组患者ECOG评分比较(分,±s )
注:与治疗前比,*P<0.05;与随访3个月比,#P<0.05。ECOG:美国东部肿瘤协作组。
组别例数治疗前随访3个月随访6个月对照组301.09±0.061.63±0.58*2.12±0.96*#研究组301.08±0.071.27±0.22*1.45±0.42*#t值0.5943.1793.502 P值>0.05<0.05<0.05
2.4 研究组患者不良反应发生情况 研究组患者治疗期间发生的不良反应中以疲乏(33.33%)发生率最高,其次是高血压(30.00%),然后是手足综合征率(16.67%),见表3。

表3 研究组患者不良反应发生情况[ 例(%)]
3 讨论
目前临床普遍认为,晚期NSCLC在根治性含铂同步放化疗后疾病未进展的患者,通过维持治疗可使患者生存获益[7]。安罗替尼是我国研发上市的抗血管生成药,其作用靶点有血小板衍生生长因子受体(PDGFR)、络氨酸激酶受体(c-Kit)等,可以抑制肿瘤血管形成,阻止肿瘤细胞生长增殖,达到抗肿瘤的目的。相关研究表明,安罗替尼用于NSCLC患者的维持治疗,可取得较满意的效果,延长患者的平均总生存期与平均无进展生存期[8]。
CEA主要由肿瘤细胞分泌,促进正常细胞逐渐向恶性细胞转化,可在NSCLC患者血清中异常升高;CA125是黏蛋白家族糖蛋白成员,主要来源于体腔上皮细胞,在肺癌中呈高表达;Cyfra21-1广泛表达于肺癌组织的细胞质中,激活的蛋白酶可加速肿瘤细胞的溶解、坏死进程,导致Cyfra21-1大量释放入血,使血清中的含量升高,且肿瘤分期越晚,其血清水平越高[9]。本研究中,与治疗前比,治疗4个周期后对照组患者血清CEA、CA125、Cyfra21-1水平显著升高,但相比对照组,研究组患者血清肿瘤标志物水平更低,表明相对于放化疗后维持阶段未继续服用药物,使用安罗替尼能够在一定程度上抑制肿瘤细胞增殖生长,减少肿瘤标志物分泌。晚期NSCLC患者在放化疗治疗结束后,残留的肿瘤细胞容易继续生长增殖,从而使血清肿瘤标志物分泌增加,而安罗替尼可阻碍肿瘤血管新生,抑制内皮细胞迁移,加速肿瘤细胞的死亡。
本研究中,与对照组比,研究组患者无进展生存时间与总生存时间均显著延长;与治疗前比,随访3、6个月两组患者ECOG评分均呈显著升高趋势,但研究组患者ECOG评分升高幅度较小,表明晚期NSCLC患者在放化疗控制疾病稳定后,采用安罗替尼维持治疗可以延长患者的生存期,维持体力状况。分析原因,肿瘤的生长、转移需要充足的营养及氧气供应,而这些主要依赖于肿瘤血管的供给,安罗替尼通过抑制肿瘤血管生成,阻断了肿瘤的营养及氧气供给途径,使残留的肿瘤细胞生长受到抑制,从而有效控制疾病进展,延长生存期。
本研究中患者的不良反应以疲乏、高血压发生率较高,其次为手足综合征等。可能原因是安罗替尼在抑制血管内皮生长因子通路的同时,减少了血管内皮细胞一氧化氮的分泌,导致血管收缩,循环阻力增大,使血压升高。安罗替尼引起疲乏的原因可能与肿瘤本身、抗肿瘤治疗相关,同时受到合并症、疾病进展等多种因素的影响。安罗替尼引起手足综合征的原因可能是,抑制汗腺管上的血小板衍生生长因子(PDGF)、c-Kit,使汗腺管发生病理生理改变,引起皮肤毒性,使手足部位的毛细血管受损,出现红斑、疼痛、充血等皮肤反应,从而引起手足综合征[10]。
综上,安罗替尼维持治疗放化疗后晚期NSCLC,能抑制患者血清肿瘤标志物分泌,延长生存期,改善患者体力活动,治疗期间应注意观察及处理药物不良反应,提高治疗的安全性。本次研究样本量较小,在今后的研究中仍需扩大研究范围,以期获得更加完善的研究结果。

