辅酶A的生物合成途径及其应用
承朋利,吴胜,黄建忠*
(1.福建师范大学生命科学学院 工业微生物发酵技术国家地方联合工程研究中心 工业微生物教育部工程中心,福建 福州 350108;2.中国科学院微生物研究所,北京 100101)
20 世纪40年代,德裔美国生化学家Fritz Albert Lipman教授在研究胚胎细胞代谢时发现一种热稳定的分子,该分子具有乙酰化其他物质的生物学活性,并将该分子命名为辅酶A(Coenzyme A,简称CoA),其中“A”代表乙酰化活性。10年后,Lipman教授和合作者共同鉴定了CoA的分子结构[1]。CoA的结构如图1所示,可以看作由一分子β-巯基乙胺,一分子泛酸以及一分子3’,5’-ADP组成,其中末端的巯基是其主要的活性基团。CoA是大多数生物体内不可或缺的辅因子,其作为酰基载体和羰基激活基团在许多中心代谢的生物转化中起重要作用。据统计,在已鉴定的生化反应中,约4 %的酶分子利用辅酶A作为特定的辅助因子,辅酶A也参与超过100种不同的中间代谢反应[2]。
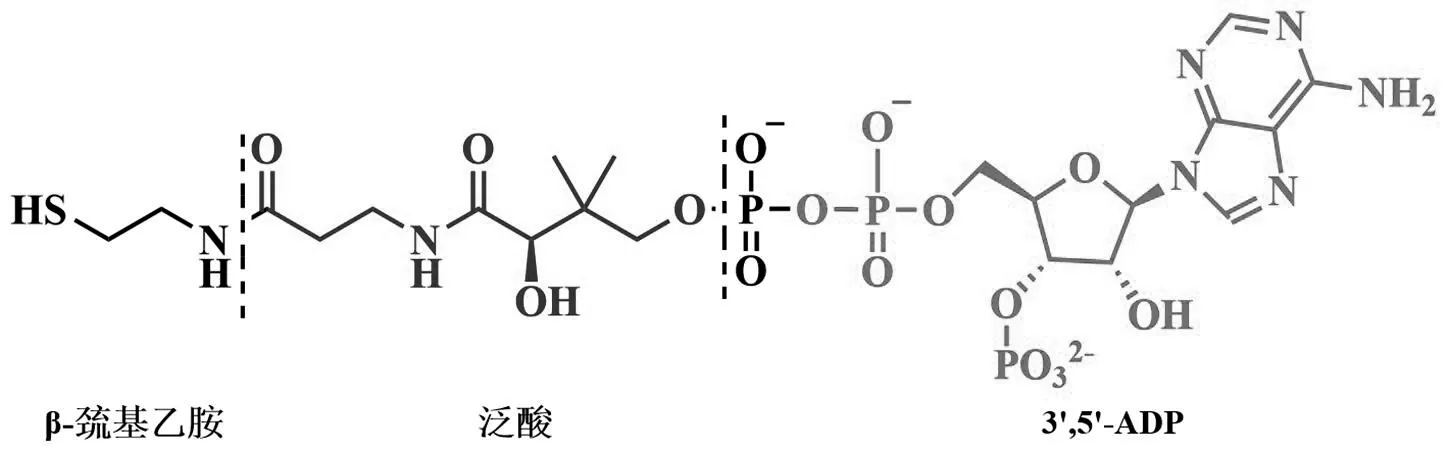
图1 辅酶A结构
1 辅酶A的生物合成途径
1.1 经典途径
从泛酸到辅酶A的合成途径在原核生物和真核生物体内普遍存在。目前,公认的CoA合成途径[3]如图2-A所示:⑴首先由泛酸激酶(PanK)催化泛酸的4’-OH磷酸化,形成4’-磷酸泛酸(P-Pan);⑵经由磷酸泛酰半胱氨酸合酶(PPCS)酶催化与半胱氨酸缩合,得到4’-磷酸泛酰半胱氨酸;⑶之后由磷酸泛酰半胱氨酸脱羧酶(PPCDC)进行脱羧得到4’-磷酸泛酰巯基乙胺;⑷后两步分别由磷酸泛酰巯基乙胺腺苷酰基转移酶(PPAT)催化腺苷酰基的转移形成脱磷酸-CoA和⑸去磷辅酶A激酶(DPCK)催化磷酸化得到CoA。在细菌中,这5种酶也被称为CoaA、CoaB、CoaC、CoaD和CoaE,而在酵母中通常被称为(CAB1-CAB5)。
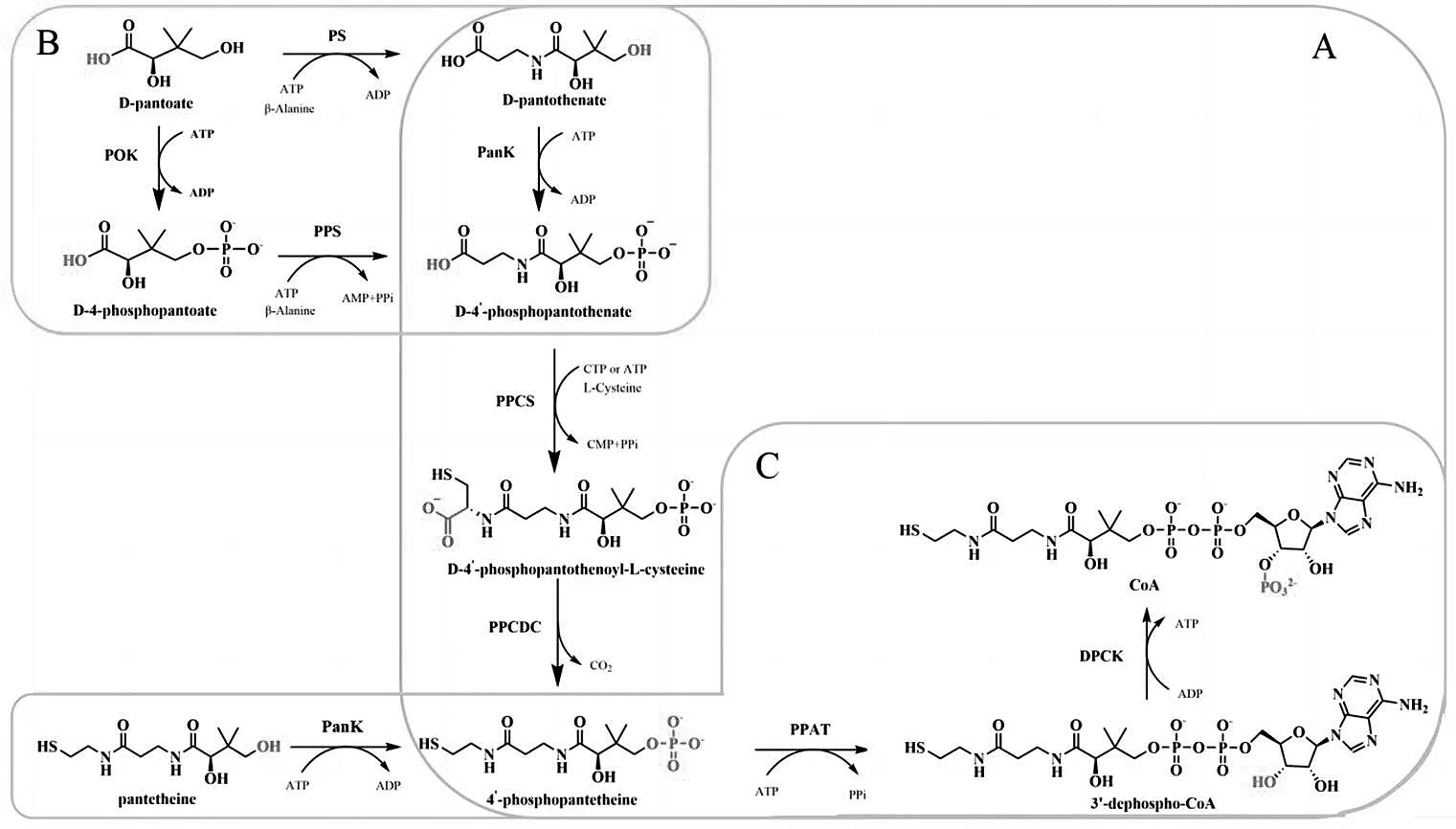
图2 辅酶A的生物合成途径
最初,人们对于合成途径的实际顺序提出了2种不同的潜在途径。这2种途径的区别在于CoA泛酸部分4’-磷酸化的先后顺序,即PanK的底物特异性。基于摩氏摩根菌和大鼠肝脏提取物都能只将4’-磷酸泛酸(而不是泛酸)与半胱氨酸耦合。这一研究发现,Brown最终制定了这一合成途径[3]。
1.2 古生菌的生物合成途径
在对古生菌中CoA合成途径的研究中发现,在大多数的古生菌中磷酸泛酸生物合成途径不同于真核生物和细菌。在大多数细菌和真核生物中,磷酸泛酸的合成是以泛解酸为底物通过泛酸合成酶(PS)和PanK酶的连续两步催化合成[4]。在大多数的古生菌中由泛解酸激酶(PoK)和磷酸泛酸合成酶 (PPS)作为替代途径[5],如图2-B。研究发现,该途径在海洋共生菌中的亚群Entoporibacteria中也存在[6],而对古生菌Picrophilus torridus的基因组的研究中也发现一种与细菌I型PanK同源性较远的PanK酶基因[7]。
1.3 挽救途径
如1.1.1小节所述,辅酶A的生物合成途径最初出现争议的原因是生物体内PanK酶也可以作用于泛酰巯基乙胺[8],另外有研究发现大肠杆菌能够利用泛酰巯基乙胺维持其CoA生物合成正常需求[9]。这些研究结果表明许多生物可以绕过PPCS和PPCDC两种酶体,利用泛酰巯基乙胺为底物合成CoA,如图2-C,这一途径被称其为挽救途径,这一挽救途径需要可以接受以泛酰巯基乙胺为底物的低底物特异性的PanK酶。
2 辅酶A的生化功能
CoA 独特的化学结构使它被用来激活分解代谢和合成代谢反应中的羧基,包括脂类、碳水化合物、蛋白质、乙醇、胆汁酸和一些外源物质的代谢,近期的研究发现基因的表达以及一些蛋白质的修饰也需要辅酶A及其硫酯衍生物的参与[10]。
CoA 及其衍生物的异常生物合成与许多病理有关,包括糖尿病、神经性退化、雷氏症候群、维生素B12缺乏症、心脏肥大和癌症等疾病[11]。由于辅酶A的生物合成底物泛酸普遍存在于大多数食物以及肠道菌群中,因此与细胞内CoA浓度异常相关的疾病通常与辅酶A合成酶相关基因的缺陷、CoA的降解或运输有关[12],如神经退行性疾病(PKAN)。还有一些研究表明CoA的异常会导致Aurora A激酶中与CoA相关的修饰失调,在感染疟原虫的红细胞中,CoA的水平高于正常红细胞,抗疟原虫的泛酸类似物并由此发展起来[13]。
3 辅酶A的生物合成途径的应用
辅酶A在生物代谢中的重要作用以及不同来源的辅酶A合成酶之间较大的差异性,使得人们对关于辅酶A合成途径的研究产生了极大的兴趣,加之相关研究证实一些微生物来源的PanK、PPAT和DPCK对底物衍生物具有高耐受性,使得辅酶A生物合成途径在许多方面进行了应用研究,从辅酶A自身的合成以及利用辅因子工程扩大CoA相关衍生物在细胞中的可用量,再到基于CoA生物合成途径所探究的一系列相关抑制剂的研发。
3.1 CoA-辅因子工程
CoA 作为存在于生命所有领域不可缺少的辅因子,这一特性使得其成为一种在制药、化妆品和临床行业中有商业价值的化合物。不仅如此,CoA也是许多生化反应过程中必不可少的酰基载体和共底物,被应用于许多生化反应的研究中,但由于商用辅酶A成本较高,其规模化生产也是一个亟待解决的问题。目前,辅酶A的合成方法中,利用全化学合成以及生物组织提取法存在着工艺复杂、收率低或者成本高、含量低等缺点,因此这两种方法只在初期研究得较多。已报道的达到制备级的合成方法主要有两种,一个是微生物发酵法,还有一个是化学酶法合成,表2汇总了目前已报道的不同合成方法中产率最高的几种。

表2 辅酶A的不同合成方法
为避免CoA对泛酸激酶的抑制作用,研究者尝试利用化学方法对泛酸进行磷酸化。通过化学方法引入磷酸根基团存在着工序复杂,收率低等缺陷,本实验室建立以泛酸为底物的体外四步酶法合成辅酶A的体系,通过引入对CoA反馈抑制不敏感的PanK酶,解决抑制问题。对反应体系中的条件优化后可合成辅酶A 65.8 mmol/L,即50.5 mg/mL,与现在已有的以泛酸为底物的合成方法相比产量有了很大的提高(4.6倍),与目前已报道的产业化方法相比提高了26倍。
CoA 生物合成途径除了直接应用于CoA合成的研究外,还可以通过CoA-辅因子工程可以增加细胞内的CoA库含量,增加辅酶A相关衍生物的可用量,以实现下游产品更高的生产率。辅酶A相关衍生物是多种生物合成途径和多种生化反应中必需的中间体,其中乙酰辅酶A是生物合成脂质、聚酮、类异戊二烯、氨基酸和许多其他生物制品的关键代谢物前体,用于各种工业。丙二酰辅酶A也是脂肪酸和聚酮等物质的生物合成相关途径中的重要中间物。
羟基丁酸酯(3HB)是聚羟基丁酸酯(PHB)的单体,是一种多用途手性C4分子,3HB生成途径的中心代谢物是辅酶A(CoA)的衍生物乙酰辅酶A。Younes S.和Awad D.在含有合成3HB途径关键酶(乙酰乙酰辅酶A硫酶和乙酰乙酰还原酶)外源基因的大肠杆菌中分别过量表达4种不同类型的PanK酶基因(大肠杆菌 PanK1、构巢曲霉菌 PanKII、小家鼠panK1β、枯草芽孢杆菌 panKIII)并评估其在合成3HB的影响。其中在含有小家鼠来源的PanK1β酶基因的菌株获得最高的3HB滴度,使其滴度增加41%[19]。Kudo H和Ono S在含有PHB合成外源基因(聚羟基烷酸合成基因phaABC)的大肠杆菌中引入恶臭假单胞菌来源coaA基因(不受游离CoA和乙酰CoA抑制)。研究发现,在加入0.5 mmol/L的泛酸条件下,携带两种基因的菌株与单独携带pha基因相比积累量从18.4% 增加到29.0%。对细胞内CoA的测定显示,coaA基因的引入和CoA前体的加入极大地扩大了细胞内CoA库的大小,其中约95%的CoA被乙酰辅酶A占据,同时还观察到从乙酰辅酶A到乙酸的过程受到抑制[20]。
可再生资源微生物发酵生产的生物燃料是化石燃料的重要替代品,而高级醇如丁醇被认为是比生物乙醇更合适的燃料替代品。Schadeweg V.和Boles E在利用酿酒酵母的乙酰辅酶A衍生途径建立正丁醇生物合成的研究中发现,酿酒酵母中的游离CoA水平明显限制了正丁醇的产量。研究发现通过过量表达来源于大肠杆菌的coaA基因(不受乙酰辅酶A的抑制)同时添加CoA前体泛酸可以增加乙酰CoA的合成,使正丁醇产量大幅度提高[21]。
在发酵酒精饮品中由酯类或高级醇类产生的风味在感官质量中起着关键作用,在酿酒酵母细胞中,酯类和高级醇类的合成受细胞内辅酶A水平的显著影响。Hong KQ和Fu XM通过在酿酒酵母中过表达其自身来源的CAB1、CAB3以及ATF1(乙醇乙酰转移酶)使得乙酸乙酯、乙酸异戊酯等乙酸酯类物质含量显著升高,细胞中的正丙醇、甲基-1-丁醇、异戊醇、异丁醇和苯乙醇的含量也发生了不同的变化,因此通过CoA-辅因子工程调控乙酸酯和高级醇的合成[22]。
Olzhausen J.和Grigat M.为增加酵母中乙酰辅酶A的合成量,构建了一株CAB1W331R(对乙酰辅酶A不敏感的突变体)基因与其他辅酶a生物合成相关基因(CAB2、CAB3、HAL3、CAB4和CAB5)联合过表达的酿酒酵母菌株,与野生菌株相比,细胞内CoA库增加了15倍。在补充过量的泛酸后,CoA库进一步提高2.3倍,这一研究可以用于改善依赖于乙酰辅酶A的生物合成途径的有用工具[23]。
丙二酰辅酶A是脂肪酸生物合成和各种通过Claisen缩合一步延长两个碳链的聚酮类物质合成中重要的酰基供体,也是细胞中最丰富的辅酶A衍生物之一。在大多数生物体中,丙二酰辅酶A是由乙酰辅酶A羧化酶(ACC)催化的乙酰辅酶a羧化反应合成的。Satoh S和Ozaki M在大肠杆菌中过表达恶臭假单胞菌来源的泛酸激酶(CoaA)和谷氨酸棒杆菌来源的乙酰辅酶a羧化酶(acc)促进CoA生物合成和丙二酰辅酶a供给,结果显示脂肪酸的含量增加了7倍以上[24]。Milke L和Marienhagen J在此基础上额外过表达脂肪酸合成酶(FasA),在23 ℃反应条件下,FasA的泄漏表达使得油酸的积累量超过100 mg/L。这一结果表明这种方法可以有效地适用于生产有价值的脂肪酸,如二十碳五烯酸(C20:5 ω-3)和二十二碳六烯酸(C22:6 ω-3)等[25]。
3.2 以辅酶A酶学为靶点的药物开发
自从证明磺酰胺类的抗菌药物靶向与维生素B族叶酸生物合成有关的酶-二氢蛋白酶合酶(DHPS)[26]以来,辅因子生物合成途径作为抗菌药物发育的潜在靶标,引起人们的注意。这种兴趣取决于两个重要因素:首先,辅酶A是维持生命的各种代谢反应的必不可少的组成部分,其次,辅酶A的生物合成是通过B族维生素泛酸的生物转化,在这一途径中,人类宿主与病原体展现出足够的差异性,因此可以作为选择性靶向。
早在20世纪40年代,CoA合成途径就被认为是一种可能的药物靶点[27]。尽管所有的CoA生物合成酶都可以是开发选择性抑制剂的潜在靶标,但因为大多数生物体(含有低底物特异性PanK酶的生物)能够利用挽救途径,一些酶可能会被绕过,加上细菌来源DPCK与人源双功能辅酶A合酶(CoASy)的DPCK结构域具有显著的同源性[28]。因此两种CoA生物合成酶(PanK和PPAT)得到了特别的关注,这两种酶都在维持细胞内CoA浓度方面起着关键的调节作用。
几乎所有病原微生物中都存在coaA基因,而真核和原核生物的序列相似性极低,加上它们的动力学特性和调节方式存在一定的差异,因此针对PanK酶的结构和特异性设计特异性抗病原菌的抑制剂成为了可能。1970年,Clifton等人首次报道了N-取代泛酸酰胺,泛酸的酰胺化物[29]其中多个化合物具有抗细菌、抗真菌或抗疟原虫活性,不过由于泛酸酰胺是在高效抗生素大量出现的时候被发现,因此并没有得到重视。随着耐药菌株的不断出现,与泛酸类似物的相关抗菌性的研究逐渐增多,Spry等人的一篇综述中全面介绍了泛酸衍生物与各种PanK亚型相互作用的抑菌活性[30]。近年来,在对抗结核药物的研究中发现一种由EthA单加氧酶激活的前体药物,在对其作用靶点的研究发现,该药物的活性代谢物可同时靶向CTP合成酶PyrG和PanK[31],以这两种酶作为双靶点的药物筛选也被认为具有鉴定新抗结核药物的潜力[32]。
在设计PPAT酶的抑制剂时,研究人员尝试基于底物P-PanSH的结构设计、合成并测试了针对EcPPAT的二肽库中筛选[33],但由于膜对分子的不渗透性,对细胞无活性。2008年的两篇专利报道了两种衍生物:四氢-异喹啉衍生物[34]、四氢-β-咔啉衍生物[35]被认为可作为靶向细菌的PPAT酶的抗菌剂。随着生物相关研究技术的不断提高,大量基于酶结构的虚拟对接以及大量化合物文库的多维片段的高通量筛选抑制剂的研究发表出来[36]。针对CoA合成途径中的其他酶的相关研究,2020年研究人员针对细菌的PPCS酶筛选CoA合成抑制剂,从脂肪素类分子中分离出新的抗生素[37]。2021年,研究者通过高通量筛选获得一种直接靶向结核分枝杆菌PPCS酶的底物非竞争抑制剂[38],并对该抑制剂的作用机制进行研究。在Spry和同事的另一篇综述[39]中对CoA合成酶的序列同源性和开发疟原虫特异性化合物的潜力得到了详细的介绍。2022年,Nurkanto A通过对大型化合物文库的高通量筛选鉴定恶性疟原虫的去磷酸辅酶A激酶的选择性抑制剂[40]。
除了直接靶向一种或多种Pan或CoA生物合成酶用于抑制剂开发外,另一种可能的替代方法是利用各自途径前体的结构类似物,它们的中间体或最终产物可作为抑制剂。这种抗代谢物策略通过干扰与一种或几种CoA生物合成酶或CoA依赖性酶紧密相关的结构,从而对其产生抑制作用[41]。相关化合物研究最多的泛酸类似物之一是N-戊基泛酰胺(N5-Pan),研究发现N5-Pan通过CoA合成途径形成无活性CoA类似物乙基CoA,该物质通过与PanZ结合,影响PanD对天冬氨酸的脱羧作用以及泛酸的合成[42]。最近,一类以利用辅酶A相关酶为靶点的反酰胺键的N取代泛酸酰胺类似物(iPanAms)MMV693183进入了抗疟疾的临床前开发[43]。Moolman等人最近的一篇综述则讨论了CoA生物合成酶作为开发抗微生物药物的新靶点[28]。Strauss等人在2020年的一篇综述中详细介绍了靶向泛酸和辅酶A的合成途径设计的抗结核药物的开发及它们作为药物靶点的适用性评估[44]。
一些研究发现CoA生物合成途径也可用于特定酶抑制剂的生物激活的例子。一种前体药物可在粪肠球菌中转化为相应的辅酶A衍生物,该分子会抑制氨基糖苷类耐药酶,从而使耐药菌株对氨基糖苷类药物重新敏感[45]。Hammerer等人报道了一种泛酸酰胺类似物,利用CoA生物合成途径在细胞中生成衣锥酸酯降解抑制剂[46]以恢复肠道沙门氏菌对内源抗菌活性分子衣锥酸酯的敏感性。Duncan D和Auclair K对比了不同类型的PanK对泛酸酰胺衍生物的不同敏感度以及底物广泛性[47]。
4 总结与展望
辅酶A作为生命所有领域中重要的辅因子,随着辅酶A生物合成途径的重建以及合成途径中关键酶结构及功能的解析,辅酶A在细胞代谢中的重要作用以及合成途径的应用得到广泛性研究。近年来,对耐药菌株的大量出现以及不同物种间辅酶A合成途径酶的差异性的深入研究使得辅酶A生物合成途径已经成为开发针对微生物系统的抗生素的潜在靶点。目前针对以辅酶A合成途径酶为靶点的抑制剂研究以及利用辅酶A合成途径作为抑制剂前体激活的大量相关研究已经发表出来。未来,通过建立高效且具有针对性的抗菌抑制剂的筛选方法,将开发出更多以辅酶A为导向的稳定性好、可溶性高、选择性强且高效的抗致病微生物的靶向药物。
——水溶性维生素泛酸篇

