QuEChERS-液相色谱-串联质谱法检测果蔬中苯并烯氟菌唑残留
叶慧娟
肇庆市食品检验所(肇庆 526040)
苯并烯氟菌唑(Benzovindiflupyr)是先正达开发的一类吡唑酰胺类杀菌剂,是琥珀酸脱氢酶抑制剂。苯并烯氟菌唑广谱、高效,持效期长,作用于病原菌线粒体呼吸电子传递链上的蛋白复合体Ⅱ,阻碍其能量代谢,进而抑制病原菌的生长,导致其死亡,从而达到防治病害的目的[1-8]。但过量的使用会导致食品中残留苯并烯氟菌唑,危害人体健康。GB 2763—2021《食品安全国家标准 食品中农药最大残留限量》[9]规定苯并烯氟菌唑在部分果蔬中的最大残留限量(MRL)为0.02~1 mg/kg。已报道仅有常海龙等[10]采用高效液相色谱测定45%苯并烯氟菌唑.嘧菌酯水分散粒剂中有效成分苯并烯氟菌唑和嘧菌酯的含量,隋程程等[11]采用QuEChERS与高效液相色谱-串联质谱联用检测动物源产品中苯并烯氟菌唑残留,姜宜飞等[12]采用高效液相色谱分析苯并烯氟菌唑原药,尚缺乏果蔬中苯并烯氟菌唑残留分析方法的报道。
我国是果蔬生产大国,苯并烯氟菌唑被广泛应用于果蔬病害的防治,因此检测果蔬中该类农药的残留对消费者的健康非常重要。采用QuEChERS法结合高效液相色谱-串联质谱建立适用于检测果蔬中苯并烯氟菌唑残留方法,该方法简单快速、分析速度快、回收率高。我国关于食品中苯并烯氟菌唑残留的检测方法还没有相应的国家及部颁标准,国外也鲜见报道,试验旨在为食品中苯并烯氟菌唑残留检测标准的制定提供参考。
1 材料与方法
1.1 材料与试剂
苯并烯氟菌唑标准物质(纯度>99%,First standard公司);C18、乙二胺-N-丙基硅烷(primary secondary amine,PSA,美国Aglient公司);氯化钠为分析纯(广州化学试剂厂);乙腈(质谱级,德国Merck公司)。
1.2 仪器与设备
Acquity H-class/X evo TQD超高效液相色谱-串联四极杆质谱联用仪(沃特世公司);KQ-300DA台式数控超声波清洗器(昆山舒美超声仪器有限公司);Fotectorp氮吹仪(美国Reeko公司);UMV-3多管漩涡混合器(北京优晟联合科技有限公司);高速台式冷冻离心机(湖南湘仪实验室仪器开发有限公司);GM200刀式混合研磨仪(德国Retsch公司)。
1.3 方法
1.3.1 样品前处理
称取10.0 g粉碎混匀果蔬样品置于50 mL离心管中,加入10 mL乙腈,涡旋振荡2 min;加入3 g氯化钠涡旋振荡2 min,超声提取10 min,以10 000 r/min离心6 min;吸取上清液于15 mL具塞离心管中,加入500 mg PSA、500 mg C18,涡旋振荡2 min,以10 000 r/min离心6 min;取上清液于40 ℃氮气吹至近干,加1 mL 20%乙腈溶液溶解,涡旋30 s,经0.22 μm滤膜过滤后上机分析。
1.3.2 标准溶液配制
准确称取10 mg苯并烯氟菌唑标准品于100 mL容量瓶中,用乙腈定容,配制成100 μg/mL标准储备液,于-20 ℃冰箱保存。
1.3.3 液相色谱条件
色谱柱为Waters BEH C18柱(2.1 mm×100 mm,1.7 μm);流动相A为0.1%氨水,流动相B为乙腈,流速0.25 mL/min;进样量10.0 μL;柱温40 ℃。梯度洗脱程序:0~0.5 min,5%~50% B;0.5~1.0 min,50%~95% B;1.0~2.0 min,95% B;2.0~2.1 min,95%~5% B;2.1~5 min,5% B。
1.3.4 质谱条件
雾化气3 mL/min;干燥气10 mL/min;加热气10 mL/min;电喷雾离子源(electron spray ionization,ESI),负离子扫描;监测方式采用多反应监测(multiple reaction monitoring,MRM);离子源接口温度300 ℃;脱溶剂温度250 ℃;加热块温度400 ℃。苯并烯氟菌唑质谱参数见表1。

表1 苯并烯氟菌唑质谱参数
2 结果与分析
2.1 质谱条件的优化
将1.0 μg/mL苯并烯氟菌唑标准溶液以流动注射的方式进样。噻霉酮在ESI源负离子模式下信号丰度远高于正离子模式下,产生带负电荷的分子离子峰[M-H]-,因此选择负离子扫描模式。通过优化锥孔电压和碰撞能量,选择离子丰度最高、基体干扰较小的离子对作为特征离子对,选择丰度最强的碎片离子作为定量离子。进一步优化毛细管电压等参数,使其离子化效率达到最佳,苯并烯氟菌唑的质谱参数见表1。
2.2 色谱柱的选择
在相同色谱条件下,考察Waters HSS T3、Waters BEH C18、Zobax Eclipse Plus C18、Waters XSelectR CSHTMC18对苯并烯氟菌唑的分离效果。结果发现,采用Waters BEH C18色谱柱可有效分离苯并烯氟菌唑,峰形尖锐、对称,而且在4 min内就可完成对样品的分析,分析速度显著提高,见图1。因此选择Waters BEH C18柱作为分析柱。

图1 苯并烯氟菌唑的提取离子总离子流图
2.3 流动相的选择
分别以甲醇、乙腈作为有机相,0.1%氨水、含5 mmol/mL乙酸铵、纯水作为水相,进行组合条件的考察。结果发现:水相采用0.1%氨水比纯水、含5 mmol/mL乙酸铵可有效提高苯并烯氟菌唑的离子化效率,增强响应信号,且有较好的峰形;以乙腈作为有机相时,与甲醇相比,可在短时间内将目标物分离出来,且出峰状况更佳;以乙腈-0.1%氨水作为流动相时,苯并烯氟菌唑的分离效果、质谱信号响应强度最佳(图1)。因此,选择乙腈-0.1%氨水作为流动相。
2.4 净化剂的选择
果蔬中含有大量色素、有机酸、纤维素、维生素与糖类。QuEChERS方法使用较多的净化剂材料有PSA、C18、GCB。PSA起到弱阴离子交换的作用,去除脂肪酸、糖、有机酸效果较好,C18吸附剂主要除去脂类及多环芳烃等非极性、弱极性和中等极性化合物,GCB吸附色素和非极性、弱极性化合物[13]。试验采用C18/PSA/MgSO4、GCB/PSA/MgSO4、PSA/MgSO4、C18/PSA、C18/MgSO4这5种组合比较净化效果。结果发现,GCB会吸附苯并烯氟菌唑,GCB/PSA/MgSO4回收率为29%,回收最低;C18/PSA/MgSO4、PSA/MgSO4和C18/MgSO4组合回收率介于52%~60%;C18/PSA组合净化后的提取液最澄清,净化效果最好,回收率最高。综合不同类型吸附剂组合的净化效果和加标回收率,最终选择C18/PSA作为净化吸附剂。
2.5 基质效应
分别以20%乙腈-水溶液,黄瓜、番茄、冬瓜、苹果和梨空白样品溶液(空白样品按照1.3.1处理所得)作为溶剂配制苯并烯氟菌唑的标准溶液和基质溶液,比较两者的平均响应值,用以判断基质效应(matrix effect,ME)的影响,计算如式(1)所示[14]。
从表2可以看出,不同样品基质的ME在71.3%~76.8%直径,不能忽略。因此,试验采用基质标样外标法定量以确保结果的准确性。
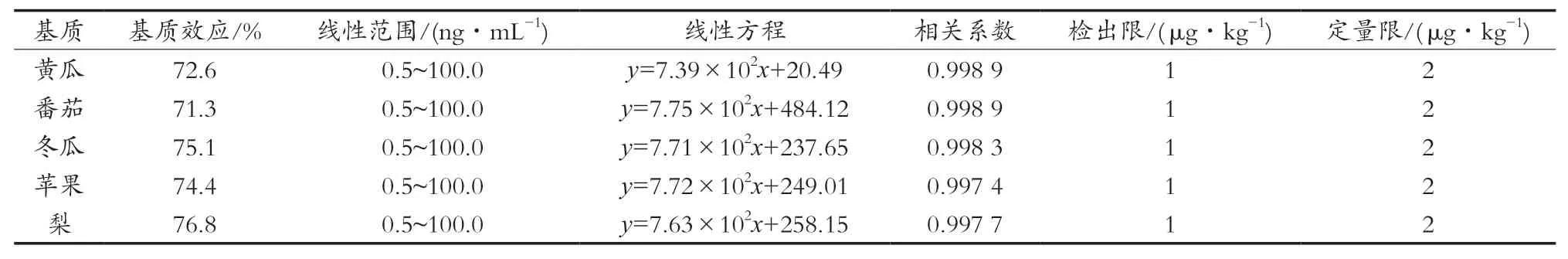
表2 苯并烯氟菌唑的基质效应、线性范围、检出限与定量限
2.6 线性范围、检出限和定量限
将质量浓度0.5,1.0,5.0,10.0,50.0和100.0 ng/mL的标准工作溶液,按上述分析条件进行测定,外标法定量。以浓度为横坐标(x),峰面积为纵坐标(y),制作标准曲线。
从表2可以看出,苯并烯氟菌唑在0.5~100.0 ng/mL浓度范围内线性关系良好,相关系数(R2)均大于0.99。对不同基质空白提取液进行加标测定,确定苯并烯氟菌唑在黄瓜、番茄、冬瓜、苹果和梨中的方法检出限均为1 μg/kg,定量限均为2 μg/kg。
2.7 准确度和精密度
在空白果蔬样品中分别添加0.5,5.0和50.0 μg/kg这3个浓度水平,按1.3.1对样品进行前处理,每个浓度水平平行6次试验。从表3可以看出,平均加标回收率是74.3%~90.8%,相对标准偏差SRSD是1.8%~4.1%,表明该方法具有较好的重现性与准确性。
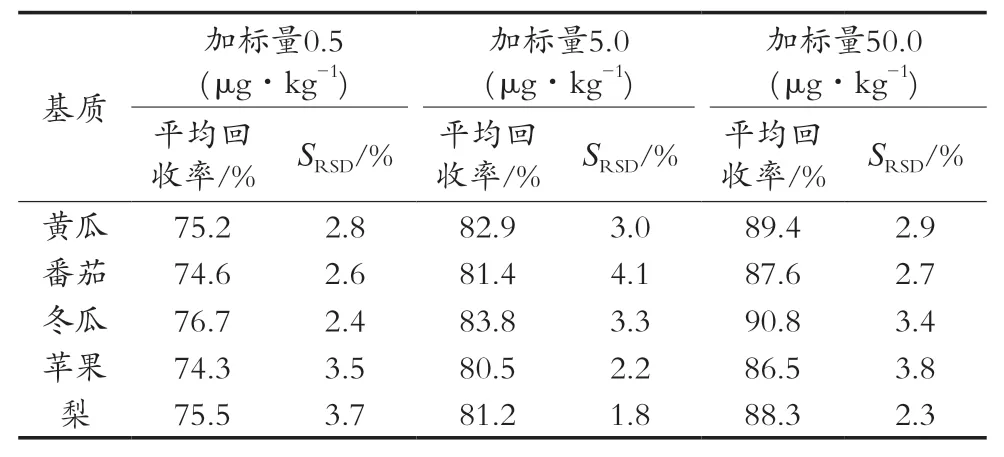
表3 不同基质中苯并烯氟菌唑的回收率和精密度(n=6)
2.8 实际样品分析
随机抽取45批市售的黄瓜、番茄、冬瓜、苹果和梨,应用试验方法对样品进行苯并烯氟菌唑残留检测。结果表明,样品中均未检出苯并烯氟菌唑。
3 结论
采用QuEChERS样品前处理方法,建立液相色谱-串联质谱法测定果蔬中苯并烯氟菌唑残留的方法。该方法具有操作简单、定性定量准确、灵敏度高的优点,满足快速检测果蔬中苯并烯氟菌唑残留的分析要求。

