高产AI-2 信号分子乳酸菌的筛选及生物性能研究
吕欣然,吕孟敏,杨冰艳,顾振辰,刘雪晴,励建荣,2*,白凤翎,檀茜倩,李英美
(1 渤海大学食品科学与工程学院 生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心辽宁省食品安全重点实验室 辽宁锦州 121013 2 大连工业大学 海洋食品精深加工关键技术省部共建协同创新中心 辽宁大连 116034 3 达莲食品(锦州)有限公司 辽宁锦州 121019)
群体感应(Quorum sensing,QS)是细菌间进行信息交流的一种机制。细菌通过自身合成来释放信号分子-自诱导物(Autoinducer,AI)以感知环境变化,当信号分子浓度达到一定阈值后,与受体蛋白结合激活信号通路,从而调控细菌生物发光,生物膜形成,毒力基因产生等[1-2]。革兰氏阴性菌主要分泌N-乙酰基高丝氨酸内酯(N-acyl-homoserine lactone,AHLs)类信号分子,而革兰氏阳性菌主要分泌寡肽类(Autoinducing peptides,AIP)信号分子进行种内交流。自诱导因子2(Autoinducter-2,AI-2)作为一种菌种间交流信号分子,存在于革兰氏阴性和阳性菌中,包括哈维氏弧菌(Vibro harveyi)、荧光假单胞菌(Pseudomonas fluorescens)、金黄色葡萄球菌(Staphylococcus aureus)及植物乳杆菌(Lactobacillus plantarum)等[3-5]。感应激酶蛋白LuxQ 由周质结合蛋白LuxP 调控后识别信号分子AI-2,AI-2 信号分子的浓度达到一定的阈值时,LuxQ 发挥磷酸酶的作用,使LuxO 去磷酸化而失去活性,进而调控相关基因的表达[6-8]。
乳酸菌(Lactic acid bacteria,LAB)是一类能将碳水化合物发酵形成乳酸的革兰氏阳性菌的统称,具有改善肠道菌群结构,调节消化系统,延缓机体衰老等功能[9-10]。研究发现,多种乳酸菌的基因组序列中都含有luxS基因的同系物,且能够分泌AI-2 信号分子,如嗜酸乳杆菌(Lactobacillus acidophilus)、长双歧杆菌(Bifidobacterium longum)NCC2705 和粪肠球菌(Enterococcus faecalis)等。AI-2/LuxS 介导的QS 系统参与调控乳酸菌的抑菌性、耐酸性、黏附性及在动物消化道中的定植与存活率等益生特性。张腾等[11]研究发现,植物乳杆菌(L.plantarum)HE-1 中含有luxS基因,AI-2 信号分子和生物膜的形成量均是在12 h 开始大量产生,18 h 达到高峰期,AI-2 信号分子的产量与生物膜的形成量呈正相关,说明AI-2 信号分子参与调控其生物膜形成。杨杰[12]研究发现外源添加AI-2 信号分子对植物乳杆菌(L.plantarum)KLDS1.0391 的生长虽无明显影响,但能促进细菌素的形成。姜黎明[13]研究发现植物乳杆菌(L.plantarum)AY01 和YM4-3 的AI-2 群体感应系统能够调控其抑菌、耐酸、耐胆盐的益生特性。乳酸菌除具有良好的益生特性外,还具备较强的抗氧化能力和产香特性。然而,关于AI-2/LuxS 群体感应系统是否可以调控乳酸菌的抗氧化活性和产香特性还有待探究。
本文从传统发酵食品、鲤鱼肠道等天然环境中分离产AI-2 信号分子的乳酸菌,比较高产与低产AI-2 信号分子的乳酸菌的生物膜形成、抗氧化活性及产香能力的差异,验证AI-2 信号分子对它们的调控作用,进而找到AI-2/LuxS 群体感应与上述三者之间的关系,为开发乳酸菌发酵剂奠定理论基础。
1 材料与方法
1.1 菌株、试剂和仪器
1.1.1 菌株 乳酸菌菌株:16 株乳酸菌DBM2-4、YF-7、YF-10、DF-9、XCT1-7、LJM2-2、LJM1-3、LJ2-2、LJ2-1、LJ3-1、LD1-4、LY2-1、LY1-2-2、L-3、ZHG2-1、ZHG1-4,以上菌株分离自丹东酸面汤(DBM、YF、DF)、葫芦岛酸菜汤(XCT、LJM)、辽宁锦州面团(LJM、LJ)、鲤鱼肠道(LD、LY、L)、辽宁彰武酸黄瓜(ZHG),均由本实验室保藏。
抗氧化阳性对照菌株:鼠李糖乳杆菌(Lactobacillus rhamnosusGG,LGG)ATCC53103,北纳创联生物技术有限公司。
报告菌株:哈维氏弧菌(Vibrio harveyi)BB170,通过哈维氏弧菌BB120 定向突变获得,菌株BB170 对AI-2 非常敏感,可以检测到极少量的AI-2,并诱导其生物发光,作为检测AI-2 信号分子的报告菌株[14]。
1.1.2 培养基和试剂 MRS 固体培养基、MRS 肉汤,北京奥博星生物技术有限责任公司;AB 培养基,山东拓普生物工程有限公司;邻苯三酚、邻苯二胺、亚硫酸氢钠,上海麦克林生化科技有限公司;细菌基因组DNA 快速抽提试剂盒、PCR 扩增引物、DNA marker-D、Taq PCR Master mix,上海生工生物工程有限公司;DPPH,Sigma-Aldrich。
1.1.3 仪器与设备 Imark 酶标仪,美国BIORAD 公司;UV2550 紫外-可见分光光度计,日本岛津有限公司;HT-ECP3000 高压电泳仪、HT8300/8500 全自动凝胶成像分析系统,北京鸿涛基业科技发展有限公司;Bioscreen C 全自动生长曲线分析仪,上海谓载商贸发展有限公司;KS50R 台式高速冷冻离心机,盐城市凯特实验仪器有限公司;VOSHIN96-IIL 超声细胞破碎机,无锡沃信仪器制造有限公司;SW-CJ-1D 型超净工作台,苏州博莱尔净化设备。
1.2 方法
1.2.1 产AI-2 信号分子乳酸菌的筛选 培养至2 代的乳酸菌按2.0%接种于MRS 液体培养基中,37 ℃培养18 h 后,于6 000 r/min 离心10 min,弃去菌泥,用0.22 μm 的滤菌器过滤,得到乳酸菌的无细胞上清液。按同样方法收集30 ℃振荡培养16 h 的哈维氏弧菌BB170 无细胞上清液。
将哈维氏弧菌BB170 按2.0%接种于AB 液体培养基,30 ℃摇床培养至OD595nm为0.8 左右,然后用新鲜的AB 培养基以1∶1 000 稀释哈维氏弧菌BB170,充分混匀后备用。参照蔡针华等[15]研究方法检测其荧光强度值。
1.2.2 产AI-2 信号分子乳酸菌菌株鉴定 形态学:对1.2.1 节筛选的高产AI-2 信号分子的乳酸菌进行革兰氏染色和形态学观察。
生理生化:对1.2.1 节筛选的高产AI-2 信号分子的乳酸菌参考凌代文等[16]的方法进行生理生化鉴定。
16S rRNA 序列分析:采用DNA 快速抽提试剂盒提取乳酸菌DNA,以通用引物27F(5'-A GAGTTTGATCCTGGCTCAG-3')和1492R(5'-TACGGYTACCTTTGTTACGACTT-3')进行PCR 扩增。PCR 扩增条件参照崔天琦等[17]方法,利用琼脂糖凝胶电泳观察扩增结果,扩增成功的产物在上海生物工程有限公司测序,测序结果与NCBI 中已知菌株序列进行比对,寻找同源性较高的菌株,并利用MEGA5.0 构建系统发育进化树。
1.2.3 乳酸菌生长曲线测定 培养至2 代的乳酸菌按2.0%接种于灭活的MRS 液体培养基中,使用全自动生长曲线仪在OD595nm下每隔3 h 测定菌密度,确定各菌株的生长情况。
1.2.4 生物膜形成的测定 生物膜定量分析:向96 孔板中加入200 μL MRS 液体培养基,将乳酸菌以2.0%接种于培养基中,置于37 ℃分别培养24,48,72 h。弃去上层培养液后,用PBS 清洗2~3次去除浮游细胞,晾干后,加100 μL 结晶紫染色20 min,去除染液后用PBS 缓慢冲洗至无明显紫色。晾干后加入200 μL 3.0%的冰醋酸脱色,将脱色后的菌液吸入到新的96 孔板中,用酶标仪在OD595nm下测定吸光度值。
生物膜形态观察:向放置有硅片(使生物膜黏附于硅片上)的24 孔板中加入1.0 mL MRS 液体培养基,乳酸菌以2.0%接种于培养基中,置于37℃分别培养24,48,72 h。硅片取出用无菌水清洗2~3 次后,在4 ℃2.5%戊二醛溶液中固定12 h,用无菌水洗去剩余的戊二醛后用40%,70%,90%,100%乙醇分别脱水15 min,干燥,喷金,扫描电镜(Scanning electron microscope,SEM)观察。
1.2.5 产AI-2 信号分子乳酸菌抗氧化能力测定乳酸菌连续活化3 代后获得的菌悬液在4 ℃,6 000 r/min 离心15 min 后收集菌体,收集的菌体用PBS 缓冲液洗涤2 次后重悬于缓冲液中,调节菌液终浓度为108CFU/mL,一部分作为完整细胞试验,另一部分菌悬液置于0 ℃下超声破碎(变幅杆:φ6;超声开1 s,超声关2 s;功率33%;15 min)后,于4 ℃,6 000 r/min 离心15 min,收集上清为乳酸菌无细胞提取物。
取1.0 mL 样品(完整细胞或无细胞提取物)加入1.0 mL 0.2 mmol/L DPPH-无水乙醇溶液,在室温下避光反应30 min,3 500 r/min 离心10 min,在波长517 nm 下测定上清吸光度值。清除率按公式(1)计算,式中,Ai——1.0 mL 样品加1.0 mL DPPH-无水乙醇;Aj——1.0 mL 样品加1 mL PBS;Ac——1.0 mL PBS 加1.0 mL DPPH-无水乙醇;以LGG 为阳性对照[18]。
超氧阴离子自由基清除能力的测定:取2.0 mL Tris-HCl 缓冲液(150 mmol/L,pH 8.0)加入0.6 mL 样品,在25 ℃下水浴预热,在加入0.4 mL 25℃水浴预热后的邻苯三酚,25 ℃水浴20 min 后在波长325 nm 下测定吸光度值。清除率按公式(2)计算,式中,A11——含样品和邻苯三酚;A10——含样品,邻苯三酚以蒸馏水代替;A01——只含邻苯三酚,A00——不含样品不含邻苯三酚。以LGG 为阳性对照[19]。
1.2.6 产信号分子AI-2 乳酸菌产香能力测定 发酵乳的制备和预处理:培养至3 代的乳酸菌用PBS 缓冲液洗涤2 次后的重悬液(108CFU/mL)按4.0%接于12%无菌脱脂乳中,37 ℃培养至乳凝固,4 ℃下放置24 h 进行后熟。制备好的发酵乳按1∶1 加入16%三氯乙酸溶液混匀,8 000 r/min 离心10 min,取上清液备用。
丁二酮的测定:参照俞本杰[20]的研究方法,以不加邻苯二胺的试管为参比液调零,在波长335 nm 下测定吸光度值。回归方程y=0.0793x +0.0507,R2=0.9952(n=5),计算出样品中丁二酮的含量。
乙醛的测定:参照李妍等[21]的方法,发酵乳中乙醛含量采用碘滴定法测定。按公式(3)计算,式中,V1——空白滴定消耗I2标准溶液体积(mL);V2——样品滴定消耗I2标准溶液体积(mL);C——1/2I2标准溶液浓度(mmol/L);25——乙醛样品称样量(mg);0.022——乙醛化学反应基本单位(g)。
1.2.7 数据处理与统计分析 试验结果均平行测定3 次,结果用“平均值±标准差”表示,并采用IBM SPSS 23 软件以及OriginPro 9.1 软件对数据进行分析处理。
2 结果与分析
2.1 高产AI-2 信号分子乳酸菌的筛选
如图1a 所示,介质对照、阳性对照以及阴性对照的荧光强度值均呈先下降后上升的趋势,这可能是因为初期哈维氏弧菌BB170 稀释液中存在一定量的AI-2 信号分子,产生一定量的荧光物质,然而由于菌体密度较低,荧光会逐渐被猝灭,导致其荧光值逐渐下降。但经过一段时间的培养,菌体密度增加到一定程度后,开始产生AI-2 信号分子并重新诱导菌株发光,使其荧光强度快速增加。阴性和介质对照的荧光强度在4 h 达到最低值,后又逐渐增强,而阳性对照在3 h 达到最低值后逐渐增强,这可能是由于阴性和介质对照没有外源添加信号分子AI-2,只有稀释液中的哈维氏弧菌BB170 菌体密度增加到一定值后,产生的信号分子AI-2 重新诱导发光。本结果与廉雪花[22]的研究结果相似,其介质对照和阴性对照在4 h 达到最低点,阳性对照在3 h 时达到最低点,相对荧光强度计算时间点为4 h。
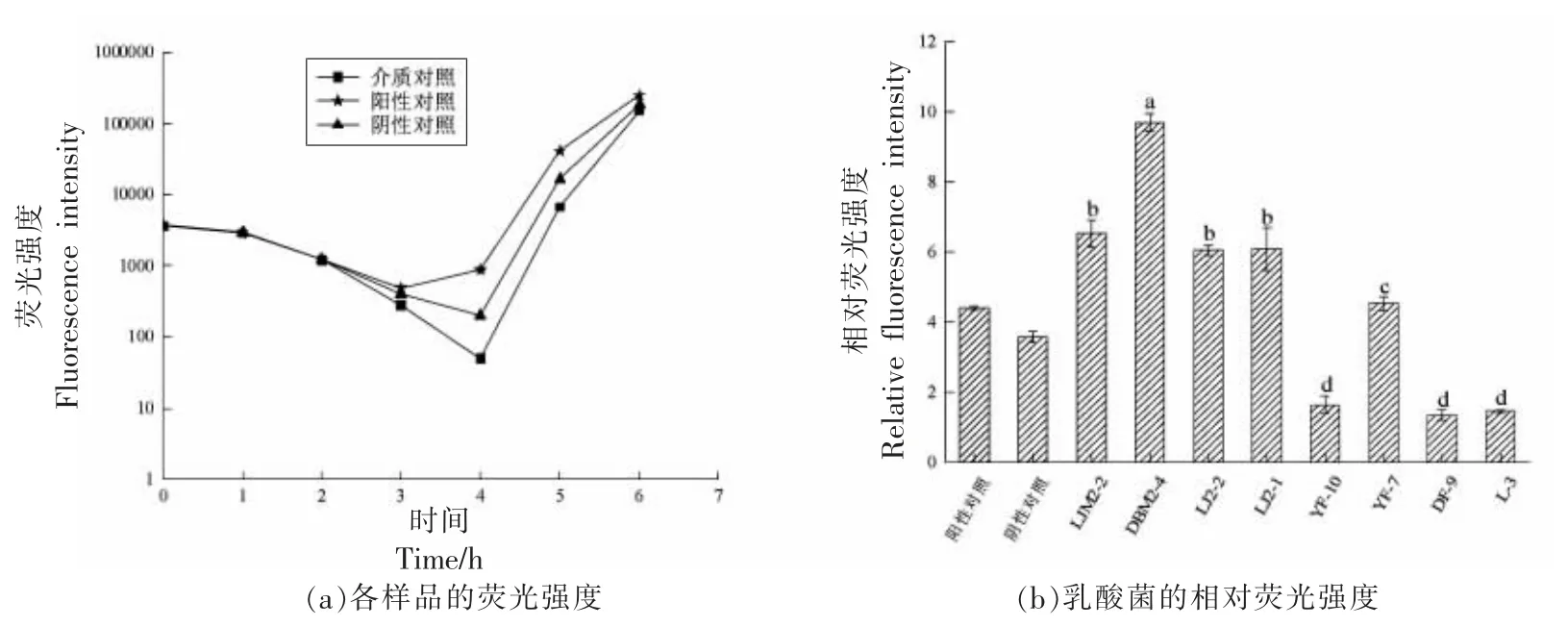
图1 高产AI-2 信号分子乳酸菌的筛选Fig.1 Screening of high-yield AI-2 signal molecule LAB
图1b 展示了8 株乳酸菌的相对荧光强度,由图可知,菌株YF-10、DF-9、L-3 的相对荧光强度均低于阴性对照,说明其不产生AI-2 信号分子。其余5 株乳酸菌的相对荧光强度均高于阴性对照,具有产AI-2 信号分子的能力,其中菌株DBM2-4 的相对荧光强度值最高(P<0.05),因此,选取高产AI-2 信号分子菌株DBM2-4 进行后续特性研究。
2.2 乳酸菌菌株鉴定
由图2 可知,菌株DBM2-4 菌落呈圆形、光滑、乳白色、不透明,可以产生溶钙圈,且革兰氏染色呈紫色的杆菌,同时结合表1 的生理生化鉴定结果,该菌株被初步确定为乳酸杆菌。
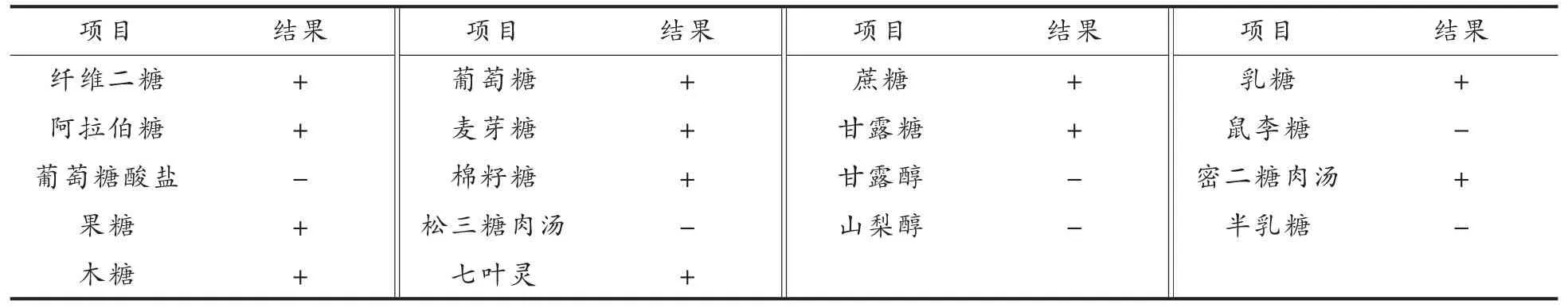
表1 乳酸菌DBM2-4 的生理生化鉴定结果Table 1 Physiological and biochemical identification results of strain DBM2-4

图2 菌株DBM2-4 菌落形态(a)及革兰氏染色(b)(1 000×)Fig.2 The colony morphology(a)and Gram stain(b)of strain DBM2-4(1 000×)
图3a 是菌株DBM2-4 的16S rRNA 电泳图,可以看出片段在1 500 bp 左右,表明该片段扩增成功。构建的发育树的结果见图3b,从图中可以看出菌株DBM2-4 与Lactiplantibacillus plantarumG2-5-6 最为相似,相似度达到99%,因此可以确定菌株DBM2-4 为植物乳杆菌(Lactiplantibacillus plantarum)。
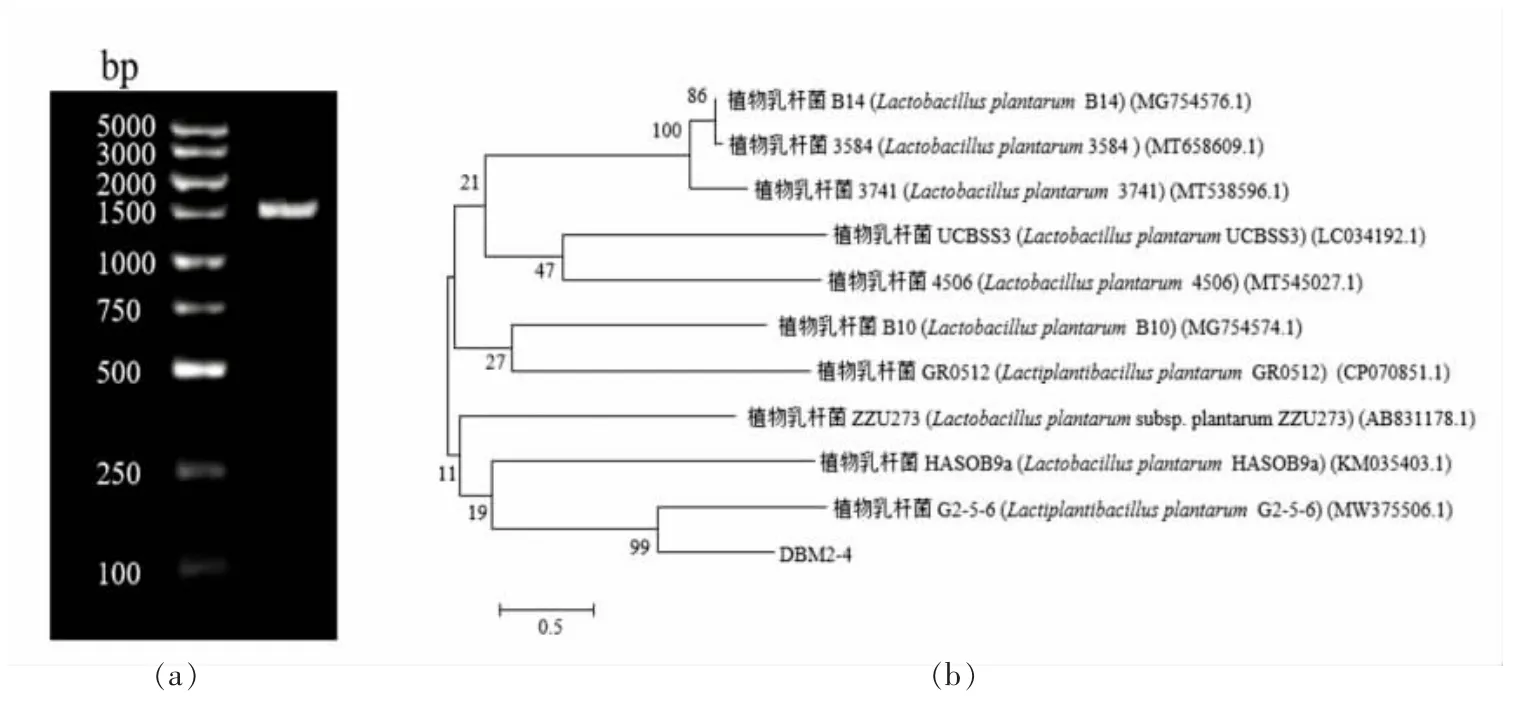
图3 菌株DBM2-4 16S rRNA 基因扩增电泳图(a)和系统发育树(b)Fig.3 The 16S rRNA gene amplification electrophoresis diagram(a)and phylogenetic tree(b)of strain DBM2-4
2.3 乳酸菌生长曲线及生物膜的测定
8 株乳酸菌的生长曲线如图4a 所示,菌株LJM2-2、DBM2-4、LJ2-2、LJ2-1、YF-7 的生长曲线变化趋势一致,在3 h 时进入对数生长期,在9 h 左右进入对数末期后进入稳定期。同时,结合5株乳酸菌的相对荧光强度值,选取菌株YF-7 作为低产AI-2 乳酸菌,比较其与高产AI-2 菌株DBM2-4 在生物膜形成、抗氧化活性和产香能力的差异。
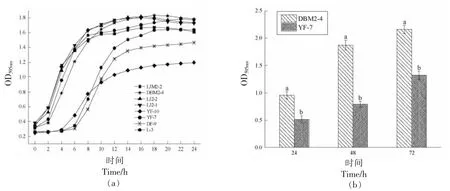
图4 乳酸菌的生长曲线(a)、生物膜形成量(b)和形态结果(c:DBM2-4;d:YF-7)Fig.4 Growth curve(a),biofilm formation(b)and morphological results(c:DBM2-4;d:YF-7)of LAB
在自然环境中,细菌生物膜不仅能抵抗外界环境的胁迫,而且能够增强机体免疫防御的功能[23]。研究发现,AI-2/LuxS 能够调控乳酸菌生物膜的形成,提高其环境适应能力[24]。图4b 显示了产AI-2 能力不同的乳酸菌、在不同时间产生物膜的能力,由图可知,高产和低产AI-2 乳酸菌的生物膜形成量均随培养时间的延长而逐渐增加。其中,高产AI-2 菌株DBM2-4 在24,48,72 h 3 个时间段的生物膜形成量比菌株YF-7 分别高出85.48%,135.54%,63.03%,且在48 h 时生物膜形成能力差异最显著(P<0.05)。图4c 和图4d 分别是菌株DBM2-4 和YF-7 生物膜在24,48,72 h 3个时间段的扫描电镜图,由图可知,随着时间的延长菌株DBM2-4 形成的生物膜变得更加致密,厚度也逐渐增加。与DBM2-4 相比YF-7 形成的生物膜比较分散,这会导致细菌形成的生物膜不牢固。这与吴荣[25]研究的结果相似,外源添加60 μmol/L AI-2 信号分子菌体与未添加AI-2 信号分子相比表面更加平整,菌膜更加光滑,分布更加密集,并且对生物膜的形成也有一定的促进作用。因此,说明群体感应AI-2 信号分子正向调控乳酸菌生物膜的形成。
2.4 乳酸菌抗氧化能力
DPPH 是一个稳定的自由基,常被用来评价菌株的抗氧化能力。图5a 是以DPPH 为指标比较产AI-2 能力不同乳酸菌的抗氧化能力,结果表明,3 株乳酸菌的DPPH 自由基清除率均是完整细胞的高于无细胞提取物的,这可能是因为乳酸菌的胞外活性物质如表面蛋白、胞外多糖等具有清除DPPH 自由基作用的结果[26]。与低产AI-2 的菌株YF-7 相比,高产菌株DBM2-4 完整细胞和无细胞提取物的DPPH 自由基清除能力提高了24.49%和11.37%,且DBM2-4 的DPPH 自由基的清除率高于LGG 阳性对照,而YF-7 略低于LGG阳性对照。说明AI-2 信号分子可以调节乳酸菌表面蛋白、胞外多糖等活性物质,进而起到清除DPPH 自由基的作用。
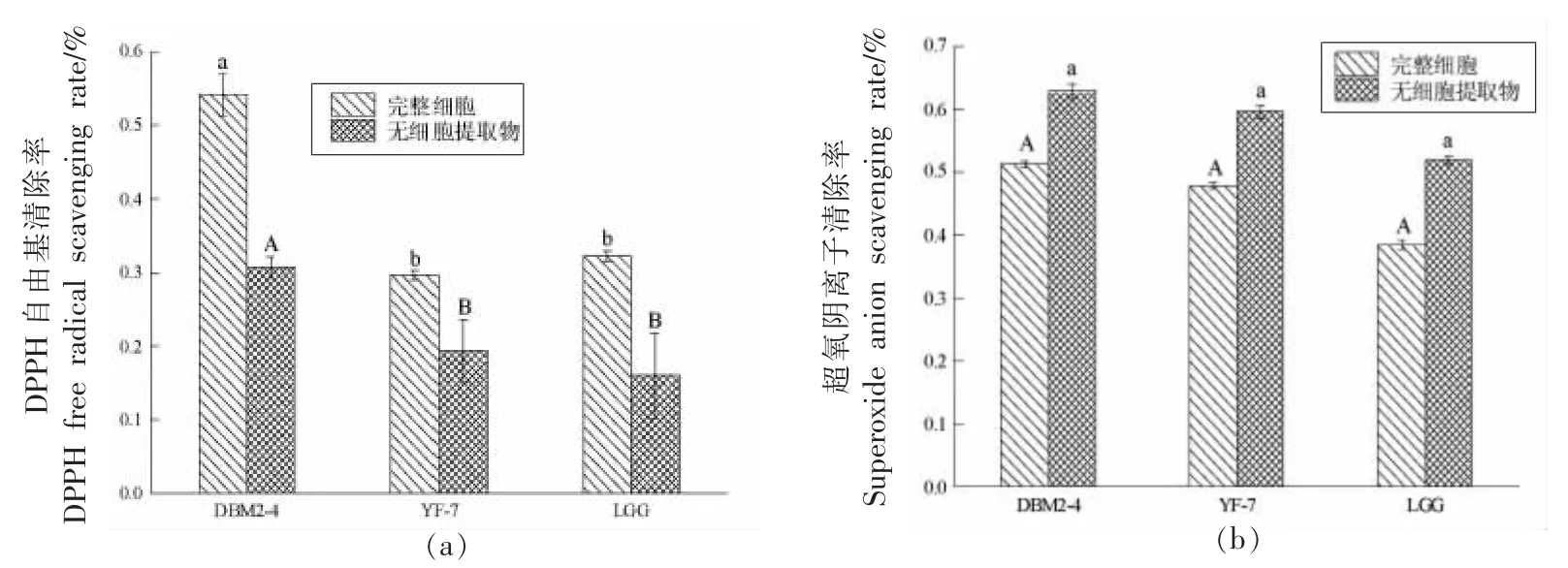
图5 乳酸菌清除DPPH 自由基(a)和超氧阴离子能力(b)Fig.5 The scavenging ability of DPPH free radicals(a)and superoxide anions(b)by LAB
此外,许多自由基是以超氧阴离子(O2-)为前体物质通过一系列的反应得到的,超氧阴离子能够损害细胞进而引发一系列的氧化反应[27]。图5b以超氧阴离子为指标比较产AI-2 不同的乳酸菌的抗氧化能力,结果表明,3 株乳酸菌的超氧阴离子清除率均是无细胞提取物的高于完整细胞的,这是因为大部分的抗氧化酶如超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)存在于细胞内[28]。而菌株DBM2-4 与YF-7 的超氧阴离子的清除率没有显著性差异。说明AI-2 信号分子对乳酸菌胞内的SOD、GSH-Px 等抗氧化酶没有显著的调节作用,使得超氧阴离子的清除率差异不显著。
乳酸菌的DPPH 自由基清除作用主要依靠其胞外的多糖和蛋白等物质,而清除超氧阴离子的能力取决于胞内SOD、GSH-Px 等抗氧化酶,研究结果表明,AI-2 信号分子可以调节乳酸菌胞外表面蛋白、多糖等活性物质,对乳酸菌胞内的SOD、GSH-Px 等抗氧化酶没有显著的调节作用,该研究结果与AI-2/LuxS 群体感应系统调控乳酸菌胞外代谢产物相一致[11-12]。
2.5 丁二酮及乙醛含量测定
优良的乳酸菌发酵剂需要具有抗氧化特性还应具有较好的产香特性,丁二酮和乙醛作为特征性风味物质,能够改善发酵乳的风味及提升产品品质[29-30]。从表2 可得出菌株DBM2-4 的丁二酮和乙醛的产量均高于菌株YF-7,产量分别高出3.88 mg/L 和5.86 mg/L。因此,说明AI-2 信号分子能够增加乳酸菌产生丁二酮和乙醛特征性风味物质的能力。本结果与李妍等[21]研究的乳酸菌菌株的丁二酮和乙醛含量测定结果相似,其中丁二酮含量在7.19~39.21 mg/L,乙醛含量在9.65~20.03 mg/L。

表2 乳酸菌中丁二酮和乙醛含量Table 2 The content of diacetyl and acetaldehyde in lactic acid bacteria
3 结论
本文从丹东酸汤面中获得1 株高产AI-2 信号分子的植物乳杆菌DBM2-4。与低产AI-2 菌株YF-7 相比,植物乳杆菌DBM2-4 培养48 h 后,生物膜形成量增加了135.54%;其完整细胞和无细胞提取物DPPH 自由基清除能力分别提高了24.49%和11.37%,香味物质丁二酮和乙醛产量分别增加了3.42 mg/L 和5.86 mg/L。上述结果表明AI-2/LuxS 群体感应系统介导乳酸菌生物膜形成、抗氧化活性及产香能力。本研究为开发具有高生物活性产AI-2 信号分子的乳酸菌发酵剂提供一定的理论基础。

