小型独立发酵体系制备的发酵菜中菌群结构及功能代谢分析
夏水英 孙全敏 王严 袁文涛 迟乃玉 张庆芳


摘要:為探究发酵菜在不同发酵阶段的菌群结构,解析优势乳酸菌与功能代谢的关系,该研究采用小型独立发酵体系制备发酵菜,以大白菜发酵液及其平板培养物为研究对象,利用高通量测序技术,通过生物信息学、Alpha多样性分析,解析发酵过程中的菌群结构并挖掘优势乳酸菌与功能代谢的关系。研究表明,物种多样性随发酵的进行逐渐降低。在发酵汤汁中,Chryseobacterium(金黄杆菌属)、uncultured_Bacterium_f_Enterobacteriaceae(未培养的肠杆菌属)、Lactobacillus(乳杆菌属)分别在发酵12 h、24 h和15 d占据绝对优势;在优势菌中,Lactobacillus(乳杆菌属)与Carbohydrate metabolism(碳水化合物代谢)、Transcription(转录)等代谢途径呈正相关;Leuconostoc(明串株菌属)与Infectious diseases:Bacterial(细菌性传染病)、Nucleotide transport and metabolism(核苷酸代谢与运输)等代谢途径呈正相关;Lactococcus(乳球菌属)与Amino acid metabolism(氨基酸代谢)、Cell wall/membrane/envelope biogenesis(细胞壁/细胞膜/膜结构的生物合成)等代谢途径呈正相关。该研究阐明了发酵菜中优势乳酸菌与功能代谢的关系,为后续发酵菜风味的改善、发酵工艺的改良提供了新思路,为研发最佳菌种配比的发酵菌剂提供了参考。
关键词:发酵菜;小型独立发酵体系;优势乳酸菌;功能代谢途径;高通量测序技术
中图分类号:TS201.3 文献标志码:A 文章编号:1000-9973(2023)08-0050-10
Analysis of Bacterial Community Structure and Functional Metabolism in
Fermented Vegetables Prepared by Small Independent Fermentation System
XIA Shui-ying1,2, SUN Quan-min1,2, WANG Yan1,2, YUAN Wen-tao1,2, CHI Nai-yu1,2, ZHANG Qing-fang1,2*
(1.School of Life and Health, Dalian University, Dalian 116622, China; 2.Liaoning Marine
Microbial Engineering Technology Research Center, Dalian 116622, China)
Abstract: In order to explore the bacterial community structure of fermented vegetables at different fermentation stages and analyze the relationship between dominant lactic acid bacteria and functional metabolism, in this study,a small-scale independent fermentation system is used to prepare fermented vegetables. With Chinese cabbage fermentation broth and its plate culture as the research objects, the bacterial community structure during fermentation process is analyzed, and the relationship between dominant lactic acid bacteria and functional metabolism is explored by using high-throughput sequencing technology, bioinformatics and Alpha diversity analysis. The results show that the species diversity decreases gradually as the fermentation goes on. In the fermentation broth, Chryseobacterium, uncultured_Bacterium_f_Enterobacteriaceae and Lactobacillus occupy absolute advantages at 12 h, 24 h and 15 d of fermentation respectively.Lactobacillus is positively correlated with the metabolic pathways
such as Carbohydrate metabolism and Transcription.Leuconostoc is positively correlated with the metabolic pathways such as Infectious diseases: Bacterial, Nucleotide transport and metabolism. Lactococcus is positively correlated with the metabolic pathways such as Amino acid metabolism, Cell wall/membrane/envelope biogenesis. In this study, the relationship between dominant lactic acid bacteria and functional metabolism in fermented vegetables is clarified, which has provided new ideas for the improvement of the flavor of fermented vegetables and fermentation process in the future, and provided references for the development of fermenting agents with the optimal proportion of strains.
Key words:fermented vegetables; small-scale independent fermentation system; dominant lactic acid bacteria; functional metabolic pathway; high-throughput sequencing technology
收稿日期:2023-02-19
基金项目:国家重点研发计划(2018YFC0311100)
作者简介:夏水英(1997-),女,硕士,研究方向:微生物及酶工程的基础理论与应用。
通信作者:张庆芳(1965-),女,教授,博士,研究方向:微生物及酶工程的基础理论与应用。
泡菜又称发酵菜,由各类蔬菜经乳酸发酵而成。我国泡菜历史可以追溯到3 000年前,《诗经》有云:“中田有庐,疆场有瓜,是剥是菹,献之皇祖”,“瓜”有蔬菜之意,“菹”即鹽渍工艺,其中盐渍蔬菜就是发酵菜的原型[1]。发酵菜的制作方法各地大同小异,传统的方法是将新鲜的瓜果蔬菜洗净,沥干水分后装坛,加入卤水、冰糖、香辛料、调味料等,进行自然发酵制得的。但随着生物工程技术的发展,发酵菜的制作工艺也得到了进一步优化,主要通过控制发酵温度[2]、pH值[3]、盐浓度[4]、乳酸菌接种量[5]、接种不同菌剂[6]等来达到增产、改善品质与口感的目的。成熟的发酵菜色泽鲜亮、呈草黄色、酸香浓郁、口感脆嫩,具有开胃、解腻和促消化的功效。近年来,有研究表明,发酵菜中的植物乳杆菌具有预防糖尿病[7]、抗肥胖[8]、抗鼠伤寒沙门氏菌感染[9]以及提高免疫力的作用[10]。
各地水质、环境、气候、温度等差异赋予了发酵菜独特的风味与口感,其根源在于菌群结构的差异。在发酵菜的发酵体系中,具有成千上万甚至更多菌群,有益菌会产生对人体有益的代谢产物,腐败菌则会产生不利于身体健康甚至致癌的物质,例如亚硝酸盐。根据我国国家标准,发酵菜中亚硝酸盐含量不得超过 20 mg/kg。当亚硝酸盐摄入超标时,会导致高铁血红蛋白症、维生素A缺乏症与胎儿畸形,还会产生强致癌的N-亚硝基化合物,引发食道癌和胃癌等疾病[11]。正因为发酵菜的营养与危害由微生物的菌群结构决定,所以近年来学者们专注于发酵体系的菌群结构以及细菌多样性的研究,而对发酵菜中优势菌群与功能代谢的关系的研究在国内鲜有报道,国外仅两篇文章有与此相关的内容。由于发酵菜的营养及风味来自于微生物代谢,且乳酸菌在发酵体系中起主导发酵的作用,所以解析乳酸菌与功能代谢的关系对于改善发酵菜的风味、丰富其营养、优化发酵工艺和研发最佳菌种配比的发酵菌剂具有重要意义。
本研究以大白菜为原料,采用小型独立发酵体系进行自然发酵,选取发酵12 h、24 h、15 d的发酵菜汤汁与其平板培养物,进行高通量测序,通过生物信息学的方法分析其多样性与潜在功能,并对二者的菌群结构、功能代谢进行分析,解析了乳酸菌与功能代谢的关系,以期为改善发酵菜的品质、发酵工艺的优化提供理论依据与技术支撑,为新型发酵菌剂的研发提供参考。
1 实验材料与方法
1.1 实验材料
1.1.1 材料与试剂
新鲜大白菜(大连91-12);DP812土壤基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:天根生化科技(北京)有限公司;16S rRNA基因V3~V4区引物合成及建库测序:由北京百迈客生物科技有限公司完成。
1.1.2 培养基配方
MRS液体培养基:葡萄糖 20 g,蛋白胨 10 g,牛肉膏 10 g,酵母膏5 g,三水合乙酸钠 5 g,柠檬酸氢二铵 2 g,四水磷酸氢二钾 2 g,七水硫酸镁 2 g,硫酸锰 0.05 g,吐温80 1 mL,调pH为6.2~6.6,定容至1 000 mL。
MRS固体培养基:在液体培养基的基础上,每1 000 mL加20 g琼脂,调pH为6.2~6.6, 于37 ℃厌氧培养48 h。
1.1.3 仪器与设备
PHS-3E pH计 上海仪电科学仪器股份技术有限公司;CRY-2112恒温摇床 上海茸研仪器有限公司;Thermo Multiskan 1510酶标仪 芬兰Labsystems公司;AL204天平 梅特勒-托利多仪器(上海)有限公司;UV-1200紫外可见分光光度计 上海美谱达仪器有限公司。
1.2 实验方法
1.2.1 发酵制品的制备
采用小型独立发酵体系进行发酵。挑选新鲜、无病害、无枯叶的大白菜,用流水洗净后沥干,将白菜切成均匀的小块(0.5~1 cm),将不同部分的小块混匀,分别称取160 g混匀的白菜小块于若干统一规格为555 mL的无菌矿泉水瓶中,加入1.5%的盐水至完全淹没小块,拧紧瓶盖,置于恒温箱中25 ℃发酵。工艺流程:新鲜、无病害的大白菜→清洗→沥水→切块混匀→装瓶→注盐水→封盖→恒温发酵。将发酵12 h、24 h、15 d的汤汁样品分别命名为S2、S3、S5,将这组命名为S组。
1.2.2 发酵汤汁中微生物的培养
分别取10 mL发酵12 h、24 h、15 d的发酵菜汤汁,于90 mL无菌生理盐水中,加入适量玻璃珠充分振荡,使菌落分散均匀。吸取上述菌液1 mL于9 mL无菌生理盐水试管中,再用另一支1 mL无菌移液管在该试管中吹吸数次,然后精确吸取1 mL菌液至下一试管内,如此重复至稀释到10-7,即得10-1~10-7的稀释液。在无菌条件下选取3个适宜的稀释梯度进行平板涂布,在每个稀释度的试管内吸取200 μL菌液,均匀涂布,每个稀释度做3次重复。将培养皿放入37 ℃恒温培养箱中培养48 h,待长出明显菌落后,将平板中的所有菌落转接于MRS液体培养基中,25 ℃培养至对数期后,以3%的接种量二次转接于MRS液体培养基中,设置3组重复,每12 h取样测定其pH值、OD600 nm值。将发酵12 h、24 h、15 d的发酵汤汁平板培养物分别命名为J2、J3、J5,将这组命名为J组。
1.2.3 平板上菌落的转接
取一个无菌镊子,将长有菌落的整块琼脂培养基夹入装有适量玻璃珠的液体培养基中,轻微振荡瓶身,避免弄碎琼脂,待所有菌落完全洗入液体培养基后,用无菌镊子将琼脂夹出。全过程严格遵守无菌操作。
1.2.4 pH值的测定
每隔12 h,使用精密pH计直接测定汤汁与发酵液的pH值,取3组重复实验的平均值为最终读数。
1.2.5 OD600 nm值的测定
采用紫外分光光度计进行测定,取1 mL MRS液体培养液于9 mL无菌生理盐水中稀释至10-1倍,然后取200 μL稀释后的发酵液于无菌96孔板中,在600 nm波长处测定其吸光度,取3组重复实验的平均值为最终读数。
1.2.6 发酵制品与平板培养物基因组DNA的提取
按照土壤基因组DNA提取试剂盒说明书提取样品DNA。将提取的样品DNA经纯化后进行PCR扩增。
1.2.7 發酵制品汤汁与平板培养物高通量测序
以提取的DNA为模板,采用338F:5'-ACTCCTACGGGAGGCAGCA-3和806R:5'-GGACTACHVGGGTWTCTAAT-3'为引物进行PCR扩增,对扩增产物进行纯化、定量和均一化构建测序文库,并对文库进行质检,将合格的文库用 Illumina HiSeq 2500进行测序,测序任务委托北京百迈客生物科技有限公司完成。
1.2.8 生物信息学分析
首先使用Trimmomatic软件[12]对原始数据进行质量过滤,然后使用Cutadapt软件进行引物序列的识别与去除,其后使用Usearch软件[13]对双端reads进行拼接并去除嵌合体,最终得到高质量的序列用于后续分析。
用Usearch软件对相似度为97.0%的有效序列进行聚类分析,获得操作分类单元(operational taxonomic unit,OTU)[13]。使用QIIME 2软件进行α多样性分析。使用PICRUSt2软件对发酵菜样本中的微生物进行基因功能预测,并比较样本在不同功能之间存在的差异[14]。
2 结果与分析
2.1 理化特性差异分析
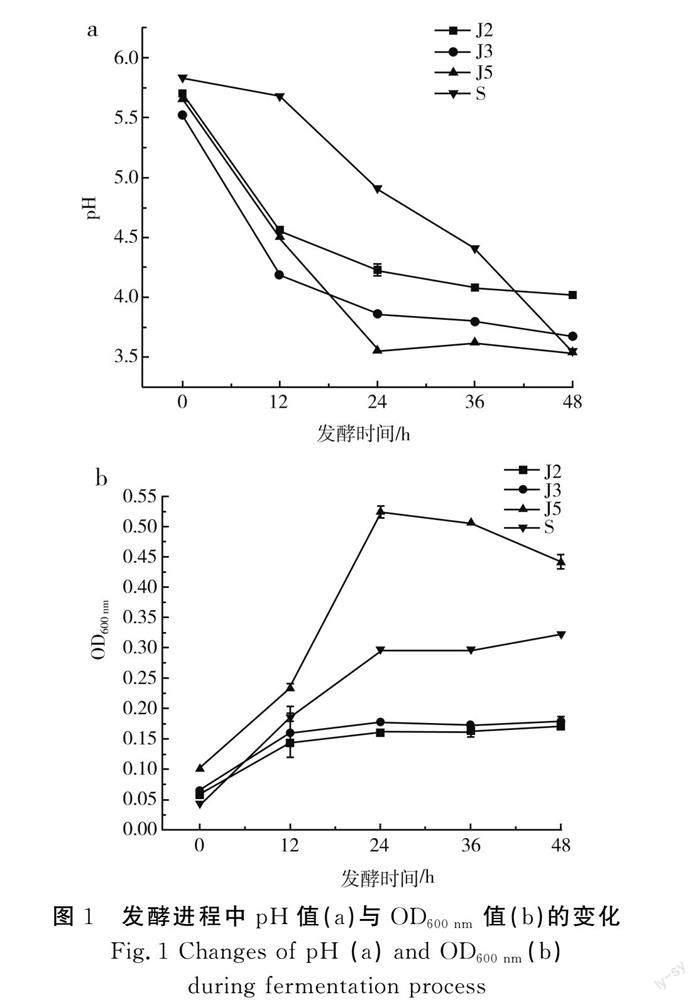
发酵过程中pH值与OD600 nm值变化曲线见图1。
由图1中a可知,J2、J3、S样品的pH值均呈现下降的趋势,J5样品呈现先下降后上升再下降的趋势。其中J5样品的产酸能力最强,在24 h时发酵液的pH值最低,为3.54,低于其他样品的最低pH值,表明该样品中含有大量耐酸菌,能够在低pH值下继续产酸;J3样品产酸最快,发酵12 h时pH值降至4.19,低于其他样品,表明该样品中含有大量的产酸菌;S样品在发酵前36 h,pH值高于其他3个样品,在发酵36 h以后,pH值逐渐低于J2、J3样品,但仍高于J5样品,表明发酵汤汁中含有大量的杂菌,抑制了产酸菌的生长繁殖,当低pH值抑制杂菌生长时,产酸菌的生长抑制解除而大量产酸。由图1中b可知,J2、J3、S样品的OD600 nm均呈现上升趋势,表明在发酵48 h时,体系环境(J2、J3、S的pH值分别为4.01,3.68,3.54)依旧适宜微生物生长。J5样品的OD600 nm值在各个时间点均大于其余3个样品,表明该样品中耐酸菌的含量远大于其他样品;且J5样品的OD600 nm值在发酵24 h左右呈先升后降的趋势,原因可能是24 h时pH值最低,超出了微生物的承受范围,因此OD600 nm值下降,这一解释与图1中a相符合。
2.2 高通量测序质量评估
本实验测序结果见表1。
6个样品共获得566 432条原始序列,经过双端序列质量控制和拼接后共得到564 758条高质量序列,再将高质量序列进行拼接、过滤和嵌合后共得到533 350条有效序列,每个样品的有效序列数均在70 000条以上,序列的平均碱基长度≥426 bp,平均GC含量>50%,另外,所有样本的测序质量值Q20>98%、Q30>95%,有效序列占比>92%。以上表明本测序结果数据可信。
2.3 稀释曲线分析
稀释曲线可以评估样品的测序量以及饱和情况,也可以间接评价物种丰富度,其横坐标表示个体数,纵坐标表示物种数。该方法通过逐步扩大测序深度,从而观察曲线的变化情况。随着样品测序深度的增加,曲线随之上升,当达到一定值时,增加测序深度,曲线趋于平缓,说明取样量足够,能覆盖样品的所有物种,从而真实有效地反映样品中绝大多数物种信息[15]。
由图2可知,S组中各样品曲线均呈现先上升后趋于平稳的趋势,而J组各样品中,随着测序深度的增加,曲线的斜率逐渐减小,但未达到平稳状态,说明测序量未饱和,需进一步扩大测序深度。
2.4 Shannon指数曲线分析
Shannon指数能反映样品中的物种多样性,指数越大说明物种种类越多、越丰富,表明样本中绝大多数的物种信息已被覆盖[16]。Shannon指数曲线见图3,各样品Shannon指数均先随着测序量的扩大而增加,之后Shannon指数增加量逐渐减小,最终曲线趋于平稳,表明测序量已达到饱和。此外,Shannon指数:S2>S3>S5>J2>J3>J5,表明发酵初期的物种丰富度与物种多样性大于发酵后期。
2.5 细菌群落Alpha多样性分析
为明确发酵进程中的物种丰富度,从而进行细菌群落Alpha多样性分析,结果见表2。
ACE指数、Chao 1指数和Shannon指数合称为Alpha多样性指数,ACE指数与Chao 1指数可以用于衡量物种丰富度,指数越大说明样品的物种丰富度越大;Shannon指数通常用于衡量样品中的物种多样性,Shannon指数越大,说明样品的物种多样性越高;覆盖率则表示可观测到的OUT数目,每个OUT数则对应一个不同的微生物种。其中ACE指数和Chao 1指数表现为S2>S3>S5>J5>J3>J2,Shannon指数表现为S2>S3>S5>J2>J3>J5,表明S2样品物种丰富度与物种多样性最大,即发酵12 h的汤汁中,微生物数目和种类最多;各样品的覆盖率均大于99%,说明样品中所有物种均能被检测出,测序数据真实可靠。
2.6 物种组成与结构的差异分析
为揭示发酵汤汁与平板培养物的菌群结构差异,将发酵汤汁及其平板培养物进行高通量测序,结果见表3,可以看出发酵汤汁中,发酵12 h的物种数明显多于24 h与15 d时,此结果与前文所述相一致。
2.6.1 门水平上的菌群结构差异
由图4中a可知,门水平上,共注释到9个菌门,两体系菌群结构组成差异显著,且各菌门的相对丰度有所差异。由图4中b可知,各发酵时间点各样品之间菌群结构及相对丰度有所差异。在S2样品中相对丰度>1%的菌门有Firmicutes(25%)、Proteobacteria(36.43%)、Bacteroidetes(33.90%)、Cyanobacteria(4.08%),J2样品中相对丰度>1%的仅有Firmicutes(80.36%)、Proteobacteria(19.32%)。在S3样品中,Firmicutes(57.06%)、Proteobacteria(37.32%)、Bacteroidetes(1.05%)、Cyanobacteria(4.33%)占据优势,J3样品仅Firmicutes(55.64%)、Proteobacteria(44.32%)占据优势。由此表明在发酵12 h与24 h时发酵汤汁中优势菌门相同,仅相对丰度存在差异,发酵汤汁与其平板培养物中菌群结构与相对丰度存在显著差异。在S5样品中占据优势的菌门有Firmicutes(68.84%)、Proteobacteria(27.54%)和Cyanobacteria(2.95%),J5样品中仅Firmicutes(98.48%)、Proteobacteria(1.08%)占据优势。由此表明,在发酵15 d后,发酵菜汤汁中优势菌群发生改变,推测由低pH值导致。综上所述,Firmicutes、Proteobacteria、Cyanobacteria在发酵菜各发酵时间点均占据优势,Bacteroidetes仅在发酵12 h和24 h占据优势,其中Firmicutes在发酵进程中呈上升趋势,Proteobacteria和Cyanobacteria呈先上升后下降的趋势,Bacteroidetes呈下降趋势。
2.6.2 属水平上的菌群结构差异
所有样品共注释到89个菌属,本部分仅对相对丰度排名前十的物种进行分析,见图5。
由图5中a可知,S组与J组间属水平上菌群结构组成及相对丰度差异显著。由图5中b可知,在属水平上,各发酵时间点各样品之间菌群结构及其相对丰度差异明显。在S2样品中,相对丰度>1%的有uncultured_Bacterium_f_Enterobacteriaceae(28.49%)、Leuconostoc(10.11%)、Lactococcus(13.87%)、Chryseobacterium(33.14%)、uncultured_Bacterium_o_Chloroplast(4.08%)、Acinetobacter(2.77%);在J2样品中,Lactobacillus(58.24%)、uncultured_Bacterium_f_Enterobacteriaceae(17.55%)、Leuconostoc(17.16%)、 Lactococcus(4.93%)、Acinetobacter(1.76%)占據优势。由此可知,在发酵12 h时,发酵汤汁中Chryseobacterium占据绝对优势,平板培养物中Lactobacillus占据绝对优势。
在S3样品中,优势菌属(相对丰度>1%)有Lactobacillus(22.50%)、uncultured_Bacterium_f_Enterobacteriaceae(35.90%)、Leuconostoc(8.32%)、Lactococcus(25.15%)、uncultured_Bacterium_o_Chloroplast(4.33%)、Enterococcus(1.01%);J3中仅uncultured_Bacterium_f_Enterobacteriaceae(44.27%)、Leuconostoc(44.78%)、Lactococcus(10.16%)为优势菌属。由此可知,在发酵24 h时,发酵汤汁中uncultured_Bacterium_f_Enterobacteriaceae占据绝对优势,平板培养物中Leuconostoc占据绝对优势。在S5样品中,Lactobacillus(44.50%)、uncultured_Bacterium_f_Enterobacteriaceae(26.14%)、Leuconostoc(6.36%)、Lactococcus(17.77%)、uncultured_Bacterium_o_Chloroplast
(2.95%)占据优势;J5样品中仅Lactobacillus(97%)为优势菌属。由此可知,发酵15 d时,无论是发酵汤汁中,还是平板培养物中,Lactobacillus均占据绝对优势。
此外,在优势菌中,Lactobacillus、Leuconostoc、Lactococcus等乳酸菌在不同发酵时间点、不同发酵体系中相对丰度不同,Lactobacillus在所有样品中的相对丰度出现S2
2.7 KEGG功能预测差异分析
通过KEGG代谢途径的组成及差异分析,可以观测不同样品间微生物群落的功能基因在代谢途径上的差异和变化,是研究在环境条件变化下群落代谢功能改变的有效手段。KEGG代谢途径差异见图6,P<0.05表示KEGG代谢差异显著。
由图6可知,在43条KEGG代谢途径(S5、J5中仅42条)中,相对丰度排名前三的为Global and overview maps(全局和总览图)、Carbohydrate metabolism(碳水化合物代谢)、Amino acid metabolism(氨基酸代谢),表明这3个代谢途径对样品中微生物的生长繁殖非常重要,其中Global and overview maps为关键代谢途径。
此外,由图6可知Endocrine system (内分泌系统)、Cellular community-prokaryotes(细胞群落-原核生物)、Carbohydrate metabolism(碳水化合物代谢)、Metabolism of terpenoids and polyketides(萜类和酮类化合物代谢)、Membrane transport(膜运输)5个代谢途径在样品中的相对丰度出现S2
2.8 COG功能预测差异分析
COG(Clusters of orthologous groups of proteins)即原核生物同源蛋白簇数据库,是原核生物常用的蛋白功能分类数据库。COG功能差异柱状图见图7。
由图7可知,样品间COG功能差异显著,经过基因注释共得到24条COG功能代谢途径,其中General function prediction only (一般功能预测) 在所有样品中相對丰度最大,表明该途径为关键COG代谢途径;相对丰度较大的还有Amino acid transport and metabolism(氨基酸运输与代谢)、Translation, ribosomal structure and biogenesis(核糖体和生物发生)、Transcription(转录)等代谢途径,表明这些COG代谢途径为生物生长繁殖所必需。
此外,Defense mechanisms(防御机制)、Carbohydrade transport and metabolism(碳水化合物的运输和代谢)、General function prediction only(一般功能预测)、Signal transduction mechanisms(信号传导机制)、Transcription(转录)5个代谢途径相对丰度出现S2
2.9 优势乳酸菌与功能代谢的相关性分析
基于上述结果,为了进一步明确优势乳酸菌与功能代谢的关系,利用Canoco 5软件进行RDA分析,结果见图8。
由图8中a和b可知,Endocrine system(内分泌系统)、Cellular community-prokaryotes(细胞群落-原核生物)、Carbohydrate metabolism(碳水化合物代谢)、Metabolism of terpenoids and polyketides(萜类和酮类化合物代谢)、Membrane transport(膜运输)等KEGG代谢途径,以及Defense mechanics(防御机制)、Carbohydrade transport and metabolism(碳水化合物的运输和代谢)、General function prediction only(一般功能预测)、Signal transduction mechanisms(信号传导机制)、Transcription(转录)等COG代谢途径与Lactobacillus呈正相关;由图8中c和d可知,Translation(翻译)、Infectious diseases:Bacterial(细菌性传染病)、Signaling molecules and interaction(信息分子与相互作用) 3条KEGG代谢途径,以及Translation, ribosomal structure and biogenesis(翻译、核糖体结构与生物发生)、Nucleotide transport and metabolism(核苷酸代谢与运输)2条COG代谢途径与Leuconostoc呈正相关;由图8中e和f可知,Circulatory system(循环系统)、Energy metabolism(能量代谢)、Amino acid metabolism(氨基酸代谢)、Transport and catabolism(运输与分解代谢)、Excretory system(排泄系统)等KEGG代谢途径,以及Cell wall/membrane/envelope biogenesis(细胞壁/细胞膜/膜结构的生物合成)、Chromatin structure and dynamics(染色质结构和动力学)、Inorganic ion transport and metabolism(无机离子运输级分解代谢)、Function unknown(未知功能)等COG代谢途径与Lactococcus呈正相关。
3 讨论与结论
发酵菜物种丰富、组成多样,因此受到了大批学者的青睐。根据文献[17-19]对发酵食品在发酵前、中、后期细菌群落结构的研究,再结合本实验室前期研究结果,即发酵12 h、24 h、15 d时发酵菜理化指标及 OD600 nm 值变化明显[20],本研究选取发酵12 h、24 h、15 d的发酵菜汤汁及其平板培养物作为研究对象,通过高通量测序技术,研究各发酵时间点两组样品的菌群结构,并通过生物信息学与统计学的方法对其潜在功能进行预测,进一步分析优势乳酸菌与潜在功能代谢的关系。
目前,通常采用泡菜坛、玻璃罐、大型塑料桶和发酵池制作发酵菜[21],这在食用和取样时带来发酵菜腐败的风险,也无法保证发酵过程中的安全问题。而本研究采用小型独立发酵体系制作发酵菜,制造了多个独立的发酵环境。在取样时,直接取其中一瓶发酵菜进行相关测定,下次取样时再取另一瓶,该方法避免了因反复取样带来的杂菌污染问题,防止了腐败现象的发生,从而使实验结果更准确;另外,有利于简化取样操作,一般需要分别从泡菜坛的上、中、下层取样[22],而该体系仅需要将发酵容器摇匀即可取样。此外,该体系也避免了家庭式手工制作的发酵菜因制作过多、食用不及时而带来的食品腐败问题和食品浪费问题,保证了工厂式大规模发酵过程中的生产卫生问题。
本研究发现,随着发酵的进行,体系中物种多样性呈下降趋势。该结果已被先前的研究所证实,例如Yang等[23]研究发现萝卜泡菜中细菌多样性随着发酵的进行而显著下降。Wang等[19]研究发现,泡菜中的杂菌在发酵过程中出现“自净”的现象。本研究还发现, Firmicutes、Proteobacteria是发酵菜汤汁与其平板培养物中的优势菌门,uncultured_Bacterium_f_Enterobacteriaceae、Lactobacillus、Lactococcus和Leuconostoc是二者的优势菌属。该结果与Rao等[24]的研究结果相符合,但该研究并未对平板培养物中的物种情况作介绍。此外,Chryseobacterium、uncultured_Bacterium_f_Enterobacteriaceae、Lactobacillus分别在发酵12 h、24 h、15 d的汤汁中占绝对优势,因此发酵12 h与24 h的发酵菜不适宜食用。有研究发现,Lactobacillus能减少4种苦味氨基酸(His、Met、Phe、Lys)的含量,具有降低发酵菜苦味的功效[27],还能提高发酵菜的感官品质和风味[25]。所以,为减少发酵菜的苦味,改善发酵菜的风味,可以采取接种Lactobacillus的方式进行发酵。在本研究中,无论是发酵汤汁还是平板培养物中,Lactobacillus在发酵15 d时相对丰度最高,分别为44.5%、97.6%,所以,以发酵15 d的发酵液作为母水进行发酵,有望提升发酵菜的口感。
挥发性成分与非挥发性成分共同贡献发酵菜的风味,挥发性成分决定发酵菜的香味,非挥发性成分则影响发酵菜的口感[26]。这些均归功于微生物的代谢,例如,有研究发现,Bacteroides、Lactobacillus、Lactococcus、Enterobacteriaceae等菌属是发酵菜中产挥发性成分的主要物种[27]。本研究发现,Glabal and overview maps、Carbohydrate metabolism和Amino acid metabolism为主要的KEGG代谢途径。此结果与文献[28]的研究结果一致。
本研究还发现Carbohydrate metabolism、Metabolism of terpenoids and polyketides等5条KEGG代谢途径以及Carbohydrade transport and metabolism、Transcription等5条COG代谢途径受Lactobacillus影响,且呈正相关。Liang等[29-30]也发现Lactobacillus参与碳水化合物、氨基酸、脂类的代谢,从而形成风味物质。所以为增加发酵菜的风味,在研发发酵菌剂时可以适当提高乳杆菌属的比例。
此外,本研究还发现,Infectious diseases等3条KEGG代谢途径与Translation,ribosomal structure and biogenesis、Nucleotide transport and metabolism 2条COG代谢途径与Leuconostoc呈正相关。由于该菌具有Infectious diseases的功能,可在發酵菌剂的研发中适当降低其比例。Lactococcus影响Amino acid metabolism等5条KEGG代谢途径和Cell wall/membrane/envelope biogenesis等4条COG代谢途径,随着其丰度的增加而增加。由于Amino acid metabolism能够产生改善发酵菜风味的氨基酸,所以在发酵菌剂的研发中,可以增加其比例。但目前没有相关研究发现此类现象,所以本课题组下一步工作将致力于研发发酵菌剂,该菌剂能生产出最佳风味与口感的发酵菜。
参考文献:
[1]陈功,夏有书,张其圣,等.从中国泡菜看四川泡菜及泡菜坛[J].中国酿造,2010(8):5-8.
[2]MAJOR N, BAZON I, ISIC N, et al. Bioactive properties, volatile compounds, and sensory profile of sauerkraut are dependent on cultivar choice and storage conditions[J].Foods,2022,11(9):1218.
[3]SKONBERG D I, FADER S, PERKINS L B, et al. Lactic acid fermentation in the development of a seaweed sauerkraut-style product:microbiological,physicochemical, and sensory evaluation[J].Journal of Food Science,2021,86(2):334-342.
[4]WANG X, SONG G, HE Z, et al. Effects of salt concentration on the quality of paocai, a fermented vegetable product from China[J].Journal of the Science of Food and Agriculture,2021,101(15):6202-6210.
[5]YANG X, WANG Y, HAO M, et al. Synergistic effect of the lactic acid bacteria and salt coagulant in improvement of quality characteristics and storage stability of tofu[J].Journal of Oleo Science,2020,69(11):1455-1465.
[6]ALAN Y, YILDIZ N. Effects of Lactobacillus used as the starter culture on naturally fermented pickled cabbage[J].Food Science and Technology,2022,42:45020.
[7]HUANG Z H, LIN F X, ZHU X Y, et al. An exopolysaccharide from Lactobacillus plantarum H31 in pickled cabbage inhibits pancreas alpha-amylase and regulating metabolic markers in HepG2 cells by AMPK/PI3K/Akt pathway[J].International Journal of Biological Macromolecules,2020,143:775-784.
[8]ZHU K, TAN F, MU J, et al.Anti-obesity effects of Lactobacillus fermentum CQPC05 isolated from Sichuan pickle in high-fat diet-induced obese mice through PPAR-α signaling pathway[J].Microorganisms,2019,7(7):194.
[9]HIRANO S, YOKOTA Y, EDA M, et al. Effect of Lactobacillus plantarum Tennozu-SU2 on Salmonella typhimurium infection in human enterocyte-like HT-29-Luc cells and BAL-B/c mice[J].Probiotics and Antimicrobial Proteins,2017,9(1):64-70.
[10]BALLESTER E, RIBES S, BARAT J M, et al. Spoilage yeasts in fermented vegetables:conventional and novel control strategies[J].European Food Research and Technology,2022,248(2):315-328.
[11]皮佳婷,劉冬敏,王建辉,等.乳酸菌降解泡菜中亚硝酸盐的机制及应用研究现状[J].食品与发酵工业,2021,47(24):301-307.
[12]BOLGER A M, LOHSE M, USADEL B. Trimmomatic: a flexible trimmer for Illumina sequence data[J].Bioinformatics,2014,30(15):2114-2120.
[13]EDGAR R C. UPARSE: highly accurate OTU sequences from microbial amplicon reads[J].Nature Methods,2013,10(10):996-998.
[14]PARKS D H, TYSON G W, HUGENHOLTZ P, et al. STAMP: statistical analysis of taxonomic and functional profiles[J].Bioinformatics,2014,30(21):3123-3124.
[15]TANG Y, ZHOU X, HUANG S, et al. Microbial community analysis of different qualities of pickled radishes by Illumina MiSeq sequencing[J].Journal of Food Safety,2019,39(2):12596.
[16]QIU Z C, LI N Y, LU X M, et al. Characterization of microbial community structureand metabolic potential using Illumina MiSeq platform during the black garlic processing[J].Food Research Intrnational,2018,106:428-438.
[17]ZABAT M A, SANO W H, WURSTER J I, et al. Microbial community analysis of sauerkraut fermentation reveals a stable and rapidly established community[J].Foods,2018,7(5):77.
[18]LIU Z, PENG Z, HUANG T, et al. Bacterial community dynamics and physicochemical characteristics in natural fermentation of jiang-shui, a traditional food made in northwest China[J].Journal of the Science of Food and Agriculture,2019,99(7):3391-3397.
[19]WANG D D, CHEN G, TANG Y, et al. Effects of temperature on paocai bacterial succession revealed by culture-dependent and culture-independent methods[J].International Journal of Food Microbilogy,2020,317:108463.
[20]周姝靜,孙全敏,迟乃玉,等.东北酸菜发酵前后期细菌菌群多样性分析[J].中国酿造,2022,41(5):42-46.
[21]LIU L, SHE X, CHEN X, et al. Microbiota succession and chemical composition involved in the radish fermentation process in different containers[J].Frontiers in Microbiology,2020,11:445.
[22]YANG X Z, HU W Z, XIU Z L, et al. Microbial community dynamics and metabolome changes during spontaneous fermentation of northeast sauerkraut from different households[J].Frontiers in Microbiology,2020,11:1878.
[23]YANG Y, FAN Y, LI T, et al. Microbial composition and correlation between microbiota and quality-related physiochemical characteristics in Chongqing radish paocai[J].Food Chemistry,2022,369:130897.
[24]RAO Y, TAO Y F, CHEN X, et al. The characteristics and correlation of the microbial communities and flavors in traditionally pickled radishes[J].LWT-Food Science and Technology,2020,118:108804.
[25]XIANG W L, ZHANG N D, LU Y, et al. Effect of Weissella cibaria co-inoculation on the quality of Sichuan pickle fermented by Lactobacillus plantarum[J].Food Science and Technology,2020,121:108975.
[26]陈卓,黄丹,于华,等.功能菌对泡菜风味物质形成的影响[J].中国调味品,2017,42(12):66-70.
[27]LIN L J, ZENG J, TIAN Q M, et al. Effect of the bacterial community on the volatile flavour profile of a Chinese fermented condiment-red sour soup during fermentation[J].Food Research International,2022,155:111059.
[28]LIANG H P, CHEN H Y, ZHANG W X, et al. Investigation on microbial diversity of industrial Zhacai paocai during fermentation using high-throughput sequencing and their functional characterization[J].LWT-Food Science and Technology,2018,91:460-466.
[29]LIANG H P, CHEN H Y, JI C F, et al. Dynamic and functional characteristics of predominant species in industrial paocai as revealed by combined DGGE and metagenomics sequencing[J].Frontiers in Microbiology,2018,9:2416.
[30]PENG Q P, JIANG S M, CHEN J L, et al. Unique microbial diversity and metabolic pathway features of fermented vegetables from Hainan, China[J].Frontiers in Microbiology,2018,9:399.

