紫心甘薯IbMYB1 上游7 个调控蛋白的互作与表达分析
付丹文,陈亚慧,杨少华,高 峰
(1.华南师范大学生命科学学院,广东 广州 510631;2.广东省科学院南繁种业研究所,广东 广州 510315)
【研究意义】甘薯〔Ipomoea batatas(L).Lam.〕是重要的粮食、饲料和工业原料作物。花色素苷具有抗氧化和清除自由基的作用,对肝脏和眼睛具有保护作用,对糖尿病具有一定的治疗作用[1]。紫心甘薯的块根生长于土壤中,处于完全黑暗的环境,内部能大量积累花色素苷,其花色素苷积累部位具有一定的特殊性。目前,对于植物的花、果、茎、叶等地上部分花色素苷合成以及环境信号因子影响的分子机制有了一定认识,尤其是光照对花色素苷合成的调控机制及信号传导过程已比较清楚[2]。对于非依光型或无法直接接受光照的植物根、块根或块茎中花色素苷合成调控机制及信号传递过程却不明了。紫心甘薯具有重要的开发价值,对其进行非依光型及植物地下部分花色素苷合成的调控机制研究,可以丰富和深化植物花色素苷生物合成分子调控的基础理论,为紫心甘薯高花色素苷品种选育提供新的遗传标记,为其分子育种筛选出合适的操作元件或改造靶标,还可为提高块根中色素含量提供新的思路。
【前人研究进展】花色素是类黄酮家族最大的分支,类黄酮是一类以黄烷C6-C3-C6 为骨架的衍生物,是普遍存在的植物次生代谢产物。根据黄烷骨架上烃基和甲氧基的数目和位置,花色素可以分为六类:花葵素、花青素、花翠素、甲基花青素、牵牛花色素和锦葵色素[3]。植物花色素苷是原位合成的,由一系列的酶催化完成。随后,由谷胱甘肽-S-转移酶将花色素苷由细胞质转移至液泡,并储藏于液泡中[3]。在植物体内,特定花色素苷是否合成、合成多少及合成部位主要是由其合成途径中多个结构基因的表达水平决定,而表达水平受转录因子的调控[4]。参与植物花色素苷合成酶基因表达调控的转录因子主要有三类:MYB、bHLH(也称MYC)和WD40。其中,R2R3-MYB 型转录因子直接与花色素苷生物合成酶基因的启动子区域结合,从而激活其转录表达。R2R3-MYB 参与植物花色素苷生物合成已有较多报道,如R2R3-MYB 转录因子GhMYB1a参与调控非洲菊花青素和黄酮醇积累[5];茄子中R2R3-MYB 转录因子SmMYB75受光诱导,在花瓣中特异性表达,调控茄子花青素的积累[6];毛白杨中R2R3-MYB 转录因子MYB6,主要在幼叶中表达,MYB6的过表达上调类黄酮生物合成基因的表达,导致花青素和原花青素的积累显著增加[7];R2R3-MYB 转录因子MdMYB114促进苹果果皮中花色素苷的积累[8];葡萄紫色叶和茎中,2 号染色体上的VvMYBA1表达上调,14号染色体上VvMYBA5、VvMYBA6和VvMYBA7调控葡萄营养组织花色素苷的积累,1 组R2R3-MYB 负调控葡萄营养组织花色素苷的积累[9],LMMYB参与番茄果实颜色的形成[10],CsMYB4-5、CsMYB4-6 和CsMYB4-7 参与调控茶树树叶花青素积累[11]。
【本研究切入点】已有研究表明,紫心甘薯中R2R3-MYB 转录因子IbMYB1通过与花色素苷合成途径酶基因启动子的直接结合激活其表达,从而促进花色素苷的合成[12]。IbMYB1基因在转基因黄肉甘薯中超表达,导致一系列花色素苷合成酶基因表达上调,花色素苷含量增加,出现黄中带紫的“双色”薯肉,抗氧化性显著提高[13]。IbMYB1基因的上游转录调控因子的调控机制目前尚不明确。本研究前期利用已克隆的IbMYB1启动子序列,分别进行酵母单杂交文库筛选,以筛选其上游转录调控因子,并对筛选出的上游转录调控因子与靶基因关系、亚细胞定位、自激活活性以及它们之间的相互作用进行研究,筛选得到的7 个IbMYB1上游转录调控因子分别为IbERF1、IbPDC、IbPGP19、IbSCF、IbWRKY1、IbJOX4 和IbEIN3-2。【拟解决的关键问题】 本研究对7 个IbMYB1上游调控蛋白的互作与表达进行分析,进一步阐明花色素苷在特定时空合成与积累的调控网络。
1 材料与方法
1.1 试验材料
供试材料为紫心甘薯品系‘A5’和白心甘薯‘禺北白’,采自华南师范大学生物园。野生型拟南芥(Arabidopsis thaliana)种子保存于华南师范大学生命科学学院实验室。载体pCambia1300由华南师范大学生命科学学院高彩吉老师提供;载 体pSAT4-nEYP-C1 和pSAT4-cEYP-C1 由 华南师范大学生命科学学院王亚琴老师提供;载体pGADT7 和pGBKT7 由华南师范大学生命科学学院实验室保存。
1.2 试验方法
1.2.1植物总RNA 提取、纯度鉴定及反转录 使用植物总RNA 小提试剂盒(Magen),进行紫心甘薯块根RNA 的提取,具体方法参照试剂盒操作步骤。从所得RNA 溶液中吸取2 μL 总RNA,使用Nano Drop ND1000 微量测定分光光度计测定RNA 浓度并进行纯度鉴定,测定结果为OD260/OD280<2.0,OD260/OD280>2.0,可用于反转录试验,同时吸取5 μL 总RNA 进行琼脂糖凝胶电泳检测其纯度。紫外检测能看到两条清晰可区分的主带(28S 和18S)的RNA,表明RNA 无降解,用于后续反转录试验。按照Takara 说明书合成cDNA 第一链,-20 ℃保存备用。
1.2.2目的片段与表达载体的连接 以紫心甘薯块根cDNA 为模板,用TaKaRa 高保真酶PrimeSTAR®Max DNA Polymerase 扩增两端带有不同酶切位点末端的目的片段序列,PCR 产物使用琼脂糖凝胶DNA 回收试剂盒(Magen)纯化回收,具体方法参照试剂盒操作步骤。使用TaKaRa 限制性内切酶对质粒进行双酶切,反应条件为37 ℃,连接30 min。经电泳检测正确的酶切产物进行切胶回收。使用Clon Express II One Step Cloning Kit试剂盒(Vazyme)将目的片段和表达载体进行连接,反应条件为37 ℃,连接30 min。连接产物转化DH5α 感受态细胞。取阳性菌落进行菌落PCR检测,取扩增得到与目的片段大小一致的阳性菌种的菌液200 μL,送至上海生工生物有限公司进行测序。测序正确的菌液中加入20%的灭菌甘油于1.5 mL 离心管,-80 ℃冰箱保存。
1.2.3pGBKT-7-上游调控因子载体的毒性检测 将前期筛选得到的7 个IbMYB1上游调控因子(IbERF1、IbPGP19、IbPDC、IbEIN3-2、IbJOX4、IbSCF 和IbWRKY1),分别构建pGBKT-7-上游调控因子酵母重组表达载体,将重组载体与空载体pGBKT-7 分别转到酵母Y2HGold 细胞,将转化的酵母菌液均匀涂布在SD/-Trp 培养基,观察重组表达载体与空载体酵母菌株生长情况,进行毒性检测。选择载体中EcoR Ⅰ和BamH Ⅰ作为目的片段插入的酶切位点,合成引物序列。LB 固体培养基含Kan 抗性,使用Magen 质粒小量提取试剂盒提取构建好的酵母重组表达载体质粒,-20℃保存。
1.2.4pGBKT-7-IbERF1菌株最低AbA浓度的确定自激活试验结果显示,pGBKT-7-IbERF1菌株具有自激活活性,需确定抑制其自激活活性的最低金担子素A(AbA)浓度。从Y2H[pAGBKT-7-IbERF1]、阳性对照和阴性对照的培养皿中挑取较大的单克隆菌落,将0.9 % NaCl 重悬溶液稀释成10-1、10-2和10-3浓度梯度。吸取10 μL 重悬菌液于相应缺素培养基和添加不同浓度AbA 的缺素培养基上培养。若在某浓度下菌落Y2H[pAGBKT-7-IbERF1]和阴性对照不生长,而阳性对照正常生长,则该浓度为该酵母菌株的最低AbA 浓度,可用于后续试验。
1.2.5酵母双杂交载体的构建与Y2HGold 酵母转化 使用酵母双杂交的方法,研究7 个IbMYB1上游调控因子的相互作用。构建酵母双杂交试验所需的载体,通过转化酵母Y2H 验证蛋白与蛋白之间的相互作用,将IbERF1构建到pGADT-7 载体中,将IbPGP19、IbPDC、IbEIN3-2、IbJOX4、IbSCF和IbWRKY1构建到pGBKT-7 载体中。LB 固体培养基含Kan 抗性,使用Magen 质粒小量提取试剂盒提取构建好的酵母重组表达载体质粒,-20 ℃保存。
酵母转化参照Yeastmaker Yeast Transformation System 2 进行,取5 μL Yeastmaker Carrier DNA 于95 ℃水浴5 min 使其变性,快速置于冰上至温度降至4 ℃(重复1 次)。在已预冷的1.5 mL 离心管中依次加入500 μL PEG/LiAc(50 μL TE、50 μL LiAc、400 μL PEG4000)、5 μL 变性的Yeastmaker Carrier DNA、100 ng 重组融合表达质粒、50 μL Y2HGold 感受态细胞,涡旋混匀,置于30 ℃恒温培养箱中孵化30 min(期间每隔10 min 轻轻倒混数次)。加入20 μL DMSO,轻混匀,置于42 ℃水浴中15 min(期间每隔5 min 轻轻倒混数次)。12 000 r/min 离心30 s,弃上清,加入0.9% NaCl 溶液1 mL,重悬菌体。吸取200 μL 转化后的酵母菌液,涂布于SD/-Trp 培养皿。30 ℃培养箱中倒置培养48~96 h。从缺陷培养基SD/-Trp 培养皿上挑取阳性克隆,转移到含AbA 的缺陷培养基SD/-His/AbA,观察其生长情况。再从缺陷培养基SD/-His/AbA 挑取阳性克隆,转移到缺陷培养基SD/-His/AbA/X-a-Gal plus,30 ℃避光条件培养2~3 d,观察酵母生长情况,拍照记录。
1.2.6双分子荧光互补载体的构建 将IbERF1构建到pSAT4-nEYFP-C1 载体中,将IbSCF和IbWRKY1构建到pSAT4-cEYFP-C1 载体中。将重组质粒转化拟南芥原生质体瞬时表达蛋白,在共聚焦显微镜下观察检测GFP 信号并拍照,在活细胞内验证蛋白与蛋白之间的相互作用,选择pSAT4-nEYFP-C1 和pSAT4-cEYFP-C1 载体中作为目的片段插入的酶切位点为BglII 和BamH I,合成引物序列。LB固体培养基含Amp 抗性,使用Magen 质粒小量提取试剂盒提取质粒,-20 ℃保存备用。
1.2.7拟南芥原生质体的制备与转化 拟南芥原生质体的制备:将配制好的酶解液于55 ℃水浴锅中预热,4 周后选择抽苔前的野生型拟南芥叶片,将叶片下表皮撕掉迅速置于酶解液中。25 ℃、50 r/min 避光轻微振动酶解50 min,至叶肉细胞酶解完全,显微镜下观察原生质体形态,当细胞较圆、透亮时状态较好。
用等体积的W5 稀释酶液,轻轻混匀,然后将洗干净的75 μm 尼龙网布用W5 浸湿后过滤原生质体。800 r/min 离心2 min,尽量吸去上清,用1 mL W5 溶液重悬原生质体(3 次重复)。将原生质体重悬于1 mL W5 溶液中,冰上放置30 min,备用。
拟南芥原生质体的转化:2 mL EP 管中加入10~20 μg 目的质粒,加入100 μL 拟南芥原生质体,轻轻混匀后立即放置冰上。加入110 μL PEG/CaCl2,轻弹离心管使之混匀,室温孵育10 min。加入220 μL W5 溶液,颠倒离心管使其混匀,放置1 min。再向离心管加入440 μL W5 溶液,轻轻颠倒,放置1 min。最后向离心管加入880 μL W5溶液,颠倒混匀,放置1 min。4 ℃ 800 r/min 离心3 min,吸去上清。原生质体用500 μL W5 溶液重悬,22 ℃黑暗条件培养16~20 h。
2 结果与分析
2.1 pGBKT-7-上游调控因子载体的毒性检测
pGBKT-7-上游调控因子毒性检测,观察pGBKT-7-上游调控因子载体与空载在SD/-Trp培养基上单克隆菌落的生长情况,结果显示,试验组和对照单克隆菌落在数量和大小上无明显差异(图1),说明pGBKT-7-上游调控因子载体对酵母没有毒性。
2.2 最低AbA 浓度的确定
将已检测的具有自激活活性的上游调控因子单克隆阳性菌体置于10 μL 0.9% NaCl 溶液重悬菌液,将重悬容液稀释为10-1、10-2和10-3浓度梯度,点在SD/-Trp 和SD/-Trp/AbA(100~1 000 ng/mL)培养基培养。结果显示,pGBKT7-IbERF1自激活AbA 最低抑制浓度为600 ng/mL。
2.3 酵母双杂交检测IbMYB1 上游调控因子之间的相互作用
将具有自激活活性的IbERF1与pGADT-7 连接构建重组载体,其余上游调控因子与pGBKT-7连接构建重组载体,进行酵母双杂交试验检测其相互作用,结果显示,IbERF1 与IbSCF、IbWRKY1 存在相互作用(图2),IbERF1 与IbPDC、IbPGP19、IbJOX4 和IbEIN3-2 不存在相互作用。
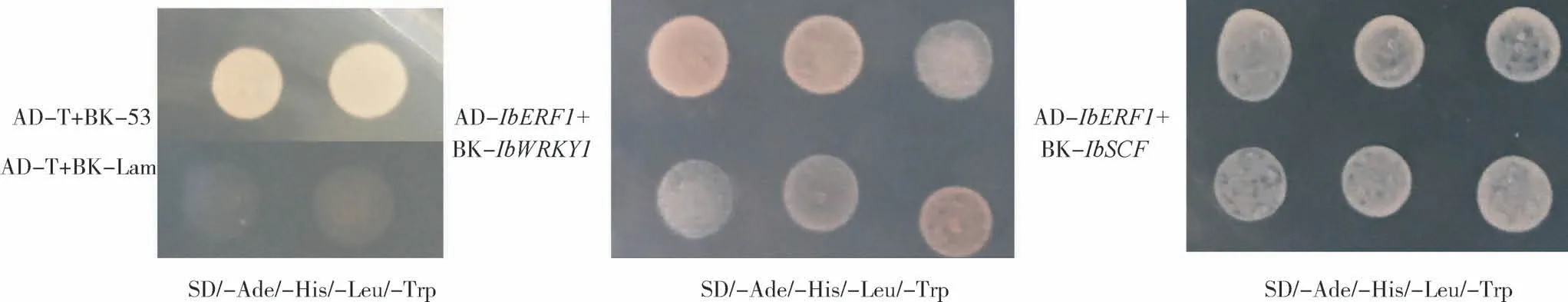
图2 酵母双杂交检测 IbMYB1 启动子上游调控因子的相互作用Fig.2 Interaction detection among upstream transcription factors on the promoter of IbMYB1 by yeast two-hybrid assay
2.4 双分子荧光互补试验检测IbMYB1 上游调控因子之间的相互作用
用双分子荧光互补试验对酵母双杂交检测结果进行验证,检测上述蛋白在植物细胞中是否存在相互作用。将IbERF1与EYFP 蛋白N 端融合,IbSCF和IbWRKY1与EYFP 蛋白C 端融合,然后将带EYFP 蛋白N 端的融合质粒和带EYFP 蛋白C 端的融合质粒转化到拟南芥原生质体中进行表达,若两个蛋白有相互作用,则EYFP 蛋白N 端和C 端靠近形成完整的蛋白,能检测到荧光信号。
由图3 可知,GFP 荧光蛋白在拟南芥原生质体里呈现组成型表达,在整个原生质体中均有表达,IbERF1-nYFP+cYFP 和nYFP+IbSCF/IbWRKY1-cYFP 分别转到拟南芥原生质体中都未检测到荧光信号,说明这3 个蛋白与空载并没有相互作用,而共转到拟南芥原生质体后能够检测到明显的荧光信号,且荧光信号均在细胞核内,说明IbERF1蛋白与IbSCF 和IbWRKY1 蛋白在细胞核中可发生相互作用,两者形成复合物共同调控基因的表达。
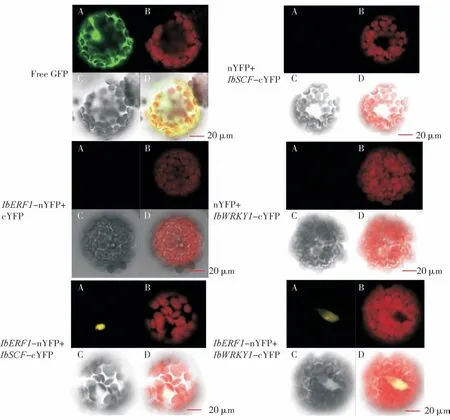
图3 双分子荧光互补试验检测IbERF1 与其他上游调控因子在拟南芥原生质体的相互作用Fig.3 Interaction detection among IbERF1 and other upstream transcription factors by BiFC experiment in Arabidopsis thaliana protoplast
2.5 IbMYB1 上游调控因子表达分析
从图4 可以看出,不同发育时期紫心甘薯柴根、膨大根和块根中转录因子的表达量均高于白心甘薯根,说明花色素苷的合成需要这些转录因子的大量表达。IbERF1基因在紫心甘薯根不同时期的表达量均低于白心甘薯,且随着根中花色素苷的积累其表达量逐渐减低,推测IbERF1可能负调控花色素苷的合成。IbWRKY1与IbSCF基因在紫心甘薯和白心甘薯根不同发育时期中的表达量与花色素苷的积累没有呈现单一的正相关或者负相关,推测这些基因参与紫心甘薯花色素苷的合成与调控可能还存在更为复杂的机制。
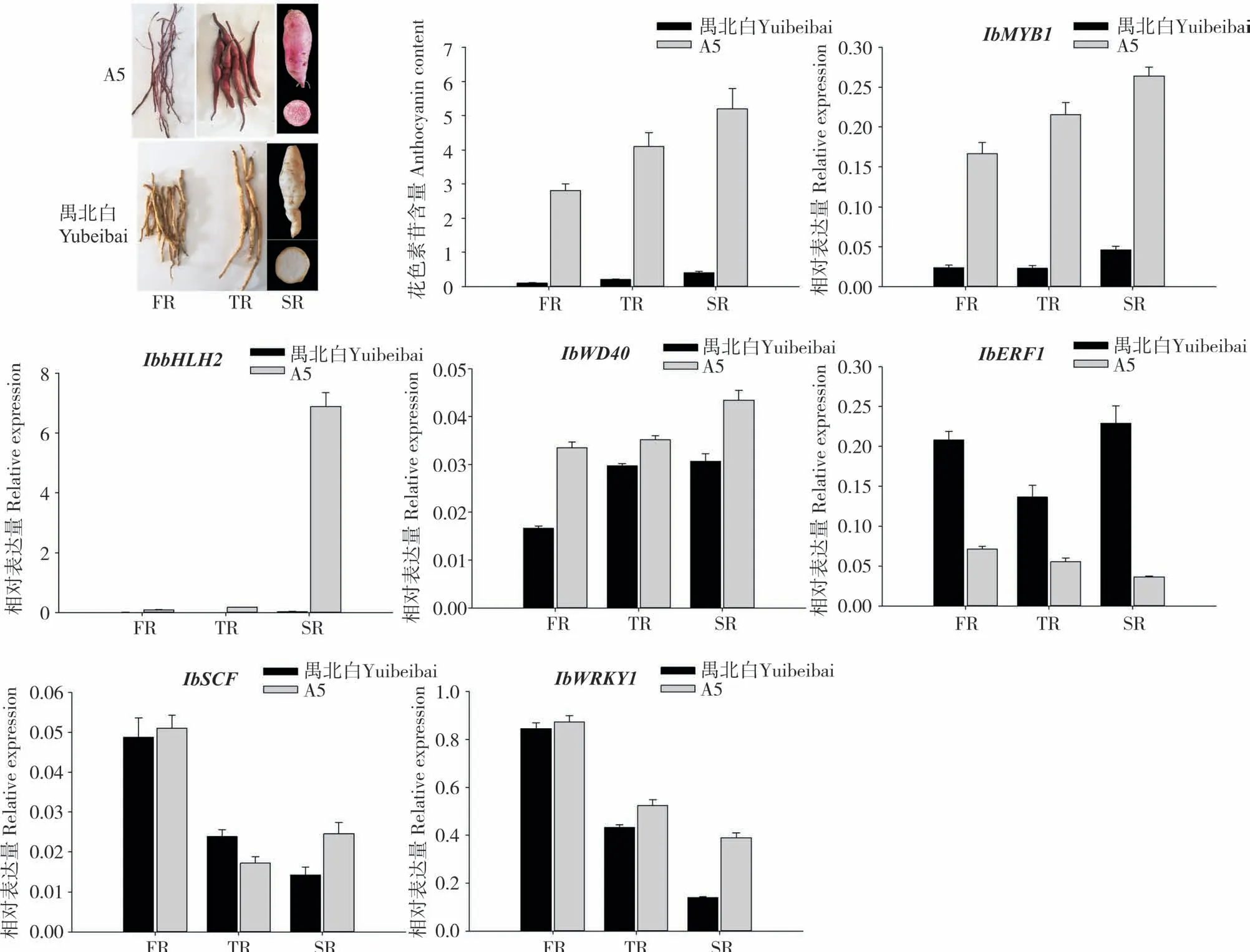
图4 紫心甘薯与白心甘薯不同根系阶段花色素苷合成调控基因的相对表达量Fig.4 Relative expression levels of anthocyanin synthesis regulatory genes in purple-fleshed and white-fleshed sweet potato at different root stages
3 讨论
花色素是目前发现最有效的天然抗氧化物质[1],近年来广泛受到人们的青睐。紫心甘薯中调控花色素苷合成的关键转录因子IbMYB1上游转录调控因子之间存在的互作关系鲜有报道。本研究采用酵母双杂交试验,对7 个IbMYB1上游调控因子(IbERF1、IbPDC、IbPGP19、IbSCF、IbWRKY1、IbJOX4 和IbEIN3-2)之间的相互作用进行检测。结果显示,IbERF1 与IbSCF、IbWRKY1 存在相互作用,双分子荧光互补试验证实了酵母双杂交的试验结果。
乙烯响应因子ERF 家族蛋白属于已知最大的转录因子家族,参与多个生理过程[14]。在植物中,转录因子ERF 参与花色素苷生物合成的调控。比较紫心甘薯和白心甘薯的转录组数据显示,花色苷合成结构基因受转录因子在转录水平上调控,参与调控的转录因子有MYB、bHLH、ERF 和WRKY[15]。比较紫花和白花的转录组和代谢组数据可知,在紫色花中分别检测到MYB、bHLH、AP2/ERF、WD40、WRKY 和Zinc-finger转录因子14、9、1、33、4、12 个,其中上调的转录因子数量分别为10、6、0、30、4、10 个[16]。转录因子ERF 与MYB 存在相互作用,转录因子ERF 既可以与转录因子MYB 蛋白结合调控花色素苷合成相关基因的表达,也可与MYB基因启动子结合调控其表达。在苹果的愈伤组织中过表达MdERF1B,乙烯合成途径中的相关基因MdACO1、MdERF1和MdERF3与花色素苷合成与调控相关的基因MdCHS、MdCHI、MdF3H、MdDFR、MdANS、MdLAR、MdANR、MdMYB9和MdMYB11均显著上调,花色素苷和原花色素苷含量也明显上升。通过酵母双杂交、双分子荧光互补和pull-down 试验结果显示,MdERF1B与MdMYB9、MdMYB1 和MdMYB11 蛋白存在相互作用。酵母单杂交和EMSA 试验结果显示,MdERF1B 与MdMYB9、MdMYB1和MdMYB11的启动子具有相互作用。在LUC 试验中,MdERF1B主要通过激活MdMYB9和MdMYB11启动子的活性来调控其基因表达[17]。在红皮梨中,PpERF24和PpERF96 与PpMYB114 调节蓝光诱导的花色素苷合成,PpERF24 和PpERF96 加强PpMYB114 和PpbHLH3 蛋白的相互作用,也加强PpMYB114 诱导的结构基因的表达[18]。在红皮梨中,PpERF3与PpMYB114、PpbHLH3 形成转录复合物调控红皮梨中花色素苷的合成[19]。WRKY基因家族是高等植物转录因子家族中一个大家族,在植物生理过程和环境适应的转录调节中起重要作用[20]。在甘薯中,WRKY 蛋白(SPF1)的cDNA 序列被首次克隆[21]。有报道发现,WRKY 参与花色素苷合成的调控,如WRKY40 参与苹果中花色素苷合成的调控[22]。SCF 蛋白(GID2)复合物介导了DELLA 蛋白(GAI、RGA 和RGL2)的泛素化和降解。本研究结果显示,IbERF1 与IbSCF 和IbWRKY1 相互作用参与紫心甘薯中参与花色素苷合成的关键转录因子IbMYB1表达,为提高甘薯花色素苷含量的分子定向育种提供新的操作元件和研究思路。
4 结论
酵母双杂交与双分子荧光互补试验发现,紫心甘薯IbMYB1上游7 个调控蛋白中,IbERF1 与IbSCF、IbWRKY1 存在相互作用。定量检测结果显示,IbERF1基因在紫心甘薯根不同时期的表达量均低于白心甘薯,且随着根中花色素苷的积累其表达量逐渐降低,推测IbERF1可能负调控花色素苷的合成。IbWRKY1和IbSCF基因在紫心甘薯和白心甘薯根不同发育时期中的表达量,与花色素苷的积累未呈现明显的正相关或者负相关关系,推测这些基因参与紫心甘薯花色素苷的合成与调控可能还存在更为复杂的机制。本研究结果为进一步深入阐释紫心甘薯块根及地下部分特异性合成与积累花色素苷的调控机理奠定基础。

