载姜黄素的透明质酸-熊果酸-硫辛酸交联纳米粒的制备及其体外抗肿瘤活性
郭晨曦,史薇,冯旭曼,杨雅欣,龚法伍,刘占军
华北理工大学 药学院,河北 唐山 063210
在水溶液中,具有两亲性的分子可自组装成纳米粒,暴露出与周围水分子接触的亲水链,而将其疏水链隐藏在里面,为主药特别是疏水药物提供空间[1]。透明质酸能够主动靶向许多癌细胞过度表达的细胞表面受体CD44 受体,可作为构建纳米粒的亲水链[2]。熊果酸作为一种抗癌活性成分,可与姜黄素表现出协同抗肿瘤作用[3],但较低的水溶性和生物利用度限制了其临床应用,需引入纳米技术制成纳米级制剂,以提高药物的临床疗效[4]。硫辛酸具有含二硫键的硫辛环结构,可发生硫醇/二硫醚的氧化还原反应[5]。在催化量1,4-二硫代苏糖醇的水性条件下,硫辛酸的硫辛环易开环,聚合形成线性聚硫化物[6]。谷胱甘肽在肿瘤细胞内的浓度为2~10 mmol/L,在细胞外的浓度为2~20 μmol/L,细胞外浓度明显高于细胞外,纳米粒中的硫–硫键结构断裂以响应肿瘤细胞内高浓度谷胱甘肽的细胞质环境[7]。熊果酸具有抗癌活性、强疏水性,所以将其作为疏水链,通过共价键接枝到具有肿瘤靶向性的透明质酸亲水骨架上,构建两亲性偶联物,同时在亲水骨架上接枝具有二硫键结构的交联剂硫辛酸,催化生成线性聚硫醚结构,进行交联,自组装后载姜黄素,构建具有氧化还原响应和肿瘤靶向性的纳米粒。基于以上,本实验对两亲性透明质酸-熊果酸-硫辛酸交联物(hyaluronic acid-ursolic acidlipoic acid conjugate,LA-HU)自组装形成的纳米粒包载姜黄素的工艺进行研究,并对载姜黄素的透明质酸-熊果酸-硫辛酸交联纳米粒(curcumin-loaded hyaluronic acid-ursolic acid-lipoic acid cross-linked nanoparticles,Cur/cLA-HU NPs)进行评价。
1 仪器和试剂
ZEN3690 型激光粒度分析仪(英国Malvern 仪器公司);F-320 荧光分光光度计(天津港东科技股份有限公司);Lambda 35 紫外可见光分光光度计(珀金埃尔默仪器有限公司);Agilent 1260-API500高效液相色谱仪(美国安捷伦公司);iMark 全自动酶标仪(美国Bio-Rad 公司);I70-S8F2 荧光倒置显微镜(日本Olympus 公司);JEM-2800 场发射透射电子显微镜(日本电子株式会社);实验透析袋MD44(相对分子质量3 500,北京怡康盛世生物科技有限公司)。
姜黄素(质量分数98%,批号C400271)、甲醇(分析纯)、二甲基亚砜(分析纯)、无水乙醇(分析纯)均购于阿拉丁有限公司;0.1%磷酸盐溶液由实验室自配;甲醇、乙腈(色谱纯,北京迈瑞达科技有限公司);LA-HU(实验室自制,相对分子质量1.17×104,熊果酸取代度为10.5%,硫辛酸取代度为13.6%);DMEM 高糖培养基(Eallbio,批号NG190320EL)、胰酶(Eallbio,批号N190823CF)、四甲基偶氮唑蓝(MTT,Eallbio,批号190114)均购于北京中生奥邦生物科技有限公司;胎牛血清(FBS,天津康源生物技术有限公司);人肝癌细胞HepG2 受赠于华北理工大学的齐亚娟教授实验室。
2 方法
2.1 制备流程
称取LA-HU 10 mg,溶于5 mL 水和二甲基亚砜混合溶液中,搅拌混匀。称取姜黄素3 mg,加入1 mL 药物溶剂溶解。将姜黄素溶液滴加入到LAHU 聚合物溶液中,磁力搅拌混匀后于100 W 下进行超声处理,纯水过夜透析,离心后过0.45 μm 滤膜,即得非交联载姜黄素纳米粒(curcumin-loaded hyaluronic acid-ursolic acid-lipoic acid nanoparticles,Cur/LA-HU NPs)。使用催化剂催化纳米粒内部分子内二硫键断裂,重构聚硫环,构建交联载姜黄素纳米粒Cur/cLA-HU NPs。
2.2 姜黄素的HPLC 测定方法的建立
2.2.1色谱条件 Diamonsil C18色谱柱(250 mm×4.6 mm,5.0 μm);流动相为甲醇–0.1%磷酸水溶液(80∶20);紫外检测波长为425 nm;体积流量为1.0 mL/min;进样量为10 μL;柱温为30 ℃。
2.2.2样品处理 精密量取100 μL Cur/cLA-HU NPs 的PBS 溶液置离心管中,并加入100 μL 二甲基亚砜和4 mL 甲醇,超声1 h 进行破乳,离心后取上清,过0.22 μm 滤膜。
2.2.3药物测定 方法学试验参考文献报道[8]。以姜黄素质量浓度为横坐标,峰面积为纵坐标,得到回归曲线方程Y=102 100 171X—236 390.604,R2=0.999 8,姜黄素在10.0~100.0 μg/mL 线性关系良好。取滤液进样测定,代入回归曲线方程计算Cur/cLA-HU NPs 中姜黄素的质量分数。
2.3 载药量和包封率的计算
将所得的姜黄素质量分数的测定结果代入公式,计算载药量(DL)和包封率(EE)。
DL=纳米粒包载的药物质量/载药纳米粒质量
EE=纳米粒包载的药物质量/药物投料质量
2.4 超声法单因素考察最佳载药工艺
从超声次数、药物溶剂、姜黄素与载体LA-HU的质量比(药质比)3 个因素进行单因素变量比较,测定纳米粒的DL 和EE,确定载药非交联的最佳制备条件。
2.4.1超声次数的考察 固定LA-HU 的质量为10 mg,姜黄素的投料量为3 mg,以甲醇为溶剂,于100 W 功率下对LA-HU 溶液进行超声处理,结果见表1。超声3 次后的载药量和包封率较超声2、4次都高,结果更理想。超声3、4 次后的沉淀比超声2 次少,可能是因为超声时间较长,破坏聚合物结构后药物与聚合物接触程度更大,被包裹住的药量更多。超声4 次的载药量和包封率较超声3 次略小,且差距不大,所以采用超声3 次作为实验操作。
表1 不同超声次数对纳米粒DL 和EE 的影响(,n =3)Table 1 Effect of different ultrasonic times on DL and EE of nanoparticles (,n =3)

表1 不同超声次数对纳米粒DL 和EE 的影响(,n =3)Table 1 Effect of different ultrasonic times on DL and EE of nanoparticles (,n =3)
2.4.2药物溶剂的考察 固定LA-HU 的质量为10 mg,姜黄素的投料量为3 mg,使用溶剂甲醇、无水乙醇和二甲基亚砜溶解姜黄素,于100 W 功率下对LA-HU 溶液进行超声处理,结果见表2。作为药物溶剂,甲醇的载药量和包封率最高,乙醇次之,二甲基亚砜最低。甲醇作药物溶剂时,溶液的沉淀少,说明整个纳米体系较稳定,所以以甲醇作为药物良溶剂来进行接下来的实验。
表2 不同药物溶剂对纳米粒DL 和EE 的影响(,n=3)Table 2 Effects of different drug solvents on DL and EE of nanoparticles (,n =3)

表2 不同药物溶剂对纳米粒DL 和EE 的影响(,n=3)Table 2 Effects of different drug solvents on DL and EE of nanoparticles (,n =3)
2.4.3药质比的考察 固定LA-HU 的质量为10 mg,姜黄素的投料量为3 mg,以甲醇为溶剂,以不同药质比(1∶10、2∶10、3∶10、4∶10、5∶10)对Cur/cLA-HU NPs 进行载药。结果见表3。药质比增加的同时,载药量也随之增加,但包封率先增后减。药质比增加到2∶10 时,包封率最大,包封效果最好;但是药质比达到5∶10 时,包封率比之前减小,可能是因为药物与载体的接触程度在药质比4∶10 已达到了饱和,以致药物无法再包载,造成损失。所以采用药质比4∶10 的条件进行以下实验。
表3 不同药质比对纳米粒DL 和EE 的影响(,n=3)Table 3 Effects of different drug-to-carrier ratios on DL and EE of nanoparticles (,n =3)
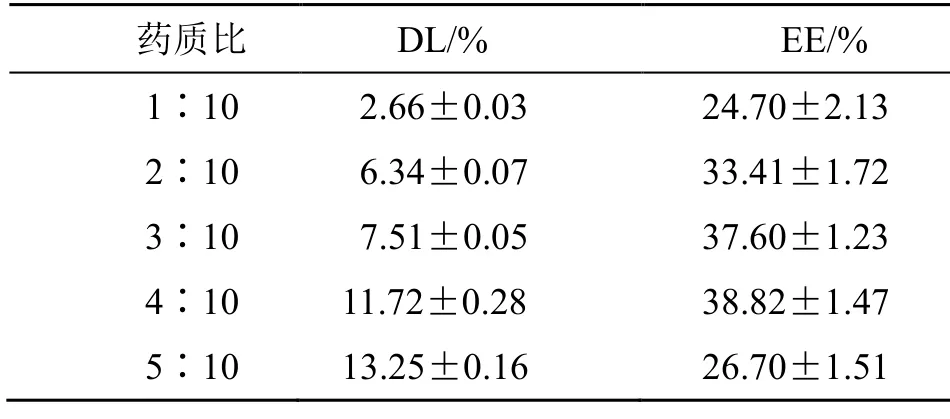
表3 不同药质比对纳米粒DL 和EE 的影响(,n=3)Table 3 Effects of different drug-to-carrier ratios on DL and EE of nanoparticles (,n =3)
2.4.4最佳载药工艺 以单因素变量法筛选出优化工艺:以甲醇为药物姜黄素有机溶剂,以药质比4∶10 进行投料,超声于100 W 下次数为3 次,每次处理3 min,超声程序设置为开2 s、停4 s。
2.5 交联纳米粒的制备
向非交联载药纳米粒的溶液中加入适量的二硫代苏糖醇(其中硫辛酰基基团物质的量比例的10%),在氮气保护下磁力搅拌,纯水透析过夜,离心15 min 去沉淀,过0.45 μm 滤膜即得交联后的载药纳米粒,测定纳米粒的DL 和EE。结果见表4。Cur/cLA-HU NPs 的包封率为(87.91±1.51)%,载药量为(16.64±0.45)%。载药交联纳米粒的载药量和包封率都略高于载药非交联纳米粒。
表4 交联对纳米粒DL 和EE 的影响(,n =2)Table 4 Effect of cross-linking on DL and EE in nanoparticles(,n =2)

表4 交联对纳米粒DL 和EE 的影响(,n =2)Table 4 Effect of cross-linking on DL and EE in nanoparticles(,n =2)
2.6 Cur/cLA-HU NPs 的粒径、电位、PDI 测定
使用透射扫描电镜观察Cur/cLA-HU NPs 的形态。将纳米粒溶液用适量水和乙醇的混合溶液稀释,滴少量溶液于样品台的碳支持膜上,室温环境中待其干燥后,进行拍照。通过电镜观察Cur/cLAHU NPs 的外观形态,见图1。可以看出该纳米粒颜色比周围环境暗,是球形结构。通过激光粒度仪进行粒径、电位、PDI 的考察,结果Cur/cLA-HU NPs粒径为(172.3±2.57)nm,PDI 为(0.174±0.021),分散均匀,Zeta 电位为(−35.3±2.12)mV。

图1 Cur/cLA-HU NPs 的TEM 图Fig.1 TEM image of Cur/cLA-HU NPs
2.7 Cur/cLA-HU NPs 的体外释放实验
采用动态膜透析法模拟细胞在不同条件下的药物释放,研究Cur/cLA-HU NPs 在pH 7.4 还原型谷胱甘肽(GSH)不同浓度下的还原响应性。取5 mL Cur/cLA-HU NPs 溶液密封于透析袋中,浸泡入50 mL 含有两种不同浓度(10 μmol/L、10 mmol/L)GSH 的PBS 缓冲溶液中,在37 ℃、100 r/min 的水浴中振荡,在预定的时间取出1 mL 释放介质,补充等体积介质,测定纳米粒的DL 和EE,计算累积释放率[8],结果见图2。

图2 姜黄素在GSH 不同浓度条件下的释放(,n=2)Fig.2 Drug release of curcumin under different GSH conditions (,n =2)
可见Cur/cLA-HU NPs 在pH 7.4、10 mmol/L 的GSH 溶液中,在12 h 内姜黄素达到约40%的累积释放率,在72 h 内姜黄素累积释放率达66%左右;而在10 μmol/L GSH 中,Cur/cLA-HU NPs 在12 h内姜黄素的累积释放率只有16%左右,低于10 mmol/L GSH 溶液条件下的累积释药量。结果表明,在高浓度GSH 的环境下,GSH 诱导二硫键断裂,Cur/cLA-HU NPs 结构被破坏,从而快速释放姜黄素,而在低浓度GSH 的环境下,纳米粒的释药较慢,提示Cur/cLA-HU NPs 具有还原响应性,释放药物的快慢受到GSH 浓度的影响。
2.8 细胞摄取试验
用含有姜黄素、Cur/LA-HU NPs 和Cur/cLA-HU NPs 的新鲜培养基处理贴壁的HepG2 细胞,使6 孔板中各孔姜黄素的质量浓度均为10 μg/mL,通过荧光倒置显微镜观察HepG2 细胞的荧光强度。精密称取姜黄素1 mg,置于100 mL 量瓶内,加新鲜培养基定容,得到10 μg/mL 姜黄素培养基溶液。精密称取Cur/LA-HU NPs、Cur/cLA-HU NPs 各0.6 mg,置于10 mL 量瓶内,加新鲜培养基定容,得姜黄素质量浓度为10 μg/mL 的培养基溶液。因姜黄素具有荧光特性,所以通过荧光倒置显微镜可以进行追踪显示绿色荧光的姜黄素,无需使用其他荧光染料进行标记。如图3 所示,在6 h 时,相比于姜黄素溶液,Cur/LA-HU NPs、Cur/cLA-HU NPs 具有较强的荧光,说明纳米粒靶向肿瘤细胞,且被细胞快速摄取,胞内GSH 诱导二硫键断裂,释药速度加快,显示更强的荧光;由于Cur/cLA-HU NPs 的载药量和包载率均高于Cur/LA-HU NPs,Cur/cLA-HU NPs在HepG2 细胞中的荧光稍强,且被更多的细胞快速摄取。

图3 姜黄素、Cur/LA-HU NPs 和Cur/cLA-HU NPs 的细胞摄取Fig.3 Cell uptake of curcumin,Cur/LA-HU NPs,and Cur/cLA-HU NPs
2.9 细胞毒性实验
将HepG2 细胞以5×103cells/well 的密度接种于96 孔板中,孵育过夜。精密称取姜黄素、熊果酸、空白交联纳米粒(cLA-HU NPs)和Cur/cLAHU NPs,配制0.1、0.2、1.0、5.0、10.0、50.0 μg/mL的溶液。熊果酸/姜黄素溶液(UA/Cur)中姜黄素质量浓度分别为0.10、0.2、1.0、5.0、10.0、50.0 μg/mL,对应其中熊果酸质量浓度分别为0.060、0.12、0.61、3.04、6.08、30.43 μg/mL。实验组分别加入姜黄素溶液、熊果酸溶液、熊果酸/姜黄素溶液、cLA-HU NPs溶液和Cur/cLA-HU NPs 溶液,对照组加入等体积培养液,培养24 h 后,每孔加5 mg/mL MTT 溶液10 μL 后培养4 h,终止培养,并弃旧细胞液,每孔加入150 μL 二甲基亚砜,避光,摇床震荡10 min后于570 nm 处酶标仪测定吸光度(A)值,计算细胞存活率(细胞存活率=A实验/A对照),结果见图4。
结果显示Cur/cLA-HU NPs 对HepG2 人肝癌细胞增殖具有明显抑制作用。姜黄素对细胞增殖有抑制作用,其抑制作用呈现剂量相关性[9];而熊果酸抑制作用也呈现剂量相关性[10]。两者联合用药后,显示抑制作用显著性加强(P<0.01),与文献报道[3]一致,药物的联合应用比单独用药对肿瘤细胞的抑制作用更大。相比于Cur/cLA-HU NPs,cLA-HU NPs的细胞抑制作用较弱,除了没有包载姜黄素的原因,可能还由于硫辛酸本身是作为参与机体内物质代谢的辅酶,具有生物相容性和生物安全性。相比于熊果酸/姜黄素,Cur/cLA-HU NPs 对细胞的增殖抑制作用更强,是因为透明质酸可以与CD44 受体特异性结合,增加HepG2 细胞的摄取,并且剂型的改变也有助于细胞的摄取。
3 讨论
本实验优化了Cur/cLA-HU NPs 的制备工艺,并对其进行了的体外评价。采用单因素变量法来筛选优化非交联Cur/LA-HU NPs 的制备工艺。通过非交联Cur/LA-HU NPs 溶液载药量和包封率值的测定,得出最佳制备工艺条件。后经催化剂催化交联后,制备高载药率和高包封率的Cur/cLA-HU NPs。可能是在催化剂二硫苏糖醇的作用下,分子内二硫键断裂后形成的具有分子间二硫键的网状结构包载了更多的药物,使得交联纳米粒的载药量和包封率都略高于未交联的纳米粒。Cur/cLA-HU NPs 粒径大小合适,且分散均匀,呈球形结构。由于Cur/cLA-HU NPs 具有还原响应性,在高浓度GSH的环境下,其释药速度比在低浓度GSH 的环境下更快。
MTT 实验和细胞摄取实验表明,姜黄素和熊果酸的联合应用对肿瘤细胞的抑制作用比单独用药更大,达到协同增效作用;Cur/LA-HU NPs 通过透明质酸与CD44-受体特异性结合,增强了细胞对姜黄素的摄取,为实现药物的集中累积提供可能。因此Cur/cLA-HU NPs 载药量和包封率高,其体外抗肿瘤活性稍优于姜黄素,具有肿瘤靶向性,安全性好,在递送疏水性抗癌药物方面具有良好的应用前景,实现肿瘤的靶向治疗作用,达到减毒增效的目的,可为其他肿瘤药物的开发提供一种策略。
利益冲突所有作者均声明不存在利益冲突

