褪黑素通过诱导铁死亡抑制食管鳞癌生长的机制研究
李敏,杨素清,王伟*,李洪峰,张慧欣
1.冀中能源峰峰集团有限公司总医院 骨科,河北 邯郸 056201
2.邯郸市第一医院 胸外科,河北 邯郸 056000
3.冀中能源峰峰集团有限公司总医院 消化科,河北 邯郸 056201
食管癌是常见消化系统恶性肿瘤,其主要组织病理学以食管鳞癌为主,发病率与死亡率较高,目前食管鳞癌的治疗方式以手术联合放化疗为主,由于肿瘤耐药性,患者5 年生存率很低,寻找新的治疗药物是提高患者生存率的重要途径[1-2]。铁死亡是细胞内铁依赖的脂质过氧化损伤导致的非凋亡性死亡,研究显示,铁死亡与肿瘤的发生发展密切相关[3]。褪黑素是由松果体分泌的吲哚类物质,具有抗炎、抗肿瘤、免疫调节的作用,研究显示,褪黑素可抑制胃癌[4]、卵巢癌[5]等肿瘤细胞的增殖与迁移,促进肿瘤细胞的凋亡,且在食管癌中,褪黑素可协同5-氟尿嘧啶(5-FU)抑制食管癌细胞迁移与侵袭,促进细胞凋亡,提高5-FU 对食管癌细胞的敏感性[6]。溶质运载蛋白7 家族成员11(SLC7A11)是调节铁死亡的蛋白酶,在维持细胞内外的谷胱甘肽氧化还原平衡中发挥重要作用,SLC7A11 过表达可抑制铁死亡,与胃癌、乳腺癌等肿瘤的发展密切相关[7-8]。研究显示,SLC7A11 在食管鳞癌组织中表达水平升高,与食管鳞癌的临床分期、有无淋巴结转移、及分化程度、患者预后及新辅助化疗耐药有关[9]。因此,本研究通过探究褪黑素对食管鳞癌细胞铁死亡及对SLC7A11 表达的影响,旨在揭示褪黑素调控食管鳞癌细胞铁死亡的作用机制,为食管鳞癌的分子靶向治疗提供理论基础。
1 材料
1.1 细胞与动物
人食管鳞癌KYSE150 细胞购自中国科学院上海细胞库。5~6 周龄SPF 级BALB/c 雄性裸鼠,体质量16~20 g,购自武汉大学动物实验中心[生产许可证号SCXK(鄂)2019-0004]。所有实验按照《实验动物护理和使用指南》执行,均经过冀中能源峰峰集团有限公司总医院批准(动物实验伦理批号2022019)。
1.2 主要试剂与仪器
褪黑素(质量分数≥98%,货号M5250)、碘化丙啶(PI,规格10 mg,货号P4170)、铁死亡抑制剂Ferrostatin-1(Fer-1,规格5 mg,货号SML0583)、铁含量检测试剂盒(货号MAK025)购自Sigma 公司;DMEM 培养基(货号10566016)购自美国Gibco公司;SLC7A11 过表达质粒及空载质粒(pcDNA)购自广州锐博生物科技有限公司;MTT 细胞增殖及细胞毒性检测试剂盒(货号E-CK-A341)、BCA 蛋白浓度测定试剂盒(货号E-BC-K318-M)购自Elabscience 公司;RIPA 裂解液(货号R0010)购自北京索莱宝生物科技有限公司;兔抗人SLC7A11(货号ab175186)、β-actin(货号ab8227)及辣根过氧化物酶(HRP)标记的羊抗兔IgG 二抗(货号ab205718)购自Abcam 公司;总谷胱甘肽(GSH)检测试剂盒(货号S0052)、活性氧(ROS)检测试剂盒(货号S0033S)购自上海碧云天生物技术有限公司。
JEM-1230 透射电子显微镜购自日本电子公司;FACS Calibur 流式细胞仪购自美国BD 公司;Flexstation-3 多功能酶标仪购自美国 Molecular Devices 公司。
2 方法
2.1 铁死亡细胞模型的建立
KYSE150 细胞接种至DMEM 培养基常规培养,培养至对数期时,以每孔4×103个细胞接种至96 孔板中,分别使用浓度为0.25、0.5、1.0、2.0、4.0 mmol/L 的褪黑素处理KYSE150 细胞24 h,并单独设置空白组,MTT 检测细胞存活率。
另选择对数生长期的KYSE150 细胞,使用1.0 mmol/L 褪黑素处理KYSE150 细胞为褪黑素组;另设置褪黑素+Fer-1 组,使用5 μmol/L Fer-1[10]与1.0 mmol/L 褪黑素共同处理KYSE150 细胞。褪黑素组、褪黑素+Fer-1 组处理24 h,MTT 检测细胞活性[490 nm 处吸光度(A490)值]。
2.2 细胞分组
将KYSE150 细胞分成4 组,分别为对照组、褪黑素组、褪黑素+pcDNA 组、褪黑素+SLC7A11组。褪黑素组使用1.0 mmol/L 褪黑素处理24 h,褪黑素+pcDNA(转染空载质粒)组、褪黑素+SLC7A11(转染SLC7A11 过表达质粒)组先进行质粒转染,转染24 h 后,使用1.0 mmol/L 褪黑素处理24 h,每组设置6 个复孔。
2.3 细胞线粒体形态观察
离心收集各组处理的细胞,PBS 洗涤后,使用2.5%戊二醛4 ℃固定过夜,加入1%锇酸放置1 h,PBS 洗涤3 次,分别使用50%、70%、90%乙醇及丙酮脱水,包埋固化后,切成50~60 nm 的切片,3%醋酸铀–枸橼酸铅双染色,透射电子显微镜观察并拍照。
2.4 PI 染色检测细胞死亡
将各组处理后的细胞1 500 r/min 离心5 min,收集细胞,PBS 洗涤,加入70%乙醇4 ℃固定30 min,PBS 洗涤,加入500 μL PI(50 μg/mL)避光孵育30 min,流式细胞仪检测细胞死亡。
2.5 细胞内Fe2+及GSH 水平检测
离心收集各组处理的细胞,PBS 洗涤后加入RIPA 裂解液裂解2 h 后,分别使用铁含量检测试剂盒及总GSH 检测试剂盒检测细胞中Fe2+及GSH 的水平。
2.6 细胞中ROS 的检测
离心收集各组处理的细胞,PBS 洗涤后加入10 μmol/L DCFH-DA,37 ℃孵育20 min,去除多余的液体,荧光酶标仪(488 nm 激发波长,525 nm 发射波长)检测荧光强度,荧光越强则表示ROS 的含量越高。
2.7 Western blotting 法检测SLC7A11 蛋白表达
离心收集细胞PBS 洗涤2 遍,加入RIPA 裂解液裂解,超声破碎3 min,12 000 r/min 离心20 min取上清,采用BCA 法进行蛋白定量,每组取25 μg蛋白煮沸变性后进行SDS-PAGE 电泳,转至PVDF膜后5%的脱脂牛奶封闭,加入兔抗人SLC7A11 和β-actin 抗体,4 ℃孵育过夜,再加入HRP 标记的羊抗兔IgG 二抗,室温孵育1 h,ECL 显色液显色,以β-actin 为内参,Image J 软件分析目的蛋白相对表达量。
2.8 裸鼠荷瘤实验
将BALB/c 裸鼠分为模型组、褪黑素组、褪黑素+pcDNA 组、褪黑素+SLC7A11 组,每组各10只。KYSE150 细胞使用PBS 调整细胞浓度为1×107个/mL,模型组与褪黑素组在无菌条件下,在裸鼠右侧腋下注射100 μL 细胞液,褪黑素+pcDNA组、褪黑素+SLC7A11 组按照同样方法在在裸鼠右侧腋下注射100 μL 分别转染过空载质粒(pcDNA)和SLC7A11 过表达质粒(SLC7A11)的KYSE150细胞,接种第8 天,褪黑素组、褪黑素+pcDNA 组、褪黑素+SLC7A11 组小鼠ip 给药25 mg/kg,2 d 给药1 次,给药剂量参考文献报道[6],第23 天脱颈处死小鼠,取肿瘤组织,测量体积并称质量,免疫组化法检测肿瘤组织SLC7A11 蛋白表达。
2.9 统计学分析
3 结果
3.1 褪黑素诱导KYSE150 细胞铁死亡模型的建立
结果显示,不同浓度的褪黑素均可显著降低KYSE150 细胞增殖活性,当褪黑素浓度为 1.0 mmol/L 时,细胞存活率约70%,因此选用1.0 mmol/L 的褪黑素用于后续实验,见图1A。
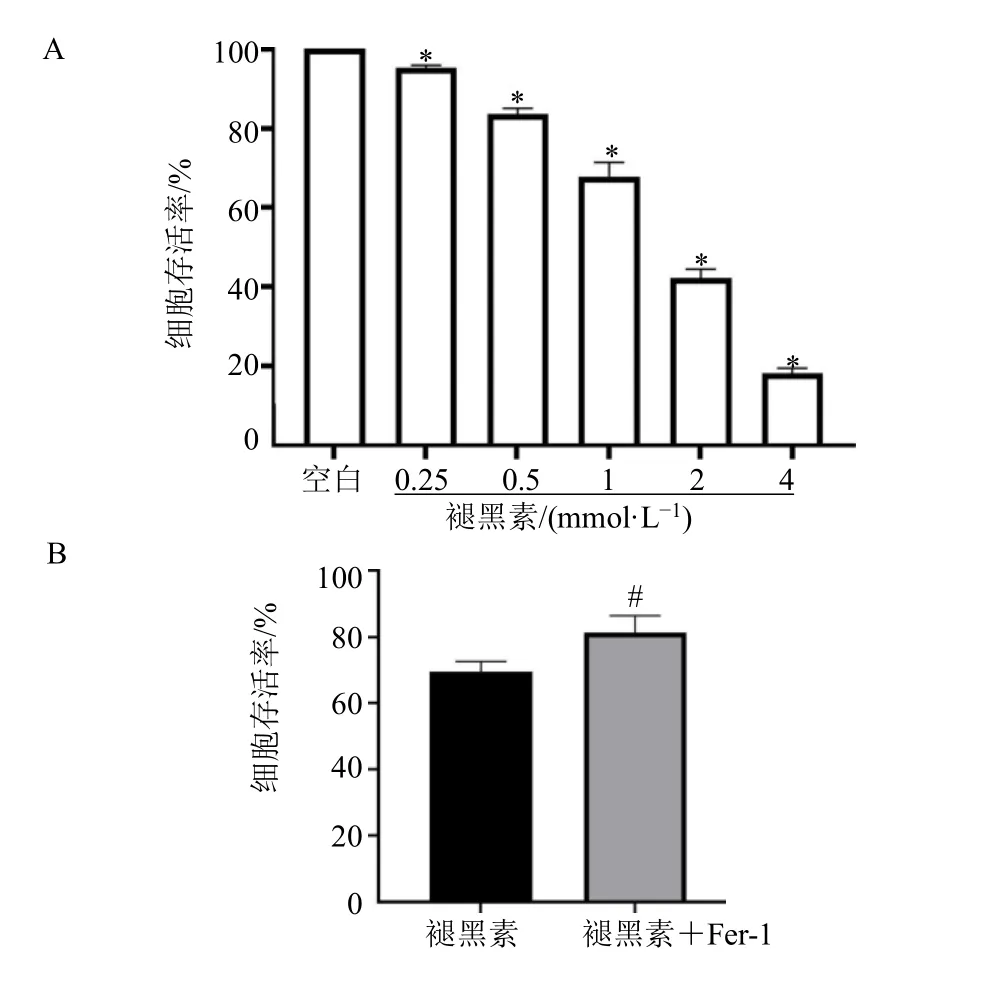
图1 不同浓度褪黑素对KYSE150 细胞存活率(A)和褪黑素对铁死亡细胞模型(B)的影响Fig.1 Effects of different concentrations of melatonin on KYSE150 cell survival (A) and on iron-dead cell models (B)
为验证褪黑素通过铁死亡诱导KYSE150 细胞死亡,使用1.0 mmol/L 褪黑素与Fer-1 共同处理KYSE150 细胞。结果显示,与褪黑素组比较,褪黑素+Fer-1 组KYSE150 细胞增殖活性显著升高,表明Fer-1 可逆转褪黑素对KYSE150 细胞的增殖抑制作用,见图1B。
3.2 褪黑素对KYSE150 细胞形态的影响
如图2 所示,透射电子显微镜观察细胞形态,褪黑素组细胞内的线粒体较对照组变小,线粒体膜密度增加;褪黑素+SLC7A11 组细胞线粒体较褪黑素+pcDNA 组正常,线粒体膜密度减少。
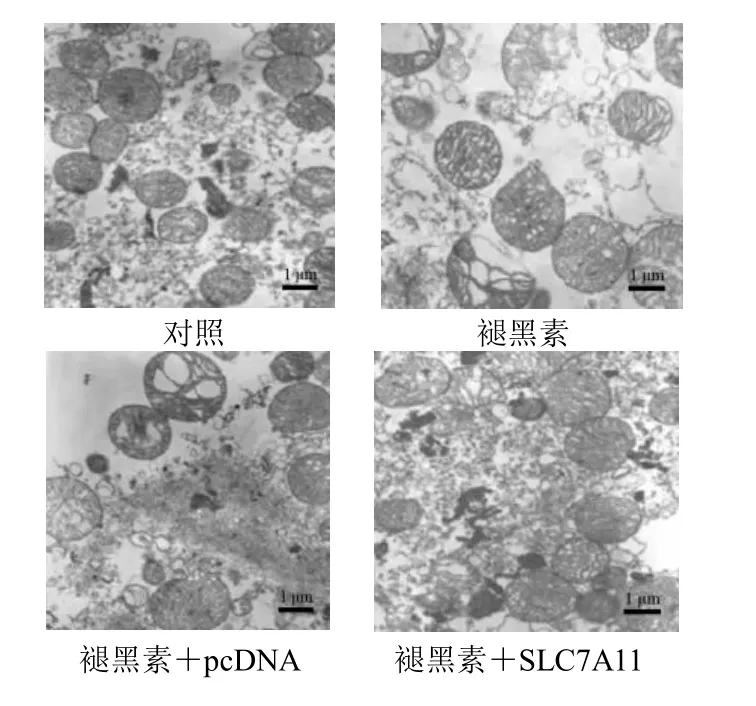
图2 透射电子显微镜观察细胞形态(×50 000)Fig.2 Cell morphology observed by transmission electron microscope (×50 000)
3.3 褪黑素对KYSE150 细胞死亡的影响
如图3 所示,死亡细胞的细胞核被PI 染成红色,褪黑素组KYSE150 死亡细胞数较对照组增多,褪黑素+SLC7A11 组死亡细胞数较褪黑素+pcDNA 组减少。
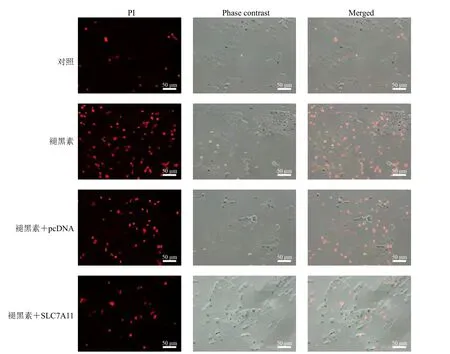
图3 褪黑素对KYSE150 细胞死亡的影响Fig.3 Effect of melatonin on KYSE1500 cell death
3.4 褪黑素对KYSE150 细胞内Fe2+水平的影响
与对照组比较,褪黑素组KYSE150 细胞内Fe2+水平显著升高(P<0.05);与褪黑素+pcDNA 组比较,褪黑素+SLC7A11 组细胞内Fe2+水平显著降低(P<0.05),见表1。
表1 褪黑素对KYSE150 细胞内Fe2+水平的影响(,n =6)Table 1 Effect of melatonin on Fe2+ level in KYSE150 cells(,n =6)

表1 褪黑素对KYSE150 细胞内Fe2+水平的影响(,n =6)Table 1 Effect of melatonin on Fe2+ level in KYSE150 cells(,n =6)
与对照组比较:*P<0.05;与褪黑素+pcDNA 组比较:#P<0.05*P <0.05 vs control group;#P <0.05 vs melatonin+pcDNA group
3.5 褪黑素对KYSE150 细胞内ROS、GSH 水平的影响
与对照组比较,褪黑素组KYSE150 细胞内GSH 水平显著降低,ROS 水平显著升高(P<0.05),DCF 荧光强度增加;与褪黑素+pcDNA 组比较,褪黑素+SLC7A11 组细胞内GSH 水平显著升高,ROS水平显著降低(P<0.05),DCF 荧光强度降低,见图4、表2。
表2 褪黑素对KYSE150 细胞内ROS、GSH 水平的影响(,n =6)Table 2 Effects of melatonin on ROS and GSH levels in KYSE150 cells (,n =6)
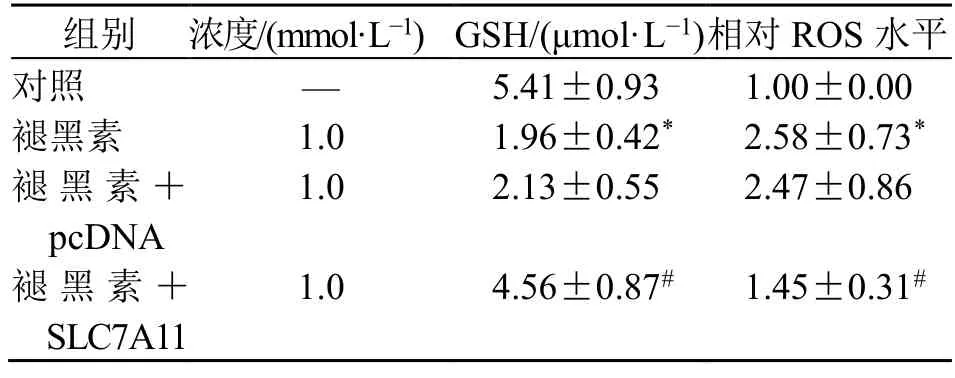
表2 褪黑素对KYSE150 细胞内ROS、GSH 水平的影响(,n =6)Table 2 Effects of melatonin on ROS and GSH levels in KYSE150 cells (,n =6)
与对照组比较:*P<0.05;与褪黑素+pcDNA 组比较:#P<0.05*P <0.05 vs control group;#P <0.05 vs melatonin+pcDNA group
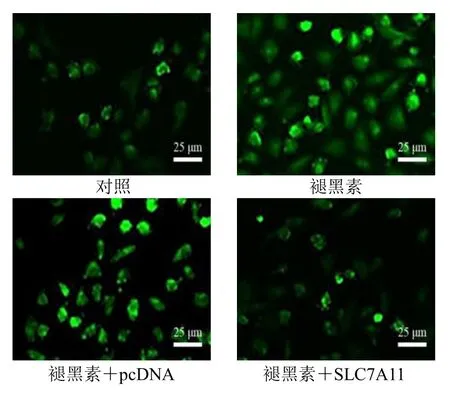
图4 DCFH-DA 荧光探针检测细胞内ROS 的变化Fig.4 Changes of intracellular ROS detected by DCFH-DA fluorescent probe
3.6 褪黑素对KYSE150 细胞SLC7A11 表达的影响
Western Blotting 结果显示,与对照组比较,褪黑素组KYSE150 细胞SLC7A11 蛋白表达水平显著降低(P<0.05);与褪黑素+pcDNA 组比较,褪黑素+SLC7A11 组细胞SLC7A11 蛋白表达水平显著升高(P<0.05),见图5、表3。
表3 褪黑素对KYSE150 细胞SLC7A11 表达的影响 (,n =6)Table 3 Effect of melatonin on SLC7A11 expression in KYSE150 cells (,n =6)
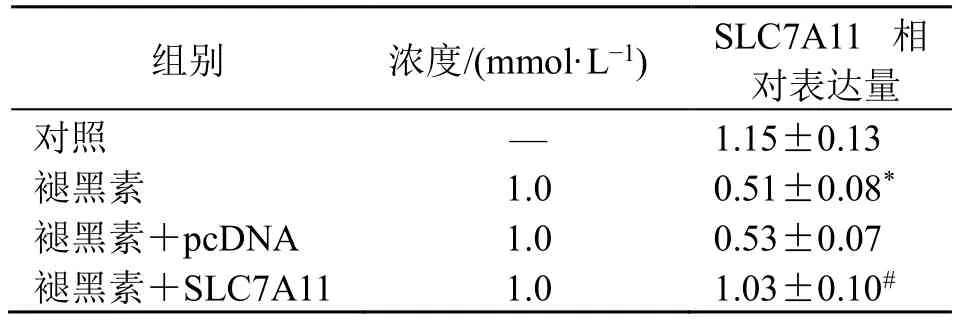
表3 褪黑素对KYSE150 细胞SLC7A11 表达的影响 (,n =6)Table 3 Effect of melatonin on SLC7A11 expression in KYSE150 cells (,n =6)
与对照组比较:*P<0.05;与褪黑素+pcDNA 组比较:#P<0.05*P <0.05 vs control group;#P <0.05 vs melatonin+pcDNA group

图5 各组KYSE150 细胞SLC7A11 蛋白表达情况Fig.5 SLC7A11 protein expression of KYSE150 cells in each group
3.7 褪黑素对荷瘤小鼠肿瘤体积与质量的影响
与对照组比较,褪黑素组肿瘤质量与体积显著降低(P<0.05);与褪黑素+pcDNA 组比较,褪黑素+SLC7A11 组肿瘤质量与体积显著降低显著升高(P<0.05),见表4。
表4 褪黑素对荷瘤小鼠肿瘤体积与质量的影响(,n =10)Table 4 Effects of melatonin on tumor volume and mass in tumor-bearing mice (,n =10)
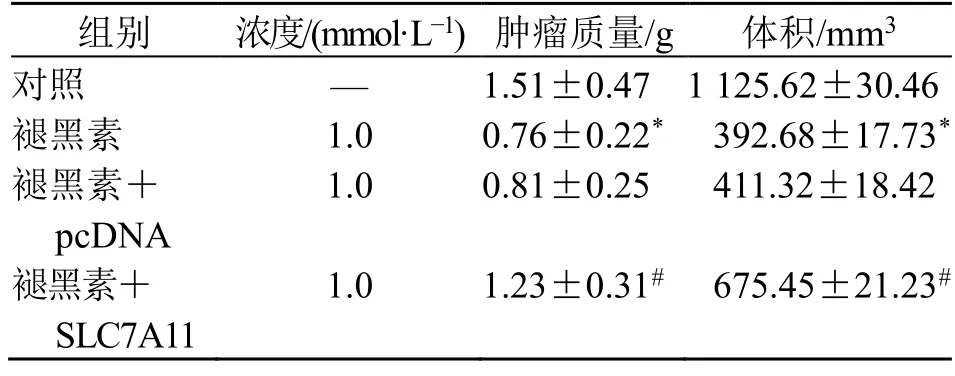
表4 褪黑素对荷瘤小鼠肿瘤体积与质量的影响(,n =10)Table 4 Effects of melatonin on tumor volume and mass in tumor-bearing mice (,n =10)
与对照组比较:*P<0.05;与褪黑素+pcDNA 组比较:#P<0.05*P <0.05 vs control group;#P <0.05 vs melatonin+pcDNA group
3.8 褪黑素对荷瘤小鼠肿瘤组织SLC7A11 表达的影响
免疫组化结果显示,对照组肿瘤组织褐色或中褐色细胞较多,SLC7A11 呈强阳性表达,褪黑素组与褪黑素+pcDNA 组细胞SLC7A11 阳性颗粒表达较对照组减少,褪黑素+SLC7A11 组细胞SLC7A11阳性颗粒表达较褪黑素+pcDNA 组增多,见图6。
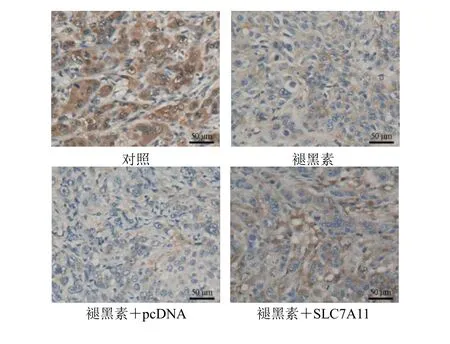
图6 免疫组化检测肿瘤组织SLC7A11 蛋白表达(SP,×200)Fig.6 Immunohistochemical detection of SLC7A11 protein expression in tumor tissue (SP,×200)
4 讨论
褪黑素是一种吲哚类神经内分泌激素,在多种人类肿瘤中具有抗肿瘤的作用,通过诱导细胞周期阻滞,抑制肿瘤细胞增殖,促进细胞凋亡和调节免疫等多种途径发挥抗癌作用[11]。为验证褪黑素对食管鳞癌的抑制作用,本研究建立食管鳞癌细胞裸鼠移植瘤模,ip 一定的褪黑素治疗后,结果显示,褪黑素可显著抑制食管鳞癌细胞裸鼠移植瘤的生长。除抗肿瘤作用,褪黑素还可增加肿瘤细胞对紫杉醇、多柔比星等化疗药物敏感性[12]。另有研究显示,褪黑素通过激活核因子E2 相关因子2(Nrf2)/血红素加氧酶-1(HO-1)信号通路抑制高葡萄糖诱导2 型糖尿病骨质疏松症的铁死亡[13]。铁死亡是一种依赖性的脂质过氧化物介导的细胞死亡方式,与恶性肿瘤的发生、发展密切相关[14]。褪黑素对食管鳞癌细胞铁死亡的影响尚不清楚,本研究结果显示,使用 0.25~4.0 mmol/L 褪黑素均可显著降低KYSE150 细胞增殖活性,且使用1.0 mmol/L 褪黑素与铁死亡抑制剂Fer-1 共同处理KYSE150 细胞显示,Fer-1 可逆转褪黑素对KYSE150 细胞的增殖抑制作用,表明褪黑素可通过铁死亡诱导KYSE150细胞死亡。
铁死亡是一种铁依赖性氧化细胞死亡,GSH 是维持细胞内氧化还原平衡的重要成分,ROS 水平反映细胞抗氧化能力,细胞铁死亡发生时,表现为线粒体变小、线粒体膜密度增高、线粒体嵴减少或消失,细胞内抗氧化能力降低,细胞内ROS 大量生成,Fe2+升高,GSH 水平降低[15]。本研究使用1.0 mmol/L 褪黑素处理KYSE150 细胞24 h 后,细胞死亡数目增加,细胞线粒体变小,线粒体膜密度增加,细胞内Fe2+水平与ROS 水平升高,GSH 水平显著降低,符合铁死亡特征,表明褪黑素可诱导KYSE150 细胞铁死亡。
SLC7A11 为一种氨基酸转运蛋白,属于溶质载体家族成员,可与溶质载体家族3 成员2(SLC3A2)组成胱氨酸/谷氨酸反转运体,抑制胱氨酸/谷氨酸转运体可促进细胞铁死亡,导致SLC7A11 表达代偿性的增加,研究显示,SLC7A11 在肝癌、食管鳞癌等肿瘤中上调表达,SLC7A11 可通过摄取胱氨酸与合成还原性GSH 保护细胞损伤及铁中毒[16-17]。研究显示,SLC7A11 在食管鳞癌组织中上调表达,与淋巴结转移和患者预后差有关,且体外细胞实验显示,Nrf2 的过度激活可诱导SLC7A11 表达,降低放射治疗诱导的脂质过氧化水平,促进食管鳞癌放射抗性[10]。本研究结果显示,使用1.0 mmol/L 褪黑素处理KYSE150 细胞24 h 后,SLC7A11 表达水平降低;在乳腺癌中,二甲双胍可通过抑制SLC7A11 表达诱导乳腺癌细胞铁死亡[18]。为进一步探究褪黑素调控SLC7A11 对KYSE150 细胞的影响,将KYSE150 细胞转染过表达SLC7A11 质粒后,使用褪黑素处理,结果显示,与褪黑素+pcDNA组比较,褪黑素+SLC7A11 组细胞死亡数目减少,细胞线粒体变大,线粒体膜密度减少,细胞内GSH水平显著升高,Fe2+水平与ROS 水平降低,提示过表达SLC7A11 可逆转褪黑素诱导的铁死亡,表明褪黑素可通过抑制SLC7A11 表达诱导食管鳞癌细胞铁死亡。另外,本研究荷瘤小鼠实验显示,使用褪黑素给予小鼠腹腔给药治疗后,肿瘤组织SLC7A11 蛋白表达水平升高,而裸鼠右侧腋下注射SLC7A11 过表达质粒(SLC7A11)的KYSE150 细胞后载给予褪黑素,小鼠肿瘤质量与体积显著升高,证实褪黑素可通过抑制SLC7A11 表达抑制肿瘤升高。
综上所述,褪黑素通过抑制SLC7A11 表达,升高细胞内Fe2+水平与ROS 水平,降低GSH 水平,诱导食管鳞癌细胞铁死亡。
利益冲突所有作者均声明不存在利益冲突

