斑点追踪纵向应变及左室心肌整体做功指数评价乳腺癌化疗后心脏功能的价值
王 薇,马 勇(通信作者),杨 菲
(1 江苏省扬州五台山医院B 超室 江苏 扬州 225001)
(2 苏北人民医院心超室 江苏 扬州 225001)
乳腺癌是女性常见恶性肿瘤之一,我国在近年成为乳腺癌高发国。基于乳腺癌发病部位以及具体病理生理机制分析认为,由于胸部复杂的血液循环通路与淋巴路径,乳腺癌患者虽然自身死亡率相对较低,但极易发生淋巴转移与血行转移,故乳腺癌根治术需进行多部位淋巴结清扫以尽可能降低术后乳腺癌复发转移风险,手术后化疗对于乳腺癌患者是一种有效的治疗方式,通过术后化疗可进一步降低淋巴转移与转出转移的发生风险。蒽环类药物化疗可以有效地降低各类恶性肿瘤患者的死亡率及复发的风险,是目前临床化疗的一线用药,有效性与安全性均相对较高,因此使用蒽环类药物化疗仍然是一个重要的和常用的辅助治疗手段,但仍需重视其引起的并发症与不良反应。近年来,乳腺癌的化疗预后有所改善,在诊断后5年生存率为79%,在这些患者中化疗所致心血管后遗症被证明比癌症本身更危险[1-2]。乳腺癌化疗可以延长患者的生存时间,随之而来的是抗癌治疗后心血管疾病发病率的增高。这些并发症最常见的是左心室收缩功能障碍。蒽环类化疗药物导致的不能敏感检测到的亚临床改变到大量的心肌受损,往往不可逆转[3],从而导致失去提前干预的机会。化疗所导致的潜在的不可逆转的心脏损害成为临床需要关注的问题,本研究选取2019年3月—2020年5月江苏省扬州五台山医院及苏北人民医院收治的行蒽环类药物化疗的乳腺癌患者28 例为研究对象。报道如下。
1 资料与方法
1.1 一般资料
选取2019年3月—2020年5月江苏省扬州五台山医院及苏北人民医院收治的接受蒽环类化疗药物治疗的乳腺癌患者28 例,均为女性,年龄58 ~65 岁,平均年龄(62.3±1.1)岁。患者及家属均知情并签署知情同意书。
纳入标准:①入院时经检查心肌酶谱无异常(CK 24 ~190 IU/L,CK-MB 0 ~25 IU/L,LDH 100 ~240 IU/L),LVEF >55%且未接受过化疗;②能够积极配合检查及治疗者。排除标准:①患有高血压、扩张性心肌病、冠心病等致左心室收缩功能减退等心血管疾病者;②所采集图像欠清晰;③合并其他部位恶性肿瘤;④先心病患者。
1.2 方法
超声心动图仪检查:仪器采用美国GEvividE95及E9,心脏探头频率为(1.7 ~3.3)M H z。在左侧卧位连接心电图后探查三腔、二腔和心尖四腔动态图像。记录至少三个心动周期的测量值,并取平均值。一般参数包括患者的身高、体重、血压以及辛普森双平面法测得左心室射血分数(left ventricular ejection fraction,LVEF)、二尖瓣口E 峰值速度(peak mitral valve velocity,PMVV)和组织多普勒二尖瓣环e 峰值速度(systolic mitral annular velocities,Sa),获得E/e 值,用于评价左心室的舒张功能。应用EchoPAC软件对留取的动态图像进行脱机分析,描述二腔心、三腔心、四腔心的心内膜,并进行优化调整后获得左心室的整体纵向应变值(GLS)及左室心肌整体做功指数(GWI)。
1.3 观察指标
①对比乳腺癌患者化疗前后心脏结构与功能相关指标变化情况,包括LVEF、E、e,并计算E/e 值;②对比乳腺癌患者化疗前后左室整体纵向应变,并计算心肌做功指数。
1.4 统计学方法
采用SPSS 17.0 统计软件分析数据。符合正态分布的计量资料以均数±标准差()表示,两组间比较采用独立样本t检验,多组间采用方差分析;计数资料以频数(n)、百分率(%)表示,采用χ2检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 乳腺癌患者化疗前后心脏结构与功能指标比较
化疗前后乳腺癌患者LVEF 比较,差异无统计学意义(P>0.05),但化疗后乳腺癌患者E、e 值明显低于化疗前,且化疗后E/e 值明显高于化疗前,差异有统计学意义(P<0.05);且随着化疗周期的延长,其E/e 值进一步增大,LVEF 指标减小,但差异均不显著(t=1.959、0.930,P>0.05)。见表1。
表1 乳腺癌化疗前后心脏结构与功能变化情况(±s)
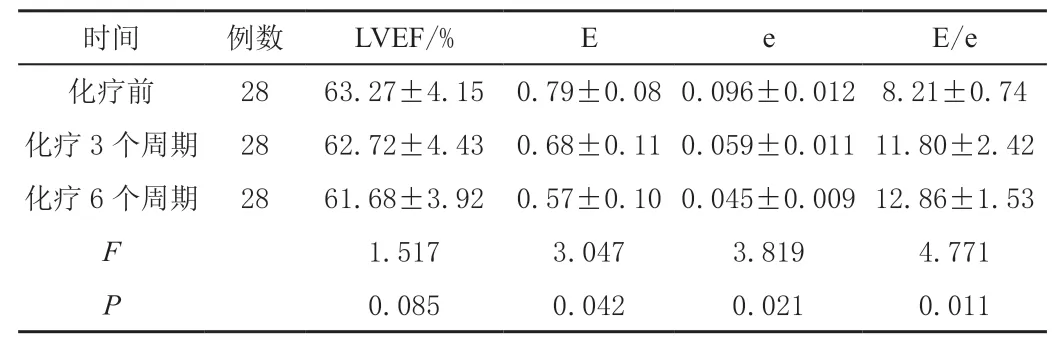
表1 乳腺癌化疗前后心脏结构与功能变化情况(±s)
时间例数LVEF/%EeE/e化疗前2863.27±4.15 0.79±0.08 0.096±0.012 8.21±0.74化疗3 个周期 2862.72±4.43 0.68±0.11 0.059±0.011 11.80±2.42化疗6 个周期 2861.68±3.92 0.57±0.10 0.045±0.009 12.86±1.53 F 1.5173.0473.8194.771 P 0.0850.0420.0210.011
2.2 乳腺癌患者化疗前后GLS 及GWI 指标比较
化疗后乳腺癌患者左室GLS 及左室心肌GWI 与治疗前比较,差异有统计学意义(P<0.05),随着化疗周期的延长,乳腺癌患者GLS、GWI 指标变化更为显著。见表2。
表2 乳腺癌化疗前后左室GLS、心肌GWI 比较(±s)

表2 乳腺癌化疗前后左室GLS、心肌GWI 比较(±s)
时间例数左室GLS/%左室心肌GWI/mmHg%化疗前28-19.36±0.721815.83±147.35化疗3 个周期28-17.06±0.491768.54±214.73化疗6 个周期28-15.72±0.571659.33±185.74 F 3.48125.749 P 0.0350.001
3 讨论
蒽环类药物由于抗瘤谱广、疗效显著。成为乳腺癌化疗患者使用的重要药物。然而临床推广却因药物副作用而受到限制,长期使用蒽环类药物会导致心脏毒性,严重者导致心脏衰竭。研究表明心脏毒性的初期会产生心肌细胞水肿、变性,通过治疗可以治愈[4]。而后期时则表现出心肌严重病变,会出现类似心肌缺血的改变,甚至是心肌纤维化。蒽环类药物作为乳腺癌治疗的药品被视为双刃剑,没有可以绝对安全使用的剂量。其副作用包括左心室收缩功能降低等一系列的心血管问题。且随着年龄的增长,其心脏毒性的发生率会逐渐增高。因此,蒽环类化疗药物导致的左室收缩功能下降能否早期检测到对临床制定患者的进一步治疗方案具有指导意义[5-6]。
在日常工作中,LVEF 是临床评价左心功收缩功能的重要指标,对综合判断患者病情有重要的意义,但是对于亚临床的左室收缩功能障碍无法正确评估。本研究采用的二维斑点追踪是一种基于组织多普勒原理的超声技术,作为一种超声定量分析软件,在二维超声图像基础上通过逐帧追踪会截图小于入射超声波场的细小结构产生的散射斑点信息,实时跟踪同一位置不同帧频间心肌的实际运动轨迹,进而达到无创、精确、定量评价左室旋转与解旋运动,对左心室整体与局部心肌收缩舒张功能的反馈更为全面、精确,并且由于无角度依赖性,具有较高的空间和时间分辨率,被广泛应用于评价各种心血管疾病中左室心肌的整体应变能力。心内膜下心肌纤维以纵行纤维为主,所以左室纵向应变更能反映心室收缩时的应变特性[7]。相比较于圆周应变纵向应变分析所需要的图像采集更方便,结果更精确且可以在超声机上直接分析[8]。
左室做功指数是新近发展起来用于评估左室整体收缩功能的新参数,正常生理状态下心肌的收缩本质为心肌细胞的电-机械耦联,各节段心肌快速同步且协调有序的运动方能实现心脏的正确泵血功能,而化疗后的心脏损害会导致心脏电传导出现不同程度的延迟,导致室壁运动协调性出现破坏,表现为节段收缩不同步的现象,并进一步影响心肌射血效率,GWI、GLS 是近年来临床新发现的检测心脏收缩功能障碍的敏感参数,GWI 表示二尖瓣从关闭到开放整个时间段左室PSL 区域内所做的总功,也反映了左心室做功的总量[9],GLS 能尽早察觉心脏损伤情况,但该方法对微血管的变化诊断更为敏感,对左室的纵向病变检出更为准确,但是对心肌扭转收缩运动的检查不够精确[10]。将GLS 和GWI 两者相结合评价蒽环类药物对左室心肌所产生的影响将更客观准确[11]。在该研究中,通过软件分析GLS 和左室整体做功的情况直接评价左室整体收缩功能。有研究表明,GWI 可以识别局部心肌缺血导致的节段功能障碍,它能更好地考虑到前后负荷对心肌做功的影响,因而对左室心肌的收缩功能的评估更准确[12]。
本文结果发现,辛普森双平面法测得LVEF 值无论是化疗前还是化疗后,均在正常范围内,差异无统计学意义。左室舒张功能化疗后是减低的,与化疗前相比差异有统计学意义,与以往的研究结果一致[13-14]。化疗前GLS、GWI 与对照组比较均在正常范围内,差异无统计学意义。随着化疗周期的延长,GLS 化疗三周期后增高,GWI 值在化疗3 个周期后下降,差异有统计学意义。分析其原因是由于心内膜下毛细血管丰富,化疗药物最先作用于心内膜,导致内膜下心肌缺血的发生,从而影响心肌的收缩[15]。随着心肌缺血的发生,心肌所做无用功增加,进一步说明心肌收缩能力下降[16]。与左心室射血分数相比,GLS 及GWI 对判断左心室收缩功能早期下降更敏感。
此次研究的缺点在于未能对所有的患者进行跟踪观察记录,未能对蒽环类化疗药物所导致的长期影响进行分析研究。在接下来的研究中将增加样本量,提出更完善的超声指标评价乳腺癌患者蒽环类药物化疗后所导致的早期左心功能减低。实现药物所致心脏毒性的早期发现早期治疗。
综上所述,运用二维斑点追踪应变技术分析乳腺癌患者蒽环类药物化疗后GLS 结合GWI 是具有可行性的,可以早期检测药物心脏毒性所导致的左心功能变化,为临床对老年乳腺癌患者的进一步治疗提供依据。但本研究也存在不足之处,如纳入的乳腺癌化疗患者样本量相对较少,可能对结果、结论的客观性与准确性产生一定程度的影响,并且本研究并未针对乳腺癌患者心脏损害程度与指标的量化关系进行研究,有待于进一步临床研究证实。

