黔麦1175茎秆抗倒伏机制的转录组测序分析
王艳丽,隋建枢,陈天青,王 伟 ,何庆才
(1.贵州省农业职业学院,贵州清镇 551400; 2.贵州省旱粮研究所,贵州贵阳 550006; 3.贵州省农业科学院,贵州贵阳 550006)
倒伏是限制小麦高产、稳产、优质的主要因素之一,灌浆期倒伏可使小麦减产10.00%~37.29%[1]。因此在全球主要小麦种植区,抗倒伏皆是最重要的育种目标之一[2]。小麦抗倒伏能力与株高、基部第1~2节间长度和充实度、茎壁厚度、髓腔大小等性状密切相关,这些性状均为多基因控制的数量遗传性状[3-4]。
纤维素和木质素是构成小麦次生细胞壁重要高分子物质[5-6],二者含量增加,次生细胞壁增厚,茎秆的拉伸强度及抗倒伏能力也显著增强[7-8]。木质素的生物合成与苯丙氨酸裂解酶(PAL)、4-香豆酸辅酶A连接酶(4CL)、肉桂酰辅酶A还原酶(CCR)、肉桂醇脱氢酶(CAD)、羟基肉桂酰CoA转移酶(HCT)等关键酶基因有关[9-10]。与小麦纤维素合成相关基因的研究报道较少,Ceaser等[11]研究表明,纤维素的生物合成与一些转录因子和纤维素合成酶有关。
本研究为分析抗倒伏小麦品种与易倒伏小麦品种间抗倒伏能力的差异机制,以抗倒伏品种黔麦1175和易倒伏品种黔麦18为材料,在田间观察了两个品种的抗倒伏情况,统计比较了株高、木质素和纤维素含量等性状指标,并通过转录组测序分析茎秆形成不同阶段和品种间的差异表达基因,以期明确抗倒伏能力与木质素和纤维素含量的关联性,发掘抗倒伏小麦茎秆形态建成的基因,为抗倒伏小麦育种提供参考依据。
1 材料与方法
1.1 供试材料
本研究所用抗倒伏小麦材料黔麦1175是贵州省农业科学院旱粮研究所在引进铁杆小麦中洛铁杆麦1号的基础上,与小麦品种黔9903进行杂交,经过多年选育而成的新型铁杆小麦新品系,对条锈病、白粉病均表现为高抗;所用对照材料黔麦18是本课题组育成的丰产性好、品质优良的新品种。两品种都是在生产上有大面积推广的杂交小麦新品种,其中黔麦1175的抗倒伏能力优于黔麦18。两品种于2020年种植于贵州省农业科学院小麦试验地,行长4 m,行距20 cm,株距10 cm,试验地肥力均一,随机区组设计,常规田间管理。
1.2 试验方法
1.2.1 生长及茎秆特性的测定
于扬花期和成熟期,每个小区取代表性植株30株,调查茎秆重心高度(茎秆基部至平衡支点的距离)、穗长、穗重、茎秆长度和干重、基部第1~2节间长度和干重,并于扬花期调查株高和茎秆抗折力(N)。茎秆抗折力的调查方法:取基部第2节间,除去叶鞘,两端置于高50 cm、间隔5 cm的支撑木架凹槽内,在其中部挂弹簧秤,向下缓慢用力拉,使茎秆折断所用的力加上弹簧自身的重量即为该茎秆的抗折力。
1.2.2 木质素和纤维素含量的测定
于花后30 d左右,小麦拔节完成,进入乳熟期,将小麦基部第2节间除去叶鞘,75 ℃条件下干燥24 h至恒重,将样品研磨至匀浆,称取0.3 g样品,转移至100 mL小烧杯中。采用硫酸蒽酮比色法测定纤维素含量[12],采用浓硫酸法测定木质素含量[13]。
1.2.3 RNA的提取
2021年3月至4月,于小麦基部茎节开始伸长早期(第2节间形成7~10 d)和中晚期(第2节间形成10~20 d),取茎基部第1~2节间材料,每个品种取50株。用Trizol法提取总RNA,3次生物学重复,用1%的琼脂糖凝胶电泳检测RNA的完整性,用Oligo(dT)磁珠富集mRNA。加入fragmentation buffer将mRNA打断成短片段,反转录合成双链cDNA。加入End Repair Mix(生工,上海)将cDNA补成平末端,随后在3’末端加上一个A碱基,用于连接Y字形的接头,随后在Illumina平台上进行测序。
1.2.4 RNA-Seq测序及原始数据的组装
原始测序数据(raw data)中会出现测序接头序列、低质量读段、含N率较高序列及长度过短序列,为保证后续分析的准确性,首先对原始测序数据进行过滤,得到高质量的有效数据(clean data),然后将质控后的数据与中国春参考基因组进行比对。
1.2.5 差异基因的筛选与功能注释
用DEGseq 2软件进行组间差异表达分析,根据|log2fold change|>2且FDR<0.01筛选差异表达基因,以FPKM(fragments per kilobase of transcript per millionmapped reads)衡量基因表达水平的指标。其中,差异倍数(fold change)指两样品组间表达量的比值,错误发现率(false discovery rate,FDR)是通过Benjamini-Hochberg校正方法对原有假设检验得到的显著性P值进行校正得到。利用GO和KEGG数据库对差异表达基因进行GO功能分类和KEGG代谢通路富集分析,找出共同的的代谢通路,在此基础上,筛选出与抗倒伏相关的差异表达基因。
1.2.6 qRT-PCR验证差异表达基因
以茎秆伸长中晚期的黔麦1175和黔麦18为材料,选取木质素合成相关基因(PAL、4CL、CCR、CAD、HCT)和纤维素合成相关基因(纤维素合成酶基因和NAC转录因子基因),根据其全长cDNA序列,用Primer Premier 5.0设计引物(表1),以小麦Tubulin基因为内参。将提取的RNA用DNaseI处理后,用Superscript III逆转录酶和oligo(dT)18引物进行cDNA第一链的合成。参照SYBR○RPremix Ex TaqTMII 试剂盒(Takara,北京)说明书的反应体系和反应程序,使用Rotor-Gene 3000 Real-Time PCR System(Corbett Life Science,美国)进行qRT-PCR分析,按照2-ΔΔCT法计算基因的相对表达量,3个生物学重复。
2 结果与分析
2.1 黔麦1175和黔麦18的生长及茎秆特性
对两个品种比较,黔麦1175株型紧凑,茎秆弹性好,田间每公顷有效分蘖达750多万时不倒伏,而黔麦18田间每公顷有效分蘖达600多万时易倒伏,说明黔麦1175的抗倒伏能力优于黔麦18。黔麦1175扬花期的株高、茎秆重心高度和穗长以及成熟期的茎秆重心高度、茎秆鲜重和穗长均显著低于黔麦18,而扬花期和成熟期两个品种的穗重均无显著差异(表2)。
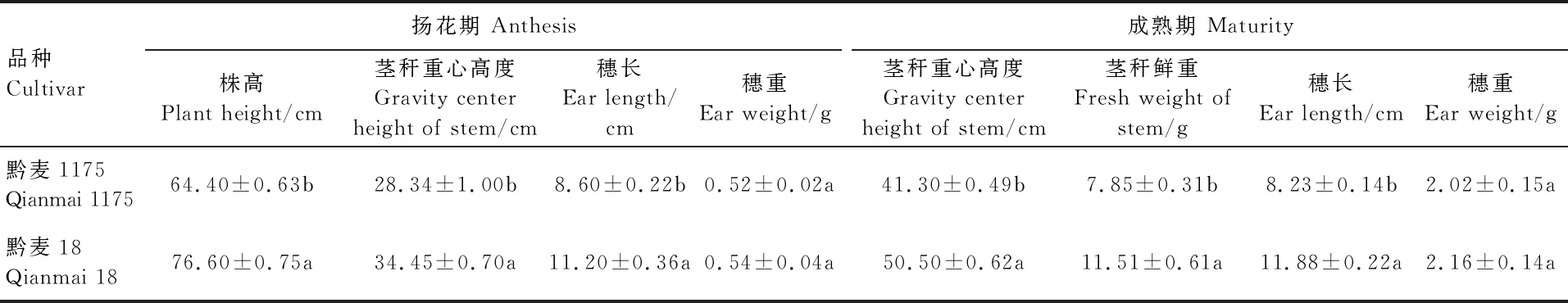
表2 黔麦1175和黔麦18的生长特性
进一步对两个品种的茎秆特性进行比较,发现扬花期黔麦1175和黔麦18的茎秆长度和干重、基部1~2节间长度和干重均无显著差异;而成熟期黔麦1175的茎秆长度和干重均显著低于黔麦18,但两品种间基部1~2节间长度和干重也无显著差异。黔麦1175的茎秆抗折力为6.80 N,显著高于黔麦18(4.90 N)(表3)。

表3 黔麦1175和黔麦18的茎秆特性
2.2 黔麦1175和黔麦18茎秆的木质素和纤维素含量
从表4可以看出,黔麦1175的木质素和纤维素含量分别为18.13和310.67 mg·g-1,均显著高于黔麦18(16.27和233.00 mg·g-1)。又由于黔麦1175的茎秆抗折力显著高于黔麦18,因此推测黔麦1175的抗倒伏能力与茎秆中木质素和纤维素含量相关。

表4 黔麦1175和黔麦18茎秆的木质素和纤维素含量
2.3 转录组测序分析
通过对黔麦1175和黔麦18茎秆伸长早期、茎秆伸长中晚期共 4个处理12个小麦茎秆样本的转录组数据进行分析比较,发现各样品的有效数据(clean data)均达到13.85 Gb以上,Q20碱基百分比均在97.95%及以上(表5),Q30碱基百分比在93.80%及以上,说明Illumina平台测序质量较高,可用于后续组装和分析。
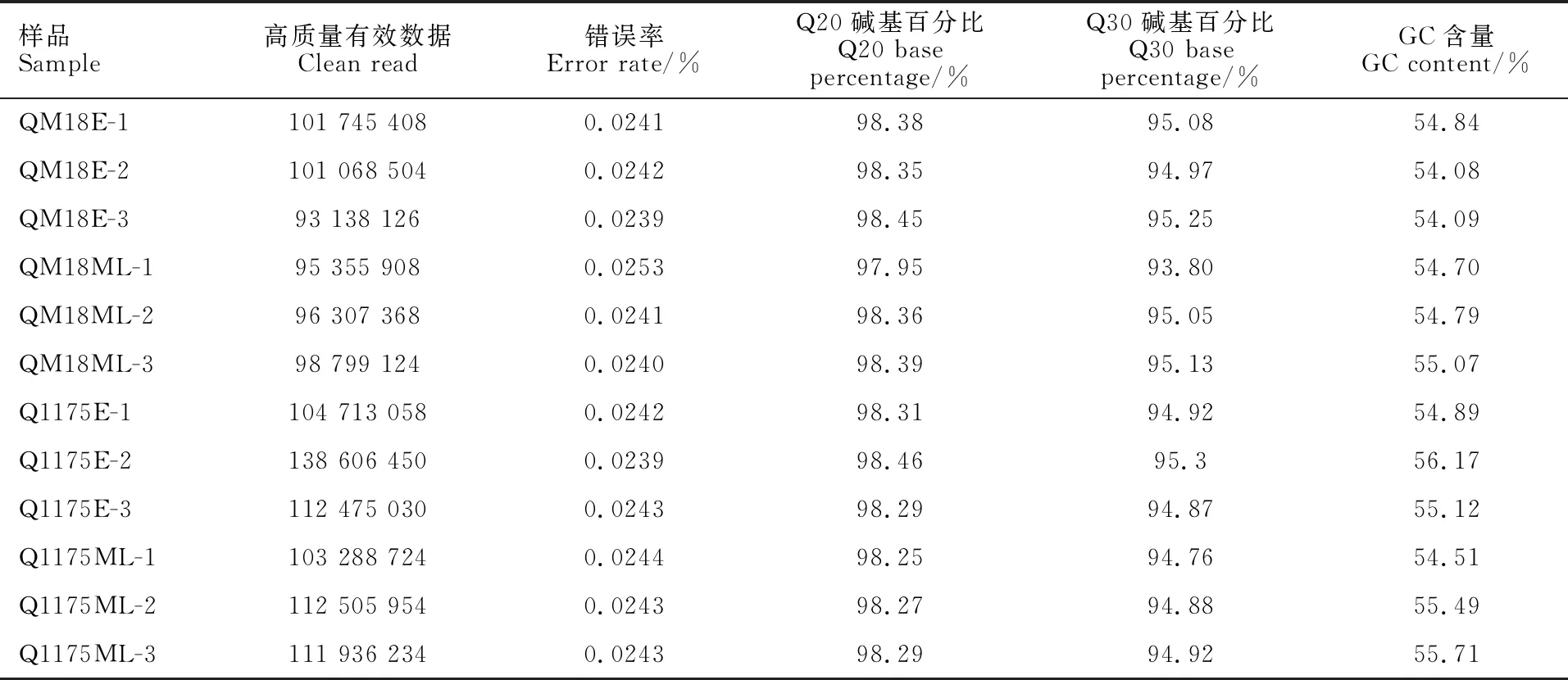
表5 测序数据质量统计表
2.4 差异表达基因统计分析
从图1可以看出,与黔麦1175茎秆伸长早期相比,黔麦1175茎秆伸长中晚期有4 695个差异表达基因,其中1 122个基因上调表达,3 573个基因下调表达;与黔麦18茎秆伸长早期相比,黔麦1175茎秆伸长早期有9 257个差异表达基因,其中5 287个基因上调表达,3 970个基因下调表达;与黔麦18茎秆伸长中晚期相比,黔麦1175茎秆伸长中晚期有9 535个差异表达基因,其中6 552个基因上调表达,2 983个基因下调表达;与黔麦18茎秆伸长早期相比,黔麦18茎秆伸长中晚期有10 424个差异表达基因,其中3 181个基因上调表达,7 243个基因下调表达。

图1 各处理间的差异表达基因统计
2.5 差异表达基因的GO注释分析
从图2可以看出,差异表达基因的功能注释可分为生物过程(biological process)、细胞组分(cellular component)和分子功能(molecular function)3个大类,其中黔麦1175茎秆伸长中晚期与其茎秆伸长早期的差异表达基因中,各通路占比从高到低依次为催化活性(46.9%)、结合(44.2%)、代谢过程(36.2%)、细胞部分(34.2%)、膜部分(32.8%)、细胞过程(31.9%)、膜(17.9%)等。黔麦1175茎秆伸长早期与黔麦18茎秆伸长早期的差异表达基因中,各通路占比从高到低依次为结合(53.1%)、细胞部分(43.0%)、细胞过程(38.8%)、催化活性(38.8%)、代谢过程(26.8%)、膜部分(26.8%)、细胞器(27.0%)等。黔麦1175茎秆伸长中晚期与黔麦18茎秆伸长中晚期的差异表达基因中,各通路占比从高到低依次为结合(49.9%)、催化活性(41.5%)、细胞部分(37.9%)、代谢过程(35.7%)、细胞过程(34.4%)、细胞器(20.8%)、膜(16.4%)等通路。黔麦18茎秆伸长中晚期与其茎秆伸长早期的差异表达基因中,各通路占比从高到低依次为结合(48.9%)、细胞部分(46.9%)、催化活性(41.6%)、代谢过程(40.9%)、细胞过程(40.1%)、细胞器(28.1%)、膜部分(28.1%)等。此外,部分差异表达基因还涉及刺激应答、生物调控、转运活性、转录调控活性等通路。
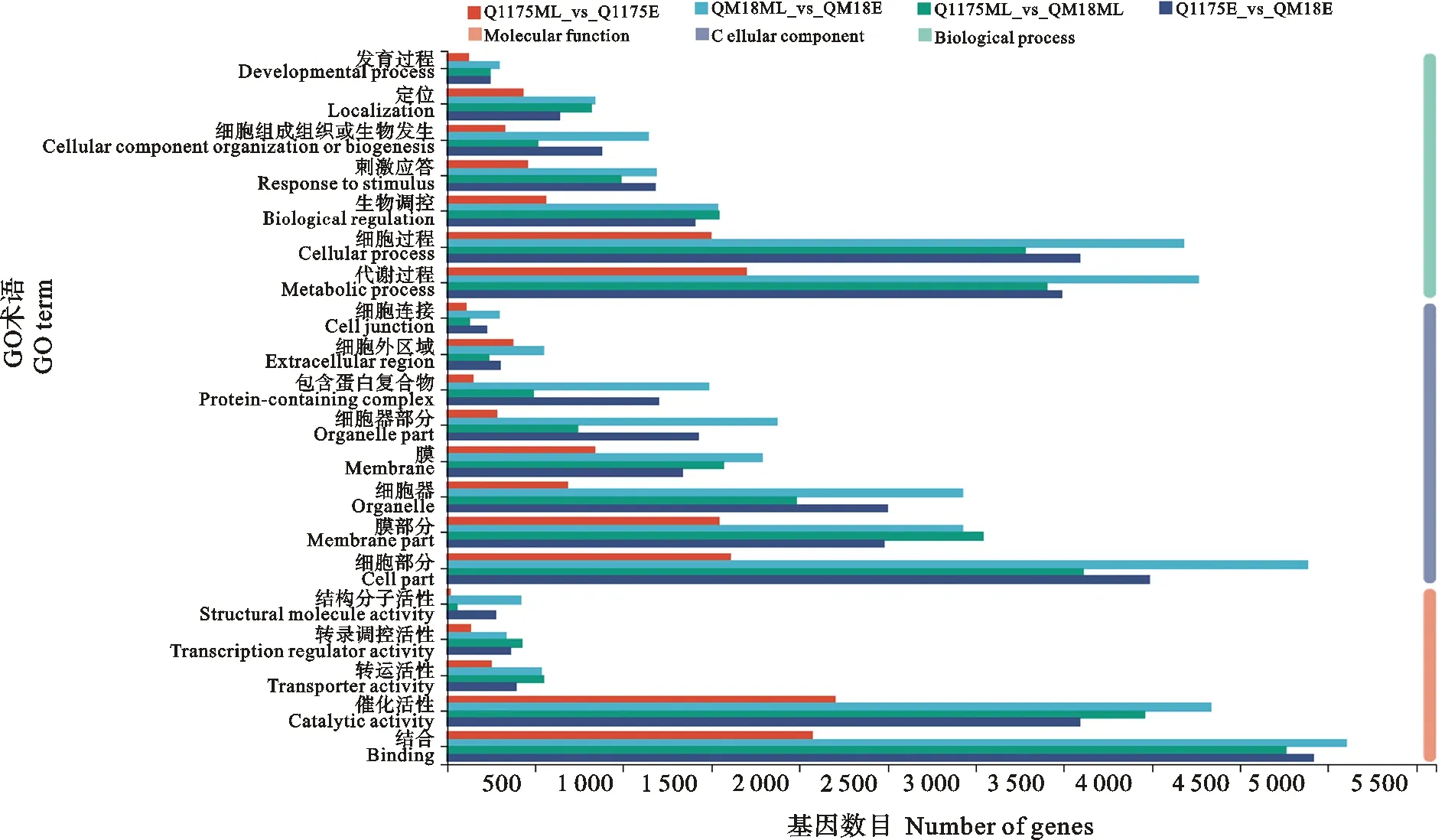
图2 差异表达基因的GO注释分类
2.6 差异表达基因KEGG富集分析
从图3可以看出,黔麦1175茎秆伸长中晚期与其茎秆伸长早期的差异表达基因显著富集到苯丙烷生物合成谷胱甘肽代谢、淀粉和蔗糖代谢、甘油酯代谢等通路;黔麦1175茎秆伸长早期与黔麦18茎秆伸长早期的差异表达基因显著富集到苯丙烷生物合成、核糖体、DNA复制等通路。黔麦1175茎秆伸长中晚期与黔麦18茎秆伸长中晚期的差异表达基因显著富集到光合作用-天线蛋白、植物病菌互作、植物MAPK信号转导等通路。黔麦1175茎秆伸长中晚期与黔麦18茎秆伸长早期的差异表达基因显著富集到核糖体、苯丙烷生物合成、DNA复制、光合作用-天线蛋白等通路。
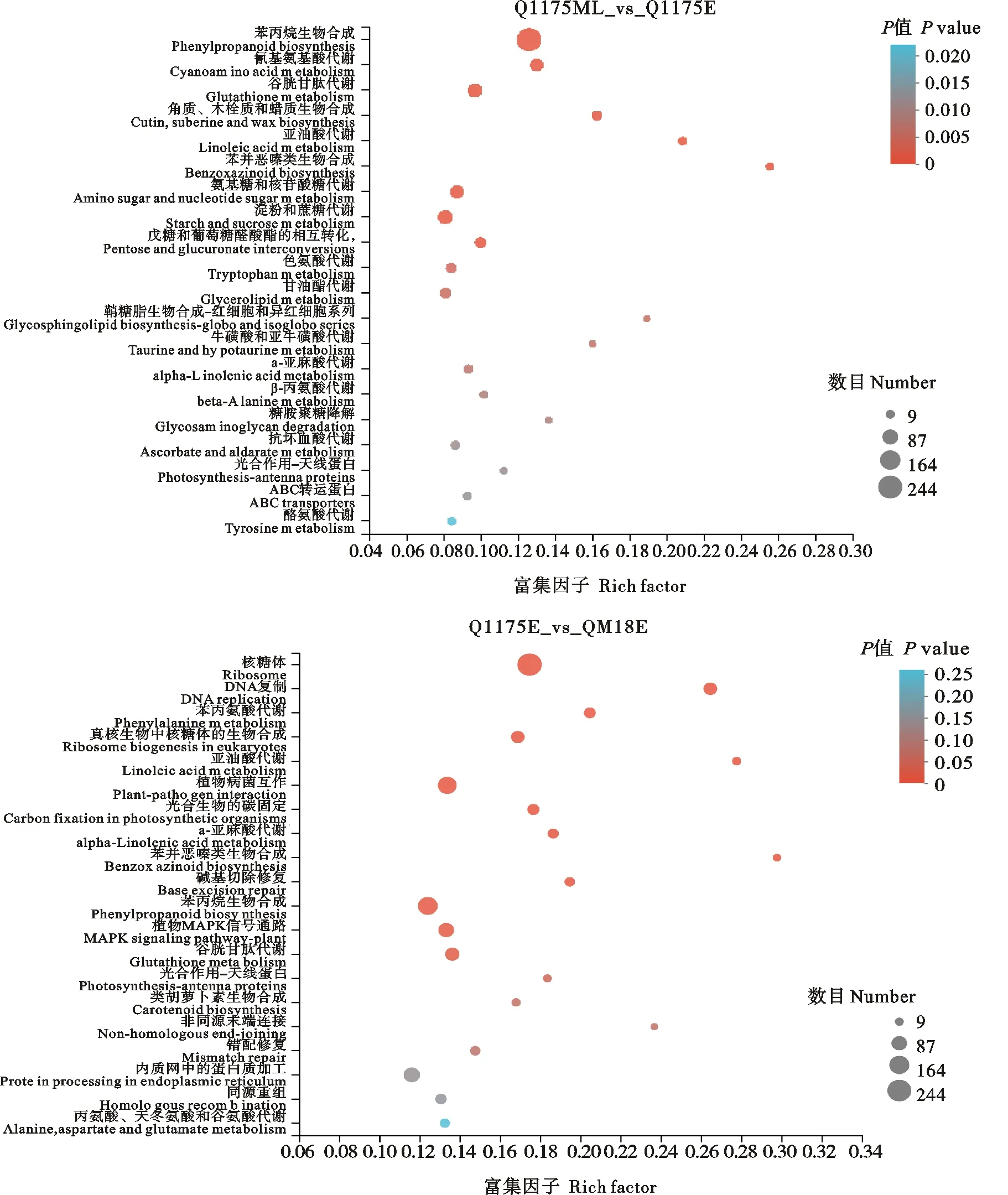
图3 差异表达基因的KEGG富集分析
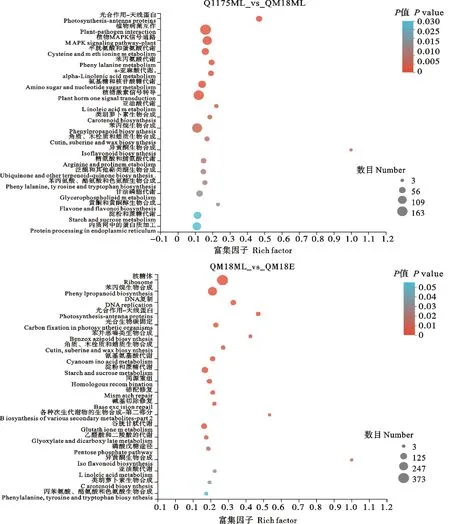
续图3 差异表达基因的KEGG富集分析
2.7 木质素生物合成的相关基因分析
苯丙烷生物合成途径与木质素合成密切相关[14],因此进一步分析富集到苯丙烷生物合成途径上的差异表达基因,发现黔麦1175茎秆伸长中晚期与其茎秆伸长早期的差异表达基因有153个(24个上调,129个下调),黔麦1175茎秆伸长早期与黔麦1175茎秆伸长早期的差异表达基因有151个(92个上调,59个下调),黔麦1175茎秆伸长中晚期与黔麦18茎秆伸长中晚期的差异表达基因有136个(98个上调,38个下调),黔麦1175茎秆伸长中晚期与黔麦18茎秆伸长早期的差异表达基因有255个(64个上调,191个下调)。4CL、CCR、CAD、PAL、HCT属于木质素合成过程中的关键酶,因此比较分析了编码这5种关键酶的差异基因表达情况,具体见表6。
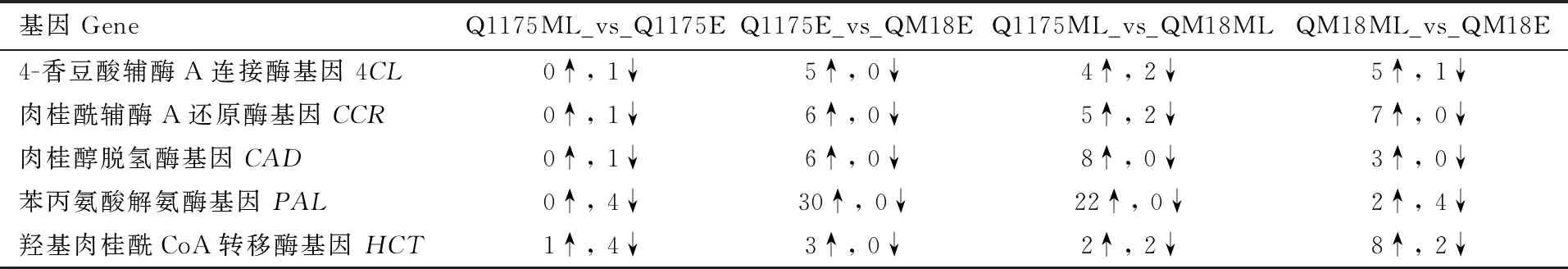
表6 编码木质素生物合成关键酶的差异表达基因数量及表达模式
2.8 纤维素生物合成的相关基因分析
纤维素的生物合成主要与蔗糖合成酶(sucrose synthas, SUSY)、胞质转化酶,UDP-葡萄糖焦磷酸化酶、纤维素合成酶等有关[15]。与纤维素合成相关的基因中,黔麦1175茎秆伸长中晚期与其茎秆伸长早期的差异表达基因有53个,其中12个上调表达(如NAC转录因子基因和MYB转录因子基因),41个下调表达(如蔗糖合成酶基因、MYB 转录因子基因和NAC转录因子基因),黔麦1175纤维素合成酶基因的表达量在茎秆伸长中晚期低于早期,但仍维持在较高水平,且差异不显著。黔麦1175茎秆伸长中晚期与黔麦18茎秆伸长中晚期的差异表达基因有75个,其中55个上调表达,20个下调表达,黔麦1175纤维素合成酶基因的表达量显著高于黔麦18。黔麦18茎秆伸长中晚期与其茎秆伸长早期的差异表达基因有110个,其中29个上调表达,81个下调表达。
黔麦18茎秆伸长早期和黔麦1175茎秆伸长早期的差异表达基因有71个,其中41个上调表达,30个下调表达,上调表达基因主要编码纤维素合成酶、蔗糖合成酶、NAC转录因子6A、MYB转录因子SM155-1、NAC转录因子4等。
2.9 荧光定量PCR验证
为验证转录组测序结果的准确性,以茎秆伸长中晚期的黔麦1175和黔麦18为材料,挑选木质素合成相关基因(PAL、4CL、CCR、CAD和HCT)和纤维素合成相关基因(纤维素合成酶基因和NAC转录因子基因)共7个基因进行qRT-PCR,结果(图4)显示,这些基因的表达趋势与转录组测序所得结果基本一致,证明了转录组数据的可靠性。
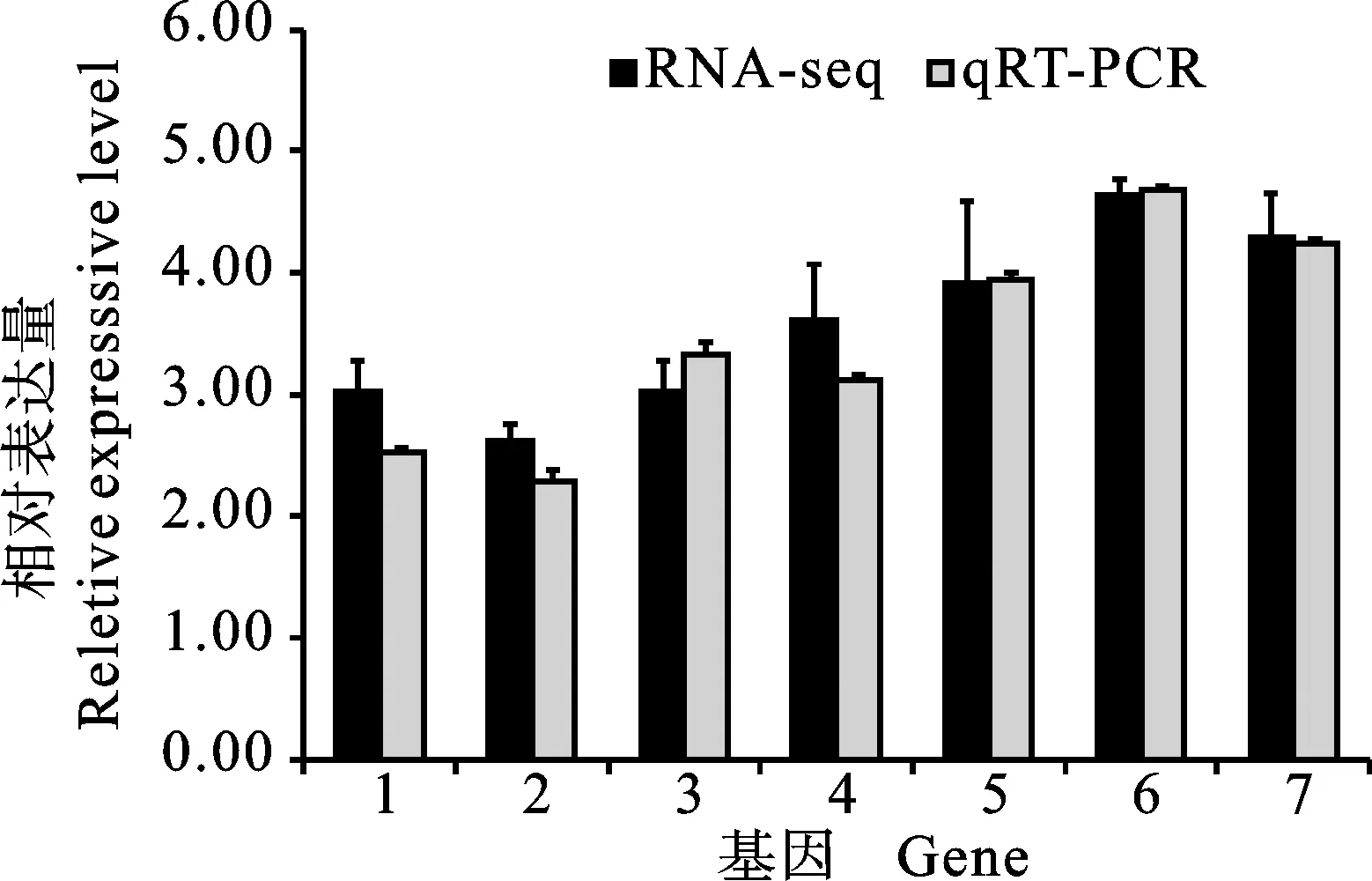
1: NAC转录因子基因;2:纤维素合成酶基因;3:羟基肉桂酰CoA转移酶基因;4:肉桂酰辅酶A还原酶基因;5:4-香豆酸辅酶A连接酶基因;6:苯丙氨酸解氨酶基因;7:肉桂醇脱氢酶基因。
3 讨论
植株抗倒伏性状与株高和茎秆重心高度有关,在一定株高范围内,株高越高,倒伏率越高;重心高度上移也使茎秆头重脚轻,易于倒伏[16]。本研究中,扬花期黔麦1175的株高和茎秆重心高度均显著低于黔麦18,这也是生产上黔麦1175抗倒伏能力强的原因之一。黔麦1175和黔麦18的茎秆长度和干重在扬花期无显著差异,而在成熟期差异显著,说明黔麦1175在扬花期就已经具备较强的抗倒伏能力,而黔麦18在扬花后的灌浆期,茎秆继续伸长生长,因此灌浆期是黔麦18预防小麦茎秆倒伏的关键发育时期。
增加小麦次生壁中木质素和纤维素含量来增强茎秆的机械强度,是提高小麦抗倒伏能力的有效途径。本研究发现黔麦1175茎秆伸长早期与黔麦18茎秆伸长早期、黔麦1175茎秆伸长中晚期与黔麦18茎秆伸长中晚期的差异表达基因中,与木质素合成相关的基因(4CL、CCR、CAD、PAL和HCT)在抗倒伏品种黔麦1175中的表达量均显著上调,说明抗倒伏品种黔麦1175比对照品种黔麦18的木质素合成代谢旺盛,木质素含量高是其抗倒伏的重要原因之一。尤其是PAL基因上调表达30多倍,qRT-PCR也验证了转录组数据的准确性。PAL是苯丙烷类代谢途径中的限速酶,催化L-苯丙氨酸觧氨生成反式肉桂酸,为下游木质素等次级代谢产物合成提供底物,不仅与木质素含量呈显著正相关,而且与白粉病和条锈病抗性相关[17]。与茎秆伸长早期的黔麦1175相比,茎秆伸长中晚期的黔麦1175体内4CL、CCR、CAD、PAL和HCT基因均下调表达,说明木质素合成基因在茎秆伸长早期表达量较高,随着茎秆伸长,木质素的含量呈下降趋势。
UDP-葡萄糖为纤维素合成的底物,而蔗糖合成酶在UDP-葡萄糖的合成中具有重要作用[18]。MYB转录因子可直接结合木质素合成基因顺式作用元件,直接调控其基因表达[19]。纤维素合成酶复合体以UDP-葡萄糖为底物,催化β-1,4糖苷键的形成,进一步合成纤维素[20]。在抗倒伏品种黔麦1175茎秆形成早期,蔗糖合成酶基因、MYB转录因子基因和NAC转录因子基因的表达量均较高,随着茎秆形成,其表达量逐渐下调,而抗倒伏品种黔麦1175茎秆形成中晚期,纤维素合成酶基因的表达量仍显著高于黔麦18。植物激素尤其是生长素,对维管组织的分化具有重要作用。Chini等[21]研究表明,JAZ是一类在植物发育和防御反应中起广泛作用的蛋白家族,是茉莉酸信号转导途径中的关键抑制因子,参与作物茎秆形态建成。本研究也表明,与茎秆伸长早期和中晚期的黔麦18相比,茎秆伸长早期和中晚期的黔麦1175中,一个茉莉酮酸酯ZIM结构域蛋白基因(JAZ)均持续上调表达,说明JAZ基因与茎秆形成有关。

