小麦 G6PDH基因家族的鉴定与表达分析
车 卓,张沛沛,陈 涛,刘 媛,马靖福,田 甜,王 鹏,杨德龙,
(1.甘肃农业大学生命科学技术学院,甘肃兰州 730070; 2.甘肃省种子总站,甘肃兰州 730070;3.干旱生境作物学国家重点实验室,甘肃兰州 730070)
葡萄糖-6-磷酸脱氢酶(glucose-6-phosphate dehydrogenase,G6PDH)是磷酸戊糖途径的关键限速酶[1]。根据亚细胞定位,植物G6PDH可分为胞质型和质体型,均由细胞核基因编码。其中,质体型又可划分为P0、 P1和P2三种类型。P1和P2类型分别主要定位于叶绿体和质体中,P0是一类非功能性酶(AtG6PD4)[2]。植物G6PDH基因首先在马铃薯中被分离到,之后相继在水稻[3]、拟南芥[4]、大麦[5]和大豆[6]中分别克隆到6、5、5和9个G6PDH基因家族成员,其中拟南芥AtG6PDH5、AtG6PDH6基因和大豆Gm G6PDH2、Gm G6PDH4、Gm G6PDH6基因属于胞质型[4,6]。研究发现,大豆中胞质型Gm G6PDH基因主要在根和种子中高表达,而质体型基因大多在叶片中表达[6]。胞质型G6PDH的活性占整个细胞中G6PDH活性的80%~95%,显著高于质体型G6PDH的活性[7]。
相关研究表明,G6PDH不仅参与植物生长发育[8],还参与非生物胁迫的应答反应[4,9]。过表达甜杨胞质型PsG6PDH基因可显著提高转基因烟草的耐旱性、抗病性和抗冷性[10];拟南芥AtG6PDH6与糖原合成激酶GSK-3互作,通过调节还原型谷胱甘肽(GSH)的水平,促进H2O2的积累,从而提高植株对盐胁迫的抗性[11];过表达大豆GmG6PDH2基因可显著提高转基因大豆的耐盐性;大麦幼苗叶片和根中HvG6PDH1~HvG6PDH4基因受干旱和盐胁迫诱导表达,其中胞质型HvG6PDH2基因在氧化胁迫反应过程中起主导作用[5]。
目前G6PDH基因家族的研究主要集中在拟南芥、水稻、大豆等作物上,而在小麦中尚未见报道。因此,本研究拟利用生物信息学手段对小麦G6PDH基因家族成员的理化性质、系统发育、基因结构、染色体分布、蛋白质保守结构域进行探究,并分析小麦G6PDH基因家族成员的时空表达模式以及盐胁迫和干旱胁迫下该基因家族成员的表达变化,以期为进一步探究小麦G6PDH基因调控小麦的抗逆性机制奠定基础。
1 材料与方法
1.1 小麦 G6PDH基因家族成员的鉴定
从Ensembl Plants数据库(http://plants. ensembl.org/info/data/ftp/index.html)下载小麦基因组、蛋白质、CDS以及注释文件等信息。分别以已经报道的拟南芥和水稻G6PDH蛋白序列为参考,进行BLASTP比对(E-value<10-5),搜索小麦基因组中的G6PDH基因家族成员。同时从Pfam数据库(http://pfam.xfam.org/)下载 G6PDH蛋白的C-terminal NADP-dependent G6PD domain(PF02781)和 N-terminal NADP+-binding domain(PF00479)保守结构域,作为模板序列,利用HMM隐马尔科夫模型对小麦蛋白数据库进行检索比对,得到含有该保守结构域的蛋白序列。将上述两种方法得到的蛋白序列去重后,进一步利用SMART(http://smart.embl-heidelberg.de/)和 Pfam数据库验证候选蛋白是否含有小麦G6PDH家族成员所特有保守结构域,去除不含完整保守结构域的蛋白序列,最终获得小麦Ta G6PDH基因家族成员。
1.2 小麦 G6PDH基因家族成员的系统进化、基因结构及氨基酸序列分析
从拟南芥基因组数据库(http://www.arabidopsis.org)和水稻基因组数据库 (http://rice.plantbiology.msu.edu/)分别下载拟南芥和水稻的G6PDH 蛋白序列。用Clustal W2软件对拟南芥、水稻和小麦的G6PDH蛋白序列进行多序列比对,用MEGA 6.0 软件采用NJ(neighbor Joining)法和Possion模型构建系统进化树,Bootstrap参数设置为1 000。从Ensembl Plants数据库下载小麦和拟南芥G6PDH的基因组序列和CDS序列。用TBtools软件获取小麦和拟南芥G6PDH基因家族成员的DNA 序列和CDS 序列。用GSDS 2.0(http://gsds.cbi.pku.edu.cn/)对小麦和拟南芥G6PDH基因的结构进行可视化。
1.3 小麦G6PDH蛋白的理化性质和亚细胞定位分析
用ExPASy在线工具(https://web.expasy.org/compute_pi/)计算小麦G6PDH蛋白的等电点和分子量。用TargetP 2.0(http://www.cbs.dtu.dk/services/SignalP/)和 iPSORT(http://ipsort.hgc.jp)软件预测分析小麦G6PDH蛋白信号肽的剪切位置。用ProtComp 9.0软件(http://www.softberry.com/berry.phtml?topic=protcomppl&group=programs&subgroup=proloc)对小麦G6PDH蛋白进行亚细胞定位预测。
1.4 小麦 G6PDH基因的染色体定位及顺式作用元件分析
从小麦族同源基因数据库Triticeae-GeneTribe(http://wheat.cau.edu.cn/TGT/)获取小麦G6PDH基因在染色体上的物理位置,用TBtools软件[12](https://github.com/CJ-Chen/TBtools)进行可视化,并截取小麦G6PDH基因起始密码子上游2.0 kb的DNA序列。用PlantCARE在线软件(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)进行启动子顺式作用元件分析,用TBtools软件进行可视化。
1.5 小麦 G6PDH基因家族成员重复事件分析
用MCScanX(https://gmplib.org/download/gmp/gmp-6.1.2.tar.bz2)鉴定小麦G6PDH基因是否发生片段复制事件[13]。片段复制事件满足两个条件:(1)两条蛋白序列的相似性大于80%;(2)相同序列占比对序列的80%。用TBtools软件的Circos功能包对鉴定到的串联重复基因进行可视化。用KaKs_Calculator 2.0 软件(https://sourceforge.net/projects/kakscalculator2/)计算片段复制基因的非同义替换率(Ka)和同义替换率(Ks),获得基因的Ka/Ks比率,分析CDS区的适应性进化。
1.6 小麦 G6PDH基因的组织表达模式和逆境表达模式分析
从小麦WheatOmics 1.0数据库[14](http://202.194.139.32/expression/index.html)下载小麦5个组织(根、茎、叶、穗和种子)以及干旱胁迫和热胁迫下的转录组数据FPKM(fragments per kilobase of transcript per million fragments mapped),用TBtools软件绘制表达热图。为进一步了解小麦在干旱和盐胁迫处理下小麦G6PDH基因的表达模式,以供试小麦品种晋麦47为材料,将种子表面消毒后,培养两周,然后使用含有 20% PEG-6000和200 mmol·L-1NaCl的营养液进行干旱胁迫和盐胁迫处理,分别在胁迫处理0、3、6、12、24和48 h后取小麦的根组织样品,在液氮中速冻后保存于-80 ℃冰箱。同时将未处理的幼苗经春化处理后转移至温室中,采集根、茎、叶、20~30 mm幼穗、40~50 mm幼穗以及花后10 d的种子,于-80 ℃保存。
参考RNAprep Pure Plant Kit(DP432)试剂盒(天根,北京)说明书提取小麦不同组织以及干旱胁迫和热胁迫处理下植物的总RNA,使用ReverTra AceTMqPCR RT Master Mix with gDNA Remover (TOYOBO,日本) 进行cDNA第一条链的合成。用Primer Premier 5.0软件设计特异性引物(表1),参照KOD SYBR○RqPCR Mix (TOYOBO,日本)的PCR反应体系,在QuanStudioTM5实时荧光定量PCR仪(Thermo Fisher,美国)上进行qRT-PCR。PCR反应程序:98 ℃ 2 min;98 ℃ 10 s,60 ℃ 15 s,68 ℃ 20 s,共40个循环。以TaActin为内参基因,采用2-ΔΔCT法计算基因的相对表达量。

表1 qRT-PCR分析所用到的引物
2 结果与分析
2.1 小麦 G6PDH基因家族成员的鉴定及染色体定位结果
根据6个拟南芥G6PDH基因和5个水稻G6PDH基因编码的蛋白序列,利用同源搜索和HMM比对搜索,在小麦数据库中初步鉴定得到14个G6PDH候选基因。进一步使用Pfam和SMART数据库进行验证,发现这些候选蛋白均包含N端NADP结合结构域和C端NADP依赖的G6PD结合区保守功能域,说明鉴定得到的14个G6PDH基因家族成员结构域完整。染色体定位结果表明,这14个基因家族成员分布在2A、2B、2D、4A、4B、4D、6A、6B和6D染色体上,平均每条染色体含有1~2个G6PDH基因(图1)。

图1 小麦 G6PDH基因家族成员的染色体定位
2.2 小麦 G6PDH基因家族的系统进化分析
用MEGA 6.0 软件构建14个小麦G6PDH基因与6个拟南芥G6PDH基因、5个水稻G6PDH基因的进化树,结果(图2)表明,3个物种的G6PDH基因分为2个类型,即胞质型和质体型,其中质体型G6PDH基因又可分为P0、P1和P2三个亚类。小麦G6PDH基因家族成员与水稻G6PDH基因亲缘关系较近。

图2 小麦、拟南芥和水稻 G6PDH基因的系统进化树
2.3 小麦G6PDH蛋白的理化性质和亚细胞 定位
14个小麦G6PDH蛋白的氨基酸序列长度为470~632 aa,分子量为52 841.87 ~71 603.68 kD,等电点(pI)为5.53~8.71,其中6个蛋白为碱性蛋白,其余均为酸性蛋白(表2)。利用TargetP 2.0和 iPSORT对小麦G6PDH蛋白的转运肽进行预测,9个G6PDH蛋白含有信号肽。利用ProtComp 9.0对小麦G6PDH蛋白进行亚细胞定位预测,9个G6PDH蛋白定位于叶绿体中,5个G6PDH蛋白定位于细胞质中。
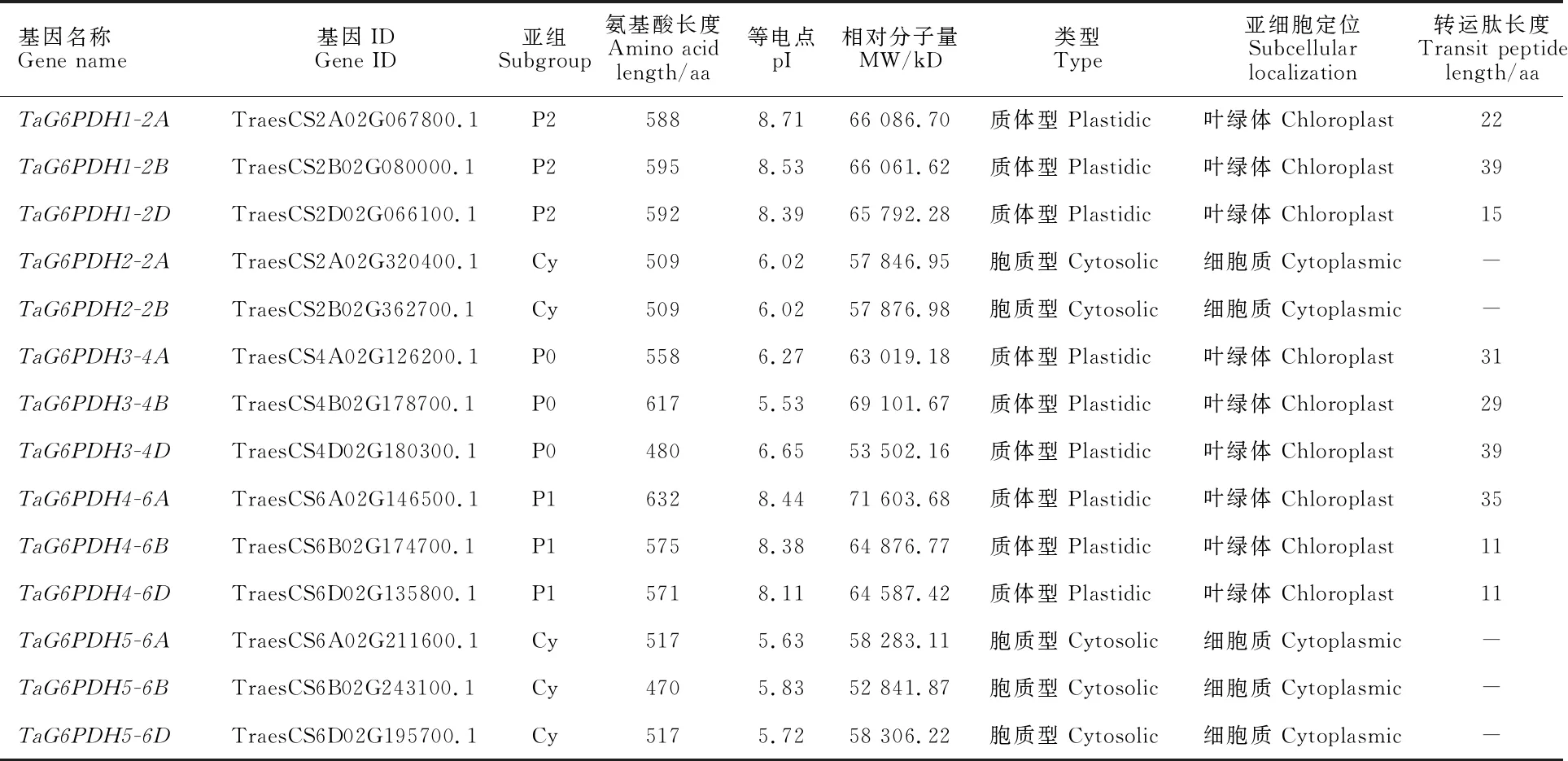
表2 小麦 G6PDH基因家族成员信息及其编码蛋白的特征
2.4 小麦和拟南芥 G6PDH基因结构及G6PDH蛋白保守结构域分析
构建14个小麦G6PDH基因与6个拟南芥G6PDH基因的系统进化树(图3A),发现这些基因可分为Cy、P0、P1和P2四个亚组。其中,Cy亚组包含5个小麦G6PDH基因和2个拟南芥G6PDH基因,P0和P1两个亚组均包含3个小麦G6PDH基因和1个拟南芥G6PDH基因,P2亚组包含3个小麦G6PDH基因和2个拟南芥G6PDH基因。利用Pfma数据库对G6PDH蛋白进行结构域预测,发现小麦和拟南芥G6PDH蛋白均含有NADP结合结构域和NADP依赖的G6PD结合区保守功能域(图3B)。基因结构分析显示,相同亚组内同一分支的小麦和拟南芥G6PDH基因具有相似的外显子-内含子组成模式,不同分支的外显子-内含子组成模式有所差异;Cy亚组除TaG6PDH5-6B基因含有14个外显子外,其他基因均含有15个外显子;P0亚组除TaG6PDH3-4D基因含有10个外显子外,其他基因均含有12个外显子,P1亚组基因均含有8个外显子,P2亚组基因均含有10个外显子(图3C)。对小麦G6PDH蛋白的氨基酸序列进行比对,结果(图4)显示,所有小麦G6PDH蛋白的氨基酸序列都含有高度保守的底物结合位点(RIDHYLG)、NADP+-结合位点(NEFVIRLQP)和Rossman fold(GASGDLAKKK)结构域。但TaG6PDH3-4A/4B/4D蛋白中这三个保守结构域的个别氨基酸发生了变化,暗示它们的功能可能不同于其他家族成员。

图4 小麦G6PDH蛋白的氨基酸序列比对及保守结构域分析
2.5 小麦 G6PDH基因片段复制分析结果
对小麦G6PDH家族基因进行共线性分析,结果共鉴定出17对片段重复基因,其中2A和2B染色体上的重复基因最多,均具有6个片段复制基因。胞质型亚组成员均存在1个片段复制事件,包含10个片段重复基因,其中2A、2B、6A、6B和6D染色体均具有4个片段重复基因(图5和表3)。质体型亚组成员存在3个片段重复事件,每一对片段重复基因均属于同一亚组。本研究结果表明,小麦G6PDH基因家族的扩展起源于片段复制。非同义替换率(Ka)和同义替换率(Ks)的比例是评价基因自然选择压力的基础。Ka/Ks=1,表示中性选择;Ka/Ks<1,表示存在纯化选择,即负选择效应;Ka/Ks>1,表示存在正选择效应。本研究中片段复制基因的Ka/Ks在 0.062 584~ 0.513 445之间(表3),说明这些基因在负选择作用下进化。

不同颜色表示小麦G6PDH 基因的片段重复基因对。

表3 小麦 G6PDH基因家族成员的片段重复分析
2.6 小麦 G6PDH基因的顺式作用元件分析
利用PlantCARE在线软件对小麦G6PDH基因启动子区域的顺式作用元件进行分析,结果共鉴定到8个激素响应元件和13个非生物胁迫响应元件。激素响应相关元件主要包括脱落酸响应元件(ABRE)、生长素响应元件(AuxRR-core和TGA-element)、茉莉酸甲酯相关元件(TGACG-motif和CGTCA-motif)以及水杨酸相关元件(TCA-element)。非生物胁迫响应元件主要包括干旱胁迫响应元件(DRE core、MBS、MYC和W box)、低温胁迫响应相关的调控元件等(图6)。其中,脱落酸响应元件(ABRE)、茉莉酸甲酯相关元件(TGACG-motif)和干旱胁迫响应元件(MYC)广泛存在于11个小麦G6PDH基因的启动子区域。TaG6PDH5-6A/6B/6D基因主要包含非生物胁迫响应元件W box、DRE core和MYC,而含有的激素响应相关元件较少。另外,TaG6PDH2-2A和TaG6PDH2-2B基因启动子区含有较多的低温响应元件,暗示它们在低温胁迫响应过程中发挥重要作用。

图6 小麦 G6PDH基因家族成员启动子的顺式作用元件分布
2.7 小麦 G6PDH基因在不同组织和非生物胁迫下的表达分析
从多组学数据库WheatOmics中下载小麦不同组织G6PDH基因的RNA-seq数据,发现小麦G6PDH基因在不同组织中的表达模式不同。从图7A可知,TaG6PDH4-6A/6B/6D和TaG6PDH3-4A/4B/4D基因在茎、穗及发育早期的籽粒中表达量较高,在其他组织中表达量较低;TaG6PDH1-2A/2B/2D在不同发育时期的根中表达量均高于其他组织;TaG6PDH2-2A/2B基因在根、发育中期的幼穗以及花后2 d的籽粒中表达量较高;TaG6PDH5-6A/6B/6D基因除了在花后10 d的籽粒中表达量较低外,在其他组织中的表达量均相对较高。
对干旱和热胁迫下小麦G6PDH基因家族成员的表达模式进行分析,结果(图7B)显示,干旱胁迫下,TaG6PDH2-2A和TaG6PDH2-2B基因在干旱胁迫1 h后上调表达,大部分成员在干旱胁迫6 h后下调表达。热胁迫下,TaG6PDH2-2A和TaG6PDH2-2B基因在热胁迫6 h后上调表达,TaG6PDH1-2A/2B/2D、TaG6PDH3-4A和TaG6PDH5-6A/6B/6D基因在热胁迫6 h后下调表达。除TaG6PDH4-6A/6B/6D基因外,其他成员在旱热共胁迫条件下均下调表达。
随机挑选6个小麦G6PDH基因,用qRT-PCR技术检测其在不同组织中的表达模式,结果(表4)表明,TaG6PDH1-2A、TaG6PDH1-2D和TaG6PDH2-2B基因在根中的表达量均最高;TaG6PDH3-4A基因在花后10 d的籽粒中表达量最高;TaG6PDH4-6A基因在叶片中的表达量最高;TaG6PDH5-6B基因在根中的表达量最高,但与叶片中的表达量无显著差异。qRT-PCR验证结果与RNA-seq分析结果基本一致。

表4 G6PDH基因在小麦不同组织中的相对表达量
为进一步揭示小麦G6PDH基因家族成员在不同胁迫下的表达模式,用qRT-qPCR技术分析小麦根中 6 个G6PDH基因在干旱和盐胁迫下的表达水平。干旱胁迫后的结果(表5)表明,与对照(干旱胁迫0 h)相比,TaG6PDH1-2A和TaG6PDH1-2D基因在干旱胁迫6 h和12 h时显著上调表达,均在胁迫6 h时达到峰值;TaG6PDH3-4A基因在干旱胁迫24 h和48 h时显著上调表达,在胁迫48 h时达到峰值;TaG6PDH4-6A基因在干旱胁迫3 h和6 h时显著上调表达,在胁迫3 h时达到峰值;TaG6PDH5-6B基因在干旱胁迫各时间点均显著上调表达,在胁迫3 h时达到峰值;而TaG6PDH2-2B基因的表达量在干旱胁迫各时间点与对照处理间均无显著差异。

表5 qRT-PCR分析小麦 G6PDH基因在干旱和盐胁迫下的表达模式
盐胁迫后的结果(表5)表明,与对照(盐胁迫0 h)相比,TaG6PDH1-2A基因在盐胁迫12 h和24 h时均显著上调表达,在胁迫12 h时达到峰值;TaG6PDH1-2D基因在盐胁迫6、12和24 h均显著上调表达,在胁迫12 h时达到峰值;TaG6PDH2-2B基因在盐胁迫各时间点均显著上调表达,在胁迫6 h时达到峰值;TaG6PDH3-4A基因在盐胁迫6、12和48 h时均显著上调表达,在胁迫12 h时达到峰值;TaG6PDH4-6A基因在盐胁迫3、24和48 h时均显著上调表达,在胁迫48 h时达到峰值;而TaG6PDH5-6B基因在除盐胁迫24 h的其他各时间点均显著下调表达。这些结果表明,大部分小麦G6PDH基因可能同时参与了小麦对干旱和盐胁迫的响应。
3 讨 论
本研究在小麦中共鉴定出14个G6PDH基因,多于拟南芥(6)[3]、水稻(5)[4]和大麦(5)[8]中的G6PDH基因家族成员数目。原因可能是小麦包含A、B和D三个亚基因组,大部分G6PDH基因在小麦染色体上存在三个部分同源基因。不过,TaG6PDH2基因只在A和B基因组中存在单个位点,推测在小麦进化过程中部分同源基因发生了丢失现象[15]。
小麦多倍体形成过程中,基因复制事件和转座事件是基因家族扩张或重排的重要驱动力[15],串联重复事件和片段复制事件是植物基因家族扩张的主要方式,在植物适应性进化过程中发挥着重要作用[16]。本研究共鉴定出17对片段重复基因对,大多数片段复制基因属于胞质型,而在小麦G6PDH基因家族成员中未发现串联复制基因,表明片段复制可能是小麦G6PDH基因家族扩张的主要原因。
前人对大豆和大麦G6PDH蛋白的研究结果发现,大部分G6PDH蛋白底物结合区的核心基序为(RIDHYLG),NADP+结合区基序为(NEFVIRLQP)[5-6]。本研究中TaG6PDH3-4A/4B/4D蛋白不含典型的基序(RIDHYLG),同时TaG6PDH3-4D蛋白也不含NADP+结合区基序。本研究对拟南芥、水稻和小麦G6PDH基因进行了聚类分析,发现小麦TaG6PDH3-4A/4B/4D基因与拟南芥AtG6PDH4基因聚在同一亚组,属于P0类型。Wakao等[2]发现,P0亚组成员AtG6PDH4不具有酶催化活性。因此,推测小麦TaG6PDH3-4A/4B/4D不同于其他亚组成员,可能编码一种非功能性蛋白。
Schaewen等[17]研究发现,质体型G6PDH蛋白比胞质型G6PDH在N端多含有一段转运肽序列。本研究进化分析表明,胞质型TaG6PDH2-2A/2B和TaG6PDH5-6A/6B/6D蛋白与已鉴定的拟南芥和水稻胞质型 G6PDH蛋白序列同源性较高,且均不含转运肽序列;质体型G6PDH蛋白又可分为P0、P1和P2亚组。前人也鉴定到不具有催化活性的P0亚组G6PDH蛋白,其主要功能是促进P1亚组G6PDH蛋白进入溶酶体[2,18]。内含子和外显子结构分析表明,聚在一类的亚组成员具有相似的内含子和外显子结构,表明同一亚组成员可能具有相似的功能。
CARDI等[19]研究表明,植物P1亚组G6PDH基因主要在叶片等光合作用组织中高表达,而P2亚组G6PDH基因在根、茎及大部分组织中均具有有较高的表达量。本研究通过RNA-seq分析小麦G6PDH基因在不同组织中的表达模式,发现P2亚组成员TaG6PDH1-2A/2B/2D基因主要在根中高表达;利用qRT-PCR也发现了TaG6PDH1-2A/2B基因在根中的表达显著高于其他组织,暗示这三个部分同源基因在小麦根的发育过程中发挥着关键作用。P1亚组成员TaG6PDH4-6A/6B/6D基因主要在叶片等光合作用组织中高表达,这与前人在拟南芥[2]中报道的P1亚组同源基因的表达模式类似。Wakao等[2]研究表明,拟南芥胞质型G6PDH基因可调控种子发育过程中的脂肪酸合成,该基因突变影响种子的含油量。本研究中胞质型基因TaG6PDH5-6A/6B/6D在种子发育后期表达量也较高,说明TaG6PDH5-6A/6B/6D也可能参与小麦种子的发育过程。
本研究采用Liu等[20]报道的干旱和热胁迫下小麦幼苗叶片的转录组数据,进一步分析了G6PDH基因家族在非生物胁迫下的表达模式,结果发现,TaG6PDH2-2A和TaG6PDH2-2B基因在干旱胁迫1 h时以及热胁迫6 h时均上调表达;进一步利用qRT-PCR检测6个小麦G6PDH基因在干旱和盐胁迫下的表达模式,发现分别有5个小麦G6PDH基因在小麦根中均上调表达。综上所述,小麦G6PDH基因家族成员在抵御非生物胁迫过程中发挥着重要作用。本研究为后续分析G6PDH基因在调控小麦生长发育和响应逆境胁迫的分子机制方面提供参考信息。

