分步法分解硫化氢制氢和硫黄催化剂研究进展
于姗,段元刚,张怡欣,唐春,付梦瑶,黄靖元,周莹
(1 油气藏地质及开发工程国家重点实验室,四川 成都 610500;2 西南石油大学新能源与材料学院,四川 成都610500)
稳油增气是保障国家能源安全的重大战略需求。我国天然气对外依存度持续升高,2021 年已达46%。为保障国家能源安全,必须加快我国天然气开发[1-4]。目前,我国天然气中约1/4 为富含H2S(体积分数大于2%)的高含硫气藏,包括普光气田和元坝气田等国家“西气东输”工程的主供气源[5]。高含硫气藏在开采中会伴随产生大量剧毒且高腐蚀性的H2S 气体,如何有效处理H2S 是保障高含硫气藏安全开发的重要前提。尤其是在双碳背景下,如何通过低碳绿色的方式有效捕获H2S中蕴藏的氢资源和硫资源,实现H2S 变“废”为“宝”、变“害”为“利”,是高含硫气藏清洁开发面临的重要挑战。
目前天然气开发中最常使用的H2S处理技术为克劳斯工艺,虽然克劳斯工艺在改进后的H2S转化率可以达到99%,但是其弊端在于未将H2S里面的氢元素得到有效利用,而且反应需在1000℃以上的高温下进行导致耗能严重[6-8],不符合双碳目标的发展要求。其他H2S处理技术有高温热分解法、电催化分解法、光催化分解法等。高温热分解法是通过在高温下将H2S裂解为H2和硫黄,反应受到热力学限制导致转化率很低。电化学分解法可分为直接法和间接法:直接法表面容易沉积硫黄造成电极钝化,反应稳定性差;间接法缺点在于传质效率低、阳极硫钝化影响电极寿命等[9-10]。光催化分解法是指利用太阳能在光催化剂的作用下将H2S光解生成H2和硫黄,光催化剂稳定性较差和H2S转化率低是其制约因素[11-14]。
分步法分解H2S 具有在较低温度区间分解、H2S转化率高的优点,是一种未来极具发展潜力的H2S 资源化利用方式,本文首先对分步法分解H2S的反应原理和发展历程进行了简介,随后对分步法使用的催化剂——金属硫化物和金属进行了分类介绍,重点概述了其催化活性及反应过程的相关研究,最后对分步法分解H2S所面临的问题提出了总结与展望。
1 分步法分解硫化氢的原理
1.1 反应原理
图1为纯H2S热分解为H2和硫黄反应过程中各组分的体积分数随温度的变化曲线[15],当热分解温度低于700℃时几乎不发生反应,即使在1000℃时H2S 转化率也只达到20%,H2S 的转化率超过50%必须要将温度升高至1375℃以上。因此,若要采用直接热分解法分解H2S制取H2和硫黄,存在以下显著的缺点:①提高H2S转化率需升高温度,高反应温度导致能耗增加;②反应器需要使用昂贵的耐热结构材料;③高温热反应后续的冷却阶段存在着H2和硫黄重新生成H2S的风险。上述缺点制约了热分解H2S制取H2和硫黄的工业应用。通过加入催化剂可降低热分解反应的活化能,从而可以增加反应速率,但是加入催化剂也不能影响稳态过程中的平衡;反应受热力学限制,催化剂对提升H2S转化率的能力十分有限。
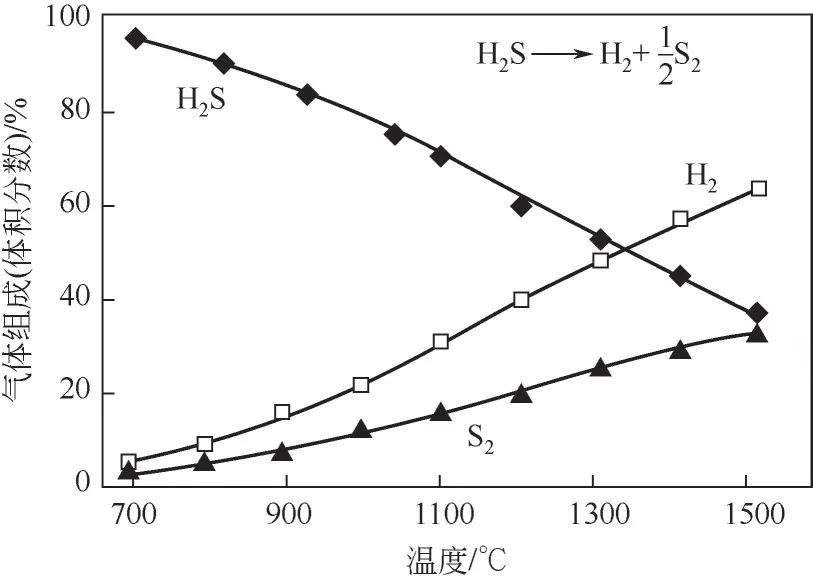
图1 纯H2S热分解反应随温度变化曲线[15]
若要在低温条件下提高H2S的分解效率,关键在于如何克服上述反应的热力学平衡限制。有研究者发现如果能将反应实现非稳态过程,则可打破热力学限制从而极大提高目标产物产率。非稳态过程是指基于温度、压力和反应混合物组成等参数变化引起的热力学平衡被打破的反应过程[16-18],具有降低能耗、提高反应器热效率、提高目标产物收率和克服平衡限制等优势。通过改变稳态过程的平衡移动可达到非稳态过程,使得H2S即使在较低的温度下也具有极高的理论转化率[19]。部分非稳态方法包括使用变压吸附或膜氢分离[20-26]等工艺将反应物H2S与产物H2分离开来,从而突破稳态过程中的热力学平衡限制,使得H2S的分解效率显著提高。
分步法分解H2S是一种典型的非稳态方法,也可以看作是一种化学链(chemical looping)反应,与传统催化反应(整个催化反应催化剂性质基本保持不变)有所不同,催化剂在整个反应过程中作为反应中间体伴随着消耗和再生,最终回到原来的状态[27-34]。具体而言,该过程将H2S分解制氢和硫黄的总反应分为在不同反应条件下进行的两步独立过程,其中反应物通过反应中间体(即催化剂)的硫化-脱硫两步循环转化过程被不断消耗分解,从而使整个反应在较低温度区间下达到高的H2S转化率。其反应原理见式(1)~式(3)。在式(1)反应中,金属或金属硫化物在H2S作用下发生硫化,得到高价金属硫化物并同时释放出H2,称为硫化产氢步骤。在式(2)反应中,高价金属硫化物在较高温度下分解为硫黄和原金属(低价金属硫化物),称为分解脱硫步骤。
硫化产氢步骤

在最简单的情况下,低价金属硫化物可能对应MxSy(x=y=1),高价金属硫化物可能对应MxSy+z(x=y=z=1),在实际反应中可能会存在非化学计量比的金属硫化物的情况[35-36]。一般而言,式(1)反应是放热的,对应的反应温度较低;式(2)反应则需要在相对高的温度下进行。如果式(1)和式(2)反应分开进行,式(2)反应中不会有H2,进而避免了分解脱硫阶段H2和硫黄发生逆反应生成H2S的可能性[37]。
2018 年,Zagoruiko[19]详细研究了分步法分解H2S 与直接热分解H2S 法的热力学过程差异。图2为直接法和分步法分解H2S反应的吉布斯自由能变化随温度的变化曲线。其中,H2S直接热分解反应的吉布斯自由能在0~1000℃区间始终为正值,说明直接热分解反应受到热力学的平衡限制,H2S的转化率较低。而在分步法中,以金属硫化物FeS/FeS2为例,FeS 的硫化产氢步骤在较低温度下(0~380℃)的吉布斯自由能变化值均为负值,说明FeS此时可与H2S 有效反应转化为高价金属硫化物FeS2,同时放出H2。FeS2的分解脱硫步骤在适宜温度下(800~1000℃)的吉布斯自由能变化值也小于0,说明在该温度区间FeS2也可有效分解为低价硫化物FeS同时生成硫黄。该作者进一步指出如果分解脱硫步骤形成的硫黄能够从反应区域连续移除,则可以在更低的温度下(低于800℃)实现FeS2的分解脱硫过程。除FeS/FeS2以外,该作者也研究了NiS/NiS2和CoS0.89/CoS2用于分步法分解H2S的热力学过程,并得出了类似的结论。由此可见,分步法可以在明显低于直接热分解反应的温度下实现H2S的高效分解,具有低反应能耗的显著优势。

图2 分步法分解H2S反应的吉布斯自由能随温度变化曲线[19]
早在20 世纪50 年代,Ralph M Parsons 公司在专利中首次报道使用Co3S4、Ni2S、FeS 等金属硫化物可进行H2S非稳态反应循环,实现了分步法分解H2S 的过程[38]。20 世纪80 年代,Lau 等[35,39-40]将Cr、Mo、W、Cu、Li、Na、K等金属组成的硫化物用于分步法实验,主要研究了金属硫化物在硫化产氢过程中的H2产率变化。Naman等[41-44]在20世纪80年代发现V、Ni等金属组成的硫化物可有效实现分步法过程,并对V基金属硫化物在硫化产氢过程中的动力学过程进行了研究。2019年Reddy等[45]分析了金属硫化物用于H2S 制H2和硫黄的分步法循环工艺,通过Aspen Plus软件对分步法循环工艺和克劳斯工艺进行了稳态模拟和工艺条件的优化,结合能效分析他们发现分步法循环工艺比克劳斯工艺具有更高的能耗优势和效率。2021 年Fan 等[46]发现2%Mo 掺杂FeS 可有效提高H2S 转化率,通过密度泛函理论揭示该过程反应机理。2022年Al-Ali等[47]通过理论计算寻找适用于分步法分解H2S的金属,结果表明Ni和Zr金属组成的硫化物是较好的催化剂,并通过实验验证了其可行性。总体而言,研究者们[40]通过在循环体系下结合减压操作能够实现较高的H2S转化率和H2产率,但由于难以收集硫黄并对其进行定量分析,导致目前大部分文献的关注点在于硫化产氢过程,对于分解脱硫过程的研究相对较少。
1.2 分步法分解H2S的催化剂选择
目前用于分步分解H2S的催化剂主要包括金属硫化物或金属,适用于分步法分解H2S的金属硫化物或金属应当满足以下条件[47]:①硫化产氢过程中在低温下具有优异的H2S转化率和H2产率;②分解脱硫过程中在较低温度下具有优异的分解效率;③两个过程中形成的金属硫化物之间应当具有良好的可逆性转换。为了进一步提升H2S转化率,研究者也对用于分步法的金属硫化物进行了改进[36-37,40,42,46-47],包括将金属掺杂于金属硫化物中或者Al2O3作为载体用于分散金属硫化物。
图3 总结了目前文献中用于分步法分解H2S 的金属硫化物和纯金属中所涉及到的金属元素,元素周期表中用于分步法分解H2S的金属硫化物的金属元素包括ⅠA族、ⅣB族、ⅤB族、ⅥB族、Ⅷ族、ⅠB 族等族的元素,纯金属元素包括ⅠB 族、ⅣA族、ⅤA族等族的元素。下文将以不同金属元素组成的硫化物或纯金属对分步法分解H2S的研究情况进行展开叙述,包括实验条件和实验结果等。
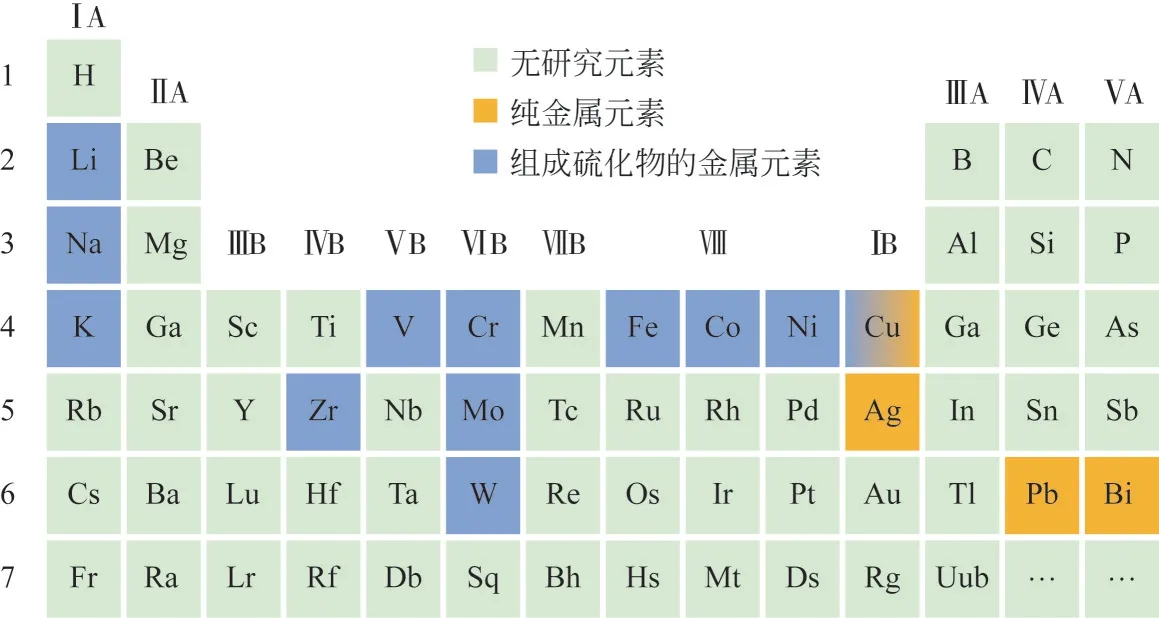
图3 元素周期表中用于分步法分解H2S的金属硫化物和纯金属中所涉及到的金属元素
2 金属硫化物在分步法分解硫化氢中的应用
2.1 IA族金属元素组成的硫化物
表1 为目前第ⅠA 族金属元素(Li、Na、K)组成的各种硫化物用于分步法分解H2S 的相关研究。Lau 等[39]研究了在400~800℃的温度范围下使用碱金属硫化物M2S(M=Li、Na、K)和多硫化物M2Sx(x=2~4;M=Na、K)用于分步法硫化产氢过程,通过测量H2产率随温度的变化,以比较碱金属硫化物促进分解H2S 的有效性。研究发现,Li2S会发生式(4)和式(5)的转化,Li2S和H2S在高温下生成Li2S2,Li2S2能稳定存在,体系中没有其他多硫化锂生成,其H2产率最大可达到7%,据报道Li2S2能够在150℃下分解为Li2S 和硫黄,因此该作者认为Li2S是通过分步法将H2S转化为H2和硫黄的金属硫化物良好候选者。

表1 IA族金属元素组成的硫化物用于分步法的研究
Na2S和K2S可被H2S快速硫化生成Na2S2和K2S2,K2S的H2产率最大可达到18%,Na2S的H2产率最大可达到14%,认为两者的硫化产氢速度均高于Li2S(但并未给出实际数据支撑),并且Na2S2和K2S2会发生进一步硫化得到多硫化物。因此,该作者也研究了多硫化物M2Sx(x=2~4;M=Na、K)的硫化产氢行为。经过400~800℃的硫化产氢实验后,所有多硫化钠Na2Sx(x=2~4)都生成了组成近似为Na2S2.4-2.6的非晶态物质,但指出多硫化钠Na2Sx(x=2~4)的H2产率相比于空白实验(不加入金属硫化物)并没有提升。K2S2和K2S4的最终产物也是K2S2.7-2.9的非晶态物质,但K2S3较为稳定,没有发生明显的化学组成变化。该作者指出K2S2的H2产率相比于空白实验有所提升,但K2S4的H2产率没有明显提高。
K2S 和Na2S 虽然能与H2S 发生硫化产氢反应且H2产率相对较高,但由于K2S和Na2S硫化得到的高价硫化物在高温下稳定性较高不易分解,所以并不适用于分解脱硫反应从而影响分步法循环过程;而Li2S虽能发生分步循环过程,但由于H2产率较低而受到限制,所以研究者也尝试使用其他族金属元素组成的硫化物用于分步法研究。
2.2 Ⅳ-ⅥB族金属元素组成的硫化物
表2 为目前第ⅣB-ⅥB 族金属元素(Zr、V、Cr、Mo、W)组成的各种金属硫化物用于分步法分解H2S的相关研究,其均主要侧重于分步法中硫化产氢过程的H2产率研究。
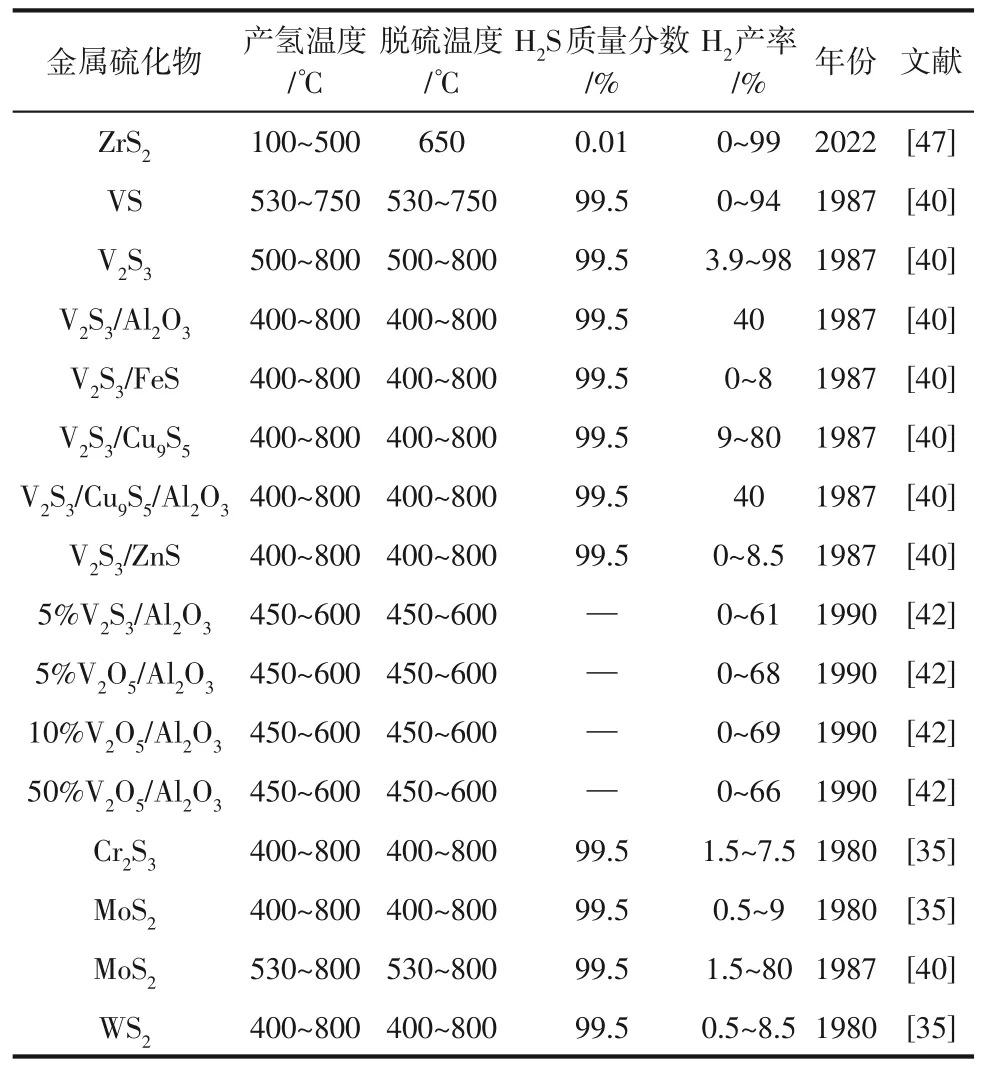
表2 ⅣB-ⅥB族金属元素组成的硫化物用于分步法的研究
Al-Ali 等[47]基于理论计算发现ZrS2可用于分步法分解H2S的循环过程。他们首先合成了ZrS3进行分解脱硫反应,发现ZrS3在650℃下能够转化为ZrS2和硫黄。在此基础上,他们在100~500℃的温度范围下对生成的ZrS2进行硫化产氢研究,发现在100℃和200℃时反应前10min 内H2S 转化率均接近99%,但随后H2S 转化率急剧下降,100℃时的H2S转化率接近0,200℃时的H2S转化率仅维持在10%左右。当硫化温度在200℃以上时,反应稳定后的H2S转化率会得到提升,但由于反应气氛中存在微量O2,微量O2会氧化ZrS2为ZrO2,ZrS2在500℃下几乎完全转化ZrO2,使得整个反应循环被中断,因此如何避免ZrS2被氧化将是该反应体系的重要挑战。
Lau 等[40]使用V2S3、VS 等金属硫化物用作分步法分解H2S实验,主要测试了在400~800℃的温度范围下的H2产率。他们分别使用流动和循环体系在石英反应器中进行长时间研究,其中循环体系是指通过循环泵将未反应的H2S重复通过石英反应器达到循环的过程,流动体系是指H2S只反应一次并没有重复循环的操作过程。研究发现VS 可作为分步法的候选金属硫化物,其H2产率最高可以达到94%,发生式(6)和式(7)反应,VS 在硫化产氢过程中得到V2S3,V2S3然后分解得到VS和硫黄。
但VS 稳定时间较短,大约在5min 后H2S 的转化率就急剧下降至15%左右。该作者进一步研究了VS 的产物V2S3用于分步法实验,发现其在流动体系中、温度为750℃时H2产率最高可以达到6.5%,使用循环体系其H2产率可以增加到12%,在移除产物H2和冷凝硫黄的情况下,V2S3的H2产率在700℃最高可接近100%,随后降至稳定状态为80%左右。为了研究不同的硫化物在分步法分解H2S反应过程中是否存在协同作用,该作者在流动体系中研究了V2S3/FeS、V2S3/Cu9S5、V2S3/ZnS 的H2产率,结果发现三种混合硫化物的H2产率都低于10%,V2S3/FeS、V2S3/ZnS 对H2产率没有明显的提升,仅V2S3/Cu9S5对H2产率有部分提升。与此同时,该作者研究了热扩散技术分离H2对提升体系H2产率的影响。他们使用Pyrex 和石英构成的热扩散柱用作热扩散反应器,在流动体系中使用V2S3/Al2O3和V2S3/Cu9S5/Al2O3作为反应催化剂,研究结果表明在热扩散反应器中H2和H2S可较好地分离,这使得V2S3/Al2O3和V2S3/Cu9S5/Al2O3的H2产率得到了明显提升,最高可达到40%。
Naman 等[42]研 究 了V2S3/Al2O3、V2O5/Al2O3用 于分步法分解H2S的可行性。他们将反应产物通过冷阱以冷却回收硫黄,同时使用二乙醇胺将未反应的H2S与产物H2进行分离,实现了硫黄和H2的连续生产。在向反应器不断供给H2S的情况下,他们测量了该体系在450~600℃温度范围下的H2产率,发现5%(质量分数)V2S3/Al2O3的H2产率随着温度升高而增加,在450℃可达44%,在600℃时则可达61%。该作者也研究了450~600℃的温度范围内不同负载量的V2O5/Al2O3的H2产率,实验结果表明当V2O5的负载量从5%增加到10%时,H2产率随之增加,但当负载量从10%进一步增加到50%时,H2产率反而减小。其中,10%(质量分数)V2O5/Al2O3的H2产率最高为69%。因此,该作者认为不需要额外制备金属硫化物V2S3,直接使用金属氧化物V2O5/Al2O3也可获得高于V2S3/Al2O3的H2产率。具体而言,V2O5或V2S3在H2S 气流中可发生式(8)~式(10)的反应。
Lau 等[35]研究了在400~800℃的温度梯度下使用Cr2S3、MoS2、WS2等金属硫化物用于分步法研究,实验结果表明在硫化产氢过程中Cr2S3、MoS2、WS2的H2产率均随温度的升高而增加,都在800℃时达到最高分别为7.5%、9%、8.5%。在600℃以下Cr2S3和WS2的H2产率均高于MoS2,而在600℃以上MoS2的H2产率又高于Cr2S3和WS2。
需要说明的是,上述研究仅重点关注了分步法中硫化产氢过程中不同硫化物和反应条件下体系的H2产率变化,并未对金属硫化物的后续分解脱硫反应展开深入研究,使得相关体系中无硫黄回收率相关数据,从而难以对其进行完整的评价。
2.3 第Ⅷ族金属元素组成的硫化物
表3为目前第Ⅷ族金属元素(Fe、Co、Ni)组成的各种硫化物用于分步法分解H2S 的相关研究,仍主要侧重于分步法中硫化产氢步骤的H2产率研究。这三类金属硫化物研究种类较多,所以下文将其分为Fe 基金属硫化物、Co 基金属硫化物、Ni 基金属硫化物三部分展开叙述。
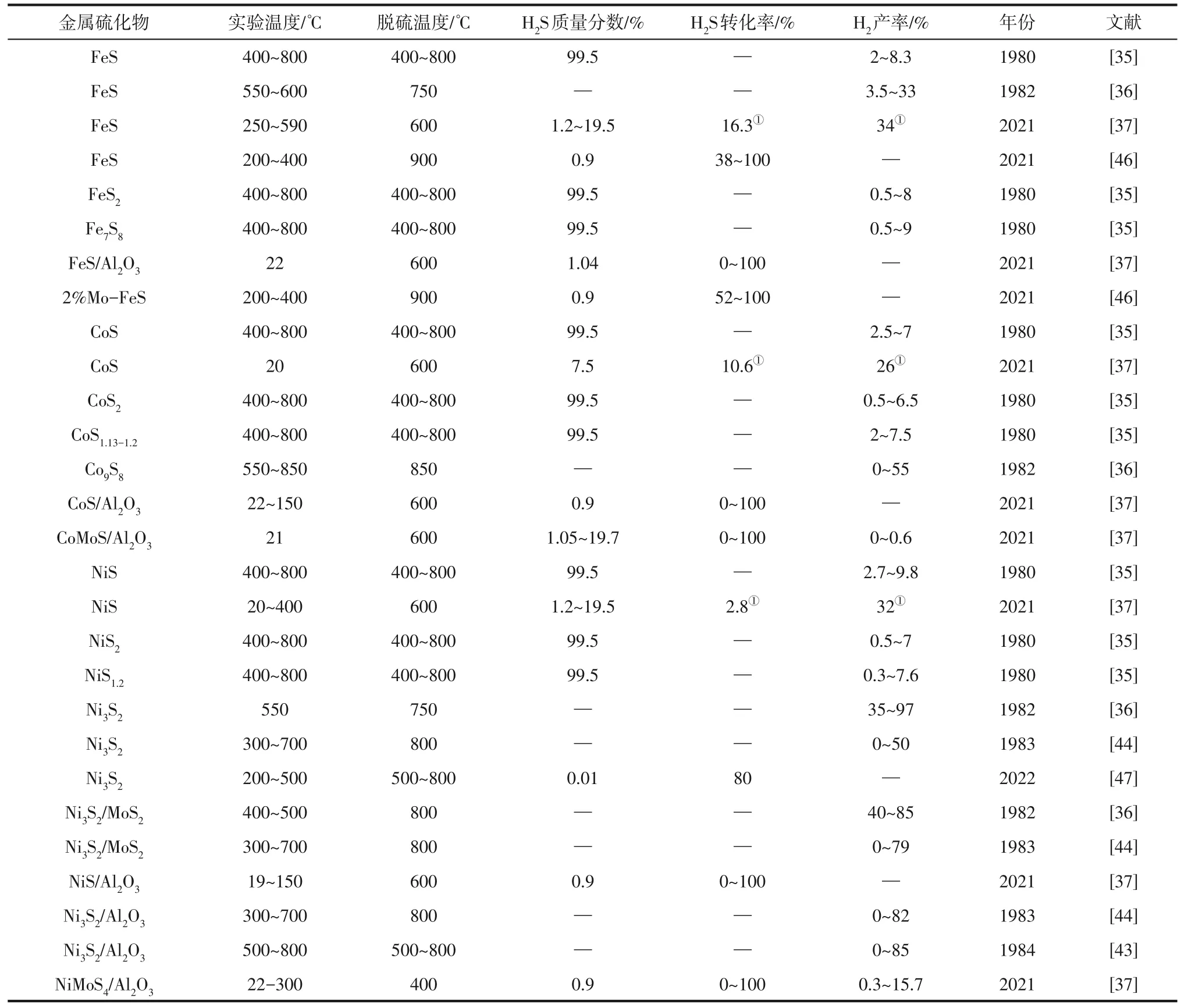
表3 第Ⅷ族金属元素组成的硫化物用于分步法的研究
2.3.1 Fe基金属硫化物
Lau 等[35]使用了FeS、FeS2、Fe7S8等Fe 基金属硫化物在400~800℃下进行分步法分解H2S 实验,在反应过程中并未严格区分硫化产氢和分解脱硫步骤,发现FeS、FeS2的产物均为非化学计量比金属硫化物Fe7S8,结果表明使用不同金属硫化物的H2产率情况不同,其中FeS 在600℃以下会快速发生硫化产氢过程,对应的H2产率为6%,但随温度升高H2产率会逐渐下降,认为是由于FeS过快硫化为非化学计量比金属硫化物Fe7S8所造成;而FeS2的H2产率随温度升高而增加,最高可达8%左右,认为是由于反应后FeS2也转化为Fe7S8,根据分步法原则该步骤应当归纳为分解脱硫步骤,但未对该过程做深入研究,所以也使用产物Fe7S8用于反应的H2产率研究,发现其H2产率较FeS、FeS2高为9%。
Tanaka 等[36]对FeS 粉末在循环体系进行了硫化产氢研究,发现在常压、550℃的反应条件下,FeS粉末的H2产率可以达到20%,通过降低反应体系的压力,H2产率可进一步提升至33%。该作者也分析了H2产率较低的原因,认为由于金属硫化物固体内部的阻力会使得H2实际产率不超过理论产率的30%。
Zagoruiko 等[37]使用Fe2O3在400℃下通过H2S 的硫化作用得到金属硫化物FeS 后,再将FeS 用于5次硫化产氢和分解脱硫的循环研究。5次循环硫化产氢过程的反应温度在250~590℃范围内,分解脱硫温度则均为600℃,实验结果表明,5 次不同循环中每吸附一分子H2S 有0.17~0.95 分子的H2生成,平均H2产率为34%。在实验中也测试了FeS的失活情况,发现FeS 在40h 内仍然保持活性。该作者认为H2S的硫化反应不仅可以通过式(1)进行,还可以形成含氢硫化物的形式,如式(11)所示。该作者还研究了Al2O3作为载体负载FeS 用于硫化产氢和分解脱硫的循环2次实验,在硫化产氢阶段,前9min 内对H2S 的转化率为100%,随后H2S 转化率随时间逐渐降低,约1h 后达到不再发生分解,在整个反应过程中反应器出口观察到极少的H2(体积分数0.01~0.02%)产生;在分解脱硫阶段,在150~200℃的温度下观察到H2S 的部分解吸,但并未对分解脱硫过程进行深入研究。
Fan 等[46]通过使用FeS 和低浓度的Mo 掺杂FeS进行了分步法实验。他们发现质量分数2%的Mo掺杂的FeS 保持了FeS 的晶体完整性,且其对H2S分解有显著的促进作用。通过5次硫化产氢和分解脱硫的循环实验表明,与未掺杂的FeS 相比,2%Mo-FeS 的平均H2S 转化率提高了24%,同时保持了良好的循环性能。具体而言,2%Mo-FeS 比FeS 在300℃时H2S 转化率提高了34%,在350℃和400℃下H2S 转化率均提高了19%。该作者通过密度泛函理论探究了FeS 和2%Mo-FeS 表面吸附H2S产氢的机理,发现催化剂表面的H扩散是硫化产氢过程的决速步。在初始硫化产氢过程中,Mo 掺杂不会在动力学上明显促进反应的发生,但随着硫在催化剂表面上的逐渐累积,H在FeS表面的扩散势垒将显著增加,Mo 掺杂可有效促进H 在FeS 表面的扩散,从而促进H2S的转化。
2.3.2 Co基金属硫化物
Lau等[35]通过使用CoS、CoS2、CoS1.13~1.2在400~800℃下进行分步法实验,在反应过程中并未严格区分硫化产氢和分解脱硫步骤,发现CoS、CoS2的产物均为非化学计量比金属硫化物CoS1.13~1.2,结果表明使用不同硫化物的H2产率情况不同,其中CoS2在550℃以下H2产率较低为2.5%左右,认为此时CoS2对H2S的热分解起催化作用并非是发生硫化产氢过程,而在550℃以上H2产率逐渐升高可达到8%,认为由于CoS2的热分解为CoS1.13~1.2的原因所导致,与上文FeS2分解为Fe7S8问题类似,该作者并未进行深入分析。与CoS2所不同,CoS 在400~800℃下会被快速硫化为CoS1.13~1.2,其H2产率在4%左右。使用CoS、CoS2的产物CoS1.13~1.2于反应中,发现其H2产率最高可达9%。
Tanaka 等[36]将Co9S8在循环体系中进行分步法研究,在反应过程中H2产率最高可达55%,从硫化反应速率对温度的依赖性而言,该循环的硫化反应在400~600℃内反应速率达到最佳,并且Co9S8在分步法循环中具有硫化产氢过程和分解脱硫过程之间温差较小的特点。
Zagoruiko 等[37]通过H2S 对CoO 进行硫化得到金属硫化物CoS,再将CoS 用于2 次硫化产氢和分解脱硫的循环研究。在CoS 硫化产氢阶段,2 次循环的平均H2S转化率为10.6%,平均H2产率为2.76%,说明体系伴随有其他副反应过程的发生。在分解脱硫阶段,理论上硫黄产量为381mg,由于硫黄沉积在反应管壁上难以全部收集等原因,实际的硫产量仅有28mg。该作者也研究了CoS/Al2O3和CoMoS/Al2O3用于3次硫化产氢和分解脱硫的循环实验:相比于CoS,CoS/Al2O3和CoMoS/Al2O3的H2产率和H2S转化率并没有明显的提升,且也未给出反应后的硫黄产量,CoS/Al2O3的H2S 转化率相比CoMoS/Al2O3较高,但其H2产率相比CoMoS/Al2O3反而更低。
2.3.3 Ni基金属硫化物
Lau等[35]使用NiS、NiS2、NiS1.2在400~800℃下进行分步法实验,发现NiS、NiS2与前文中该作者所使用的FeS、FeS2和CoS、CoS2结果类似,在反应过程中未曾严格区分硫化产氢和分解脱硫过程,反应后都生成了非化学计量比的金属硫化物NiS1.2,且三者与H2S之间的转化行为也类似,使用NiS1.2的H2产率最高为7.6%,均未对分解脱硫部分展开详细研究,所以没有硫黄回收率的数据。
Tanaka 等[36]使用Ni3S2粉末在550℃下进行6 次硫化产氢和分解脱硫循环实验,第一次循环实验的H2产率最高可达96%,发生如式(12)和式(13)反应,但是后面的循环实验H2产率逐渐降低,第六次循环的最高H2产率仅为35%左右。该作者认为这可能是由于Ni3S2发生了烧结,进而抑制了硫化产氢反应,为解决这一问题,他们将Ni3S2分散在等量MoS2粉末中进行硫化产氢实验。实验结果表明在400~500℃下,该方法可以有效维持H2产率,H2产率最高可达85%。Tanaka等[44]也通过将Ni3S2负载在Al2O3上的方法以保持硫化产氢反应的稳定性,实验表明Al2O3可有效抑制Ni3S2发生烧结,在500℃的硫化温度下体系H2产率最大为82%。该作者虽然提到在800℃下进行分解脱硫实验,但并未给出实际硫黄产量数据;进一步[43]对Ni3S2/Al2O3进行了放大实验,研究了不同Ar 流速对H2产率的影响,发现在250mL/min 的Ar 流速下H2产率最大可达85%;在500℃下硫化产氢和800℃下分解脱硫的循环过程中,近似估算得到该过程的H2S热转化效率为43%~45%。
Zagoruiko等[37]将NiO与H2S原位反应生成的NiS在室温至400℃下进行硫化产氢实验,并在600℃下的N2氛围下进行分解脱硫实验。5次循环实验结果表明,H2S 平均转化率为2.8%,H2平均产率为0.9%,根据吸收的H2S 体积计算理论硫黄产量为80mg,但在产物中仅收集到10mg 的硫黄。使用Al2O3负载NiS 进行4 次循环实验,发现H2S 转化率均在90%以上,且再生部分得到的硫黄质量与理论值接近。通过Al2O3负载双金属硫化物NiMoS4进行循环实验,实验发现NiMoS4/Al2O3反应过程中产生具有较高的H2产率,但H2在分解脱硫过程中释放,并非在硫化产氢过程中释放,对此该作者并未解释其原因。
Al-Ali 等[47]通过理论计算得到Ni3S2是有利于分步法实现分解H2S 的候选金属硫化物,并在150℃、200℃、300℃、500℃等不同温度下分别进行了硫化产氢过程的研究。实验结果表明Ni3S2在150℃下不会发生硫化反应,但在200~500℃下硫化为高价金属硫化物Ni3S2+x,同时释放出H2。XRD 测试结果表明Ni3S2+x主要包括NiS、Ni7S6和NiS1.03。H2S 转化率变化趋势均相同,在前100~300min 内接近100%,随后逐渐下降并趋于稳定。且H2S 稳定时的转化率随硫化温度升高而增加,在500℃稳定后的转化率最高可接近85%。具体而言,Ni3S2在300℃下得到的主要高价金属硫化物为NiS,并且NiS 可在700℃分解脱硫温度下得到Ni3S2和硫黄,证明了Ni3S2具有分步法分解H2S 的良好循环性能。
2.4 ⅠB族金属元素组成的硫化物
表4 为目前第ⅠB 族金属元素(Cu)组成的各种硫化物用于分步法分解H2S 产氢的相关研究。Lau 等[35]运用Cu2S、Cu9S5、CuS 等金属硫化物在400~800℃下进行分步法实验,研究发现Cu2S、Cu9S5、CuS 的H2产率最高为7%左右,但作者仅给出了H2产率,并未分析阐述具体的反应过程。

表4 IB族金属元素组成的硫化物用于分步法的研究
3 纯金属在分步法分解硫化氢中的应用
相比于金属硫化物用于分步法分解H2S 研究,金属的硫化产氢过程更容易实现,因此可以在更低的温度下实现产氢。但目前使用纯金属用于分步法的研究相对金属硫化物较少,如表5所示,主要包括Cu、Ag、Pb、Bi等金属用于产氢研究。

表5 金属用于分步法分解H2S的研究
Chen 等[48]研究了金属Cu 在250~550℃温度下的硫化产氢的动力学过程。根据速率数据和动力学分析,Cu 与H2S 发生式(14)反应,并得出Cu 与H2S的反应分为两个阶段:初期体系的反应速率由表面反应控制,此时反应速率主要取决于Cu 的比表面积,并不取决于H2S的压力或浓度,该阶段反应活化能为63kJ/mol;第二阶段,当Cu 部分硫化为Cu2S后,其会有较大的体积变化,当体积变化到一定程度后,反应速率将由Cu2S累积层的厚度和H2S的浓度共同决定,此时反应活化能为38kJ/mol。在此基础上,如何完成Cu2S 的分解脱硫过程是实现分步法分解H2S的关键。
Tanaka 等[36]通过使用Pb、Ag 进行了分步法的硫化产氢研究,研究发现金属Pb在600℃的温度下对H2S 具有很高的转化率,随着时间的增加,H2S的转化率可达到90%,通过对金属Pb中加入Cu和Ni 会进一步促进H2S 的吸收,H2S 的转化率最终接近100%。此外,金属Ag 与H2S 在600℃反应时也可得到Ag2S和H2,对应的H2S转化率最高可达56%左右。
Soliman 等[49]研究了使用金属Bi 用于分步法分解H2S 反应,反应见式(15)所示,由于Bi 的熔点较低(271℃),因此在400℃反应条件下Bi 主要以熔融态形式存在,此时硫化产氢过程主要以气液形式发生,相比于传统的气固反应,H2S气体和熔融的Bi接触更加充分,因此有利于H2S的转化。反应平衡后体系的H2产率维持在47.3%。该作者进一步指出Bi2S3可在927℃下进行分解脱硫过程生成单质Bi和硫黄,但是相关研究并未深入展开。
4 结语
分步法分解H2S法具有可在较低温度区间实现H2S 高效转化的特点,是未来最有潜力的H2S 高值利用方法之一。通过对催化剂金属硫化物和金属的总结梳理发现,目前研究最多的催化剂是金属硫化物,大部分金属硫化物并不适用分步法过程,仅有少数金属硫化物适合,其中,Ni和V基金属硫化物具有较高的转化率,并且能够有效实现低金属硫化物和高金属硫化物之间的循环转化。此外,通过使用Al2O3分散金属硫化物或金属掺杂金属硫化物等催化剂修饰方法可进一步提升H2S 转化率和稳定性。
虽然分步法分解H2S研究目前已经取得了一定的研究进展,但仍然处于发展初期阶段,存在许多问题亟待解决,针对目前所面临问题的总结及展望如下。
(1)金属硫化物需要具有高H2S转化率和循环效率,目前文献中所使用的很多金属硫化物还难以实现这一要求,原因在于硫化产氢与分解脱硫过程中的可逆性机理认识较为浅薄。可采用原位XRD等表征技术分析反应过程中的中间产物,通过理论计算辅助验证其可能的转化过程,以深入研究金属硫化物与H2S分步法反应的内部转化机理。
(2)目前文献对分解脱硫反应过程的研究关注较少,部分研究脱硫反应的硫黄回收率也不高。为了保证分步法可有效持续循环,未来必须加强脱硫反应过程的研究,实现高价金属硫化物有效分解为硫和低价金属硫化物或金属的过程。
(3)目前相关研究所用的硫化产氢过程的温度均较高,且金属硫化物在硫化产氢过程中会被大量消耗而导致H2S转化率逐渐降低,从硫化产氢过程到分解脱硫过程需要升高反应温度,导致反应能耗进一步增加,未来应当设计开发合适的分步法催化剂,在较低温度下实现分步法快速分解H2S转化为H2和硫黄的循环过程。
(4)目前对金属用于分步法的研究较少,主要原因在于金属与H2S 反应的动力学限制使得H2S 转化率较低,并且硫化产氢过程中得到的金属硫化物在高温下较为稳定,未来可适当设计开发金属催化剂体系,在促进硫化产氢反应动力学过程的同时提升金属硫化物分解脱硫过程的硫黄回收率。
(5)目前大部分研究主要探究的硫化产氢过程的H2产率和H2S转化率,但并未通过测量空时、空速等重要指标以衡量催化剂性能优劣,同时对于催化动力学的核心标准——反应速率也极少研究,未来应当加强相关实验设计,研究空时、空速等对催化剂的反应速率等性能评价指标的影响。

