甲苯一步催化硝化制备二硝基甲苯反应过程及危险性
汪嘉欣,潘勇,熊欣怡,万晓月,王建超
(1 南京工业大学安全科学与工程学院,江苏 南京 211816;2 南京工业大学化学与分子工程学院,先进化学制造研究院,江苏 南京 211816)
硝化反应被广泛应用于化工生产中的含能材料、染料、农药、精细化工等领域[1]。硝化工艺是高危险性工艺,其稳定性和安全性一直是化工安全生产的重点。二硝基甲苯(DNT,包括2,4-DNT和2,6-DNT 异构体)是甲苯硝化的重要产物,也是生产聚氨酯单体甲苯二异氰酸酯(TDI)和甲基环己基二异氰酸酯(HTDI)不可或缺的基本原料。传统的DNT 工业生产采用两段式硝-硫混酸硝化法,该方法具有操作危险、步骤繁琐、副反应多(氧化或磺化)、腐蚀性强、后处理成本高等缺点,导致爆炸、火灾、中毒等安全事故频发,造成严重的人员伤亡和经济损失。因此,开发一种绿色安全有效的硝化工艺来实现DNT 的清洁生产具有重要意义。
近年来,研究人员聚焦在开发和使用安全、高效的硝化剂和催化剂上。如HNO3/N2O5-多相催化剂(分子筛[2]、固体磷酸催化剂[3]和金属氧化物[4-5])、HNO3-均相催化剂(离子液体)[6]、HNO3-N2O5[7]、NO2-O3/O2[8-9]。其中,HNO3-多相催化剂在甲苯二硝化研究中表现出优异的DNT 选择性。尚雁等[10]发现在60℃下单独使用高浓度硝酸且在≥97% HNO3、甲苯摩尔比为8∶1 时,DNT 的选择性可达到94%;Fareghi-Alamdari 等[11]首次报道了Cu1-xCoxFe2O4尖晶石催化剂可应用于DNT 合成,在90℃的高反应温度和98% HNO3、甲苯摩尔比为2∶1下,DNT的产率达到90.2%。以上研究表明该甲苯硝化的多相催化体系不仅提高了产物DNT 的选择性,还对发展绿色化学工艺具有生态友好性,在一定程度上可减少安全隐患。然而,在没有硫酸和有机溶剂的情况下,如何用相对较低的反应温度和硝酸用量在多相催化剂上实现DNT 的高选择性仍然是一个挑战。
近年来,我国对硝化等危险工艺的审批和监管力度日益加大,硝化反应属于国家安全监管总局所列的首批重点监管的15 种危险化工工艺之一,其行业安全生产问题受到极大重视。甲苯硝化反应为强放热反应,放热滞后易出现快速升温,且硝化物料和溶剂往往具有易燃易爆特性,易导致在某种失效情况下发生危险事故。目前的研究更多集中在甲苯二硝化反应工艺的优化及产物选择性的提高,而针对构建新工艺的热危险性研究鲜有报道。发生热失控的根本原因在于热量无法及时移出[12],明确化工艺危险特性,对制定硝化工艺安全控制措施,保障安全生产十分重要。因此采用适当的方法对工艺过程热特性参数进行分析,将安全问题融入工艺设计过程中,从而预防反应失控的发生、提高化工过程本质安全度,具有重要意义。
本研究基于“替代、缓和及简化”的本质安全基本原则[13],针对工业DNT 生产工艺中操作危险、混酸体系中硫酸浓缩过程耗能耗时长、温度要求高、步骤繁琐等安全问题对合成工艺进行了改进,使用冷冻辅助-溶胶凝胶法制备的CuMnCoO4尖晶石作为催化剂,以95% HNO3替代硝-硫混酸,同时作为硝化剂,在缓和条件下考察HNO3浓度、催化剂用量、O2等参数对反应的影响,将传统两步硝化法简化为一步硝化,优化了DNT 合成工艺,且避免了浓硫酸的使用。并使用实验室全自动反应量热仪(RCle)对CuMnCoO4尖晶石催化甲苯硝化制备DNT 的热危险性进行研究,得到反应的绝热温升(ΔTad)和热失控条件下反应体系所能达到的最高反应温度(MTSR)等,研究结果可为DNT 的工业安全生产提供参考数据。
1 实验部分
1.1 试剂
主要试剂有:甲苯(分析纯,永华化学股份有限公司),95% HNO3(分析纯,国药集团化学试剂有限公司),Cu(NO3)2·3H2O(分析纯,麦克林试剂网),Mn(NO3)2·4H2O(分析纯,麦克林试剂网),Co(NO3)2·6H2O(分析纯,阿拉丁化学试剂网),无水柠檬酸(分析纯,永华化学股份有限公司);乙醇(分析纯,阿拉丁化学试剂网),二氯甲烷(色谱级,阿拉丁化学试剂网),碳酸氢钠(粒装)(分析纯,国药集团化学试剂有限公司),4-硝基苯乙酮(分析纯,阿拉丁化学试剂网)。
1.2 催化剂的制备
1.2.1 CuMnCoO4尖晶石催化剂的制备
采用冷冻辅助-溶胶凝胶法合成的CuMnCoO4尖晶石催化剂,首先按摩尔比1∶1∶1∶2 依次称取Cu(NO3)2·3H2O、Mn(NO3)2·4H2O、Co(NO3)2·6H2O和无水柠檬酸置于烧杯中,随后加入一定量的去离子水,搅拌混合均匀完毕后,滴加一定量的乙醇,将所得溶液均匀搅拌3h。将所得湿凝胶放置在冷冻干燥机中冷冻真空干燥,得到干凝胶。将其研磨成粉末,最后空气气氛中500℃煅烧4h,得到所需的CuMnCoO4尖晶石催化剂。
1.2.2 CuMnCoO4尖晶石催化剂的表征
X 射 线 衍 射(XRD)测 试:Bruker AXS D8 Advanced Focus 衍 射 仪,使 用CuKα辐 射(λ=1.5418Å,1 Å=0.1nm),在40kV 和40mA 下工作,扫描范围2θ=10°~80°。N2吸附-脱附和孔径(BET)测试:美国康塔AUTOSORBIQ 全自动比表面及孔隙度分析仪,测定样品的比表面积、孔容和孔径。X 射线光电子能谱(XPS)测试:美国Thermo Fisher Nexsa 型X 射线光电子能谱仪,X 射线源为Al 靶Kα线(1486.6eV),全谱扫描的靶功率为300W,C 1s校准结合能为284.8eV。傅里叶红外光谱(FTIR)测 试:美 国Thermo Scientific Nicolet iS20 光谱仪,采用KBr 法和样品混合压片法制样,记 录 波 长 范 围 为400~4000cm-1。拉 曼 光 谱(Raman)测试:日本Horiba LabRAM HR Evolution光谱仪,激光器波长532nm。
1.3 催化剂甲苯硝化性能评价
1.3.1 甲苯硝化步骤
室温下,将CuMnCoO4尖晶石催化剂和95%HNO3按一定比例加入带有磁子和冷凝器的圆底二口烧瓶中,滴加一定量的甲苯(95% HNO3、甲苯摩尔比为4∶1)。滴加完毕后,50℃搅拌6h。反应完成将混合物缓慢冷却至室温,用二氯甲烷转移反应液,过滤催化剂,加入碳酸氢钠中和反应液。加入内标4-硝基苯乙酮,用于气相色谱分析。每组实验均进行平行实验(≥3次)。
1.3.2 GC色谱分析
本实验采用美国Agilent 7890B 气相色谱仪对产品进行定量气相色谱分析。GC 分析条件如下:采 用 安 捷 伦DB-5 毛 细 管 柱(30m×320μm×0.25μm),柱箱温度采用程序升温,初始温度为60℃,保持6min,然后以10℃/min 的速度逐渐上升到160℃,保持5min。入口和检测器的温度均为250℃。以4-硝基苯乙酮为内标,采用内标法计算所制物质的定量组成。所有预期的甲苯硝化产品均从国药控股化学试剂有限公司购买,以确定其相对于溶剂的保留时间和校正因子。以2.5mmol甲苯、10mmol 95%HNO3、0.09g CuMnCoO4尖晶石催化剂,室温下滴加甲苯,滴加完毕后50°C 反应6h 为例计算甲苯转化率、反应碳平衡、产物选择性如式(1)~式(3)。
甲苯转化率

式中,Conv.、Carbon.、Selec.分别为甲苯转化率、反应碳平衡、目标产物选择性;ntol和ntol,r分别为初始加入甲苯和反应结束后剩余的甲苯物质的量;∑ni+∑nj为反应后收到的总化合物的物质的量,其中ni、nj分别为反应后反应物甲苯的物质的量及目标产物(2-MNT、4-MNT、2,6-DNT和2,4-DNT)和生成其他产物的物质的量。其他产物(如3-MNT,3,4-DNT)生成痕量,总选择性占比低于2%,因此下文中不再特意提及。
1.4 反应量热实验
甲苯二硝化反应,采用半间歇操作;量热反应选用梅特勒·托利多公司的反应量热仪(Reaction Calorimeter,RC1e,型号为RC1eTM),操作系统由高精密自动控温装置,装有RC1e专用软件Win-RC的PC终端、1.8L常压玻璃反应釜、温度传感器、校准加热器、搅拌装置等组成,通过自动加料控制器进行自动加料,选用等温模式。具体操作步骤为:开启PC终端,在Win-RC软件中设计反应程序。将CuMnCoO4尖晶石催化剂(162g,1.65mol)、95%HNO3(1125g,17.85mol)在 室 温 下 加 入1.8L 的常压反应釜中,开启搅拌浆,搅拌速率设置为300r/min,均匀搅拌1h。接着以2.5g/min匀速滴加甲苯(411.2g,4.46mol)。滴加完毕后,在50℃的反应温度下保温反应6h。为了防止反应在回流过程中挥发损失,搭建回流冷凝装置,使用水作为冷却剂。
对于等温半间歇常压的合成反应,绝热温升(ΔTad)、冷却失效时可能达到的温度(Tcf)和热失控条件下工艺合成反应可达到的最高温度MTSR的计算如式(4)、式(5)(以1125g 95% HNO3,411.2g甲苯。室温滴加完毕后,在50℃的反应温度下保温反应6h进行示例计算)。
式中,ΔTad为绝热温升,K;Qr为反应总放热量,kJ;cp为混合物料比热容,kJ/(kg·K);mtotal为反应后混合物料的总质量,kg;Tcf为冷却失效时可能达到的温度,℃;Tp为反应工艺温度,K;mtol为反应滴加的甲苯的总质量,kg;mtol,t为反应t时刻下累计滴加甲苯的质量,kg;qr(t)为t时刻反应的瞬时放热量,kJ。
2 结果与讨论
2.1 催化剂表征分析
2.1.1 X射线衍射(XRD)表征分析
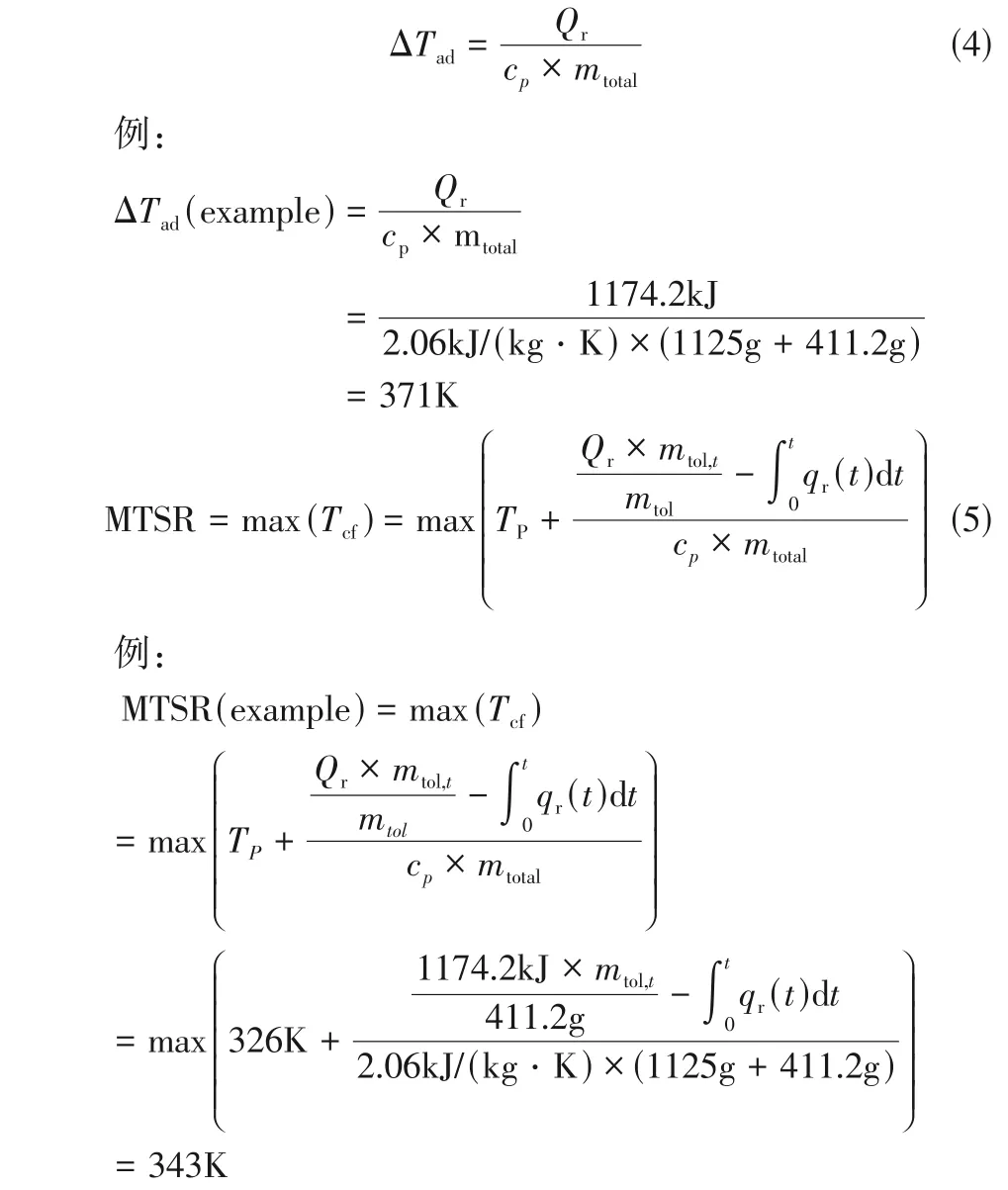
通过冷冻辅助-溶胶凝胶法制备的CuMnCoO4尖晶石催化剂的XRD 谱图如图1(a) 所示。CuMnCoO4特征衍射峰出现在18.8°、30.9°、36.4°、38.1°、44.2°、54.8°、58.5°和64.2°,分别指向标准尖晶石CoCuMnOx结构(JCPDS PDF 47-0324)的(111)、(220)、(311)、(211)、(400)、(422)、(511)和(440)晶面。CuMnCoO4的衍射峰表现出和CuMn2O4(JCPDS PDF 34-1400)相似的Fd3m 立方结构,但主峰均向右偏移。表明Co2+/Co3+取代了CuMn2O4中的Cu2+/Mn2+位点,或者Mn3+取代了Co3+形 成 了CuMnCoO4尖 晶 石 结 构[14-15]。合 成 的CuMnCoO4具有丰富的Cu2+和Mn3+,有利于晶格氧的形成和氧迁移并具有良好的结晶度,有利于提高比表面积和催化动力学。
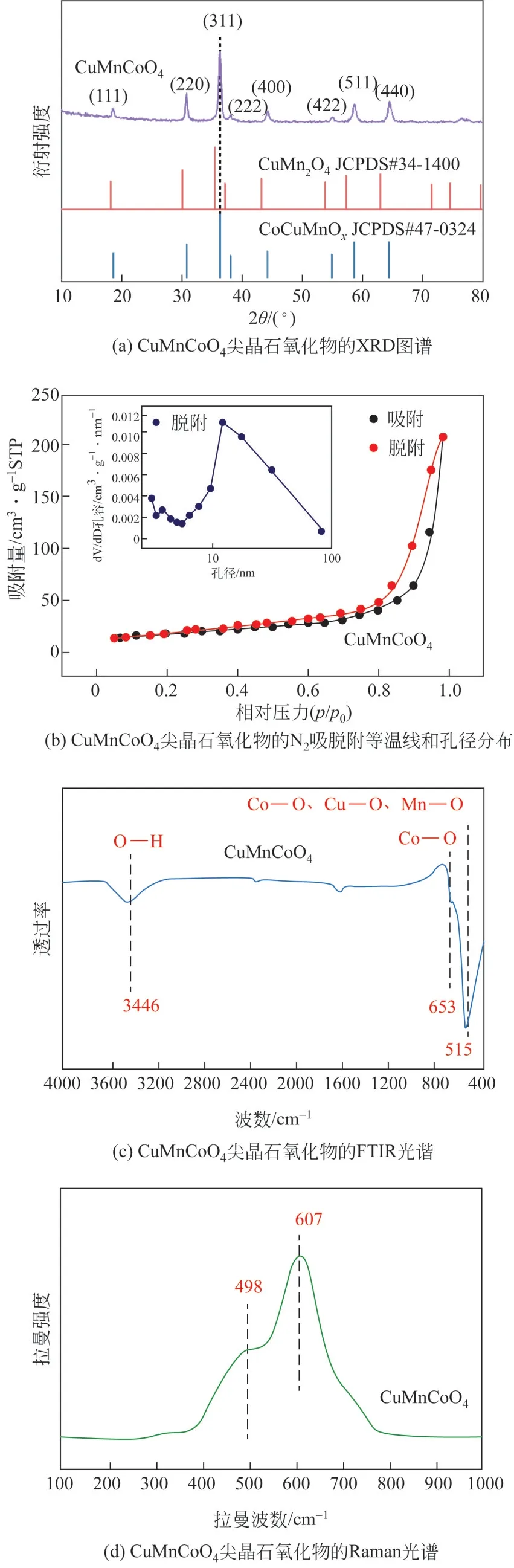
图1 CuMnCoO4尖晶石氧化物的表征
2.1.2 N2吸附-脱附分析和孔径分析
采用N2吸附-脱附等温曲线和孔径分布曲线,进一步分析了CuMnCoO4尖晶石催化剂的结构信息。如图1(b)所示,BET比表面积、孔容和平均孔径分别为62.43m2/g、0.32cm3/g 和12.13nm,明显高于传统固态法制备的Mn基尖晶石催化剂[16]。如图1所示,发现表现出典型的LangmuirⅣ型等温线,H3 型回滞环,孔径分布结果存在介孔[17]。这可能是胶体颗粒之间的静电作用阻碍了晶粒的生长,有利于介孔结构的生成[18]。
2.1.2 傅里叶红外光谱(FTIR)表征分析
CuMnCoO4尖晶石氧化物的FTIR 光谱如图1(c)所示。对于CuMnCoO4正尖晶石结构,较高的频率主要与聚合八面体晶格的振动有关,这种振动依赖于八面体中Mn3+、Co3+和氧之间的结合力。由于空气中H2O的存在,3446cm-1处的吸收带对应于羟基的振动。653cm-1出现较强的Co—O 吸收带,515cm-1处的吸收带归因于金属—氧键(Co—O、Cu—O、Mn—O金属键叠加)[19]。
2.1.3 拉曼光谱(Raman)表征分析为了获得更多的结构信息,对CuMnCoO4尖晶石氧化物进行了拉曼光谱测试,结果如图1(d)所示。拉曼位移与晶格振动模式有关,不同峰对应尖晶石的不同振动模式。607cm-1处的峰值对应于MO6 多面体中的Mn-O 键晶格振动,被称为A1g模式[20-21]。CuMnCoO4尖晶石氧化物在498cm-1存在拉曼振动峰,这可能是由于氧空位的存在[22],这不仅可促进催化过程中的氧迁移,还能削弱了Mn—O键强度,从而提高晶格氧的活性[23]。
2.1.3 X射线光电子能谱分析(XPS)表征分析
采用XPS 表征进一步确认CuMnCoO4三金属尖晶石表面组成。所制备的CuMnCoO4尖晶石催化剂中Cu 2p、Mn 2p、Co 2p 和O 1s 的XPS 光谱如图2所示。图2(a)的Cu 2p 谱带中,在933.7eV 和953.7eV 结合能附近的卫星峰归因于Cu2+的存在,在931.2eV 和950.9eV 结合能的对应于Cu+[24-25]。可以推断出,Cu+和Cu2+是催化剂表面的主要Cu 物种。图2(b)的Mn 2p3/2谱峰中分别在640.6(Mn2+)、642.0(Mn3+)和644.8eV(Mn4+)结合能进行了拟合[26-28]。结果显示,三种价态的比例为Mn2+∶Mn3+∶Mn4+=16.1∶62.5∶21.4。其中,Mn3+为Mn的主要价态,而Mn2+和Mn4+是依据电荷补偿机制而存在的[18]。Mn 基氧化物表面的Mn4+和Mn3+离子有利于提高金属离子附近的氧物种的化学势和催化能力[29]。图2(c)的Co 2p 光谱中两个自旋轨道Co 2p3/2和Co 2p1/2分别对应781.7eV 和795.5eV 结合能处的谱峰,表明Co2+和Co3+的存在[30-31]。催化剂样品的O 1s 光谱如图2(d)所示,530.0eV 附近的谱峰值归属为晶格氧(Olatt.)、531.0eV 附近的谱峰归属为表面吸附氧(Oadsorb)。氧空位在氧分子的吸附和解离中起着重要作用,会产生高度活跃的亲电性O2,而氧空位浓度与其化学吸附氧含量相关[32-33]。根据图2(d)计算得出化学吸附氧Oadsorb含量比例约为62.9%,Oadsorb/Olatt.=1.69,可产生丰富的氧空位。
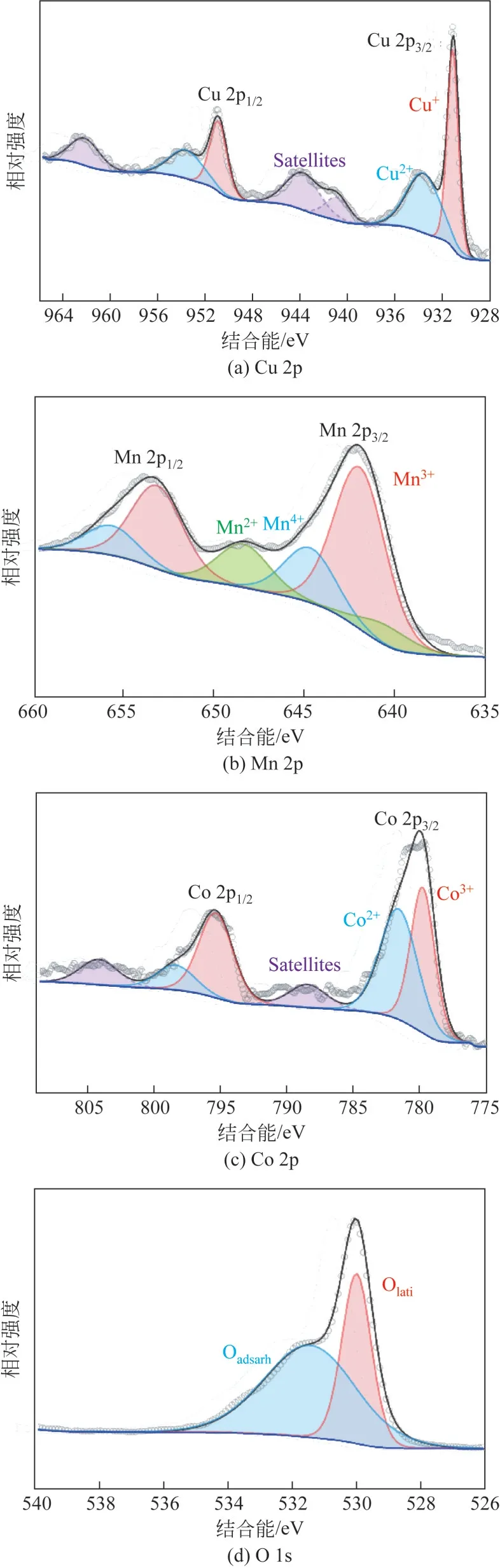
图2 CuMnCoO4尖晶石氧化物的XPS图
2.2 催化剂甲苯硝化性能评价
图3考察了不同反应条件对甲苯的硝化反应的活性及目标DNT选择性的影响。如图3(a)所示,在相同条件下使用质量分数分别为65%和95%的HNO3作为硝化剂,产物呈现极大的差异。无溶剂不加多相催化剂的条件下,65% HNO3在50℃下反应6h,甲苯仅转化76%。引入CuMnCoO4尖晶石氧化物作为催化剂,甲苯转化率提升至91%,此条件下该体系倾向生成MNT,碳平衡低,苯甲醛等氧化副产物多。这可能是由于低浓度的HNO3会导致硝酸分子的质子化,或反应温度较低不足以对甲苯对位进行二次硝化[11]。因此,尝试使用发烟硝酸(含90%~98%HNO3),本研究采用浓度适中的95% HNO3。结果显示,95% HNO3作为硝化剂有利于DNT的生成,DNT选择性达到31.4%;加入CuMnCoO4尖晶石催化剂后进一步提高DNT选择性至49.8%,此时DNT选择性是未加入催化剂时的1.6 倍。从上述结果中可见,95% HNO3和CuMnCoO4尖晶石催化剂可在甲苯二硝化制备DNT中起着相互协同促进的作用。
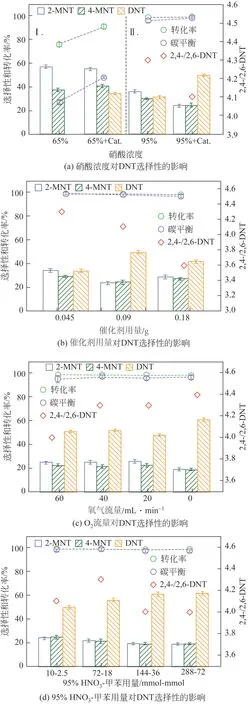
图3 不同反应条件对甲苯二硝化制备DNT的选择性的影响
当固定甲苯的加料量为2.5mmol、95% HNO3为10mmol 时,调整CuMnCoO4尖晶石催化剂用量对DNT 选择性的影响,如图3(b)所示。发现在0.09g催化剂的用量时(即95% HNO3、甲苯、CuMnCoO4尖晶石催化剂摩尔比为4∶1∶0.15),DNT 的选择性最高,可达到49.8%,2,4-/2,6-DNT=4.1。因此,最佳催化剂用量应遵循95% HNO3、甲苯、CuMnCoO4尖晶石催化剂摩尔比为4∶1∶0.15。
O2在NO2/O2体系中作为硝化活性剂,有促进甲苯单硝化的作用[34],并且通入O2可补充在反应过程中消耗的晶格氧。图3(c)研究了O2及其流量对DNT选择性的影响。在36mmol 甲苯加料量、144mmol 95%HNO3、1.28g CuMnCoO4尖晶石催化剂、室温滴加甲苯后升温至50℃条件下反应6h,DNT选择性为60.8%;在相同条件下,通入40mL/min O2,DNT选择性为56.9%;O2流速为20mL/min或60mL/min时,DNT 选择性在50%左右。可见,通入O2未促进CuMnCoO4尖晶石催化甲苯硝化制DNT选择性提高。
综上所述,在低甲苯用量的条件下,最佳硝化反应条件为:95% HNO3、甲苯、CuMnCoO4尖晶石催化剂摩尔比为4∶1∶0.15,室温下滴加甲苯,滴加完毕后在反应温度50℃下反应6h。
考虑到实验室与工业上的实验体系、底物用量等因素的区别,为了尽可能地模拟工业实际放热量,进一步扩大底物用量的实验,如图3(d)所示。结 果 发 现,保 持95% HNO3、甲 苯、CuMnCoO4尖晶石催化剂摩尔比为4∶1∶0.15 的条件下,随着甲苯用量由2.5mmol 扩大28.8 倍至72mmol,2-MNT 的选择性降至18.8%,4-MNT 的选择性降至18.7%,DNT 的选择性升至61.5%。可能是由于原料用量放大前后,搅拌由原来的磁子搅拌改为机械搅拌,95% HNO3与CuMnCoO4尖晶石催化剂得到了接触更充分,促使CuMnCoO4尖晶石中活性氧物种能够快速活化硝酸,从而有利于甲苯引入—NO2。
2.3 RC1e实验结果与分析
2.3.1 产物分布结果
为评估新型甲苯硝化体系的热危险性,使用RC1e 进行尖晶石催化甲苯硝化量热实验,见图4。根据上文中的实验结果,使用95% HNO3和甲苯,以CuMnCoO4为催化剂,反应过程中不添加有机溶剂。实验中甲苯二硝化反应采用等温半间歇硝化模式,根据文献[35-36]和实际实验的综合考量,选择在室温下将甲苯以2.5g/min 加料速度加入装有CuMnCoO4尖晶石催化剂和95% HNO3的玻璃常压反应釜中,反应釜转速选择300r/min,加料完毕后升温至50℃保温6h。反应结束后测得热危险性参数,并计算反应后的转化率、产物分布及选择性(表1)。由表1 可见引入CuMnCoO4尖晶石催化剂得到2-MNT 的选择性为15.38%,4-MNT 的选择性为15.89%,DNT 的选择性67.41%,2,4-/2,6-DNT 升至4.3;此时DNT 选择性为未加入催化剂(45.6%,表1序号1)时的1.5倍,与上文实验结果一致。
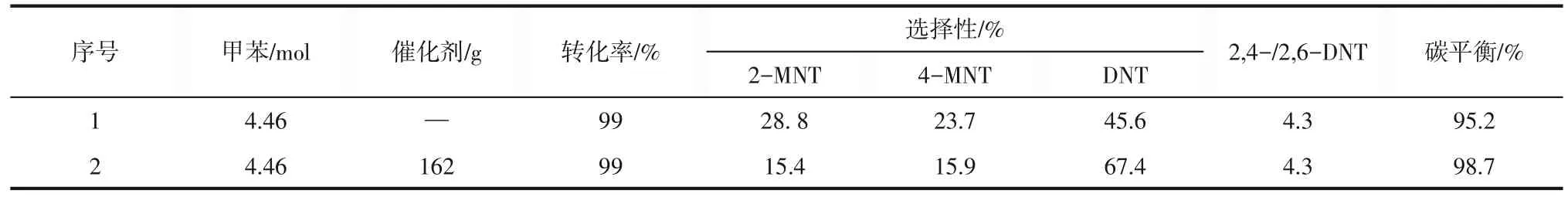
表1 反应量热仪(RC1e)等温半间歇条件下CuMnCoO4尖晶石催化剂对甲苯硝化产物分布的影响
图4 量热反应RC1e装置示意图
2.3.2 反应放热速率
甲苯硝化反应极大程度上属于界面反应,化学反应与传质现象同时发生,存在一定的受热不均衡现象,很容易导致局部过热,引发硝酸分解,这对反应产率及安全性都有显著影响[37]。在两种不同的反应条件下,根据RC1e 试验得到随时间变化的放热速率曲线和任意时刻冷却失效后体系所能达到的最高温度Tcf如图5和图6所示。
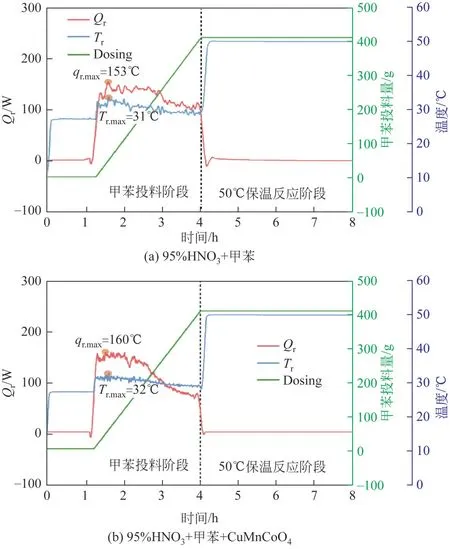
图5 甲苯二硝化反应的放热速率、甲苯投料和RC1e反应釜温度曲线

图6 不同条件下的Tcf和MTSR曲线
如图5(a)、(b)所示,两种条件下甲苯二硝化反应的放热速率曲线线型相似。首先在室温条件下将底物均匀搅拌混合1h,使得CuMnCoO4尖晶石作为催化剂与95% HNO3充分接触,有利于提高体系的二硝化性能。随后在室温环境下加料,甲苯接触95% HNO3当即快速发生反应,迅速放热。由于甲苯引入一个-NO2生成MNT 后苯环钝化减慢二硝化的速率,需要一定的时间让MNT深入95% HNO3再引入一个-NO2生成DNT,这一过程放热增加,对应了图5(a)、(b)中1.5h 左右处放热曲线的上升过程。随着加料和反应的并行,两组实验中95%HNO3被消耗并伴随着H2O 的产生,HNO3浓度降低,放热速率逐渐降低趋于平缓。图5(b)中CuMnCoO4尖晶石催化剂实验组中加料过半后放热曲线下降速率小于图5(a)未加入催化剂对照组,可能由于CuMnCoO4尖晶石催化剂表面的吸附氧和激活的晶格氧促进NO+2的释放,拉长了DNT 的可生成时间。甲苯硝化反应体系由酸相和有机相两相组成,加料结束后反应未完全结束,继续进行放热[38],但4h 后反应的升温提供了一定的热量,可能会与甲苯二硝化反应的放热重叠,隐藏部分源自硝化反应的放热。综合反应体系升温、停止加料和传质的因素,所以4h 后放热速率快速下降,最终停止放热,进行基本参数测试结束实验。CuMnCoO4尖晶石催化剂的加入略微提高了95%HNO3反应体系中的qr,max(153℃→160℃)和Tr,max(31℃→32℃)。
图5中放热集中在投料阶段,升温后仅产生轻微吸热峰,基本无明显放热,因此仅研究投料阶段的冷却失效时可能达到的温度Tcf(图6)。甲苯二硝化过程一开始仅在两相界面进行,随着MNT 的生成会在酸相中同步进行硝化反应。在整个反应过程中,Tcf曲线均呈现出先增大后减小的趋势,如图6所示。
2.4 反应过程危险性分析
硝化反应具有很高的潜在反应放热[39]。通过RC1e实验得到反应前后体系混合物的比热容(cp1、cp2)、反应前和反应后体系的综合传热系数(U1、U2),对所得放热速率曲线时间进行面积积分,获得反应热(Qr)和摩尔反应热(Qr,m),对反应热数据计算得到绝热温升(ΔTad)和热失控条件下工艺合成反应可达到的最高温度(MTSR),具体结果见表2。对于半间歇操作方式,MTSR 是假设反应体系发生冷却失效时立即停止加料的前提下获得的温度数据[30-41]。结合RC1e 测得的实验数据以及相关参数计算,得到各自的甲苯硝化反应的热危险性数据,见表2。
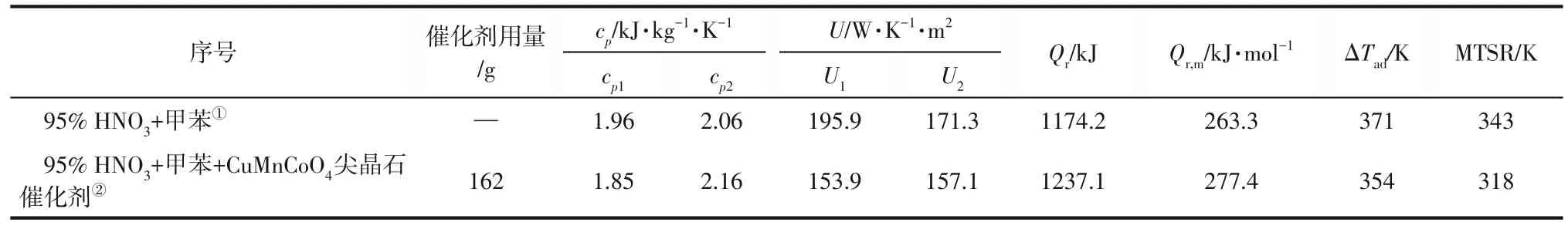
表2 投料阶段CuMnCoO4尖晶石催化剂对反应热危险性参数的影响
由表2可见,在投料阶段中,95% HNO3+甲苯总放热量为1174.2kJ,在CuMnCoO4尖晶石催化剂的催化作用下MNT 的选择性降低(52.5%→31.3%),DNT的选择性上升(45.6%→67.5%),与反应体系的总放热量Qr增加62.9kJ的表现一致。但由于反应后混合物料的总质量、混合物料比热容增加,绝热温升ΔTad由371K 降低至354K。热失控条件下工艺合成反应可达到的最高温度MTSR 由343K 降低至318K,可能是由于CuMnCoO4尖晶石催化剂延长了DNT的可合成时间。
依据工业生产条件进行的实验室DNT 生产工艺实验中,放热也基本集中在甲苯投料阶段。甲苯一段硝化制备MNT 实验在温度50℃、硝-硫混酸630g、甲苯100g 的条件下进行,得到ΔTad=143K,MTSR=73℃=346K;甲苯二段硝化制备DNT实验在温度70℃、硝-硫混酸720g、甲苯150g的条件下进行,得到ΔTad=139K,MTSR=84℃=357K[42]。使用95% HNO3作为硝化剂,CuMnCoO4尖晶石作为催化剂,在室温下投料,计算可得ΔTad=354K,MTSR=318K。已知95% HNO3沸点为356K,MNT 沸点为511K,DNT沸点为573K。CuMnCoO4尖晶石上新甲苯二硝化体系的最大MTSR远低于目标产物混合物的沸点。对比证明在新体系提高DNT 选择性的同时,也降低了热失控条件下工艺合成反应可达到的最高温度。
本质安全设计作为降低反应过程危险性的最有效方法,强调在源头上消除或控制危险源,而不是“附加的”安全防护措施或管理措施。在CuMnCoO4尖晶石上甲苯硝化制备DNT 的新工艺中,使用本质安全基本原则进行分析。①替代(substitution):使用95% HNO3作为硝化剂替代了传统DNT合成工艺中的硝-硫混酸,可减少DNT生产过程中废酸的排放,硝酸稀释后可浓缩能明显降低“三废”的治理费用。②缓和(moderation):在室温条件下甲苯加料,加料完毕后操作温度选择50℃,远低于传统工艺中DNT合成工艺中二段硝化的70~90℃的反应温度;使用95% HNO3、甲苯摩尔比为4∶1,而工业上往往采用的混酸甲苯摩尔比远大于6∶1。③简化(simplification):传统DNT 合成工艺使用两段硝化工艺,工艺复杂,使用CuMnCoO4尖晶石催化剂实现了甲苯一步硝化高选择性地制备DNT,工艺简单。综上所述,新工艺降低了传统DNT 合成工艺的危险性,实现了本质安全化设计,有着较好的工业化应用价值。
3 结论
采用冷冻辅助-溶胶凝胶法制备了CuMnCoO4尖晶石催化剂,研究了该催化剂上甲苯二硝化过程,考察了两种硝酸浓度、催化剂及其用量、O2用量等对DNT 选择性的影响,得出实验室计量时最优的工艺条件为:95% HNO3、甲苯、CuMnCoO4尖晶石催化剂摩尔比为4∶1∶0.15,室温下滴加甲苯,保持50℃下反应6h,甲苯转化率为99.9%,DNT选择性为49.8%,该DNT选择性是未加入催化剂时的1.6 倍。进一步放大加料量至甲苯72mmol,DNT 选择性可达到67.44%。可见,CuMnCoO4尖晶石催化剂可实现无硫酸和溶剂条件下的甲苯一步催化硝化高选择性制备DNT,具有良好的工业应用前景。
采用RC1e 反应量热仪对上述新型甲苯硝化反应体系进行量热实验测试,分析放热曲线可知反应放热集中在投料阶段,因此在该阶段应加强对温度的监控。对CuMnCoO4尖晶石催化硝化制备DNT 合成工艺硝化反应中投料阶段进行热危险性分析,获得热力学参数绝热温升ΔTad为316K,冷却失效后反应能达到的最高温度MTSR 为318K。综上所述,与传统的DNT 生产工艺相比,本文构建的基于CuMnCoO4尖晶石催化剂的甲苯一步催化硝化制备二硝基甲苯反应过程,实现了本质安全“替代、缓和、简化”三条基本原则,即不添加溶剂实现甲苯的高效转化和高选择性一步制备DNT,从而增强反应安全性,在源头上实现DNT 生产制备工艺的本质安全化。同时,展示了铜锰尖晶石催化香族化合物的无硫酸一步硝化的可行性,为多相催化的硝化反应的绿色环保提供了一个崭新的应用前景。

