足球菌协同发酵对低盐固态酱油风味与品质的影响
王涛,胡光耀,方芳*
1(工业生物技术教育部重点实验室(江南大学),江苏 无锡,214122)2(江南大学 未来食品科学中心,江苏 无锡,214122)3(食品合成生物技术教育部工程研究中心(江南大学),江苏 无锡,214122)4(江苏省食品合成生物技术工程研究中心(江南大学),江苏 无锡,214122)
酱油是由大豆、小麦等原料通过米曲霉、酵母菌和细菌等微生物发酵而成,具有独特风味和鲜美滋味的一种调味品。目前酱油的生产方法主要有高盐稀态发酵法和低盐固态发酵法2种。低盐固态法发酵的酱油具有上色效果好和酱香突出的优点,但鲜味和风味较高盐稀态法酿造的酱油存在差距[1-2]。
生产低盐固态酱油的发酵温度较高(45~55 ℃),发酵周期(20~30 d)较短。因此,低盐固态酱油在颜色、品质和风味方面存在颜色容易发黑、氨基酸态氮含量相对较低、风味物质含量较低等有待改善的问题。前期研究通过优化原料组成和发酵工艺在改善低盐固态酱油风味方面取得一定效果。例如选用小麦麸皮酶解进行发酵,酱油氨基酸态氮含量增加33.68%,4-乙基愈创木酚提高66.18%[3]。通过降低发酵温度等优化发酵工艺的方式减少了高温对酶活性和微生物生长代谢的不利影响,酱油氨基酸态氮含量提高了20%,醇类提高了10%[4]。酱油中风味物质的形成与米曲霉、酵母、乳酸菌等不同种类微生物之间相互作用存在一定关系[5-7]。通过发酵菌种的分离、选育、诱变等生物技术手段筛选出产酶能力强、抗逆性强、适用不同酱油酿造工艺的米曲霉,在一定程度上提高了原料利用率并改善了酱油风味[8]。真菌是酱油发酵过程中合成挥发性风味物质的重要微生物,不耐高温、具有良好抗逆性的细菌是改善低盐固态酱油品质的潜在功能微生物[9-11]。例如,芽孢杆菌和葡萄球菌可通过分泌蛋白酶和淀粉酶促进酱油发酵,也能代谢产生吡嗪类、酸类物质使酱油风味更加浓郁[12-13]。乳酸菌是参与发酵食品的常见微生物,它们被广泛用于改善发酵食品的滋味与香气[14-16]。足球菌(Pediococcus)是一类存在于酸奶、泡菜、酱油等发酵食品中的乳酸菌[17]。前期研究证实,将其用于制作香肠可降低硝酸盐含量,并提高乙酸异戊酯、己酸异戊酯、乙酸己酯等风味物质含量;在驴奶发酵时添加足球菌,可提高酸奶的颜色指标和感官品质,并使乙醛含量增加,提升酸奶香气[18-22]。食品发酵体系中存在的安全有益细菌是否也具有改善低盐固态酱油风味与品质的作用还有待证实。
本研究将从酱醅中分离筛选可耐受低盐固态发酵条件(较高温度和盐的胁迫)的功能细菌,通过考察添加功能细菌对低盐固态酱油理化指标和品质与风味特性的影响,揭示功能微生物用于低盐固态酱油发酵的可行性,为开展研究功能细菌协同发酵改善低盐固态酱油的品质与风味提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
本研究所用菌株如表1所示。

表1 本研究所用菌株
1.1.2 培养基
MRS(Man Rogosa Sharpe)培养基(g/L):尿素2,牛肉膏2.5,酵母膏2,柠檬酸三铵2,葡萄糖2,吐温80 1 mL,乙酸钠5,K2HPO42,MgSO40.2,MnSO40.05。
LB(Luria-Bertani)培养基(g/L):胰蛋白胨1.0,牛肉膏0.3,NaCl 0.5,pH 7.4。
1.2 仪器与设备
恒温恒湿培养箱,常州首创仪器设备公司;PCR仪,美国伯乐公司;恒温培养箱、恒温摇床,上海跃进医疗器械厂;UVmini-1280分光光度计、GC-2010AF气相色谱质谱联用仪,日本岛津公司;高效液相色谱仪,美国安捷伦公司。
1.3 实验方法
1.3.1 培养基
细菌分离筛选:取酱醅样品(25 g)加入225 mL无菌生理盐水,于37 ℃下220 r/min振荡1 h。取100 μL液体梯度稀释液涂布于含2 g/L山梨酸的MRS和LB固体培养基,37 ℃培养24 h。挑取单菌落划线分离纯化3次后用分离培养基培养至对数后期,然后保藏于-80 ℃。
细菌种属鉴定:采用上海生工生物公司细菌基因组提取试剂盒提取菌株的基因组DNA,并以此为模板用16S rRNA通用引物27 F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492 R(5′-GGTTACCTTGTTACGAC-TT-3′)进行PCR扩增。PCR产物送至天霖生物科技无锡有限公司测序,测序结果在NCBI进行BLAST比对,利用MEGA-X软件构建菌株系统发育树。
1.3.2 细菌耐受特性分析
耐温特性分析[17]:将菌株以2%的接种量接种至MRS液体培养基,45 ℃静置培养12 h或LB液体培养基45 ℃,220 r/min振荡培养12 h。取1 mL菌液测定600 nm处吸光值。
耐盐特性分析[17]:将菌株以2%的接种量接种至含8% NaCl的MRS液体培养基37 ℃静置培养12 h或LB液体培养基37 ℃,220 r/min振荡培养12 h。取1 mL菌液测定600 nm处吸光值。
1.3.3 低盐固态酱油发酵
将蒸熟的(121 ℃,30 min)豆粕与面粉混匀[m(豆粕)∶m(面粉)=5∶1],以原料总质量的1.5‰接种A.oryzae沪酿3.042;湿度95%、30 ℃培养48 h制得成曲。将成曲与140 g/L的盐水按1∶1质量比混合为酱醅,酱醅中盐的终质量浓度为70~80 g/L。将酱醅(200 g)装入250 mL烧杯中,轻压至厚度为6 cm,用无碘食盐覆盖(厚度为3 cm)。起始发酵温度为40 ℃,以1 ℃/d升温至42 ℃,第3天升温至45 ℃后发酵25 d。协同发酵是在发酵第0天接入P.acidilacticiWT1(终浓为108CFU/g)。在发酵第0、1、2、3、4、9、14、25天取样置于-80 ℃保存。
1.3.4 酱醅微生物数量分析
取酱醅样品(25 g)加入225 mL无菌生理盐水,于37 ℃、220 r/min,振荡1 h。取100 μL梯度稀释液涂布于含2 g/L山梨酸的MRS和LB固体培养,37 ℃培养24 h后进行活菌计数[20]。Pediococcus数量分析采用菌落PCR计数的方法:挑取平板上的菌落至PCR管中,利用Pediococcus特异性引物[17]Pa-F(5′-CGAACTTCCGTTAATTGATTAT-3′)和 Pa-R(5′-ACCTTGCGGTCGTACTCC-3′)扩增。PCR体系为:DNA模板0.5 μL(50 ng/μL),Taq酶10 μL,上下游引物各0.5 μL(10 μmol/L),ddH2O 8.5 μL;扩增条件:94 ℃ 3 min,94 ℃ 30 s,58 ℃ 30 s,72 ℃ 1 min,12 ℃ 10 min。产物进行凝胶电泳分析有目的条带的即为Pediococcus。
1.3.5 酱醅理化指标分析
取5 g酱醅,加入45 mL无菌水超声振荡30 min,于6 000 r/min离心5 min取上清液进行理化分析。总酸和氨基酸态氮的测定采用滴定法,具体方法参考文献[4]。
1.3.6 酱油颜色和风味物质含量分析
样品处理:除去酱醅上层盐封,加入与酱醅相同质量的100 ℃水,45 ℃恒温浸泡12 h,6 000 r/min、30 min离心,取上清液按1∶1的体积比添加50 g/L的三氯乙酸,常温避光处理30 min,用0.22 μm水系滤膜过滤,取滤液用于检测。
颜色指数测定:取稀释100倍的样品1 mL分别测定460、510、610 nm处吸光值,色率、红色指数和黄色指数计算如公式(1)~公式(3)所示[24]:
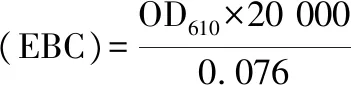
(1)

(2)
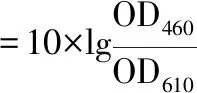
(3)
有机酸含量测定采用高效液相色谱法[12]。液相系统:岛津20A,色谱柱:Aminex-HPX-87H (300 mm×7.8 mm,9 μm);流动相5 mmoL/L稀H2SO4,进样体积10 μL,洗脱速度0.5 mL/min,洗脱时间30 min柱温40 ℃,检测器UV 210 nm。
游离氨基酸测定采用高效液相色谱法[17]。样品采用邻二甲苯(o-xylene,OPA)进行柱前衍生。液相系统:安捷伦1260,色谱柱ODS HYPERSIL(250 mm×4.6 mm,2.5 μm);流动相A相:无水乙酸钠5 g,四氢呋喃5 mL,三乙胺200 μL,pH 7.2;流动相B相:无水乙酸钠5 g,超纯水200 mL,甲醇400 mL,乙腈400 mL,pH 7.2。进样体积10 μL;洗脱速度1 mL/min;洗脱时间40 min;柱温40 ℃;检测器UV338 nm。
挥发性风味物质采用固相微萃取气质联用技术(solid phase microextraction-gas chromatography- mass spectrometry,SPME-GC-MS)进行测定[4]。取5 mL酱油样品,添加2-辛醇(终质量浓度为100 μg/L)作为内标。萃取条件:酱油样品(5 mL),50 ℃水浴30 min后,将萃取头深入液面1 cm,吸附30 min,插入气相色谱进样口,240 ℃解吸15 min。气相色谱条件:进样口250 ℃,色谱柱TG-WAMS(60 m×250 μm×0.25 μm),载气高纯He,不分流进样;梯度升温程序为:45 ℃保持1 min,以每分钟3 ℃升至130 ℃,以每分钟6 ℃升至200 ℃,再以每分钟8 ℃升至230 ℃恒温10 min。质谱条件:电离源(EI),离子源温度220 ℃,界面温度250 ℃,离子源能量70 eV,电子扫描范围为全扫描,通过NIST标准谱库根据保留指数(retention index,RI)和相似指数(similarity index,SI)大于800对风味物质进行检索鉴定,以内标2-辛醇的峰面积对化合物进行半定量分析。
1.3.7 感官评价
将10 mL发酵25 d的酱油置于25 mL品评杯中,由15名科研人员组成的评价小组对酱油色泽、香气、滋味、状态、总体接受程度进行评价。具体评价标准如表2所示。
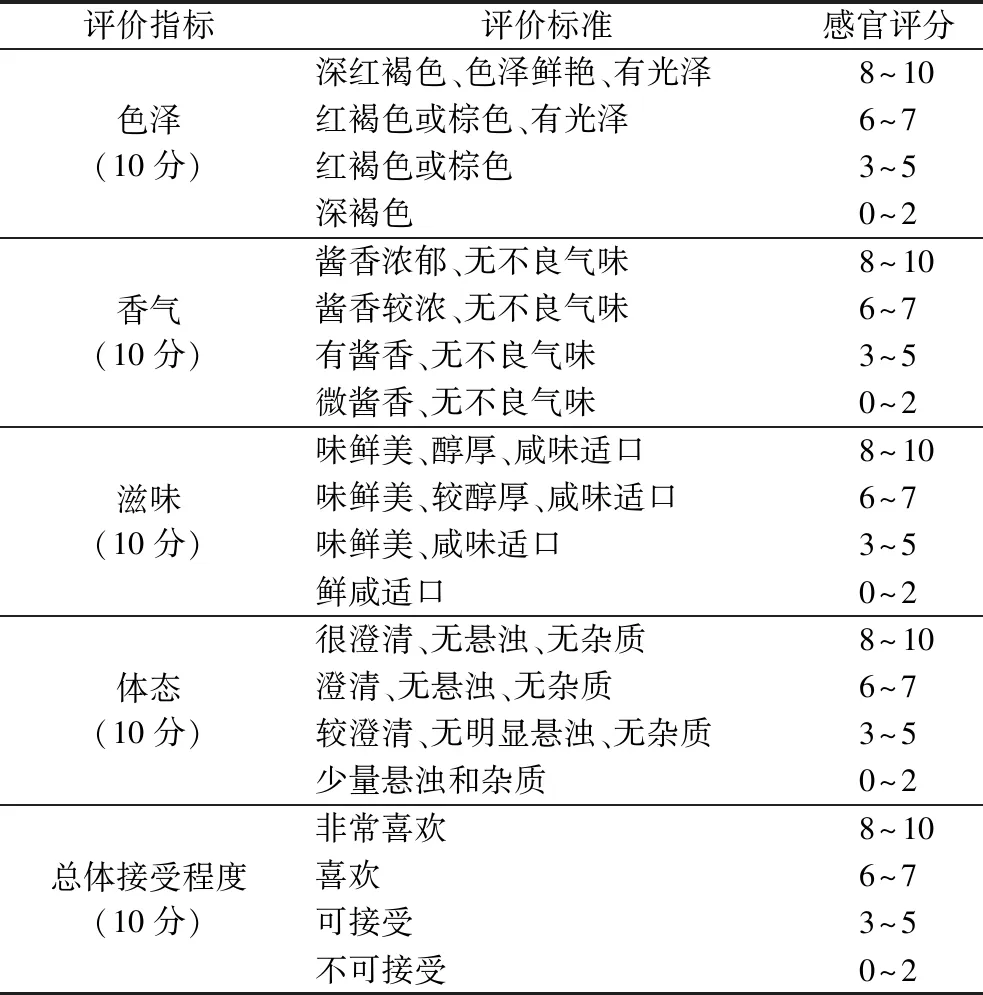
表2 酱油感官评价标准[22]
1.3.8 统计学方法
采用SPSS 19.0、Excel、Origin 8.0软件进行数据分析及可视化,数据以平均值±标准偏差表示,以P<0.05表示数据之间的显著性差异,所有数据平行测定3次。
2 结果与分析
2.1 酱醅中细菌的分离与耐受能力比较
2.1.1 酱醅中细菌的分离与鉴定
从发酵酱醅中共分离得到6个属(Bacillus、Pediococcus、Weissella、Staphylococcus、Enterococcus和Enterobacter)的18株细菌(图1),包括Bacillusvelezensis、Bacilluspumilus、Bacillussubtilis、Bacillushalotolerans、Bacillusamyloliquefaciens5株芽孢杆菌;属于Pediococcusacidilactici、Pediococcuspentosaceus、Weissellaparamesenteroides、Enterococcusdurans、Enterococcusfaecium5个种的9株乳酸菌;2株葡萄球菌StaphylococcussaprophyticusFSPT1和StaphylococcusepidermidrsBPT1;2株肠杆菌EnterobacterhormaecheiHS1和EnterobacterludwigiiLDWX1。
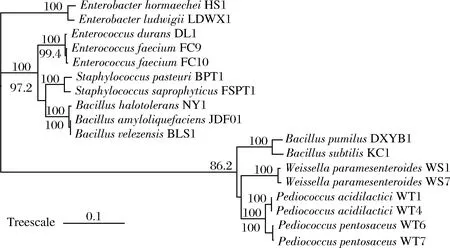
图1 基于16S rRNA 序列构建的菌株的系统发育树
2.1.2 酱醅细菌的耐温和耐盐能力比较
由于低盐固态酱油发酵温度较高,可在45 ℃和8%NaCl条件下生长良好的菌株更具有用于低盐固态酱油发酵的潜力。因此,在应用菌株进行酱油发酵前考察了这些菌株在较高温度和有盐培养条件下的生长情况,结果如图2所示。
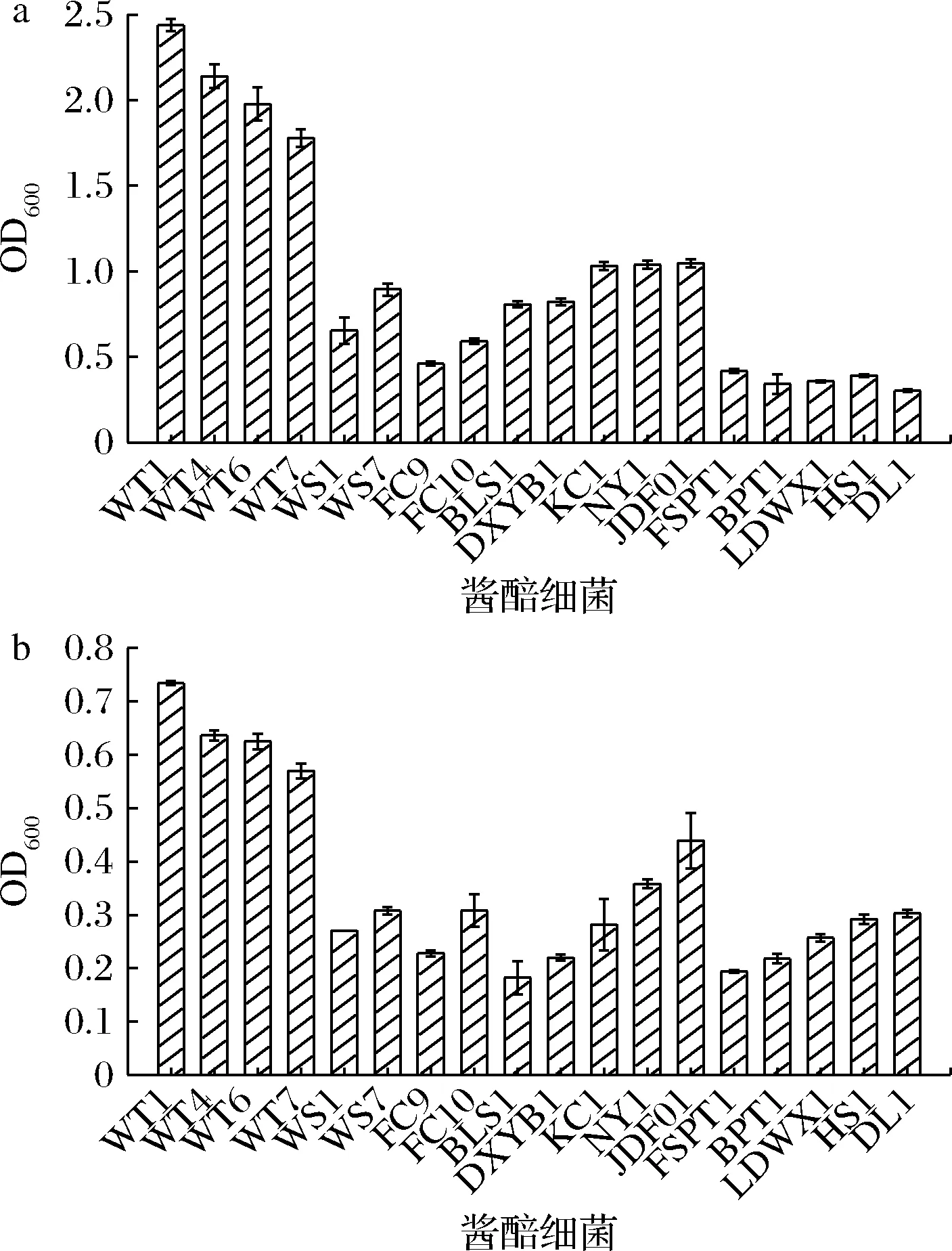
a-45 ℃;b-8% NaCl
Pediococcus在45 ℃下的生长优于Weissella、Enterobacter、Enterococcus、Staphylococcus和Bacillus菌属的菌株。其中P.acidilacticiWT1在45 ℃下生长最好,OD600达到2.44。培养基中添加8% NaCl对菌株的影响与45 ℃培养条件下的情况类似,Pediococcus的生长优于Weissella、Enterobacter、Enterococcus、Staphylococcus和Bacillus。其中P.acidilacticiWT1生长最好,OD600达到0.73。以上结果表明,P.acidilacticiWT1是所考察菌株中可在45 ℃、8% NaCl下生长最好的菌株,具有可参与低盐固态酱油发酵的应用潜力。因此,本研究后续考察P.acidilacticiWT1协同发酵对低盐固态酱油理化和品质的影响。
2.2 Pediococcus协同发酵对低盐固态酱醅细菌数量的影响
为确定在发酵起始添加菌株是否可起到在低盐固态酱油发酵过程强化Pediococcus的作用,本试验研究了发酵过程酱醅中细菌总数和Pediococcus数量的变化。结果如图3所示。
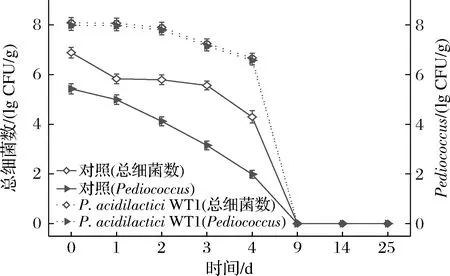
图3 发酵过程中细菌总数和足球菌数量的变化
未添加菌株的对照从发酵起始,总细菌数和Pediococcus的数量逐渐下降,细菌总数和Pediococcus数量分别在发酵第4天和第2天降至104CFU/g,到发酵中后期酱醅中已检测不到活的细菌。添加P.acidilacticiWT1进行发酵的酱醅中,细菌总数和Pediococcus的数量到第9天时酱醅中总细菌数和Pediococcus不可计;在发酵第4天,P.acidilacticiWT1中的总细菌数为4.8×106CFU/g高于对照组2.38个数量级,Pediococcus的数量为4.5×106CFU/g高于对照组4.59个数量级。表明添加P.acidilacticiWT1能够起到在低盐固态发酵中强化该菌的作用。本研究通过强化P.acidilacticiWT1使得酱醅中细菌数量显著高于对照,这可能与实际低盐固态酱油发酵过程酱醅中微生物组成和数量存在一定差异。今后可在考察强化P.acidilacticiWT1对酱醅菌群影响的基础上,深入揭示强化此菌对低盐固态酱油发酵的影响。
2.3 P.acidilactici WT1 协同发酵对低盐固态酱油理化特性的影响
2.3.1P.acidilacticiWT1协同发酵对酱油理化指标的影响
为了探究P.acidilacticiWT1对酱油品质的影响,试验研究了该菌株对酱油理化特性的相关指标。由图4可知,P.acidilacticiWT1协同发酵有利于酱油中氨基酸态氮含量的增加,发酵终点时达到1.74 g/100 g,比对照组高9.43%,酱醪体系中包括嗜盐四联球菌和魏斯氏菌等很多乳酸菌都具有寡肽酶活性。本研究通过Pediococcus协同发酵提高了酱油中氨基酸态氮含量,这可能与其具有蛋白酶活性有关[16]。添加P.acidilacticiWT1对酱油总酸的影响不显著。
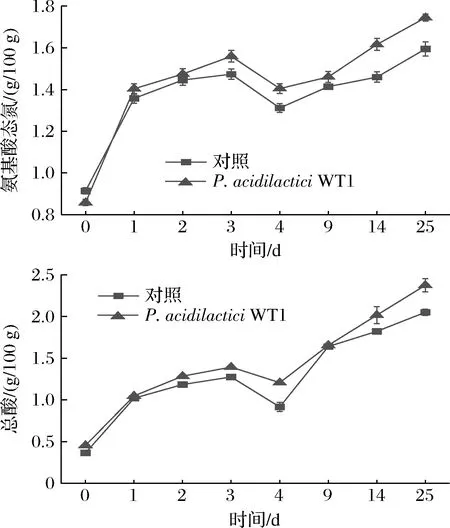
图4 酱油发酵过程理化指标的变化
2.3.2P.acidilacticiWT1协同发酵对酱油中有机酸含量的影响
有机酸是酱油中的重要物质组成,其中非挥发性有机酸对酱油的风味有重要贡献。例如琥珀酸及其钠盐能调节咸味同时具有加乘鲜味的作用[19],酒石酸是低盐固态酱油中重要的呈味有机酸,可以提高酱油的醇厚感[23]。本研究发现P.acidilacticiWT1协同发酵的酱油中柠檬酸、酒石酸、苹果酸、琥珀酸等有机酸含量均有显著增加,有机酸总量为30.04 g/L,比对照高48.56%(图5)。利用P.acidilacticiWT1协同发酵,酱油中琥珀酸含量增加71.87%,酒石酸增加4.38倍。这些有机酸的合成与积累一方面与乳酸菌代谢有关,例如Pediococcus可通过糖酵解(Embden-Meyerhof-Parnas,EMP)途径积累柠檬酸、琥珀酸和苹果酸,其中间代谢产物丙酮酸也可被还原生成乳酸或乙酸。另一方面,Pediococcus也可通过生长和代谢影响体系中其他微生物的代谢,合成或积累相关有机酸[16]。
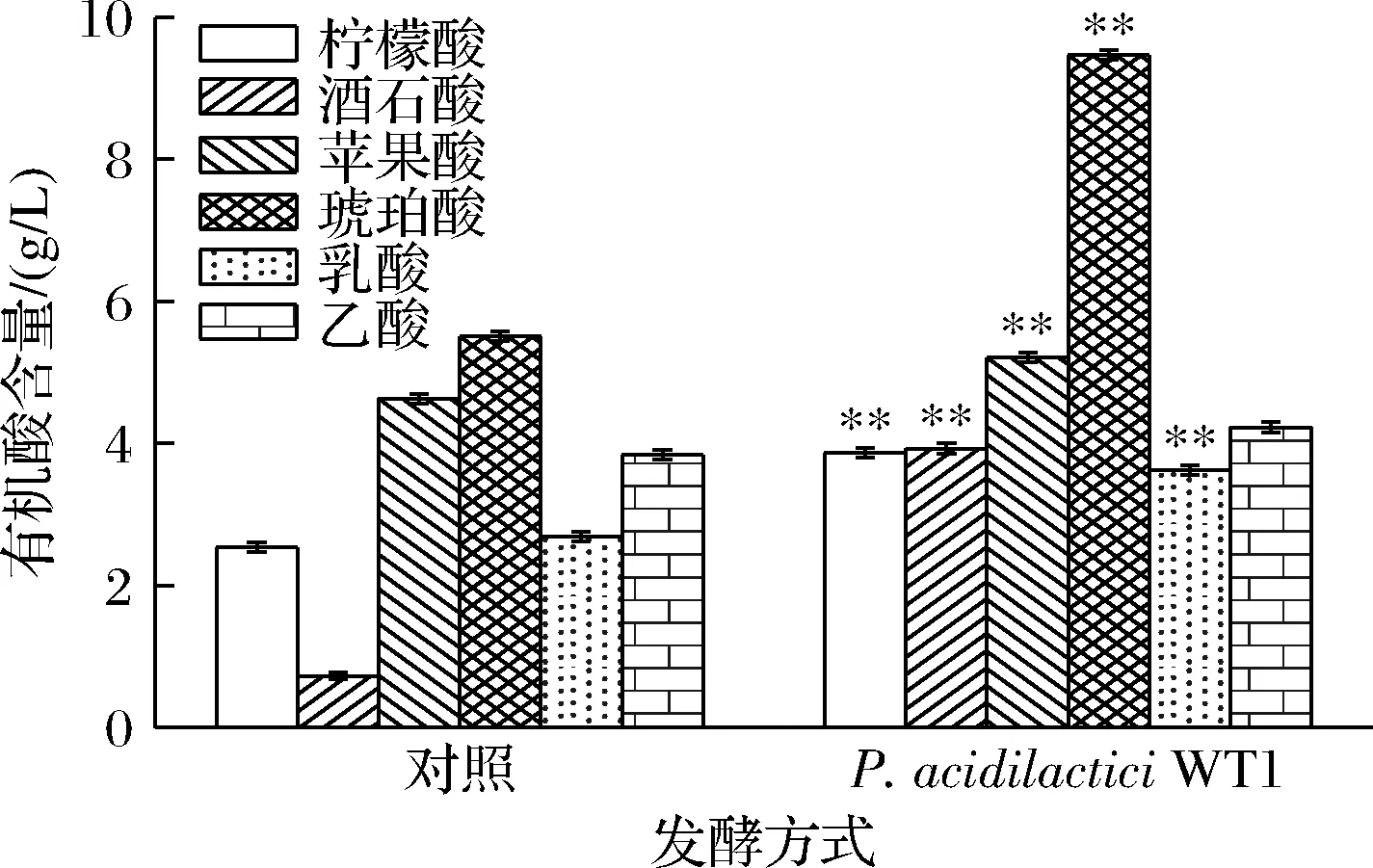
图5 酱油中有机酸含量的比较
2.3.3P.acidilacticiWT1协同发酵对酱油中色泽的影响
上色效果是低盐固态法生产酱油的重要感官特性指标之一[4]。酱油上色效果主要通过色率表征酱油颜色的深浅,以及用红色指数和黄色指数表征主要颜色的呈色情况[24]。如图6所示,通过P.acidilacticiWT1协同发酵可使酱油颜色显著加深,并可使色率增加21.36%;红色指数和黄色指数绝对值分别提高0.36和0.32。这说明利用P.acidilacticiWT1协同发酵使低盐固态酱油的色泽更加红润、透亮,对提升酱油的上色效果有显著作用。这可能与发酵期间乳酸菌生长消耗了体系中的葡萄糖或戊糖,减少或减缓了美拉德反应,从而使酱油颜色趋于红亮[24]。
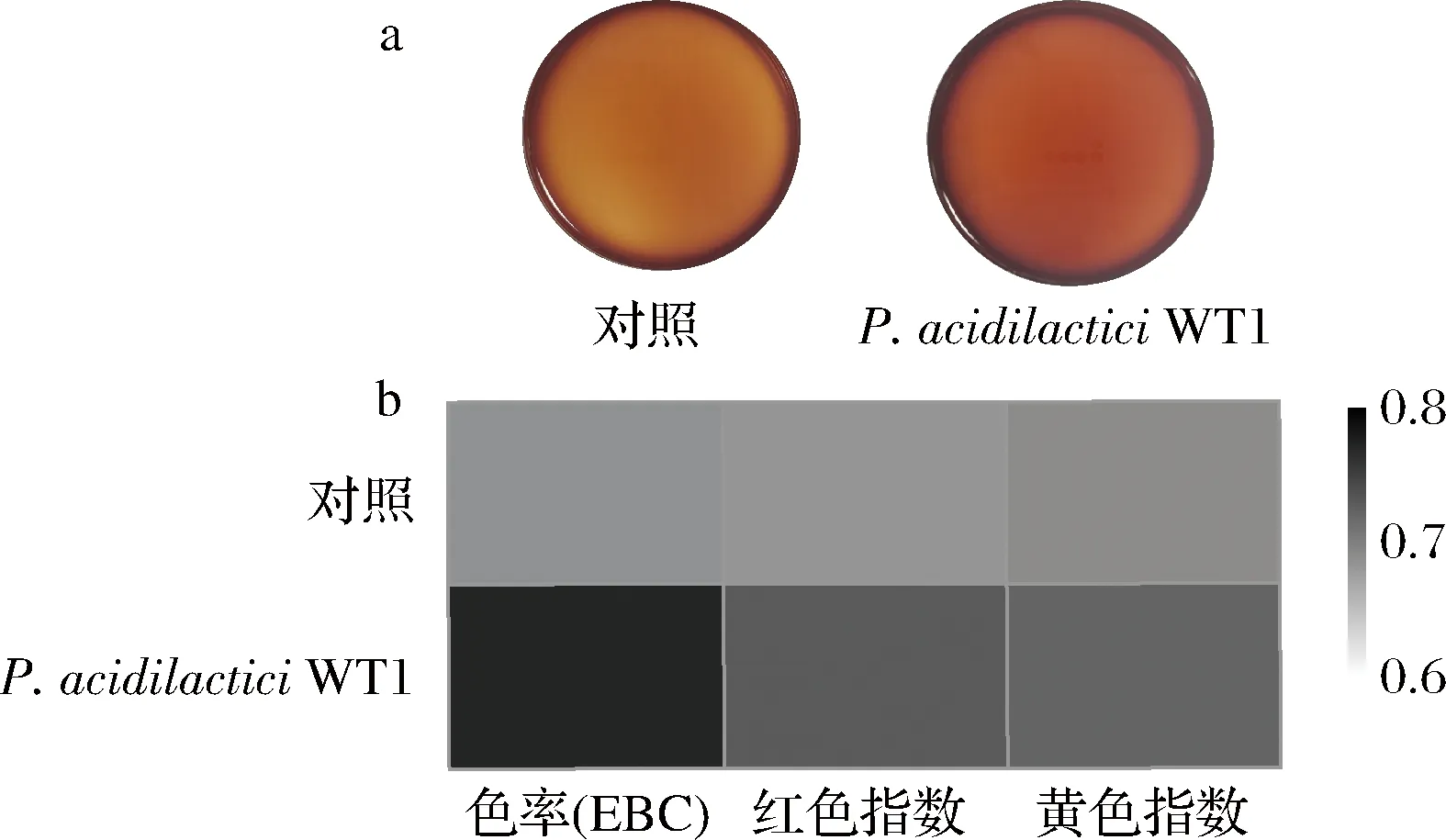
图6 酱油颜色指标的比较
2.4 P.acidilactici WT1协同发酵对酱油中游离氨基酸的影响
前期研究证实,Pediococcus可以合成用于水解原料生成氨基酸的氨肽酶和端肽酶[17]。如图7所示,P.acidilacticiWT1协同发酵的酱油中氨基酸总量为21.59 g/L,较对照提高了18.43%。天冬氨酸和谷氨酸是酱油主要呈鲜物质[17]。P.acidilacticiWT1协同发酵的酱油中这2种鲜味氨基酸总量较对照提高了35.16%,甜味氨基酸(丝氨酸和丙氨酸)提高了13.44%,苦味氨基酸比例降低了3.28%。P.acidilacticiWT1协同发酵能显著提高酱油中鲜味和甜味氨基酸含量,降低苦味氨基酸所占比例,从而有助于提高酱油的品质。
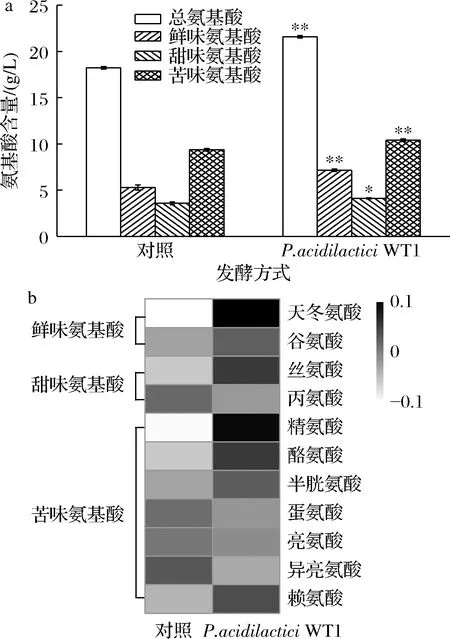
a-游离氨基酸总量;b-主要游离氨基酸含量比较
2.5 P.acidilactici WT1协同发酵对酱油挥发性风味物质的影响
酱油中的挥发性物质构成了酱油的主体风味,它的种类和含量与酱油风味密切相关。如图8-a所示,共检测到醇类、醛类、酮类、酯类、酚类和其他杂类共87种风味物质。添加P.acidilacticiWT1协同发酵酱油风味物质种类增加16种,挥发性风味物质总量为702.94 μg/L较对照组提高了19.95%;醇类、酮类和杂类分别提高了16.79%、17.52%和31.48%,而酯类和酚类则分别提高了90.53%和50.02%。然而总挥发性风味物质的含量提高并不能代表酱油的品质及风味的上升,我们对酱油中主要风味物质的变化进行了分析,如图8-b所示,P.acidilacticiWT1协同发酵酱油中苯乙醇和异戊醇是主要的醇类风味物质,较对照提高16.83%和21.86%。苯乙醇和异戊醇是酱油中呈花香的重要风味物质,对酱油香气有较大贡献,能增加酱油滋味口感。
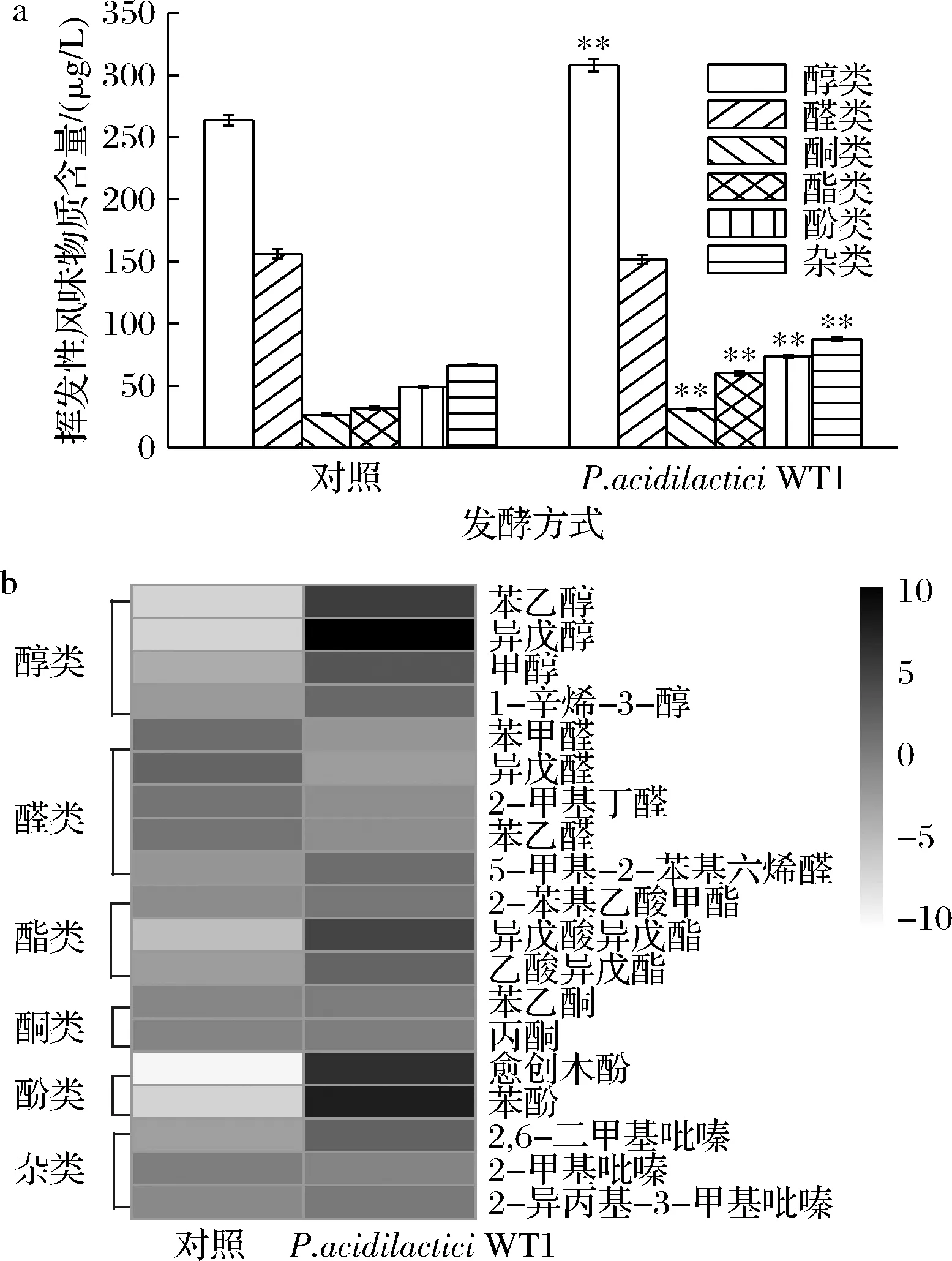
a-挥发性风味物质总量;b-主要挥发性风味物质比较
刘蕊[4]通过在低盐固态酱油中强化Lactobacillus和Zygosaccharomycesrouxii,酱油中苯乙醇、异戊醇和1-辛烯-3-醇等主要风味物质含量显著提升。P.acidilacticiWT1协同发酵酱油中主要酚类物质愈创木酚和苯酚,占总酚的89.13%,较对照提高了35.49%和50.64%;愈创木酚和苯酚是酱油烟熏香味的特征活性物质和主要贡献者[15-16],强化Tetragenococcushalophilus可以显著提高酱油的愈创木酚、4-乙基愈创木酚、异戊醇、1-辛烯-3-醇等酱油主要风味物质,进而提高酱油的风味及品质[12]。通过强化P.acidilacticiWT1能显著增加低盐固态酱油风味,特别是提高了酱油中主要挥发性风味物质。
2.6 酱油的感官分析
发酵结束时,酱油的感官雷达图如图9所示。P.acidilacticiWT1协同发酵酱油的体态无差别,滋味增加,色泽和香气显著提升,这表明通过添加P.acidilacticiWT1协同发酵使低盐固态酱油滋味更加醇厚,色泽更加鲜亮,酱香更加浓郁,显著提升了酱油品质,接受度提高。
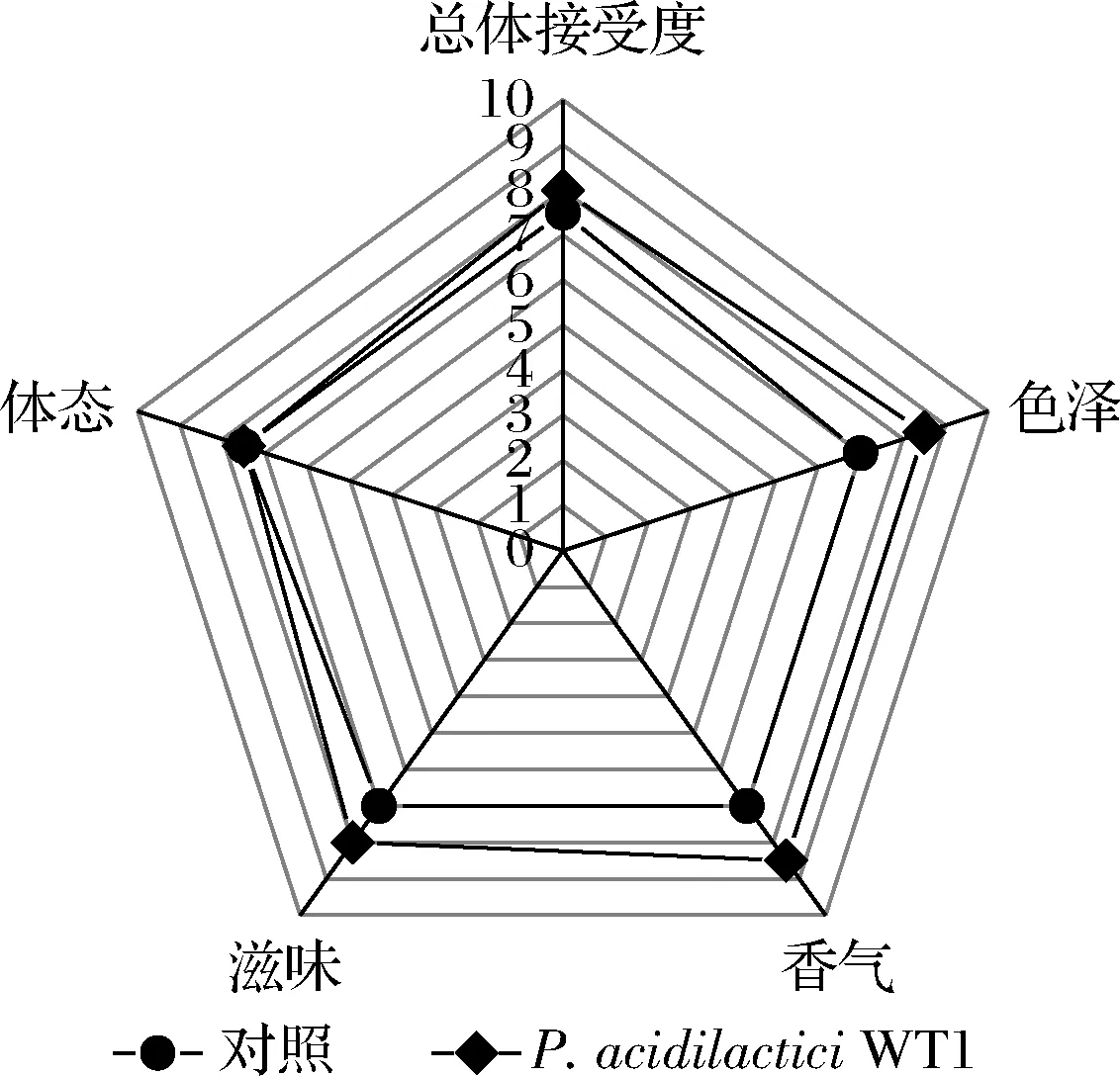
图9 酱油感官分析
3 结论
低盐固态酱油是一个多种微生物参与的混菌发酵体系,其中米曲霉、酵母菌和乳酸菌是最主要的参与者。在发酵前期,乳酸菌快速生长繁殖,代谢产生酸类物质,降低酱醅pH,抑制杂菌生长的同时还产生风味物质,是酱油发酵的重要微生物。本研究筛选到1株在45 ℃,8% NaCl培养条件下耐受性良好的乳酸菌P.acidilacticiWT1,添加P.acidilacticiWT1,发酵第4天时酱醅中的总细菌数和Pediococcus显著高于对照组2.38和4.59个数量级,表明添加P.acidilacticiWT可强化酱醅中的足球菌。采用P.acidilacticiWT1协同发酵,酱油中有机酸总量提高了48.56%,其中呈风味的琥珀酸增加了71.87%,酒石酸提高了5.43倍;鲜味氨基酸天冬氨酸含量提高了64.88%。P.acidilacticiWT1协同发酵,酱油的色率提高21.36%,红色指数和黄色指数提高6.87%和4.42%,酱油更加红润、鲜亮,提高了酱油的上色效果。发酵过程中产生的醇、醛、酮、酯、酚等挥发性风味物质总量增加19.95%;酱油风味的重要贡献者苯乙醇、异戊醇、愈创木酚和苯酚提高了16.83%、21.86%、35.49%和50.64%。本研究通过强化1株在低盐固态酱油中能够生长良好的Pediococcus,提高了酱油的品质及风味,为提高低盐酱油品质及风味提供重要参考意义。