褪黑素调节烟草丁香假单胞菌抗性的功能研究
蔡 楠,马文娜,肖 林,张佳蓉,2,宋中邦,陈 奇*
(1 昆明理工大学 生命科学与技术学院,昆明 650500;2 云南现代职业技术学院,云南楚雄 675000;3 云南省烟草农业科学研究院,昆明 650021)
植物生长会遭受多种病害的影响,严重危及作物产量和粮食安全[1]。植物在长期与病原菌抗争过程中,进化了复杂而高效的先天免疫系统来应答外部病原体的入侵。植物具有两层先天免疫系统[2],包括模式识别受体(pattern-recognition receptors,PRRs)介导的模式触发免疫(pattern-triggered immunity,PTI)和胞内核苷酸结合域富亮氨酸重复受体(nucleotide-binding domain leucine-rich repeat containing receptors,NLRs)介导的效应触发免疫(effector-triggered immunity,ETI)。植物先天免疫是通过细胞表面的PRRs感知病原体和微生物相关分子模式(pathogen-associated molecular pattern/metabolism-associated molecular patterns,PAMP/MAMPs)后启动[3-4]。丁香假单胞杆菌番茄致病变种(Pseudomonassyringaepv.tomatoDC3000,PstDC3000)是一种宿主广泛的革兰氏阴性菌,也是研究植物-微生物互作和植物先天免疫的模式菌。PstDC3000侵染和细菌鞭毛蛋白衍生多肽(flg22)处理下,植物通过调节气孔关闭以防御病原菌入侵和增强植物对病原菌抗性,这种主动防御现象称为气孔免疫或气孔防御[5-6]。由受体样蛋白(receptor like protein,RLP)和受体激酶(receptor like kinase,RLK)组成的细胞表面免疫受体负责感知微生物侵染,细胞内免疫受体NLR特异性感知传递到细胞内的免疫信号以激活胞内病原体效应蛋白,触发免疫信号激活下游免疫反应,如诱导气孔免疫和叶肉免疫以抵御病原菌入侵和抑制病原菌增殖。
褪黑素于1958年在牛松果体中发现[7],在脊椎动物中具有调节昼夜节律、睡眠和免疫等作用[8]。动物首个褪黑素受体(melatonin receptor 1,MT1)于1994年从非洲爪蟾中被克隆出来[9]。迄今为止,在哺乳动物中共报道了3种褪黑素受体,包括MT1(Mel1a)、MT2(Mel1b)和MT3(ML2)[10]。MT1和MT2属于G蛋白偶联受体(G protein coupled receptor,GPCR)超家族成员[11],对褪黑素具有高亲和力;而MT3对褪黑素的亲和力较低,属于醌还原酶家族[12]。
1995年,几个独立实验室在维管植物中检测到褪黑素[13-15],其主要由起始物色氨酸通过4个连续的酶促反应催化合成,分别是色氨酸脱羧酶(TDC)、色胺-5-羟化酶(T5H)、5-羟色胺-N-乙酰基转移酶(SNAT)和N-乙酰基-5-羟色胺-甲基转移酶(ASMT)等。色氨酸经色胺-5-羟化酶转化为5-羟色氨酸,5-羟色胺经过色氨酸脱羧酶作用后转变为血清素。5-羟色胺-N-乙酰基转移酶进一步将血清素催化生成乙酰血清素,最后由N-乙酰基-5-羟色胺-甲基转移酶将其合成为褪黑素[16-17]。与动物类似,植物褪黑素信号被一个潜在的具有7次跨膜结构的植物褪黑素受体1(phytomelatonin receptor 1,PMTR1)识别感知,通过激活G蛋白/NADPH氧化酶介导的ROS爆发或通过MAPK信号途径诱导气孔关闭和气孔免疫[18-19]。
有关研究表明,褪黑素在植物生长发育以及生物和非生物胁迫应答中起重要调节作用[20]。在拟南芥中过表达苜蓿SNAT1基因增强了转基因植物对镉胁迫的抗性[21],且大豆GmSNAT1和拟南芥AtSNAT1基因的上调表达参与植物对铝胁迫的抗性[22-23]。在葡萄中,异源过表达VvSNAT2基因,内源褪黑素含量上升,且转基因植物对白粉病抗性增强[24]。外源褪黑素处理能保护水稻免受稻瘟病菌引起的水稻细菌叶片条纹的影响[25],以及降低三七圆斑病、黑斑病等感病率[26]。拟南芥snat1突变体内源褪黑素含量较低,且对丁香假单胞菌PstDC3000的敏感性升高;棉花中GhSNAT1的沉默降低了对大丽花黄萎病的抗性,而外源性褪黑素处理可恢复对病原菌的抗性。Yang等[26]最近在三七和拟南芥中的研究发现,褪黑素通过受体PMTR1调控ROS爆发和MAPK信号途径诱导的气孔关闭是阻止病原菌入侵的主要方式,且免疫受体复合体FLS2(flagellin sensing 2)和BAK1[brassinosteroid insensitive 1(BRI1)associated kinase receptor 1]介导的flg22诱导气孔免疫也依赖于PMTR1。
为深入理解褪黑素在植物免疫反应中的功能,本研究以烟草为材料,构建了转基因烟草GmSNAT1-OE2和GmSNAT1-OE5,通过对PstDC3000处理后的病原菌含量测定、气孔敏感性分析等手段,探究内源和外源褪黑素调控植物抗病的机理,为植物褪黑素信号和功能提出新认识。
1 材料和方法
1.1 植物材料培养
研究供试材料为烟草(Nicotianatabacumcv.xathi),过表达GmSNAT1的转基因烟草由张佳蓉转化获得[27]。将野生型(WT)和T3代GmSNAT1过表达植物种子(GmSNAT1-OE2和GmSNAT1-OE5)用去离子水浸泡过夜后播种在基质中(蛭石∶珍珠岩∶营养土=3∶1∶1),置于光照培养箱在12 h光[100 μmol/(m2·s),28 ℃]/12 h黑暗(28 ℃)的条件下培养3~4周用于病原菌侵染、RT-PCR、气孔开度、保卫细胞ROS含量和叶片褪黑素含量等分析。
1.2 RNA提取和RT-qPCR分析
取0.1 g叶片于液氮中研磨,使用Trizol试剂(Takala)提取叶片总RNA,使用PrimeScriptTMRT reagent Kit with gDNA Eraser(Takara)反转录为cDNA,用SYBR Premix Ex TaqTMц试剂盒(Takara)和CFX96(BIO-RAD,美国)荧光定量PCR仪检测相关基因表达水平。用Primer5软件设计引物,RT-qPCR所用引物见表1。采用2-ΔΔCT方法计算相对基因表达水平[28]。
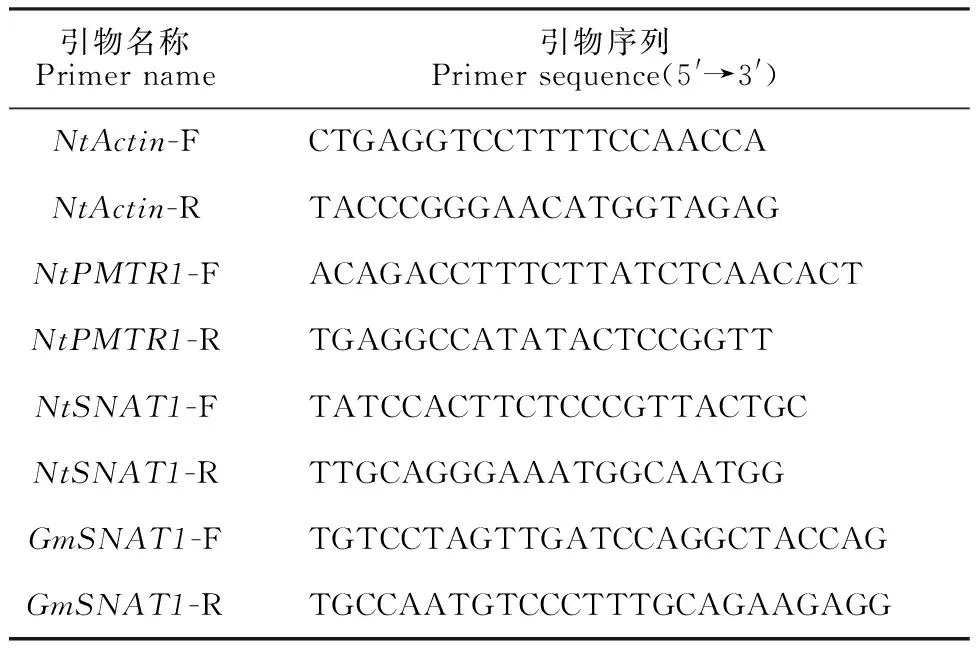
表1 RT-qPCR引物序列Table 1 Primers for RT-qPCR analysis
1.3 植物内源褪黑素含量测定
植物褪黑素的提取和含量检测参考Li等[29]的方法进行。取1月龄烟草叶片300 mg,液氮研磨后加入3 mL甲醇(75%),室温下1 500 r/min涡旋30 min,超声3次后(每次5 min)在13 000 g和4 ℃条件下离心15 min。取上清3 mL,使用氮吹仪(RayKol EVA Mini,睿科)干燥后加入200 μL 30%乙酸乙酯复溶,涡旋5 min(1 500 r/min),超声3 min后在13 000 g 和4 ℃条件下离心,取上清并加入3 ng/g的褪黑素-d4(sc-207849,SantaCruz Biotechnology),0.45 μm滤膜过滤后使用超高效液相色谱仪(Waters Acquity UPLC,Milford,MA,USA)和三重四极杆串联质谱仪(Waters,Xevo TQ-MS)检测内源褪黑素含量。
1.4 气孔开度检测
将1月龄烟草植株叶片撕下的表皮置于表皮缓冲液(50 mmol/L KCl,0.1 mmol/L CaCl2,10 mmol/L MES-KOH,pH=6.15)中,光照[100 μmol/(m2·s)]孵育3 h,使气孔完全打开,然后添加10 μmol/L褪黑素或5 μmol/L flg22(由北京中科亚光生物科技有限公司合成)处理2 h,在显微镜(Olympus BX60)下观察气孔开度,测量气孔的长度和宽度,并计算宽度/长度比以衡量气孔开度[18]。
1.5 激光共聚焦荧光显微镜分析
撕取1月龄烟草叶片下表皮条置于缓冲液(50 mmol/L KCl,0.1 mmol/L CaCl2,10 mmol/L MES-KOH,pH=6.15)中光照3 h[100 μmol/(m2·s)],然后加入10 μmol/L褪黑素或5 μmol/L flg22处理2 h,随后将表皮条转移到含有25 μmol/L的2′,7′-二氯二氢荧光素二乙酸(H2DCF-DA,一种ROS荧光探针,Sigma-Aldrich)的表皮缓冲中,在黑暗中孵育30 min。采用激光扫描共聚焦显微镜(NIKON TI-E-A1R)观察保卫细胞中H2DCF-DA荧光(波长设置:ex=488 nm,em=535 nm),使用ImageJ软件分析相对荧光强度。
1.6 Pst DC3000侵染实验
取-80 ℃保存的PstDC3000菌种在含有1.5%琼脂(W/V)和50 mg/mL利福平的King’s B(KB,20 g/L蛋白胨,10 mL/L甘油,1.5 g/L K2HPO4,1.5 g/L MgSO4·7H2O)固体培养基上划线培养后,挑取单菌落于含有50 mg/mL利福平的KB液体培养基中,28 ℃培养2 d。离心收集菌体,使用10 mmol/L的MgCl2溶液(含0.02%V/VSilwet L-77)稀释菌体至OD600=0.2备用。取生长3~4周长势一致的烟草,使用10 μmol/L褪黑素或1/10000(V/V)DMSO溶液(溶剂对照处理)喷施烟草叶片2 h后,使用PstDC3000(OD600=0.2)喷施植物叶片,直到叶片完全湿润。使用75%(V/V)乙醇表面消毒处理第0天(0 d)和第3天(3 d)叶片,用直径为0.7 cm的打孔器取样。打孔叶片使用10 mmol/L MgCl2研磨,梯度稀释后涂布于含50 mg/mL利福平的KB培养基上(1.5%W/V琼脂),28 ℃培养箱中培养2 d后统计菌落数。
1.7 数据分析
试验数据采用Excel-2015进行处理和分析,用GraphPad prism软件进行作图和显著性分析,不同字母表示P<0.05的显著性差异。
2 结果与分析
2.1 Pst DC3000侵染增加烟草褪黑素合成基因NtSNAT1和潜在受体NtPMTR1的表达
通过检测NtSNAT1和NtPMTR1基因表达衡量内源褪黑素信号对PstDC3000侵染的响应。与对照(-MT-Pst)相比,PstDC3000(+MT+Pst)处理2 h后NtSNAT1和NtPMTR1表达水平分别显著提高了84.6倍和28.2倍,然而处理8 h和24 h后却显著下降至对照水平(图1)。
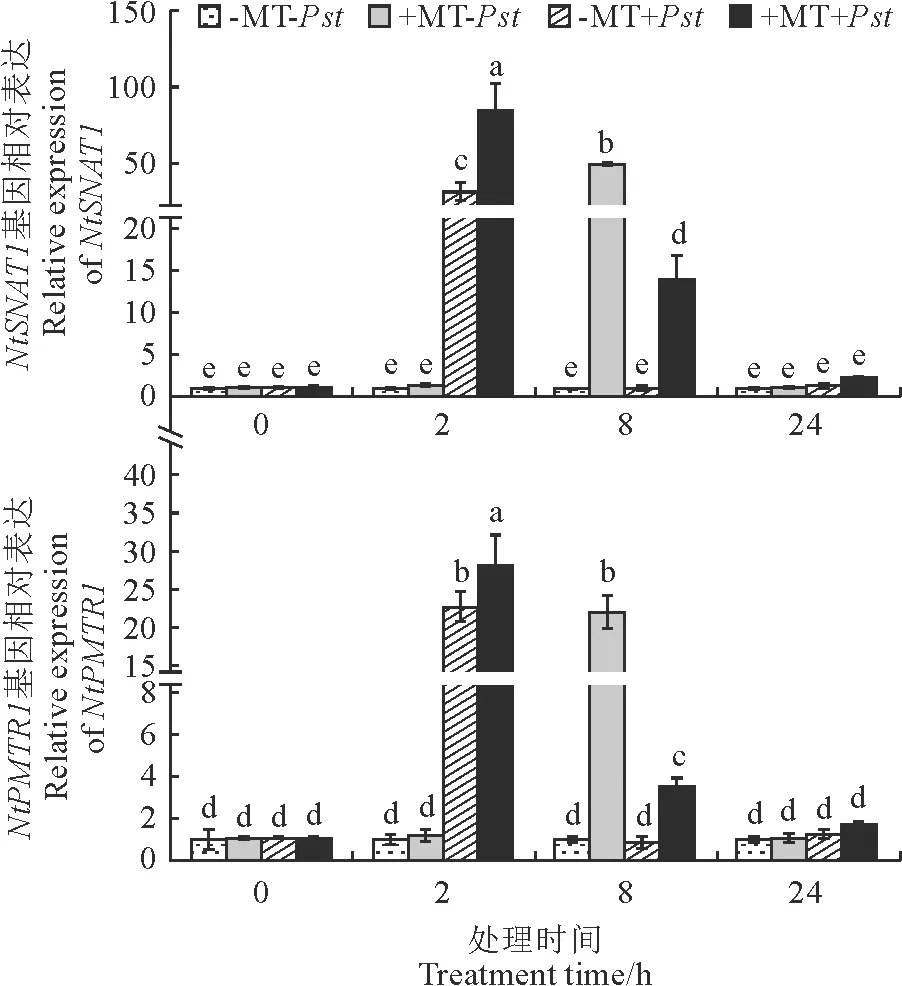
数据为平均值±SE(n=3),不同字母表示差异显著(P<0.05)。下同。图1 褪黑素和Pst DC3000对烟草叶片NtSNAT1和NtPMTR1基因表达的影响Data are presented as means ± SE (n = 3). Different letters indicate significant difference (P< 0.05). The same as below.Fig.1 Effects of melatonin and Pst DC3000 on the expression of NtSNAT1 and NtPMTR1 in tobacco leaves
褪黑素(+MT-Pst)处理8 h诱导了NtSNAT1和NtPMTR1表达,且进一步促进了PstDC3000(+MT+Pst)处理4 h和8 h对这两个基因表达的诱导(图1)。
由此可见,PstDC3000侵染能够快速诱导内源褪黑素信号。
2.2 外源褪黑素降低烟草叶片中Pst DC3000含量
为研究褪黑素在病原菌入侵中的功能,外源褪黑素预处理2 h后叶片喷施PstDC3000,分析叶片中病原菌菌落形成单位(colony forming units,CFU)以衡量叶片病原菌含量[30-34]。与对照组(-MT)相比,褪黑素(+MT)预处理后,烟草叶片上的病原菌菌落数显著降低了88%(图2)。
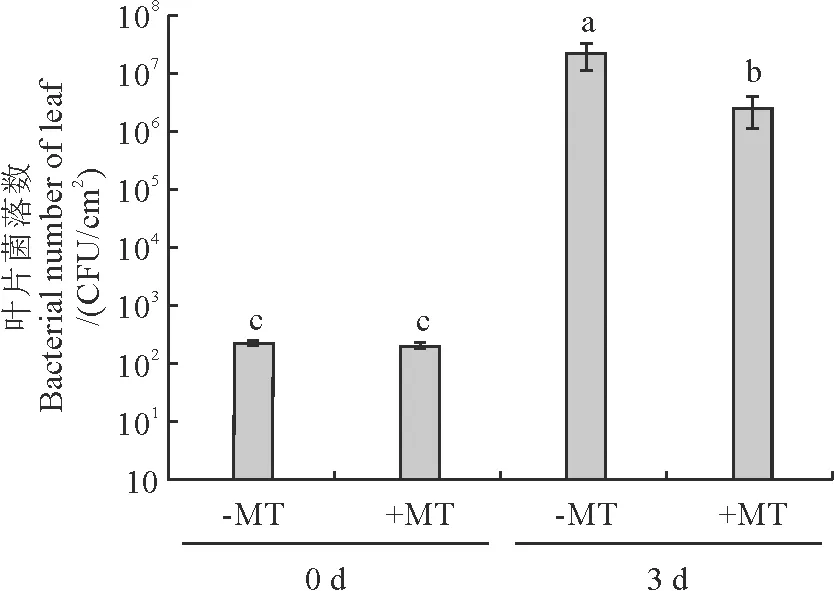
图2 褪黑素对烟草叶片Pst DC3000含量的影响Fig.2 Effects of melatonin on the Pst DC3000 contents in tobacco leaves
2.3 过表达GmSANT1基因增加转基因烟草内源褪黑素含量
与野生型相比较,GmSNAT1-OE2和GmSNAT1-OE5转基因烟草叶片中GmSNAT1的基因表达显著提高,且内源褪黑素含量分别显著提高了3.2和3.5倍,NtPMTR1的表达水平也提高了约6倍(图3)。
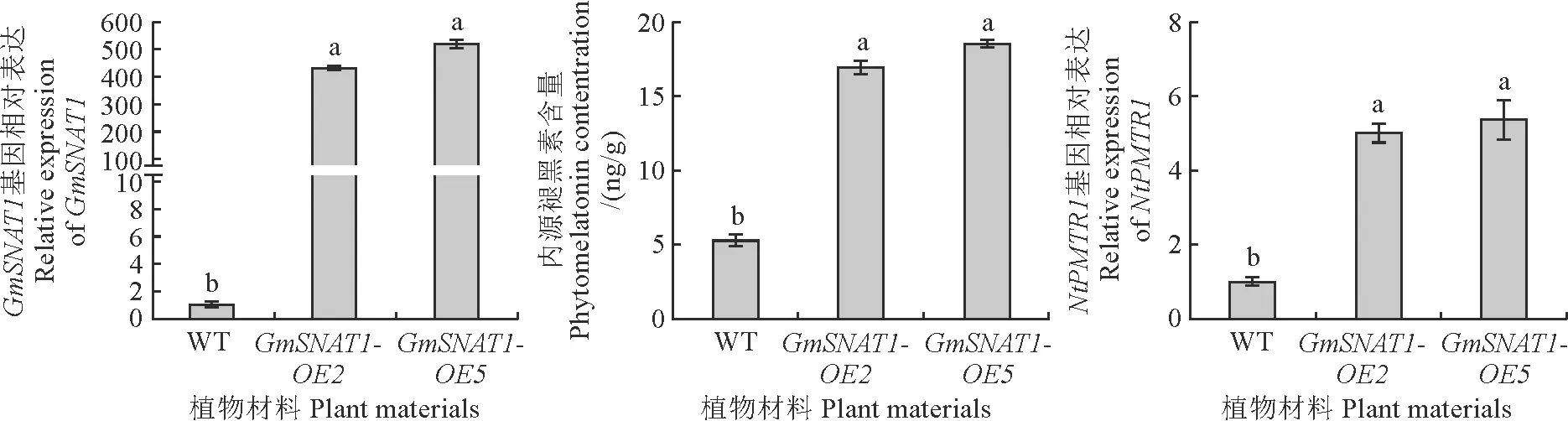
图3 过表达GmSANT1基因增加内源褪黑素合成与潜在受体NtPMTR1基因表达Fig.3 Overexpression of GmSANT1 increases endogenous phytomelaton in synthesis and expression of the putative phytomelatonin receptor NtPMTR1
2.4 过表达GmSANT1基因提高转基因烟草对Pst DC3000的抗性
本研究随后使用GmSNAT1转基因烟草为材料,探讨内源褪黑素信号在植物应答病原菌入侵中的功能。
与对照相比(-MT),外源褪黑素(+MT)预处理2 h后,野生型和转基因烟草叶片中的PstDC3000菌落数均显著下降(图4)。
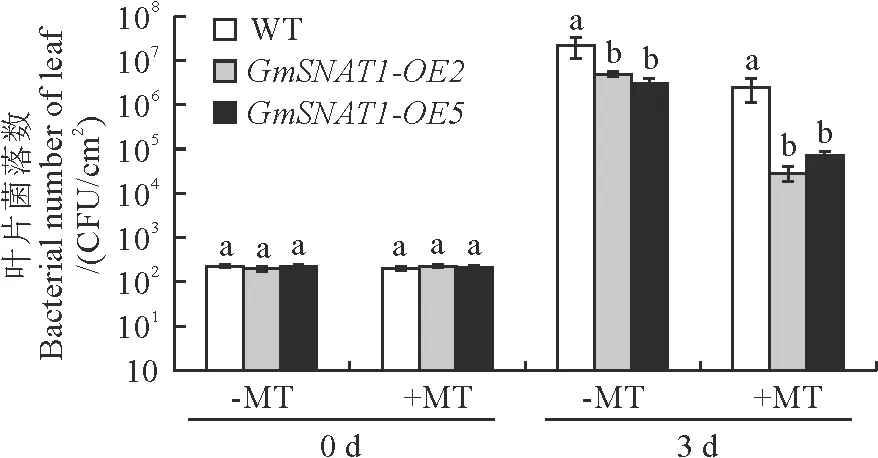
图4 褪黑素对野生型(WT)和GmSNAT1转基因烟草(GmSNAT1-OE2和GmSNAT1-OE5)叶片Pst DC3000含量的影响Fig.4 Effects of melatonin on the Pst DC3000 content in leaves of wild type (WT) and GmSNAT1-overexpressing (GmSNAT1-OE2 and GmSNAT1-OE5) tobacco plants
在有无褪黑素预处理情况下,GmSNAT1-OE2和GmSNAT1-OE5叶片中的菌落数均显著低于野生型植物。由此可见,外源和内源褪黑素均显著降低病原菌入侵。
2.5 GmSNAT1转基因烟草对褪黑素和flg22诱导气孔关闭的敏感性增加
气孔是病原菌入侵植物叶片的主要通道,且褪黑素通过诱导保卫细胞ROS产生和气孔关闭以阻止病原菌入侵[19]。
对气孔开度和ROS含量的分析结果表明,褪黑素和细菌鞭毛蛋白多肽flg22均能够诱导野生型(WT)和转基因植物(GmSNAT1-OE2和GmSNAT1-OE5)气孔关闭和ROS产生。褪黑素和flg22处理2 h后,GmSNAT1-OE2和GmSNAT1-OE5气孔开度是WT植物的90%,而ROS相对荧光强度提高了约2倍(图5)。
3 讨 论
褪黑素是生物体普遍存在的信号分子。在人体中,褪黑素主要具有调节昼夜节律、睡眠、生殖和免疫等生理功能。与之类似的是,褪黑素也调控了植物种子萌发、开花、气孔节律关闭等[35]。此外,褪黑素在提高植物抗病能力中也起到重要作用,如外源褪黑素可以有效抑制茄根根核菌的活性,增强苹果树对褐斑病的抗性[36],减轻草莓真菌感染[37]。在拟南芥中,荧光假单胞菌PstDC3000可迅速提高植物内源褪黑素含量,且外源施加褪黑素诱导了水杨酸和NO等防御信号和抗病基因表达[38]。与拟南芥Col-0相比,褪黑素合成关键基因snat1突变体中的内源褪黑素含量及其对病原菌抗性均显著下降[39]。本研究发现外源喷施褪黑素和内源褪黑素含量提高的GmSANT1转基因烟草叶片中的PstDC3000菌落数均显著下降,表明褪黑素在抵御病原菌入侵中起重要作用,且褪黑素在动植物免疫应答中的功能可能是保守的。
气孔不仅是植物叶片吸收CO2进行光合作用的主要通道,也是病原菌入侵的主要途径[40]。油菜黄单胞菌(bacteriumXanthomonascampestrispv.armoraciae)[41]、葡萄生单轴霜霉菌(OomycetePlasmoparaviticola)[42]和柄锈菌属(fungusPuccinia)[43-44]等均通过气孔进入植物叶片。植物质膜定位的模式识别受体可识别病原体相关的分子模(pathogen-associated molecular patterns,PAMP),诱导ROS产生和气孔关闭,从而“关闭”病原菌入侵的“大门”[5-6]。在三七(Panaxnotoginseng)中,Yang等[19]的研究发现外源褪黑素主要通过诱导气孔关闭以降低病原菌入侵。在拟南芥中的进一步研究发现[19,26],褪黑素通过PMTR1激活异源三聚体GTP结合蛋白Gα亚基(GPA1)或MAPK信号途径调节拟南芥气孔免疫,且免疫受体复合体FLS2(flagellin sensing 2)和BAK1[brassinosteroid insensitive 1(BRI1)associated kinase receptor 1]介导的flg22诱导气孔免疫也依赖于PMTR1。在烟草中,Kong等[45]克隆了PMTR1同源基因TrP47363和TrP13076,且褪黑素及其类似物5-甲氧基色胺和5-甲氧基吲哚诱导的气孔关闭、PR1a基因表达和水杨酸累积均依赖于TrP47363和TrP13076。在本研究中,我们发现褪黑素诱导了烟草保卫细胞ROS的爆发和气孔关闭。与野生型植物相比,内源褪黑素含量提高的GmSNAT1-OE2和GmSNAT1-OE5转基因烟草中潜在褪黑素受体NtPMTR1的表达水平显著提高,且它们对褪黑素和flg22诱导的气孔关闭和ROS产生的敏感性也显著增加。由此可见,褪黑素主要通过诱导气孔关闭以阻止病原菌的入侵。
综上所述,本研究发现病原菌PstDC3000能迅速诱导烟草叶片褪黑素信号相关基因表达(NtSNAT1和NtPMTR1),且外源喷施褪黑素通过诱导保卫细胞ROS产生和气孔关闭以阻止病原菌入侵。在烟草中过量表达GmSNAT1显著提高了转基因烟草中内源褪黑素合成及受体基因NtPMTR1的表达,从而提高植物的气孔免疫和对病原菌入侵的抗性。

