栽培型木薯Ku50的高光效生理特性分析
李秀秀 冉令之 马琳 秦晓春


摘 要:为探究栽培型木薯Ku50 的高光效生理特性,选用野生型木薯W14,近缘野生型A4047 以及栽培型木薯Ku50为材料,通过对其功能叶片光合色素含量,净光合速率(包括光合日变化及光强-光响应曲线)及不同光强条件下的叶绿素荧光参数[包括光系统Ⅱ的实际光能转换效率Y(Ⅱ)及非光化学淬灭系数NPQ]进行测定分析,研究不同品种木薯的光合生理特性。结果表明:栽培型木薯Ku50 各项光合色素含量显著高于野生型木薯W14,与近缘野生型A4047 无明显差异,推测Ku50 及A4047 具备更高的光合碳固定能力;光合日变化测定结果显示,净光合速率Ku50 略大于A4047,均远大于W14,且Ku50 及A4047 不存在午间光抑制现象,而W14 存在较明显午间光抑制现象,推测Ku50 及A4047对强光的光能转化效率较高,耐强光性更强。进一步测定光强-光响应曲线结果显示,截至最大光强2500 μmol/(m2·s),3 种木薯品种均未达到光饱和点,且随着诱导光强的升高,其净光合速率同样呈现Ku50>A4047>W14 的趋势,其中Ku50可达到约40 μmol/(m2·s),A4047 可达到约34 μmol/(m2·s),而W14 仅可达到约15 μmol/(m2·s),表明Ku50 的耐强光性更强,光能转化效率更高。此外,通过测定叶绿素荧光参数深入分析不同品种木薯对光能的吸收及分配利用,结果表明,在强光作用条件下,Ku50 光系统Ⅱ的实际光能转化效率[-Y(Ⅱ)]显著高于W14,略高于A4047,但无明显差异(P>0.05);而Ku50 的非光化学淬灭系数(-NPQ)则显著低于W14 及A4047,表明Ku50 耗散为热量的光能较低,反向证明Ku50 其光能转化效率较高,与光合色素含量及净光合速率测定结果相统一。因此,研究结果表明,栽培型木薯Ku50 高光效特性由强光诱导产生,且对强光的耐受性更强,利用率更高。
关键词:木薯;栽培型Ku50;光合生理;高光效
中图分类号:S533 文献标识码:A
木薯(Manihot esculenta Crantz)又称南洋薯、木番薯,为大戟科木薯属多年生灌木植物。木薯起源于热带美洲,于19 世纪20 年代引入中国,因其具有高生物量、耐贫瘠、抗逆性强等特性,目前在热带、亚热带地区广泛种植栽培,不仅为世界三大薯类作物之一,同时其仅次于小麦、水稻、玉米、马铃薯和大麦,为世界第六大粮食作物[1-4]。研究发现,木薯叶片中磷酸烯醇式丙酮酸羧化酶的活性较高,且木薯的净光合速率比大多数C3 植物高,因此,木薯被认为具有C3 及C4中间型的高光效光合特性[5-6]。
众所周知,光合作用是地球上一切生命活动的能量来源,是植物生长发育的物质基础。光合作用强弱与植物的产量与品质息息相关,提高植物光能转化效率,是筛选高光效品种,改良作物产量的有效途径[7-8]。木薯高光效特性是一直以来的研究热点,但目前关于木薯光合特性研究主要集中在简单光合生理指标测定方面,关于其高效光能利用效率分析及研究仍知之甚少。因此,研究木薯高光效生理特性可为其高光效育种及筛选提供理论基础及技术支持。
植物吸收光能进行光合作用主要靠光合色素分子来实现,植物光合色素主要包括叶绿素和类胡萝卜素,主要承担光合作用中光能吸收,转换及光保护等重要过程,其含量将直接影响植物光合速率及产物形成,是判定叶片光合生理活性的重要指标[9-10]。净光合速率是反映植物光合碳固定能力的直接指标,较高的光合速率是植物获得高产的重要基础,而光合速率日变化及光强-光响应曲线是判定植物光能利用效率的重要指标之一[11]。此外,叶绿素荧光作为光合作用的探针,通过叶绿素荧光参数可深入分析植物对光能的吸收及分配利用情况[12-13]。本研究通过测定不同品种木薯的光合色素含量,光合速率以及叶绿素荧光参数,最终解析栽培型木薯Ku50 高效光能利用效率的生理特性,为后续木薯品种高光效育种及筛选提供理论及技术支持。
1 材料与方法
1.1 材料
木薯材料为野生型木薯W14,近缘野生型A4047 以及栽培型木薯Ku50 均來自于中国热带农业科学院热带生物技术研究所,所有材料均种植于海南澄迈基地。
1.2 方法
1.2.1 叶绿素含量测定 参照ARNON[14]的方法,选取成熟的木薯功能叶片,采用直径为1 cm的打孔器进行等面积打孔取样,液氮保存,每个样品4 次重复。将采集回来的新鲜叶片破碎并置于80%冰丙酮溶液中暗处浸提30 min。用高效液相色谱仪于445 nm 紫外检测波长下测定各色素吸收峰面积,根据各色素标准曲线、色素吸收峰及保留时间区分并计算待测定木薯叶片中各种光合色素的含量。其中,类胡萝卜素测定包括紫黄质(Vio)、新黄质(Neo)、叶黄素(Lutein)以及β-胡萝卜素(β-Car),而叶绿素测定包括叶绿素a(Chl a)及叶绿素b(Chl b)[15]。
1.2.2 叶片光合速率测定
(1)光合日变化测定。
选择晴朗的天气,利用CIRAS-3 型便携式光合仪夹取不同木薯品种生长完好的功能叶片,从8:00(m)—14:00(n),每间隔1.5 h 测定不同木薯品种在不同时间点的净光合速率值(Pn)。每种材料在每个时间点重复测量5 次,根据结果取平均值并绘制不同木薯品种的光合日变化曲线。
(2)光强-光响应曲线测定。选择晴朗的天气,针对不同木薯品种,选取生长状态完好的功能叶片,利用CIRAS-3 型便携式光合仪设置光强梯度,由高到低分别为2500、2250、2000、1750、1500、1250、1000、750、500、250、100、0 μmol/(m2·s),每种光强条件下测量时间设置为2 min,记录稳定的净光合速率值(Pn),每个木薯品种重复测量光强梯度3 次,根据结果取平均值并绘制不同木薯品种的光强-光响应曲线。
1.2.3 叶绿素荧光参数测定 利用双通道调制叶绿素荧光仪Dual-PAM-100 进行叶绿素荧光参数测定,选用生长状态完好的功能叶片,测定前,叶片需经过30 min 充分暗适应后,测定暗适应下叶片光系统Ⅱ的最大光能转换效率Fv/Fm、光系统Ⅱ的实际光能转换效率Y(II),光系统Ⅱ非调节性能量耗散的量子产量Y(NO),光系统Ⅱ调节性能量耗散的量子产量Y(NPQ)以及非光化学淬灭NPQ 等参数。每个指标测量均重复3 次,根据结果取平均值并绘制相关叶绿素荧光参数曲线[16-19]。
1.3 数据处理
采用Microsoft Excel 2016 软件进行数据整理、制图及差异显著性分析。
2 结果与分析
2.1 不同木薯品种功能叶片形态特征及Fv/Fm数值分析
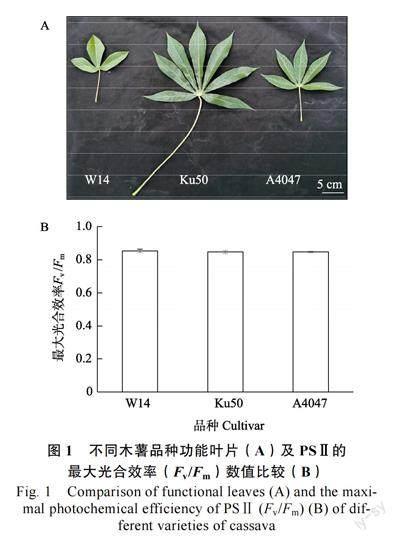
通过对海南省澄迈县8 月生长的野生型木薯W14,近缘野生型A4047 以及栽培型木薯Ku50的功能叶片表型比对分析,结果如图1A 所示,与2 种野生型木薯W14、A4047 相比,栽培型木薯Ku50 的叶片面积较大,裂叶较多,A4047 次之,而W14 叶面积最小,裂叶最少,且叶色较浅,叶绿素含量显著降低。而叶片面积及叶绿素含量是影响植物光合作用能力高低的重要参数[20],推测栽培型木薯Ku50 光合能力较强,A4047 次之,野生型木薯W14 较弱。此外,光系统Ⅱ的最大光能转换效率Fv/Fm 是判定植物是否处于健康生理状态的重要指标[21],对3 种木薯品种所选用功能叶片进行Fv/Fm 测量,结果如图1B 所示,3 种木薯品种并无明显差异,且数值均在0.84 以上,表明本研究中所用功能叶片均生长状态良好,且并未处于胁迫状态,所测数值均可参考使用。
2.2 不同木薯品种光合色素含量分析
为了进一步探究栽培型木薯Ku50 与野生型木薯(W14、A4047)叶片光合色素含量的差异,选取3 个木薯品种的功能叶片,分别在8:00(m)以及12:00(n)进行取材及色素抽提,通过高效液相色谱技术,对3 个木薯品种叶片光合色素含量进行测定,结果如图2 所示。通过对液相色谱结果进行分析,结果显示,与野生型W14 相比,在8:00(m)和12:00(n)时,A4047 及Ku50中的叶绿素(Chl a/b)(图2B)及类胡萝卜素(Vio、Neo、Lutein 及β-Car)(图2A)含量明显增加(P<0.05),而近缘野生型A4047 与栽培型Ku50相比,差异并不显著。该结果表明,相较于野生型W14,栽培型Ku50 与近缘野生型A4047 的叶绿素及类胡萝卜素等光合色素的含量更高。光合色素含量是判定植物光合作用能力的重要指标[9-10],进而推测栽培型木薯Ku50 及近缘野生型A4047 具有较强的光合固碳能力。
2.3 不同木薯品种光合日变化及光强-光响应曲线分析
为了进一步探究3 个木薯品种光合固碳能力的差异,验证栽培型木薯Ku50 是否具有更高的光合能力,分别进行了光合速率日变化测量和光强-光响应曲线分析。光合日变化测量时间段为8:00—14:00,每间隔1.5 h 测量3 种木薯净光合速率(Pn)的差异,结果如图3A 所示,Ku50的净光合速率显著高于野生型W14,略高于近缘野生型A4047,表明栽培型木薯Ku50 光合固碳能力最高,近缘野生型A4047 次之,而野生型W14 最低。此外,结果显示,随着室外自然光光照强度的升高,野生型木薯W14 呈现出较为明显的光抑制现象,其净光合速率明显降低[约17~20 μmol/(m2·s)],而栽培型木薯Ku50 则没有明显光抑制现象,持续维持在33 μmol/(m2·s)左右,该结果表明Ku50 对强光的耐受性更强,利用率更高。
另外,通过光强-光响应曲线测量可反映植物净光合速率(Pn)随光照强度变化的情况,是判断植物光能利用效率的重要指标之一,同时也反映了植物光合固碳能力的强弱。为了进一步探究野生型木薯W14、A4047 及栽培型木薯Ku50 光合固碳能力的差异,对3 种木薯的光强-光响应曲线进行分析,结果如图3B 所示。随着光强的升高,3 种木薯的净光合速率明显增加,且截至光合仪最大光强2500 μmol/(m2·s)时,野生型木薯W14,A4047 以及栽培型木薯Ku50 均未达到光饱和点,表明木薯的高光合能力特性是受强光所诱导产生,对强光的耐受力较强。同时,随着光强升高,栽培型木薯Ku50[约40 μmol/(m2·s)]净光合速率明显高于野生型W14[约15 μmol/(m2·s)],略高于近缘野生型A4047[约34 μmol/(m2·s)],进一步表明栽培型木薯Ku50 具有较高的光合固碳能力,对强光的耐受力以及光能转化效率更高。
综上所述,通过光合日变化及光强-光响应曲线的分析,表明木薯高光效受强光诱导產生,其中栽培型木薯Ku50 光合固碳能力较高,且对强光利用率较高,耐受强光的能力更强。
2.4 不同木薯品种叶绿素荧光参数分析
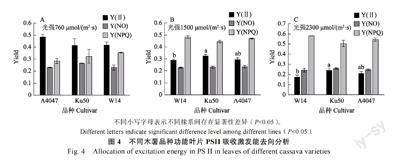
2.4.1 不同木薯品种的PSII 激发能去向分析 植物吸收光能主要通过光化学反映,热耗散以及叶绿素荧光的方式去分配,且三者呈现此消彼长的趋势关系。因此,通过测定不同光强下植物吸收光能的能量分配,进而可探究不同木薯品种的光能转化效率,而叶绿素荧光参数测量是探究植物光能利用效率的有效手段。其中,叶绿素荧光参数Y(Ⅱ)代表PSII 的实际光能转换效率,主要代表用于光化学反映的那部分能量,Y(NO)主要代表植物PSII 非调节性能量耗散的量子产量,主要包括被动耗散为热量和发出荧光的能量,作为植物是否受到光损伤的重要指标,而Y(NPQ)代表通过调节性的光保护机制耗散为热的那部分能量,且Y(Ⅱ)+Y(NO)+Y(NPQ)=1[18]。为了进一步验证栽培型木薯Ku50 的高光效特性由强光诱导产生,通过测量不同木薯品种的PSII 吸收激发能的分配去向进行深入分析。结果如图4 所示,与较低作用光强760 μmol/(m2·s)相比,在较强作用光强[1500 μmol/(m2·s) 及2300 μmol/(m2·s)]条件下,Y(NPQ)均有所增加,表明不同木薯品种吸收光能耗散为热量的形式均有所增加,但Y(NO)并没有明显升高,且不同木薯品种的Y(NO)并未产生明显差异,表明3 种木薯在较强作用光下均未处于光损伤状态,对强光的耐受性较强。此外,进一步对不同木薯品种的实际光能转化效率进行分析,结果显示,在较低作用光强760 μmol/(m2·s)时,栽培型木薯Ku50 的Y(Ⅱ)与W14 接近且明显低于A4047,而在较强作用光强[1500 μmol/(m2·s) 及2300 μmol/(m2·s)]条件下,栽培型木薯Ku50 的Y(Ⅱ)显著高于W14,但与A4047 相比无显著性差异。该结果表明随着作用光强的增加,栽培型木薯Ku50 在强光诱导条件下,其光能转化效率较高,与前期光合日变化及光强-光响应曲线结果相统一,进一步证明栽培型木薯Ku50 具备对强光利用率增加的高光效特性。
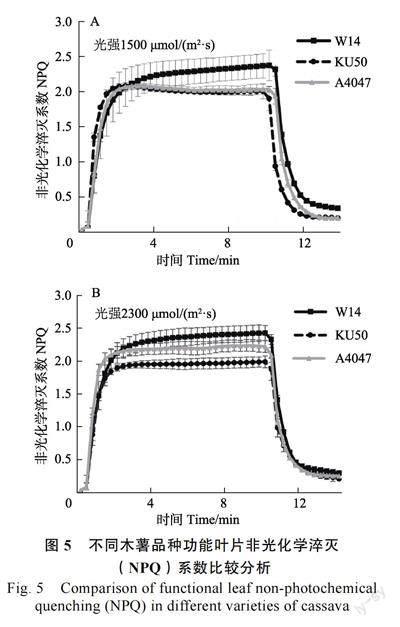
2.4.2 不同木薯品种NPQ 比较分析 非光化学猝灭系数(non-photochemical quenching,NPQ),是植物在光强过高时的一种保护机制,反映了植物耗散过剩光能为热的能力,是植物保护自身光合细胞器的重要过程。同时,基于植物吸收光能的3 個去向:光合作用,叶绿素荧光及热耗散,NPQ的测量同样可侧面反应在强光条件下植物的光能利用效率[19]。为了进一步验证栽培型木薯Ku50 对强光的高效利用率,通过Dual-PAM-100荧光仪测定了在强光条件下不同品种木薯的NPQ差异。结果如图5 所示,在光强为1500 μmol/(m2·s)条件下,栽培型木薯Ku50 及近缘野生型A4047的NPQ 数值明显低于野生型W14(图5A)。结合前期结果,在1500 μmol/(m2·s)作用下,Ku50 的实际光能转化效率Y(Ⅱ)较高,表明Ku50 的光能转化效率较高,对强光的利用率较高。而当光强升至2300 μmol/(m2·s)条件时,栽培型木薯Ku50的NPQ 数值显著低于野生型木薯W14 及A4047(图5B),进一步证明栽培型木薯Ku50 对强光的利用率更高,具有更加良好的高光效特性,与光合日变化及光强-光响应曲线结果相统一。
3 讨论
植物光合色素主要包括叶绿素(Chl a/b)和类胡萝卜素(Vio,Neo,Lutein 及β-Car),其中,叶绿素是光合作用的主要色素,而类胡萝卜素则是光能捕获中心的辅助色素,二者在光能吸收,能量转换以及光保护等方面起重要作用[22]。大量研究表明,光合色素含量的高低将直接影响植物的光能转化效率及光合产物的形成。因此,光合色素的含量可在一定程度上反映植物光合固碳能力[23-24]。在本研究中,栽培型木薯Ku50 及近缘野生型A4047 的各项光合色素含量均显著高于野生型木薯W14,推测Ku50 和A4047 具有较高的光合固碳能力。光合日变化的测定结果也印证了该结论,仅W14 存在明显午间光抑制现象,其午间净光合速率明显降低,且Ku50 整体净光合速率略高于A4047,远高于W14,同样表明Ku50对午间强光时对光能转化效率较高,A4047 次之,远高于W14,同与光合色素测定结果相统一。
此外,光强-光响应曲线是判定植物光能利用率的重要指标之一,3 种木薯测定结果表明,木薯高光效特性是由强光诱导产生,且截至最大光强2500 μmol/(m2·s),3 种木薯均未达到光饱和点,表明其均具有耐强光特性,但净光合速率结果表明,Ku50 显著高于A4047,且二者均远大于W14,这与光合色素含量测定结果相统一,表明栽培型木薯Ku50 受强光诱导时的高光利用率更高,A4047 次之。同样与光合色素测定结果相统一。
植物吸收光能主要通过光合作用,热耗散及叶绿素荧光等3 种方式进行,且三者之间彼此相互竞争,此消彼长。因此,可以通过监测植物叶绿素荧光以及热耗散的分配间接判定植物光能转换效率[25]。叶绿素荧光参数测定是分析植物对光能的吸收、利用及分配的重要手段,是探究植物叶片光能利用率的重要手段[26-27]。本研究结果显示,在较强[1500 μmol/(m2·s)及2300 μmol/(m2·s)]作用光下,栽培型木薯Ku50 的实际光能转化效率Y(Ⅱ)显著高于W14,略高于A4047,但差异不显著。表明在较强作用下,Ku50 的光能转化效率最高,对强光的利用率较高。同时,NPQ 测定结果显示,在1500 μmol/(m2·s)作用光下,Ku50 及A4047 显著低于W14,而在2300 μmol/(m2·s)作用光下,Ku50 显著低于A4047 及W14。NPQ 代表植物的热耗散分配,在同等条件下,热耗散较高,代表植物实际光能转化较低,反之,则代表光合能力较强。该结果显示,栽培型木薯Ku50 在较强作用光下NPQ 最低,A4047 次之,W14 最高,同样表明Ku50 在强光作用下,光能转化效率最高,对强光的利用率较高,A4047 次之,W14 最低[28-29]。这均与前期光合色素含量及净光合速率测定结果相统一。
4 结论
本研究通过测定不同品种木薯功能叶片的光合色素含量,证明栽培型木薯Ku50 含有更高的光合色素含量,推测其光合固碳能力更高。进一步通过测定不同品种木薯的光强-光响应曲线及光合日变化,证明木薯高光效由强光诱导产生,且栽培型木薯Ku50 的净光合速率最高,不存在午间光抑制现象,表明其耐强光性较强,光能利用率高。最终通过测定不同品种木薯的叶绿素荧光参数,在强光条件下,栽培型木薯Ku50 实际光能转化效率Y(Ⅱ)更高,热耗散NPQ 较低,从光能利用及分配的角度证明,在强光诱导条件下,与野生型木薯W14 及A4047 相比,栽培型木薯Ku50 对强光光能转化效率更高,耐受性更强,具备更好的高光效特性。
参考文献
[1] JANSSON C, WESTERBERGH A, ZHANG J M, HU X W, SUN C X. Cassava, a potential biofuel crop in (the) People’s Republic of China[J]. Applied Energy, 2009, 86(1): 95-99.
[2] TAYLOR N, CHAVARRIAGA P, RAEMAKERS K,SIRITUNGA D, ZHANG P. Development and application of transgenic technologies in cassava[J]. Plant Molecular Biology,2004, 56(4): 671-688.
[3] 蒋和平, 倪印峰, 朱福守. 中国木薯产业发展模式及对策建议[J]. 农业展望, 2014, 10(8): 41-48.
[4] ABRAHAM C T, LEBOT V. Tropical root and tuber crops.cassava, sweet potato, yams and aroids[J]. Experimental Agriculture,2009, 45(3): 382.
[5] EL-SHARKAWY M A. Cassava biology and physiology[J].Plant Molecular Biology, 2004, 56(4): 481501.
[6] EL-SHARKAWY M A. International research on cassava photosynthesis, productivity, eco-physiology, and responses to environmental stresses in the tropics[J]. Photosynthetica,2006, 44(4): 481-512.
[7] 白嵐方, 张向前, 王瑞, 王雅楠, 叶雪松, 王玉芬, 李娟,张德健. 不同玉米品种光合特性及青贮产量品质的差异性研究[J]. 作物杂志, 2020, 194(1): 154-160.
[8] 李义博, 陶福禄. 提高小麦光能利用效率机理的研究进展[J]. 中国农业气象, 2022, 43(2): 93-111.
[9] VON WETTSTEIN D, GOUGH S, KANNANGARA C G.Chlorophyll biosynthesis[J]. The Plant Cell, 1995, 7(7):1039-1057.
[10] DEMMING-ADAMS B, ADAMA W W. The role of xanthophyll cycle carotenoids in the protection of photosynthesis[J]. Trends in Plant Science, 1996, 6(1): 21-26.
[11] 刘旻霞, 夏素娟, 穆若兰, 南笑宁, 李全弟, 蒋晓轩. 黄土高原中部三种典型绿化植物光合特性的季节变化[J]. 生态学杂志, 2020, 39(12): 4098-4109.
[12] STIRBET A, GOVINDJEE. On the relation between the Kautsky effect(chlorophyll a fluorescence induction)and Photosystem II: basics and applications of the OJIP fluorescence transient[J]. Journal of Photochemistry and Photobiology B: Biology, 2011, 104(1-2): 236-257.
[13] KRAUSE G H, WEIS E. Chlorophyll fluorescence and photosynthesis:the basics[J]. Annual Review of Plant Physiology and Plant Molecular Biology, 1991, 42(1): 313-349.
[14] ARNON D I. Copper enzymes in isolated chloroplasts polyphenoloxidase in beta vulgaris[J]. Plant Physiology, 1949, 24(1): 1-16.
[15] QIN X C, WANG W D, CHANG L J, CHEN J H, WANG P, ZHANG J P, HE Y K, KUANG T Y, SHEN J R. Isolation and characterization of a PSI-LHCI super-complex and its subcomplexes from a siphonaceous marine green alga, Bryopsis Corticulans[J]. Photosynthesis Research, 2015,123(1): 61-76.
[16] KITAJIMA M, BUTLER W. Quenching of chlorophyll fluorescence and primary photochemistry in chloroplasts by dibromothymoquinone[J]. Biochimica et Biophysica Acta,1975, 376(1): 105-115.
[17] GENTY B, BRIANTAIS J-M, BAKER N R. The relationship between the quantum yield of photosynthetic electron transport and quenching of chlorophyll fluorescence[J].Biochimica et Biophysica Acta, 1989, 990(1): 87-92.
[18] KLUGHAMMER C, SCHREIBER U. Complementary PS II quantum yields calculated from simple fluorescence parameters measured by PAM fluorometry and the Saturation Pulse method[J]. PAM Application Notes, 2008(1): 27-35.
[19] BILGER W, BJORKMAN O. Role of the xanthophyll cycle in photoprotection elucidated by measurements of light-induced absorbance changes, fluorescence and photosynthesis in leaves of Hedera canariensis[J]. Photosynthesis Research, 1990, 25(3): 173-185.
[20] 沈秀瑛, 戴俊英, 胡安畅, 顾慰连, 郑波. 玉米群体冠层特征与光截获及产量关系的研究[J]. 作物学报, 1993,19(3): 246-252.
[21] BJORKMAN O, DEMMING B. Photon yield of O2 evolution and chlorophyll fluorescence characteristics at 77 K among vascular plants of diverse origins[J]. Planta, 1987,170(4): 489-504.
[22] DALL’OSTO L, CAZZANIGA S, HAVAUX M, BASSI R.Enhanced photoprotection by protein-bound vs free xanthophyll pools: a comparative analysis of chlorophyll b and xanthophyll biosynthesis mutants[J]. Molecular Plant, 2010,3(3): 576-93.
[23] 张耀文, 赵小光, 田建华, 王辉, 王学芳, 李殿荣, 侯君利,关周博, 韦世豪. 甘蓝型油菜正反交后代叶片净光合速率和叶绿素含量的比较[J]. 华北农学报, 2015, 30(5):135-140.
[24] GOLOVKO T, DYMOVA O, ZAKHOZHIY I, DALKE I, TABALENKOVA G. Photoprotection by carotenoids of Plantago media photosynthetic apparatus in natural conditions[J]. Acta Biochimica Polonica, 2012, 59(1): 145-147.
[25] SCHREIBER U. Pulse-Amplitude-Modulation (PAM) fluorometry and saturation pulse method: an overview[J]. Chlorophyll A Fluorescence A Signature of Photosynthesis,2004(19): 279-319
[26] CHEN Q H, ZHAO X Q, LEI D K, HU S B, SHEN Z G,SHEN W B, XU X M. Hydrogen-rich water pretreatment alters photosynthetic gas exchange, chlorophyll fluorescence,and antioxidant activities in heat-stressed cucumber leaves[J].Plant Growth Regulation, 2017, 83(1): 69-82.
[27] BHUSAL N, SHARMA P, SAREEN S, SARIAL A K. Mapping QTLs for chlorophyll content and chlorophyll fluorescence in wheat under heat stress[J]. Biologia Plantarum,2018, 62(1): 721-731.
[28] 朱亞红, 孙存举, 朱铭强, 孙权, 李兴财. 河北杨与沙棘的光合生理特性及叶绿素荧光参数比较[J]. 中南林业科技大学学报, 2015, 35(2): 26-31.
[29] 何淼, 刘洋, 焦宏斌, 王想, 金利妍, 周蕴薇. 神农香菊不同株系间光合特性及叶绿素荧光特性比较分析[J]. 上海农业学报, 2017, 33(2): 13-18.

