呼吸气路生物相容性ISO 18562 系列标准修订浅析
王 伟,陈兴文
(1.上海市医疗器械检验研究院,上海 201318;2.国家药品监督管理局呼吸麻醉设备重点实验室,上海 201318;3.北京怡和嘉业医疗科技股份有限公司,北京 100073)
0 引言
医疗器械上市前的安全性及有效性评价非常重要,而生物相容性评价又是其中极其重要的一个方面。为了对医疗器械进行完整的生物学安全性评价,ISO 10993 系列国际标准根据医疗器械在预期使用中与人体组织接触性质(表面接触、外部接入或植入)和接触时间(持久、长期和短期)的不同,对医疗器械进行分类评价,以矩阵的形式给出各类医疗器械所需考虑的一组生物学数据(见ISO 10993-1[1]表A.1)。该系列标准为接触人体的医疗器械的生物学评价提供了详细的解决方案,但对于通过气体与患者间接接触的呼吸类医疗器械气路材料的生物相容性评价,该系列标准难以适用,相关的问题也没有完全阐释清楚。通过气路与患者间接接触的医疗器械通常指的是含有呼吸气路的医疗器械、组件或配件,包括但不限于呼吸机、麻醉机、制氧机、呼吸气体监护仪、肺功能仪、呼吸面罩、呼吸管路,以及任何类似应用的医疗器械配件。另外,婴儿培养箱的内室,包括床垫、被褥也被认为是呼吸气路的一部分。这些呼吸气路在各种环境下通过患者呼吸道向患者提供呼吸道护理或输送气体。随着经济的发展和监管理念的更新,美国食品药品监督管理局(Food and Drug Administration,FDA)早在2010 年便提出了呼吸气路作为间接接触分类来考虑相关医疗器械生物相容性的要求。为了证明安全,需要大量的动物实验,而对于风险较高的医疗器械,如果含有塑胶高分子材料(树脂原材料),则还会要求材料符合《美国药典》(United States Pharmacopeia,USP)Ⅵ级标准,制造过程满足《医疗产品良好制造规范》(Good Manufacturing Practice of Medical Products,GMP)的要求,对欧美之外高分子材料厂商来说门槛不低。制造商一般都熟悉ISO 10993 系列标准的要求,并明确自己的产品如何根据ISO 10993 系列标准进行评价。但对于大部分参与者来说,无论是制造商还是监管者,都不是很清楚如何对器械上的呼吸气路进行适当的生物学测试和评价。
基于上述问题,国际标准化组织ISO/TC121/SC3麻醉和呼吸设备分技术委员会于2013 年成立了WG13 工作组,专门负责起草呼吸气路生物相容性系列标准ISO 18562,在与医疗器械生物学和临床评价国际标准化技术委员会ISO/TC194 的专家保持紧密沟通的情况下,ISO 18562 系列标准Biocompatibility evaluation of breathing gas pathways in healthcare applications(医疗应用中呼吸气体通路生物相容性评价)于2017 年3 月正式发布生效。2018 年6 月,美国FDA 宣布认可ISO 18562 系列标准,并将该系列标准作为联邦注册中的共识系列标准。2018 年8 月,ISO/TC194 制定的新版生物相容性标准ISO 10993-1:2018 Biological evaluation of medical devices—Part 1:Evaluation and testing within a risk management process(医疗器械的生物学评价 第1 部分:基于风险管理的评价和测试)[1]中明确指出:“对于和患者间接接触的气路组件,应当应用ISO 18562 系列标准进行相关的生物相容性评价。”
自2017 年ISO 18562 系列标准首次发布以来,标准起草组收到了各方的反馈,这些反馈包括检测机构在实施中发现的可行性问题,也包括监管方提出的ISO 18562 现行标准未覆盖的部分,因此,国际标准化组织ISO/TC121/SC3 启动了该系列标准新的一轮修订。目前修订草案中增加的内容,对从业人员提出了更高的要求。本文希望阐明相关要求的背景和变化之处,以使国内相关从业人员更早了解并应对该系列国际标准发生的变化。
1 ISO 18562 系列标准与ISO 10993 系列标准的关系及风险考虑
1.1 生物相容性评价的终点
ISO 10993-1 是医疗器械生物相容性评价的基础性标准。ISO 18562-1[2]的框架与ISO 10993-1 非常相似,是一个用管理风险的总体思想描述系统评估过程的概述文件,而不仅仅给出测试要求。
在生物学终点方面,根据ISO 10993-1:2018 的说明,涉及呼吸气体通路的部分应以ISO 18562 系列标准为终点进行评价和测试。如ISO 10993-1:2018中表A.1-生物风险评价中的终点i)所述:“组织包括组织液和皮下空间。对于仅与组织间接接触的气体通路医疗器械或组件,请参阅医疗器械专用标准来了解与这些医疗器械相关的生物相容性信息。”
如果按照ISO 18562-4[3]进行测试,得到的浸提物质谱分析中发现化学结构可能为有毒物质的分子式,则应继续以其他相关的ISO 10993 试验为终点,否则,ISO 18562-4 足以作为终点。
1.2 ISO 18562 系列标准引用到ISO 10993 系列标准相关部分
呼吸类医疗器械的生物相容性可以分为2 个部分,即通过呼吸气路间接接触,以及与皮肤或黏膜直接接触。涉及到与患者皮肤或黏膜直接接触的部分根据ISO 10993 系列标准的相关部分进行评价,涉及到通过呼吸气路间接接触的部分根据ISO 18562系列标准进行评价。根据ISO 18562-1:2017 中图2右下角方框中“根据需要,进行‘可沥滤物’、细胞毒性和致敏性评价”的要求,当按照ISO 18562-4 进行测试时,如有难以定性的沥滤物检出,还需要根据ISO 10993-5 和ISO 10993-10 作进一步测试评价。具体需要考虑进行哪些试验的流程图如图1 所示。
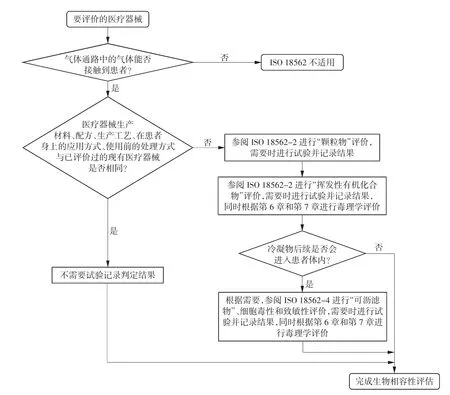
图1 ISO 18562-1:2017 中图2 确定的需要考虑进行哪些试验的流程图
在进行ISO 18562-4 的试验过程中,需要特别关注ISO 10993-17 和ISO 10993-18 的应用。ISO 18562-4 使用ISO 10993-18 的化学表征描述思想以及ISO/TS 10993-19 中的物理特性描述来量化患者每天接受的物质剂量,然后利用ISO 10993-17 的毒理学风险评价思想来确定这些物质的风险是否可接受。另外,在根据ISO 18562-4 进行样品制备过程中,还会涉及ISO 10993-12 要求的方法,所以这2 个系列标准的测试并不是孤立的。
1.3 现行ISO 18562 系列标准的风险考虑
ISO 18562 系列标准充分阐述了气路生物相容性评价的具体需求,弥补了ISO 10993 系列标准在呼吸类医疗器械等领域间接与患者接触产品生物学评价方面的不足。
1.3.1 有害物质
呼吸气路用的材料特别是气路内表面可能存在或产生其他生物化学的危害,比如气路材料可能排放的颗粒物、挥发性有机化合物(volatile organic compounds,VOC)以及可沥滤物(气路材料与水汽部分接触并进入冷凝水的析出物)毒害等。这些物质会通过气路进入患者的肺,经过肺泡的气体交换从而进入患者血液,因此风险很高。WG13 工作组也注意到其他有毒有害气体如CO、CO2、O3等物质也可能会对患者产生危害,这些物质的评价方法将会在系列标准的其他后续部分中探讨。
1.3.2 非动物实验
从伦理和动物保护的角度,ISO/TC194 一直在推动化学表征的理论应用于生物学评价实践。在呼吸类医疗器械气路方面,用物理和化学表征方法处理,是符合伦理和动物保护这一理念的。
选用化学成分测试和体外试验模型,则必须对气路材料进行化学表征,鉴定、定量有关化学成分,并考虑进行毒理评价,从而推导出每种物质的允许接触量。如果患者每天接受的剂量低于该化合物的允许接触量,那么就认为该医疗器械是符合要求的。
需要强调的是,评价并不意味着测试。制造商需要根据最终的配方、生产、应用和接触时间等进行生物相容性评价和风险识别,得出是否需要进行额外测试的结论。例如,正在研发的器械、部件或配件与已评价过的器械、部件或配件如果具有等同的功能和相同的材料,则不需要进行额外测试。只有当一些局部影响不能用化学表征充分评价,或存在的化学物质没有足够的毒理学数据来进行风险评价时,才应该考虑进行生物学测试。
2 标准实施中的挑战
ISO 18562 系列标准在发布后实施过程中遇到了一些挑战,分别来自于技术要求、试验方法和复合型人才团队。
2.1 不同产品临床应用的情况各不相同
涉及到呼吸类医疗器械,临床应用的流量范围从2L/min到150 L/min,所应用的温度从10 ℃到50 ℃甚至更高,接触时间从几分钟到30 d 以上。因此,需要针对不同的应用制订不同的测试方案,包括样品制备。另外,实验设计需要了解呼吸类医疗器械的应用场景,并深入理解风险管理的概念。
2.2 实验测评过程层面
测试人员需要掌握多种质谱分析仪的原理和应用,并根据呼吸类医疗器械不同应用场景来确定冷凝水萃取物的样品制备条件。对采样方法和防止过载的要求,分析结果有害物质定性和定量分析,以及最终的毒理评价等都需要进一步明确。更为重要的是,如何在呼吸类医疗器械应用场景下设计被测试器械和采样仪器的连接从而获得准确的采样结果,而不仅是在材料样品上进行测试,这需要测评机构和了解产品临床应用的人员达成共识。
2.3 毒理人才亟待发现
在关键的暴露量计算和毒理学家出具评价报告方面,国内具备相关能力和资质的人才大多集中在国家级、省级药品检验研究院。就笔者了解,目前国内医疗器械检验检测机构能开展ISO 18562 相关的测试和评价,且获得中国合格评定国家认可委员会(China National Accreditation Service for Conformity Assessment,CNAS)资质许可的并不多,而如果测试报告用于国际认证,则需要有国外认证的毒理学家对数据进行分析,因此产品出口美国的制造商通常委托欧美的专门机构和有资质的毒理学家出具分析报告,周期长且价格相当昂贵。
2.4 最新技术
随着近年来ISO/TC194 各项标准制修订工作的推进,ISO 10993-1:2018、ISO 10993-18:2020、ISO 10993-12:2021 和ISO 10993-23:2021 陆续发布,反映了生物相容性领域对非动物实验方面的最新认知,其对ISO 18562 系列标准的影响有待评估。另外,美国FDA 和制造商根据过去几年执行ISO 18562 系列标准的情况,结合“最新技术(state-of-art)”的监管要求,也对ISO 18562 系列标准提出了修订的建议,希望新修订标准既能协调最新版ISO 10993 系列标准要求,又能满足新的监管需求,还能减轻制造商的负担。
2.5 实际案例
2021 年,某公司发起了涉及气路生物相容性问题的大规模召回,涉及到用户端上百万台机器。根据美国FDA 官网公开信息,被召回的医疗器械属于第一代家用睡眠呼吸治疗设备,均为2009—2021 年售出的[4]。医疗器械清洁不当,或放置在高温潮湿环境中,里面的泡沫可能会碎裂,也可能释放有害气体。如果吸入泡沫颗粒,会引起头痛、刺激、炎症和呼吸问题;吸入有害气体VOC 可能会导致头痛、刺激、过敏、恶心和呕吐等。两者都有潜在的毒性和致癌性。本次召回涉及到ISO 18562-2 中规定的颗粒物和ISO 18562-3 中规定的VOC,但是现行标准的范围并未考虑多次清洁或再处理后的设备向气路中排放物质的可能性。
在此案例基础上笔者查阅了国内药品监督管理局官网公开的召回公告与不良事件公告以及相关科研论文[5-6],了解到临床机构和制造商主要还是关注呼吸类医疗器械的压力、潮气量等物理指标的输出可靠性,并未关注到颗粒物、VOC、沥滤物等气路生物相容性的问题。
3 标准新的动态
2021 年2 月到2022 年3 月,WG13 工作组重新召集成员开始标准修订,通过若干次会议讨论,形成了最新的ISO 18562 系列标准(第二版)修订方案[7]。根据目前的共识,未来呼吸类医疗器械的制造商以及测评机构需要结合如下几点考虑。
3.1 引入了ISO 10993-1:2018 的生物相容性评价路径
新版标准ISO 18562-1(第二版)中6.1“用于生物风险分析的物理化学信息”替换了前一版的“材料表征”,“材料表征”也由“化学表征”修订成“物理/化学表征”,并且强调在生物学评价和材料表征之前必须收集器械/组件的物理和化学信息。此类信息的获取是生物学评价的第一步,为后续材料表征提供产品信息依据。评价的路径参考ISO 10993-1:2018 的最新框图,而评价的终点增加了ISO 10993-23 中规定的刺激试验作为评价之一。
另外,针对不同患者人群,在ISO 18562-1 中给出了基于体质量和每日呼吸吸入气体体积的默认值,用于后续毒理学评价和可接受阈值的计算依据。不同人群吸入气体体积见表1。
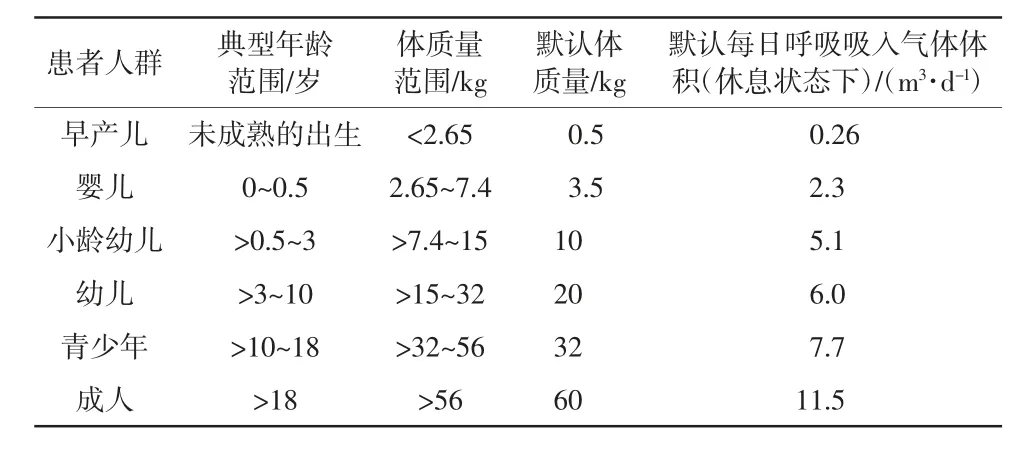
表1 根据患者人群默认的体质量和呼吸气体体积
3.2 引入了ISO 10993-12:2021 的样品制备
3.2.1 浸提液样品
考虑到呼吸类医疗器械临床应用时间和使用环境的不同,WG13 工作组认为应采用正常使用中最不利的临床参数(如温度、流量等)进行加严浸提,这意味着制造商需要明确识别最不利的临床相关参数。
3.2.2 极性与非极性浸提液
ISO 10993-12:2021[8]中10.3.5 规定:应使用极性和非极性萃取载体进行萃取,在某些特定情况下,可能适合在一个提取载体中提取,无论是极性或非极性。如果萃取仅在一种萃取载体中进行,则应提供理由。
呼吸类医疗器械在临床使用过程中主要是用水来做气体湿化的,因此,从临床应用的角度,选用水这种极性溶剂的化学表征足以对萃取物/可沥滤物进行提取,从而评价呼吸类医疗器械的安全性。
3.3 引入了ISO 10993-18:2020 化学表征的考量
ISO 10993-18:2020[9]的重大变化体现在以下几个方面。
3.3.1 重复测试
在化学表征测试时需要制造商提供更多的重复样本,这与美国FDA 目前的思路是一致的。除非制造商能证明所用测试方法的准确性,否则多次平行重复测试将作为一种标准做法。
3.3.2 分析评价阈值(analytical evaluation threshold,AET)
ISO 10993-18:2020 增加了AET 这一概念,以便在设计研究时协调化学家和毒理学家的工作。AET需要毒理学数据,例如毒理学关注阈值(threshold of toxicological concern,TTC)和暴露假设来指导化学表征的设计和执行。
3.3.3 更严苛的提取
ISO 10993-18:2020 要求对长期接触(累计接触时间在24 h 以上,30 d 以内)和持久接触(累计接触时间超过30 d)的器械进行更严苛的提取研究。第18部分的变化促使制造商必须采取积极主动的措施来应对化学表征和其他生物学评价终点的变化。
对于呼吸类医疗器械制造商来说,这涉及到与经验丰富的测评机构合作,以满足化学表征最新标准的要求,为即将到来的ISO 10993-17 变更做好准备。同时,与了解最新变化的毒理学家合作也是至关重要的。当化学表征存在未知化合物时,毒理学家很难准确评价呼吸气路的毒理学风险,这种情况可能需要追加额外的测试,从而导致研发时间、资源投入和项目资金的增加。
3.4 制定中的ISO 10993-17:202X 的影响
2022 年,针对ISO 10993-17 Biological evaluation of medical devices—Part 17:Toxicological risk assessment of medical device constituents(医疗器械的生物学评价第17 部分:医疗器械成分的毒理学评估)[10]最新国际标准草案(Draft International Standard,DIS)主要还是关注植入物的相关要求,而对于吸入物的部分并未投入太多关注的情况,WG13 工作组向ISO/TC194 相关工作组提出了建议,期望ISO 10993-17 起草组能考虑到医疗器械呼吸气体通路中的化学成分的特殊性,增补有别于传统的用于浸出物质的方法,为在医疗器械的气体通路中确定VOC 的可耐受接触量(tolerable exposure,TE)提供额外信息,以评价医疗器械中呼吸气路的生物相容性。
3.5 考虑ICH Q3D(R1):2016 的引入
在考虑ISO 18562-4 的元素杂质需要关注的物质时引入了ICH 指导原则ICH Q3D(R1):2016。这个指导原则是国家药品监督管理局药品审评中心组织转化实施的。根据药学文献[11]的观点,元素杂质包括可能存在于原料药、辅料或制剂中的催化剂和环境污染物,主要是指药品生产或贮藏过程中生成、加入或无意引入的物质。由于某些元素杂质具有毒性,还可能对药品的稳定性、保质期产生不利影响,或可能引发有害的不良反应,世界各国药品监管机构对药品元素杂质的控制越来越严格。ICH Q3D 元素杂质指导原则被认为是目前比较复杂的法规之一,这主要是由于目前全球对如何评价或量化辅料(水)、包装系统等风险因素认识有限,难以确定哪些风险因素通过科学评估需要提供数据,或可忽略不计。当经风险评估确定需要进行元素限度测定时,又需要采用专属性更强、灵敏度更高的新分析技术,这进一步增加了实施的复杂性。
医疗器械的测评采用的元素杂质测定方法,如:电感耦合等离子体-原子发射光谱(inductively coupled plasma-atomic emission spectrometry,ICP-AES)法或电感耦合等离子体-质谱(inductively coupled plasmamass spectrometry,ICP-MS)法,虽然能降低注册申请不被批准的概率,但需要购买昂贵的仪器,且仪器的运行成本较高。制造商或者测评机构不得不投入巨资升级检测方法,以符合新法规的要求。此外,是否需要对元素杂质进行如此严格的控制,在工业界也有争论。徐昕怡等[11]研究发现,目前Q3D 的使用范围多在美国、欧盟和日本,对医疗器械进行如此风险控制,其获益比是否合理,值得医疗器械业界商讨。
3.6 生物学评价报告要素
ISO 18562 最新版DIS 稿中给出了生物学评价报告应包含的内容要素,为制造商和测评机构统一了要求,也有助于监管方进行审评。对于包含气体通路的医疗器械,根据ISO 18562-1 最新标准评估的生物相容性评估报告应包括:
(1)作为评估对象的医疗器械或附件的说明。
(2)生物相容性评估计划。
(3)测试样品的描述和基本原理,以及它们与医疗器械成品最终结果之间的任何差异。
(4)风险评估结果。
(5)对于完成的测试,测试结果与接受标准的比较。具体如下:①根据ISO 18562-2 测试得到的颗粒物暴露剂量和接受标准的总结比较;②根据ISO 18562-3 测试得到的VOC 暴露剂量和接受标准的总结比较;③根据ISO 18562-4 测试得到的冷凝水中可沥滤物暴露剂量和接受标准的总结比较;④根据ISO 14971:2019 对结果进行的风险评估,包括根据ISO 10993-17:2002 附录D 对冷凝水中VOC 和可沥滤物的毒理学相关性分析(此部分需要有资质的毒理学家进行)。
(6)任何风险收益比分析的结果。
根据ISO 18562 最新版DIS 稿,颗粒物暴露剂量、VOC 剂量阈值的数值相对于已发布的2017 版标准并未加以调整,而是对当下制造商提供的生物学评价报告的要素欠缺给出了明确指示,并不是简单地看测试数据和可接受的剂量之比来确定测试结果是否符合标准,而是要充分论述测试计划、描述测试过程以及对结果进行分析总结,以批判性分析报告的形式作为符合标准的证据。
3.7 对制造商的影响
上述变化要求制造商从产品设计之初就进行气路相关原材料级别的风险评估、对材料的多次测试,并落实原材料供应商控制。在产品上市之前,要结合产品应用场景进行多次消毒灭菌处理后的再次生物相容性评价。这些环节要求提供有资质的原料供应商、测评机构和毒理学家,这几个要素都会对产品研发造成影响,包括成倍地提高产品的研发费用,延长开发周期并提高企业的运营成本。
4 结语
针对国际标准发生的变化,相关制造商和准备开展相关测试评价的测评机构都应该积极准备,以保证新标准的顺利实施。从采标的必要性来看,如果国内企业有产品要到欧美上市,需要尽早采用该系列国际标准,特别是预期有产品出口美国的医疗器械制造商,更应当充分地审视产品的安全性评价,以应对美国FDA 提出的问题。从国内产品上市和监管的角度,目前ISO 18562-1:2017 已被转化为国内行业标准YY/T 1778.1—2021[12],但是后续的颗粒物、VOC 测试等部分标准尚未转化。在国家药品监督管理局2022 年及以后组织制定的呼吸类医疗器械注册审查指导原则中,也提到制造商应考虑呼吸气路的生物相容性要素,鼓励尽早提高对原材料和上游供应商的管控,并根据自身产品特点进行风险分析和管理,准备产品设计历史文件,积极参与到测评机构的具体方案制订中。另一方面,呼吸类医疗器械的研发和合规相关从业人员也需要关注到器械领域引入药品领域法规的趋势,尽早跨界学习了解药品相关的法规,更充分地理解呼吸气路的生物学评价要求,尽快让产品符合ISO 18562 系列标准的要求,保障患者的安全。

