日粮添加葡萄籽原花青素对断奶仔猪生长性能、血液指标及肠道损伤的影响
涂枫 郜平光 李琦 陈慧 张峰 陈锡山 方晓敏

摘要:为研究葡萄籽原花青素(GSP)对断奶仔猪生长性能、血液指标及肠道损伤的影响,选择144头21日龄苏农黑猪,随机分为3个处理组,即哺乳对照组、断奶对照组及断奶试验组,每组6个重复,每个重复8头哺乳仔猪。哺乳对照组采食母乳,断奶对照组和断奶试验组分别饲喂基础日粮及含有100 mg/kg GSP的试验日粮。试验期共计 7 d,结束时采集血液与空肠样本,用于生化指标检测。结果表明:(1)断奶导致仔猪21~28日龄平均日增质量显著降低(P<0.05),但日粮添加GSP对仔猪断奶后1周内的生长性能无显著影响(P>0.05)。(2)断奶对照组血液D-木糖含量和血浆超氧化物歧化酶(SOD)活性较哺乳对照组显著下降,而血浆二胺氧化酶活性与丙二醛(MDA)含量较哺乳对照组显著升高(P<0.05);经GSP干预后,上述现象得到明显改善(P<0.05)。(3)与哺乳对照组相比,断奶对照组空肠绒毛高度(VH)及其与隐窝深度的比值明显下降,黏膜SOD活性与还原型谷胱甘肽含量显著降低,黏膜MDA含量显著增多(P<0.05);与断奶对照组相比,饲喂GSP试验日粮的断奶仔猪空肠VH和黏膜SOD活性均得到明显提高,黏膜MDA含量显著减少(P<0.05)。(4)断奶显著抑制了断奶仔猪空肠超氧化物歧化酶2(SOD2)转录水平,上调了肿瘤坏死因子α和白细胞介素6 mRNA丰度(P<0.05);GSP显著提高了断奶仔猪空肠还原型辅酶Ⅰ/Ⅱ依赖性醌氧化还原酶1和SOD2 mRNA表达水平(P<0.05),但未影响细胞因子转录表达(P>0.05)。综上可知,日粮添加GSP可有效提高断奶仔猪血浆抗氧化能力,缓解肠道损伤并改善黏膜氧化还原状态。
关键词:断奶应激;仔猪;葡萄籽原花青素;肠道损伤;氧化还原状态;炎性反应
中图分类号:S816.7 文献标志码:A
文章编号:1002-1302(2023)13-0197-06
断奶是仔猪饲养过程中的重要环节,也是制约养猪生产效益的关键因素。早期断奶不仅能够缩短母猪产仔间隔,减少疾病传播风险,也可提高仔猪饲料报酬与胴体品质[1]。然而,由于仔猪在断奶后早期阶段的生长发育尚不成熟,肠道消化、吸收及代谢能力不足,正常的微生物系统也未建立,故易发生以腹泻、采食量降低及生长迟滞为主要特征的“断奶应激综合征”,给养猪生产造成不可忽视的经济损失[2]。因此,在饲料中添加能够提高仔猪抗应激能力、改善肠道功能的活性物质是缓解断奶应激综合征的有效途径之一。
原花青素是一类由不同数量的儿茶素或/和表儿茶素组成的多酚类化合物,广泛存在于各类植物中,具有较强的抗氧化、清除自由基、抗炎及改善机体代谢等生物学功能。在结构上,原花青素含有多个活性酚羟基,能够提供氢质子与超氧阴离子、羟自由基等活性氧反应,降低氧化应激的发生风险[3]。原花青素还可通过抑制炎症信号蛋白核因子Kappa B核移位,降低其对下游炎性介质的转录激活作用,从而发挥抗炎效果[4]。此外,有报道称原花青素可通过降低胆固醇与低密度脂蛋白水平,减少血栓形成,改善机体脂质代谢[5]。可见,在生产中适当应用原花青素或有助于缓解断奶应激对仔猪生长发育与肠道健康造成的不良影响。
近年来,葡萄籽原花青素(GSP)因其良好的抗氧化与抗炎效果,在食品营养与保健领域崭露头角。在啮齿动物中的研究发现,GSP可有效降低结肠炎小鼠结肠促炎性细胞因子的转录活性与蛋白水平,缓解黏膜氧化应激,改善绒毛形态与黏膜屏障功能[6]。Gao等试验发现,GSP能够缓解高脂饮食造成的小鼠肠道功能紊乱,提高黏膜完整性,减轻氧化应激与炎症[7]。临床试验表明,GSP不仅在抗氧化方面的应用效果优于维生素C和维生素E,还可抑制组胺分泌,发挥抗炎和抗过敏效果[8]。然而,目前GSP在仔猪生产领域的应用研究较少,其对断奶仔猪肠道氧化应激与炎性反应的调节效果也尚未明确。因此,本试验旨在研究日粮添加GSP对断奶仔猪生长性能、血液指标及肠道损伤的影响,为GSP在仔猪生产中的应用提供参考依据。
1 材料与方法
1.1 试验动物与试验设计
本试验于2022年5月在扬州市峰豪生态农业科技有限公司养殖场进行。试验选择144头体质量相近、健康状态良好的21日龄苏农黑猪(含黄淮海黑猪和外种猪血统的新培育品种),随机分为哺乳对照、断奶对照和断奶试验3个处理组,每组6个重复,每个重复8头仔猪,公母各半。哺乳对照组寄养于体况相近、泌乳能力良好的6头母猪,断奶对照组断奶并饲喂基础日粮,断奶试验组断奶并饲喂含有100 mg/kg GSP的试验日粮,试验期共计7 d。GSP购自天津尖峰天然产物研究开发有限公司,有效含量不低于95%,添加量参照前人研究报道[9-11]。日粮配制参考NRC(2012),日粮组成与营养水平见表1。所有仔猪自由饮水,断奶仔猪由专人定时饲喂,试验期间执行常规免疫程序。
1.2 样品采集
试验结束时,每个重复随机选择1头小公猪,按1 mL/kg体质量的剂量灌喂10% D-木糖溶液,1 h后于前腔静脉处采集10 mL血液,置于肝素钠抗凝管,离心后收集血浆待测。采集血液样本后,仔猪电击致晕、放血致死,迅速剖开腹腔,分离肠道组织,于空肠中间位置采集长度约为10 cm的肠段组织,取1.5~2.0 cm肠段置于4%多聚甲醛溶液,剩余肠段用剪刀剖开并使用载玻片刮取黏膜,样品装至冻存管内,液氮速冻后置于超低温冰箱保存。
1.3 生长测定
试验开始与结束当日清晨对所有仔猪进行空腹称质量,其间按重复记錄断奶对照与断奶试验组采食量,并计算平均日采食量(ADFI)、平均日增质量(ADG)与饲料效率(FE)。
1.4 血液指标
采用比色法检测血液D-木糖含量及血浆二胺氧化酶(DAO)与超氧化物歧化酶(SOD)活性、丙二醛(MDA)含量,所用试剂盒购自南京建成生物工程研究所,试验步骤严格按照试剂盒说明书执行。
1.5 肠道形态观察
空肠样品于室温下在4%多聚甲醛溶液中固定24 h,结束后分别使用梯度乙醇和二甲苯溶液进行脱水与透明处理,最后使用石蜡进行包埋。对石蜡包埋的组织样本进行切片,厚度为5 μm。采用苏木精-伊红对肠道切片进行常规染色,树脂封片后,在倒置的光学显微镜下成像,观察肠道形态结构并记录肠道绒毛高度(VH)和隐窝深度(CD),计算VH和CD比值(VH ∶CD)。
1.6 空肠氧化还原状态
按照南京建成生物工程研究所推荐的方法制备空肠黏膜匀浆液。称取约200 mg冻存样本,加入9倍体积且预冷的无菌生理盐水,在冰水浴条件下使用玻璃匀浆器进行充分研磨,于4 ℃条件下 4 000 r/min 离心15 min,收集上清液用于指标分析。采用南京建成生物工程研究所试剂盒测定黏膜匀浆液SOD与谷胱甘肽过氧化物(GSH-Px)活性及还原型谷胱甘肽(GSH)与MDA含量。
1.7 空肠基因表达
参照NCBI公布序列设计猪还原型辅酶Ⅰ/Ⅱ依赖性醌氧化还原酶1(NQO1)、血红素加氧酶1(HO1)、超氧化物歧化酶1(SOD1)、超氧化物歧化酶2(SOD2)、肿瘤坏死因子α(TNF-α)、白细胞介素1(IL-1β)、白细胞介素6(IL-6)、白细胞介素10(IL-10)及β-肌动蛋白(ACTB)基因的特异性引物(表2),序列由生工生物工程股份有限公司合成。取约100 mg空肠黏膜冻存样品,借助RNA提取试剂盒提取总RNA,检测RNA完整性及浓度;使用TaKaRa反转录试剂盒进行反转录,所获得的cDNA采用诺唯赞SYBR Green Master Mix试剂盒在Applied Biosystems公司StepOnePlusTM Real-Time PCR System進行RT-qPCR;ACTB为内参基因,结果以2-ΔΔCT法表示。
1.8 数据分析
采用SPSS 22.0统计学分析软件统计试验数据平均值与标准误,采用单因素方差分析和Tukey两两比较方法计算差异显著性,组间P值<0.05时为差异显著。
2 结果与分析
2.1 日粮添加GSP对断奶仔猪21~28日龄生长性能的影响
由表3可知,与哺乳对照组相比,断奶对照组和断奶试验组21~28日龄ADG均显著降低(P<0.05)。日粮添加GSP后,断奶试验组仔猪21~28日龄ADG较断奶对照组提高约8.8%,但未达显著水平(P>0.05)。此外,饲喂GSP对断奶仔猪21~28日龄ADFI和FE均无显著影响(P>0.05)。
2.2 日粮添加GSP对断奶仔猪血液D-木糖含量与血浆二胺氧化酶(DAO)活性的影响
由表4可知,断奶对照组仔猪血液D-木糖含量显著低于哺乳对照组,但血浆DAO活性显著高于哺乳对照组(P<0.05);断奶试验组仔猪血液D-木糖含量显著高于断奶对照组,而血浆DAO活性显著低于断奶对照组(P<0.05)。
2.3 日粮添加GSP对断奶仔猪血浆氧化还原状态的影响
由表5可知,与哺乳对照组相比,断奶对照组仔猪血浆SOD活性显著降低而MDA含量显著升高(P<0.05)。与此相反,饲喂含有GSP试验日粮的断奶仔猪血浆SOD活性较断奶对照组显著升高而MDA含量明显下降(P<0.05)。
2.4 日粮添加GSP对断奶仔猪空肠形态的影响
由表6可知,断奶对照组空肠VH与VH ∶CD显著低于哺乳对照组(P<0.05);添加GSP可显著提高断奶仔猪空肠VH(P<0.05),但对CD或 VH ∶CD 无显著影响(P>0.05)。
2.5 日粮添加GSP对断奶仔猪空肠氧化还原状态的影响
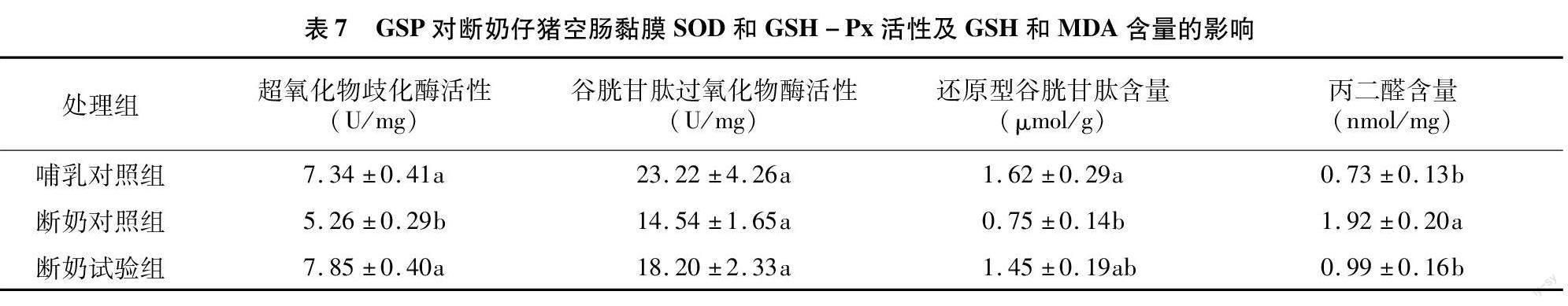
由表7可知,断奶对照组空肠黏膜SOD活性和GSH含量较哺乳对照组显著降低,但MDA含量较哺乳对照组明显增多(P<0.05)。饲喂含有GSP的试验日粮后,断奶仔猪空肠黏膜SOD活性显著高于饲喂基础日粮的断奶对照组,而且断奶试验组空肠黏膜MDA含量也显著下降(P<0.05)。此外,早期断奶或日粮干预对断奶仔猪空肠黏膜GSH-Px活性无明显影响(P>0.05)。
2.6 日粮添加GSP对断奶仔猪空肠黏膜抗氧化酶与细胞因子基因表达的影响
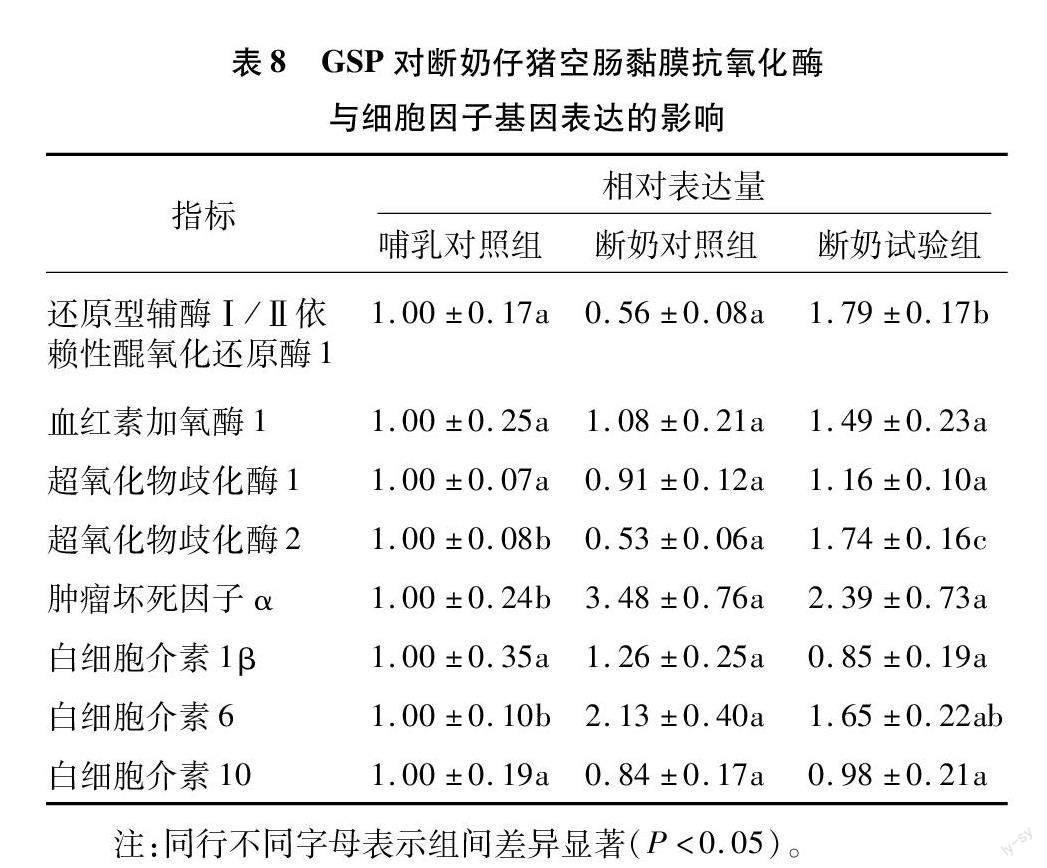
由表8可知,断奶对照组空肠黏膜SOD2 mRNA表达丰度较哺乳对照组显著减少,而TNF-α和IL-6 mRNA表达水平较哺乳对照组显著增多(P<0.05)。与断奶对照组相比,日粮添加GSP显著提高了NQO1和SOD2转录表达水平(P<0.05)。此外,早期断奶或日粮干预对断奶仔猪空肠黏膜HO1、SOD1、IL-1β或IL-10 mRNA表达丰度均无显著影响(P>0.05)。
3 讨论
3.1 GSP对仔猪断奶后早期阶段生长性能的影响
断奶期是仔猪生长发育的一个重要时期,此时肠道发育尚未完善,断奶应激易造成肠道功能紊乱,导致采食量不足、生长缓慢甚至停滞。重要的是,仔猪断奶后1周内体增质量与其出栏日龄有一定负相关性,ADG较高的仔猪达出栏体质量用时更短[1]。因此,改善仔猪断奶后早期阶段的生长性能对提高生猪养殖效率具有积极意义。本试验中,日粮添加100 mg/kg GSP对断奶仔猪21~28日龄ADG、ADFI或FE均无明显影响,这与以往的研究结果基本一致,即日粮添加50~150 mg/kg GSP对仔猪断奶后4周内的生长性能无显著改变[9-10]。但Park等在初始体质量约为19 kg的断奶仔猪上的试验发现,日粮添加100 mg/kg或200 mg/kg GSP均可显著提高保育阶段FE[9]。可见,GSP对生长性能的改善效果与饲喂时间及仔猪生长阶段等有关。
3.2 GSP对断奶仔猪肠道损伤相关血液指标的影响
在断奶过渡期,由于仔猪胃肠道功能无法完全适应饲料的消化,特别是固体饲料颗粒易导致肠道绒毛结构损伤,会直接影响营养物质的消化吸收效率。本试验发现,断奶导致仔猪血浆DAO活性显著升高,断奶对照组血浆DAO活性较哺乳对照组提高约2.5倍,提示断奶仔猪肠道黏膜受损严重。DAO是肠道黏膜上层绒毛的胞内酶,当绒毛受损时DAO会随细胞破裂而释放入血,故血浆DAO活性可反映肠道黏膜受损程度及其完整性。另外,与哺乳仔猪相比,断奶仔猪血液D-木糖含量显著降低,表明断奶仔猪肠道吸收能力下降,其原因或与断奶应激造成的肠道损伤有关。
本试验中,饲喂GSP显著降低了断奶仔猪血浆DAO活性,表明GSP能够改善断奶应激引起的肠道黏膜损伤。Li等试验发现,添加50~150 mg/kg GSP均可显著降低35日龄断奶仔猪血清DAO活性,且添加量为100 mg/kg时效果最优[11]。在免疫应激状态下,添加GSP也具有降低断奶仔猪血清DAO活性的作用,并达到统计学显著水平[12]。另外,本试验发现添加GSP可有效提高断奶仔猪血液D-木糖含量。GSP可能通过缓解断奶应激造成的仔猪肠道损伤,从而改善了仔猪肠道吸收能力。
3.3 GSP对断奶仔猪血浆抗氧化能力的影响
SOD和GSH-Px在调节机体氧化还原平衡方面起着重要作用。SOD可将氧毒性较高的超氧阴离子转化为毒性较低的过氧化氢,后者经GSH-Px催化生成无毒的水。因而,SOD和GSH-Px协同保护细胞免受自由基引发的氧化损伤,其活性可反映机体对自由基的清除能力[13]。本试验结果显示,断奶对照组血浆SOD活性较哺乳对照組显著降低,这可能是导致断奶仔猪血浆MDA含量较高的一个重要因素。MDA是脂质过氧化反应的终末代谢产物,其含量与机体氧化损伤程度呈正相关性[13]。当抗氧化酶活性降低时,自由基会因清除不及时而在细胞内大量积聚,导致细胞膜、脂蛋白及其他含脂质结构发生过氧化反应,对细胞稳态与生理功能造成负面影响,严重时会引发细胞凋亡[14]。
本试验发现,添加GSP显著提高了断奶试验组血浆SOD活性,降低了血浆MDA含量,表明GSP可有效提高断奶仔猪血浆抗氧化能力,对缓解断奶应激引发的机体氧化损伤具有积极作用。赵家奇等报道,日粮添加100 mg/kg或150 mg/kg GSP可显著提高断奶仔猪血清SOD和GSH-Px活性,降低血清MDA含量;当GSP添加量为150 mg/kg时,还可显著提高断奶仔猪血清总抗氧化能力(T-AOC)[15]。赵娇等研究发现,添加100 mg/kg GSP可有效缓解敌草快攻毒造成的断奶仔猪血清SOD、GSH-Px、T-AOC 和过氧化氢酶活性降低,并提高仔猪血清超氧阴离子和羟自由基的清除能力[16]。
3.4 GSP对断奶仔猪肠道形态、氧化还原状态与炎性反应的影响
肠道VH与CD是评价仔猪肠道发育水平的重要指标。以往的研究表明,断奶应激可造成仔猪肠道绒毛萎缩、脱落,隐窝增生[17]。绒毛变短、隐窝加深表明肠道黏膜上皮受损,会直接影响仔猪消化机能,导致营养物质的吸收能力下降,这也解释了断奶对照组血液D-木糖含量较哺乳对照组显著下降的现象。同时,肠道消化吸收能力不足还会导致大量未消化物质堆积,引发异常发酵、腹泻等负面问题,是造成仔猪断奶后生长受阻的关键因素。本试验中,日粮添加GSP显著提高了断奶仔猪空肠VH,这有助于提高营养物质的吸收面积,对改善仔猪肠道健康与生长性能具有一定积极影响。
诸多试验表明,早期断奶会诱导仔猪肠上皮细胞、固有层免疫细胞等细胞产生大量自由基,引发黏膜氧化损伤乃至肠道疾病、免疫力降低及生长性能下降等一系列负面问题[17-18]。本试验发现,断奶对照组空肠黏膜SOD活性与GSH含量较哺乳对照组显著降低而MDA含量明显升高,同时断奶对照组空肠黏膜SOD2转录表达也受早期断奶影响而明显减少,说明断奶应激导致仔猪肠道抗氧化能力下降,并伴有脂质过氧化损伤,这与前人的试验结果[17]基本一致。另外,本试验结果表明,饲喂断奶仔猪含有GSP的试验日粮可显著提高空肠黏膜SOD活性,抑制断奶应激诱导的MDA含量升高现象。值得注意的是,GSP干预有效提高了断奶仔猪空肠SOD2与NQO1 mRNA表达水平,其转录增多一定程度上解释了GSP改善断奶仔猪空肠氧化还原状态的机制。SOD2负责编码位于线粒体内的Mn-SOD,它对清除线粒体超氧阴离子、保护线粒体蛋白功能及维持线粒体膜电位等方面具有重要作用[19]。NQO1酶属于Ⅱ相代谢酶,在还原型辅酶Ⅰ或辅酶Ⅱ的参与下,对进入体内的外源毒性物质进行解毒代谢,保证机体的正常生理功能[20]。上述结果表明,添加GSP能够改善断奶仔猪肠道抗氧化和解毒能力,缓解断奶应激造成的黏膜脂质过氧化,这有助于修复断奶仔猪肠道形态损伤。
在断奶后早期阶段,由于仔猪免疫功能尚不完善,加之肠道形态损伤,致使微生物、病原体及其他有害物质易越过黏膜屏障、逃脱免疫监视,侵入机体后会引发肠道黏膜乃至系统性炎症[21]。本试验中,断奶对照组空肠促炎性细胞因子TNF-α和 IL-6 mRNA表达水平均显著高于哺乳对照组,表明此时断奶仔猪黏膜发生炎性反应,这与早期断奶引起的日粮类型转变、生理应激及肠道损伤等因素密切相关。然而,添加GSP对断奶仔猪空肠促炎性细胞因子转录表达水平无显著改变,提示GSP对仔猪肠道损伤的保护作用或通过其他途径实现。不过,在结肠炎小鼠模型上的试验发现,GSP处理可有效降低肠道炎症评分及黏TNF-α和IL-1β含量。造成上述试验结果差异的原因可能与炎症程度、动物种属及干预时间有关。
4 结论
本试验结果表明,日粮添加100 mg/kg GSP对仔猪断奶后1周内的生长性能无明显影响,但具有提高断奶仔猪血浆抗氧化能力、缓解肠道损伤及改善黏膜氧化还原状态等积极作用。
參考文献:
[1]Campbell J M,Crenshaw J D,Polo J. The biological stress of early weaned piglets[J]. Journal of Animal Science and Biotechnology,2013,4(1):19.
[2]Jayaraman B,Nyachoti C M. Husbandry practices and gut health outcomes in weaned piglets:a review[J]. Animal Nutrition,2017,3(3):205-211.
[3]Jayaprakasha G K,Singh R P,Sakariah K K. Antioxidant activity of grape seed (Vitis vinifera) extracts on peroxidation models in vitro[J]. Food Chemistry,2001,73(3):285-290.
[4]Ma X,Wang R H,Yu S T,et al. Anti-inflammatory activity of oligomeric proanthocyanidins via inhibition of NF-κB and MAPK in LPS-stimulated MAC-T cells[J]. Journal of Microbiology and Biotechnology,2020,30(10):1458-1466.
[5]Valls R M,Llauradó E,Fernández-Castillejo S,et al. Effects of low molecular weight procyanidin rich extract from French maritime pine bark on cardiovascular disease risk factors in stage-1 hypertensive subjects:randomized,double-blind,crossover,placebo-controlled intervention trial[J]. Phytomedicine,2016,23(12):1451-1461.
[6]Sheng K L,Zhang G H,Sun M,et al. Grape seed proanthocyanidin extract ameliorates dextran sulfate sodium-induced colitis through intestinal barrier improvement,oxidative stress reduction,and inflammatory cytokines and gut microbiota modulation[J]. Food & Function,2020,11(9):7817-7829.
[7]Gao Z P,Wu H,Zhang K Q,et al. Protective effects of grape seed procyanidin extract on intestinal barrier dysfunction induced by a long-term high-fat diet[J]. Journal of Functional Foods,2020,64:103663.
[8]Shi J,Yu J,Pohorly J E,et al. Polyphenolics in grape seeds-biochemistry and functionality[J]. Journal of Medicinal Food,2003,6(4):291-299.
[9]Park J C,Lee S H,Hong J K,et al. Effect of dietary supplementation of procyanidin on growth performance and immune response in pigs[J]. Asian-Australasian Journal of Animal Sciences,2014,27(1):131-139.
[10]Hao R R,Li Q H,Zhao J Q,et al. Effects of grape seed procyanidins on growth performance,immune function and antioxidant capacity in weaned piglets[J]. Livestock Science,2015,178:237-242.
[11]Li Q H,Yan H S,Li H Q,et al. Effects of dietary supplementation with grape seed procyanidins on nutrient utilisation and gut function in weaned piglets[J]. Animal,2020,14:491-498.
[12]Wu Y,Mo R,Zhang M,et al. Grape seed proanthocyanidin alleviates intestinal inflammation through gut microbiota-bile acid crosstalk in mice[J]. Frontiers in Nutrition,2021,8:786682.
[13]Zhang H,Chen Y,Li Y,et al. Medium-chain TAG attenuate hepatic oxidative damage in intra-uterine growth-retarded weanling piglets by improving the metabolic efficiency of the glutathione redox cycle[J]. British Journal of Nutrition,2014,112:876-885.
[14]Serbecic N,Beutelspacher S C. Anti-oxidative vitamins prevent lipid-peroxidation and apoptosis in corneal endothelial cells[J]. Cell and Tissue Research,2005,320:465-475.
[15]赵家奇,郝瑞荣,高俊杰,等. 葡萄籽原花青素对断奶仔猪免疫力和抗氧化功能的影响[J]. 山西农业大学学报(自然科学版),2016,36(10):735-739.
[16]赵 娇,周招洪,梁小芳,等. 葡萄籽原花青素及维生素E对氧化应激仔猪生长性能、血清氧化还原状态和肝脏氧化损伤的影响[J]. 中国农业科学,2013,46(19):4157-4164.
[17]Zhang H,Chen Y N,Chen Y P,et al. Comparison of the protective effects of resveratrol and pterostilbene against intestinal damage and redox imbalance in weanling piglets[J]. Journal of Animal Science and Biotechnology,2020,11:52.
[18]徐建雄. 不同斷奶日龄仔猪的氧化应激损伤及其机理研究[D]. 南京:南京农业大学,2014:39-40.
[19]Flynn J M,Melov S. SOD2 in mitochondrial dysfunction and neurodegeneration[J]. Free Radical Biology & Medicine,2013,62:4-12.
[20]Ross D,Siegel D. NQO1 in protection against oxidative stress[J]. Current Opinion in Toxicology,2018,7:67-72.
[21]易宏波. 抗菌肽CWA对断奶仔猪肠道炎症和肠道屏障功能的作用及其机制[D]. 杭州:浙江大学,2016:2-3.

