香菜多酚超声辅助提取工艺优化及其生物活性
张波,连芯,2,杨若琦,孙红艳*
(1.太原科技大学环境与资源学院,山西 太原 030024;2.太原科技大学化学工程与技术学院,山西 太原 030024)
果蔬组织中存在的酚类物质、类黄酮和花青素等植物次生代谢产物,与果蔬的色泽发育、品质和风味形成、抗逆性和抗病性等作用密切相关,还可影响果蔬的贮藏加工性能和营养价值[1]。其中,多酚类化合物已被列入天然抗氧化剂范畴,广义的多酚类化合物可分为黄酮类、酚酸、单宁、芪类和木脂素类,具有一定的抗氧化能力、抗癌作用以及抗炎、抗菌等多种生物活性[2-3]。
香菜,学名芫荽,是我国南北各地普遍食用的一种蔬菜,以其特殊香味而深受喜爱,主要食用器官是茎叶。香菜的营养丰富,含有丰富的胡萝卜素、维生素、铁、钙和磷等元素,具有较高的食用和药用价值,同时具有抗氧化、抑菌、抗肿瘤、抑制重金属、抗糖尿病和抗抑郁症等多种保健功能,可应用于食品、饲料添加剂和重金属吸附剂等领域[4-5]。香菜在食品中的应用研究多处于初始加工阶段,在香菜多酚的提取及其抗氧化活性方面仅有少量的研究。香菜中多酚的提取多采用亚临界水萃取法、微波辅助提取法和超声辅助提取法[6-8]。在天然抑菌剂方面,段斌等[9]对水提香菜精油抑菌作用的初步研究表明,其对部分微生物有较强的抑制作用。Kubo 等[10]证明了香菜中的挥发性化合物对霍乱沙门氏菌具有一定的抑菌活性,并分析了可能的抑菌原理。然而,在香菜多酚的提取工艺、抗氧化活性及抑菌活性等方面的研究均未得到很好的开发应用。
超声辅助提取法是利用超声波的空化作用、机械效应和热效应等加速有效物质的释放、扩散和溶解,显著提高提取效率的提取方法。其设备便宜、操作简单、提取时间短、多酚提取率高。
本研究以乙醇为溶剂,采用超声辅助提取法,通过单因素试验结合正交试验对香菜多酚的提取工艺进行优化,并对其抗氧化活性和抑菌活性进行分析,以期为进一步开发利用香菜提供参考。
1 材料与仪器
1.1 试验材料与主要试剂
新鲜香菜:市售;金黄色葡萄球菌(Staphylococcus aureus)(ATCC25923)、大肠杆菌(Escherichia coli)(ATCC 25322):上海博湖生物科技有限公司;无水乙醇、福林酚试剂、钨酸钠、钼酸钠、硫酸锂、浓盐酸、溴水、硫酸亚铁、双氧水、碳酸钠、邻二氮菲、维生素C、氯化钠、牛肉膏、蛋白胨、琼脂、氯化铁、醋酸钠、冰醋酸、硫酸、铁(III)-三吡啶三嗪(ferric-tri-pyridyl-triazine,Fe3+-TPTZ)(均为分析纯):国药集团化学试剂有限公司;磷酸缓冲溶液(pH7.4):生工生物工程(上海)股份有限公司;多酚标准品、没食子酸:西格玛奥德里奇(上海)贸易有限公司。
1.2 主要仪器设备
PX125DZH 电子天平:奥豪斯仪器(上海)有限公司;XFB 粉碎机:吉首市中诚制药机械厂;UV-2600i 紫外-可见分光光度计:山西凯米科技有限公司;5430R小型台式高速冷冻离心机:艾本德(中国)有限公司;THC-5B 实验室超声波提取机:济宁天华超声电子仪器有限公司;DHG-9075A 烘干机:上海合恒仪器设备有限公司。
2 方法
2.1 香菜多酚提取工艺优化
原料预处理:新鲜香菜去根洗净晾干,置于60 ℃烘箱烘干12 h 至恒重后,用粉碎机粉碎过40 目筛,避光密封于4 ℃冰箱保存备用。
多酚超声辅助提取法提取多酚:称取0.67 g 已预处理的香菜置于锥形瓶中,加70%乙醇至10 mL,用封瓶膜封口。超声提取温度60 ℃,功率100 W,3 次试验分别提取50、60、70 min 得到提取液,提取液分别在10 000 r/min 离心10 min,分别取上清液,即为香菜多酚提取液,置于4 ℃冰箱避光密封保存。
单因素试验:在文献和预试验的基础上[11-13],设定料液比1∶16(g/mL)、乙醇体积分数70%、提取时间70 min。分别考察料液比1∶10、1∶12、1∶14、1∶16、1∶18、1∶20、1∶22(g/mL),乙醇体积分数55%、60%、65%、70%、75%、80%、85%,提取时间40、50、60、70、80、90、100 min 对香菜多酚提取率的影响。
正交试验:在单因素试验结果基础上,以香菜多酚提取率为指标,选择料液比、乙醇体积分数和提取时间进行正交试验,正交试验设计见表1。

表1 试验因素水平Table 1 Experimental factor levels
2.2 香菜多酚浓度测定
采用福林酚法测定香菜多酚浓度[14-15],以没食子酸为标准品绘制标准曲线并计算香菜多酚浓度及提取率。
没食子酸标准曲线的绘制:依次量取没食子酸标准液0、0.25、0.50、0.75、1.00、1.25、1.50、1.75 mL 于25 mL具塞试管中,分别加入1 mL 福林酚试剂,摇匀后,再加入2 mL 12%Na2CO3溶液,用蒸馏水定容至25 mL,摇匀。室温避光反应2 h 后,在765 nm 波长下分别测定吸光度。以没食子酸标准溶液的浓度为横坐标,吸光度为纵坐标,得到标准曲线方程:y=120.11x-0.004 5(相关系数为0.992)。
香菜多酚浓度及提取率测定:取0.25 mL 香菜提取液,加1 mL 福林酚试剂,摇匀后再加入2 mL 12%Na2CO3,最后用蒸馏水定容至25 mL,摇匀。室温避光反应2 h,测定765 nm 处吸光度。多酚浓度按照没食子酸标准曲线方程计算,多酚提取率按以下公式进行计算,试验3 次取平均值。
式中:Y 为多酚提取率,mg/g;C 为多酚浓度,mg/mL;V 为提取液体积,0.25 mL;W 为原料质量,0.67 g。
2.3 香菜多酚抗氧化活性分析
2.3.1 铁离子还原/抗氧化能力(ferric reducing/antioxidant power,FRAP)测定
采用FRAP 法测定总抗氧化能力[16],其原理是酸性条件下抗氧化物可以还原Fe3+-TPTZ 产生蓝色的Fe2+-TPTZ,随后在593 nm 处测定吸光度即可获得样品的总抗氧化能力。以硫酸亚铁(FeSO4)作标准样品绘制标准曲线:y=0.000 7x+0.034 6(相关系数为0.990 3;式中:y 为吸光度;x 为FeSO4浓度,μmol/L)。取2.7 mL FRAP 工作液进行预热,分别加入浓度为0.1、0.2、0.3、0.4、0.5、0.6 mg/mL 的香菜多酚提取液0.3 mL,静置10 min,于593 nm 处测吸光度。6 组试验均重复3 次,求平均值,计算得到FeSO4浓度,即FRAP 值,并与维生素C(VC,乙醇溶解)的FRAP 值作比较。
2.3.2 羟基自由基(·OH)清除能力测定
量取2 mL 0.75 mmol/L 邻二氮菲溶液,加2 mL 150 mmol/L、pH7.4 的磷酸缓冲溶液,混匀。再加2 mL 0.75 mmol/L 硫酸亚铁,混匀。最后加1 mL 0.01%H2O2,蒸馏水定容至10 mL,作为损伤管。37 ℃水浴60 min,测量539 nm 处吸光度Ap。未损伤管中用1 mL 蒸馏水代替H2O2,其他同损伤管,测得的吸光度记为Ab。样品管以0.5 mL 香菜多酚提取液(0.1、0.2、0.3、0.4、0.5、0.6 mg/mL)样品代替损伤管中的蒸馏水,蒸馏水定容至10 mL,测得的吸光度记为As,6 组试验均重复3 次,并与维生素C(VC,乙醇溶解)的羟基自由基清除率进行比较。羟基自由基清除率(R,%)的计算公式如下[17]。
2.4 香菜多酚抑菌活性试验
采用滤纸片法测定香菜多酚提取液对大肠杆菌(G-)和金黄色葡萄球菌(G+)的抑菌活性[7,18]。将经过2 次活化的菌种于恒温培养箱培养至对数生长期,通过平板计数法使菌种浓度为108CFU/mL。将香菜多酚提取液稀释成0.1、0.2、0.3、0.4、0.5、0.6 mg/mL 抗菌液。分别移取以上抗菌液10 μL 垂直滴于6 组直径为10 mm 的灭菌圆滤纸上,备用。在超净台中分别向3 个培养皿中倒入培养基并冷却。移取100 μL 经扩大培养后的菌种均匀涂布于固体培养基上制成3 个含菌平板。将6 组含不同浓度抗菌液的滤纸按照浓度从小到大依次放入到平板中,每个平板包含2 张不同浓度的抗菌液滤纸和1 张空白对照滤纸,呈正三角平铺间隔放入。以灭菌蒸馏水作为对照,放置于37 ℃培养箱培养24 h 后测量抑菌圈直径。重复3 次取平均值。
2.5 统计分析
本研究中所有试验均重复3 次,所有数据均以平均值±标准差表示。采用SPSS 18.0 进行统计学分析,采用Origin 2022 作图。
3 结果与分析
3.1 单因素试验结果分析
3.1.1 料液比对香菜多酚提取率的影响
料液比对多酚提取率的影响见图1。
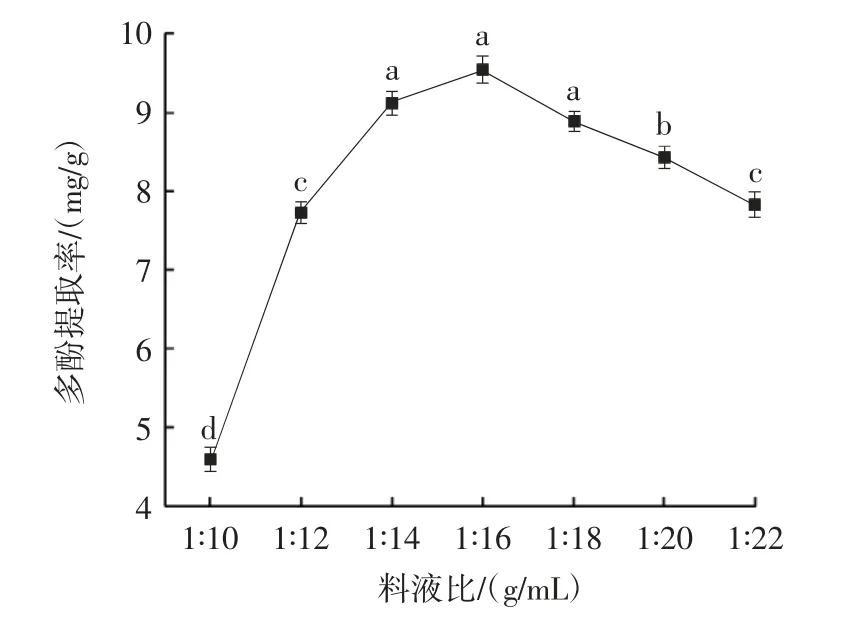
图1 料液比对多酚提取率的影响Fig.1 Effect of material-to-liquid ratio on the extraction rate of polyphenols
由图1 可知,多酚提取率随溶剂用量增加,呈先上升后缓慢降低的趋势,在料液比为1∶16(g/mL)时,达到最大值。这是由于当溶剂用量较少时,提取不完全,多酚提取率较低。随着溶剂用量增多,香菜中的多酚逐渐浸出,当料液比为1∶14、1∶16、1∶18(g/mL)时,多酚的提取率较高。随着溶剂继续增加,不仅多酚浸出,香菜中的杂质也溶出,使得提取液中的多酚提取率降低[19]。因此,选择料液比1∶16(g/mL)左右为宜。
3.1.2 乙醇体积分数对香菜多酚提取率的影响
乙醇体积分数对多酚提取率的影响见图2。

图2 乙醇体积分数对多酚提取率的影响Fig.2 Effect of ethanol volume fraction on the extraction rate of polyphenols
由图2 可知,多酚提取率随乙醇体积分数的增大呈先升高后降低的趋势。当乙醇体积分数为55%时,多酚的提取率仅为5.02 mg/g。当乙醇体积分数增大时,香菜多酚提取率逐渐升高。乙醇体积分数为70%时,多酚提取率达到最大值,为8.06 mg/g。随着乙醇体积分数继续增大,多酚提取率呈现逐渐降低的趋势。这是由于当乙醇体积分数增大时,较易溶出香菜中醇溶性杂质脂类物质,反而使得多酚提取率降低[20]。因此,乙醇体积分数70%左右为宜。
3.1.3 提取时间对香菜多酚提取率的影响
提取时间对多酚提取率的影响见图3。

图3 提取时间对多酚提取率的影响Fig.3 Effect of extraction time on the extraction rate of polyphenols
由图3 可知,当提取时间小于70 min 时,提取率与提取时间呈正相关;当提取时间大于70 min 时,提取率与提取时间呈负相关。当提取时间为70 min 时,香菜多酚提取率达到最大值,为9.02 mg/g。当提取时间较短时,香菜多酚浸出不完全,提取率较低。随着时间在一定范围内的不断延长,香菜多酚提取率逐渐升高,达到最大提取率。当提取时间继续延长时,香菜多酚易被氧化,且香菜中的其他物质也不断溶出,导致多酚提取率降低。因此,合适的提取时间为70 min 左右。
3.2 正交试验
基于上述单因素试验结果,依次确定料液比、乙醇体积分数和提取时间的正交试验水平,试验设计和结果见表2。

表2 正交试验结果Table 2 Results of orthogonal test
由表2 极差R 值可知,各影响因素对香菜多酚提取率的影响从大到小依次为料液比、乙醇体积分数、提取时间。香菜多酚超声辅助提取最优工艺条件:料液比1∶16(g/mL)、乙醇体积分数75%、提取时间60 min,为正交试验表中的第6 组,最优条件下多酚提取率为(13.11±0.19)mg/g。
3.3 香菜多酚抗氧化活性结果分析
3.3.1 香菜多酚总抗氧化能力
香菜多酚总抗氧化能力见图4。

图4 香菜多酚提取液总抗氧化能力Fig.4 Total antioxidant capacity of cilantro polyphenol extracts
由图4 可知,香菜多酚提取液和VC的FRAP 值均随浓度增大而增加,且同等浓度下香菜多酚提取液的FRAP 值均小于VC。说明香菜多酚具有一定的抗氧化能力,但是抗氧化能力低于VC。
3.3.2 香菜多酚羟基自由基清除能力
香菜多酚羟基自由基清除能力见图5。
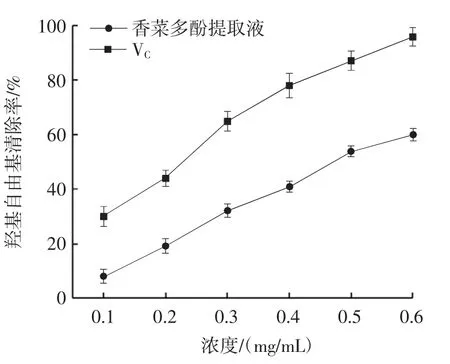
图5 香菜多酚提取液羟基自由基清除率Fig.5 Hydroxyl radical scavenging by cilantro polyphenol extracts
由图5 可知,香菜多酚提取液对羟基自由基具有一定清除作用,且呈现一定的量效关系。但与VC的羟基自由基清除能力相比,还具有一定差距。试验中当溶液浓度为0.6 mg/mL 时,VC的羟基自由基清除率达90%以上,而香菜多酚的羟基自由基清除率仅为60%左右。
3.4 香菜多酚抑菌活性
香菜多酚抑菌活性见表3。

表3 不同浓度香菜多酚提取液抑菌圈直径Table 3 Diameter of the inhibition circle for different concentrations of cilantro polyphenoe extracts
由表3 可以看出,香菜多酚提取液对大肠杆菌和金黄色葡萄球菌均有一定的抑制作用。相同浓度的多酚提取液,对金黄色葡萄球菌的抑制强度大于对大肠杆菌的抑制强度。0.6 mg/mL 的香菜多酚提取液对大肠杆菌进行活性测试的抑菌圈直径为(6.76±0.02)mm,对金黄色葡萄球菌活性测试的抑菌圈直径为(7.04±0.02)mm。抑菌圈直径与香菜多酚提取液浓度呈正相关,随着香菜多酚提取液浓度升高,抑菌圈直径增大。
4 结论
本研究通过单因素试验和正交试验确定了超声辅助提取香菜多酚的最优工艺条件:料液比1∶16(g/mL)、乙醇体积分数75%、提取时间60 min,此时,提取率为(13.11±0.19)mg/g。影响效果依次为料液比>乙醇体积分数>提取时间。通过FRAP 法和邻二氮菲法测定香菜多酚的抗氧化能力和羟基自由基清除能力,结果显示,香菜多酚具有一定的抗氧化活性,且抗氧化能力和羟基自由基清除率与提取液浓度呈正相关。最后,对香菜多酚提取液的抑菌活性进行了研究,证明香菜多酚对大肠杆菌和金黄色葡萄球菌均有一定抑制作用。抑制强度大小排序为对金黄色葡萄球菌>大肠杆菌;且抑菌圈直径与香菜多酚提取液浓度相关。本研究为香菜多酚的开发和应用提供了理论依据。

