乳酸菌作为生物活性物质体内递送载体的研究进展
陈韫慧,夏永军,宋 馨,艾连中,王光强
(上海理工大学健康科学与工程学院,上海 200093)
生物活性物质可以调节人体生命活动,维持人体健康,包括蛋白质、多肽、多酚、黄酮等多种化合物,1982年美国食品和药品监管总局批准了重组人胰岛素的使用,促进了生物活性分子在疾病治疗中的应用[1]。蛋白质和多肽等生物活性分子经口服传递时要经受胃介质的酸性和胃肠道环境中分泌的各种降解酶等的破坏,使其功效的发挥具有极大难度[2-3],因此,生物活性物质的递送成为热门研究领域。为通过口服途径有效传递蛋白质和多肽等活性物质,许多策略被用于提高其口服生物利用度,如化学改性、使用pH敏感性肠溶衣包埋、添加蛋白酶抑制剂等[4]。然而,这些方法都存在局限性:由于胃肠道环境中pH值变化范围广、降解酶种类多样,肠溶衣和蛋白酶抑制剂的可靠性和效率不能确定,而化学改性方法存在降低目标蛋白生物活性的可能性[5]。为克服上述问题,细菌常被用作体内递送载体以防止活性物质在消化道运输过程中的快速降解[6]。本文将重点讨论乳酸菌作为生物活性物质体内递送载体的研究进展。
乳酸菌在自然界中广泛存在,常定植于植物和哺乳动物肠黏膜,在生长过程中释放共轭亚油酸、多胺、细菌素和酚类化合物衍生物等生物活性化合物,具有调节肠道微生态平衡、促进健康的作用[7-9]。由于存在长期的安全食用历史,乳酸菌通常被认为是一种安全的食品级载体。同时,易于获得的参考基因组和高通量多组学分析手段提供了乳酸菌功能基因和调控元件的关键信息;由此开发的一系列遗传工具使乳酸菌作为细菌载体的可操作性和兼容性极大增强[10-11]。在乳酸菌载体中,乳酸乳球菌与乳酸杆菌中的一些属(植物乳杆菌、干酪乳杆菌、嗜酸乳杆菌等)应用最为广泛。乳酸乳球菌作为一种在胃肠道中短暂定植的模式微生物,具有成熟的质粒载体与表达系统,是生物活性物质生产的理想宿主。而乳酸杆菌在胃肠道内定植时间更长,并且可以引起强烈的局部和全身免疫反应,是一种很有潜力的黏膜递送载体[3]。本文聚焦于蛋白质和多肽这类易被破坏的生物活性物质,首先介绍乳酸菌递送载体中影响基因表达的重要因素,包括启动子、复制子等,然后详细论述生物活性物质不同的表达形式,最后介绍乳酸菌递送系统在各类疾病中的应用情况。
1 乳酸菌表达系统
乳酸菌表达系统中的重要元件包括:具有相关核糖体结合位点的启动子、用于筛选阳性重组菌株的选择性标记以及用于维持乳酸菌宿主系统中重组质粒的复制子。这些元件的功能与效率将直接影响乳酸菌载体的稳定性和承载能力。
1.1 启动子
启动子控制基因表达起始时间和表达程度,是表达载体的关键元件,可以分为组成型启动子和诱导型启动子两种。P23、P32、P44等都是乳酸菌中常见的组成型启动子[12]。组成型启动子的调控不受外界条件影响且基因的表达具有持续性,因此当需要在体内进行原位生产或需要稳态基因表达时一般使用组成型启动子[13]。Hazebrouck等[14]将牛β-乳球蛋白基因插入到干酪乳杆菌染色体中内源性的组成型启动子下游并成功表达,在第1天与第6天灌胃重组菌株后连续收集小鼠的新鲜粪便并进行分析,结果显示该重组菌株可有效定植肠道,且在小鼠体内β-乳球蛋白可持续分泌10 周以上,有效治疗了小鼠的过敏症状。
诱导型启动子可识别特定转录因子激活基因表达,在短时间内达到生物活性分子的高水平表达[15]。Peirotén等[16]介绍了乳酸菌中用于基因表达的诱导型启动子,常见的有细菌素诱导型启动子、应激诱导型启动子、碳水化合物诱导型启动子以及锌诱导型启动子等。其中,基于双组分系统开发的细菌素诱导型启动子通过添加相应的肽信息素诱导基因表达,应激诱导型启动子通过pH值、温度、胆汁盐或NaCl等环境胁迫条件诱导基因表达,而碳水化合物诱导型启动子通常来源于碳水化合物相关代谢途径的操纵子,比如乳糖诱导型启动子。尽管使用诱导型启动子控制生产的生物活性物质可以在体内发挥作用,但在使用这些重组菌株之前需事先添加诱导剂以诱导蛋白质的生产,不能实时控制菌株中基因的表达。因此,应激诱导型这类不需要外部添加诱导剂、可以响应体内环境信号并进行原位生产活性分子的启动子具有极高的应用潜力。Zhao Chenming等[17]构建了通过酸诱导型启动子P170表达草酸盐脱羧酶的重组乳酸菌并灌胃大鼠,结果表明酸诱导启动子P170显著缓解了高草酸尿症的症状。Chien等[18]在大肠杆菌中将环境响应型启动子如厌氧诱导启动子、乳酸盐诱导型启动子及pH诱导型启动子与细菌生长相结合,通过逻辑门电路构建多路复用的生物防护回路。未来相似的设计可以应用于乳酸菌,通过逻辑门设计实现未来特定生理区域的精确定位,控制生物活性分子的有效表达,提高疗效并避免脱靶毒性。
1.2 选择性标记
大多数质粒依靠抗生素标记物,如红霉素和氯霉素抗性基因,进行转化子选择和质粒维持。然而,抗生素基因的存在会增加抗生素耐药性转移到菌株外部环境的风险。出于生物防护的需要,近些年研究人员开发了多种基于非抗生素显性选择标记或互补选择标记替代常规抗生素标记物的方法。非抗生素显性选择标记主要通过细菌素耐药性或重金属耐受性基因进行选择,如乳酸链球菌素抗性基因以及一些耐镉离子、铜离子的抗性基因[19]。值得注意的是,重金属抗性标记的使用会在菌体培养阶段引入有毒害作用的重金属离子,且在胃肠道中很难找到相关环境维持质粒的稳定性,因此,这种标记并不适用于生物活性物质的体内递送。
互补标记通常需要在宿主染色体基因中敲除特定代谢途径中重要的或赋予其某种表型特性的关键基因,同时在质粒载体上携带相应的互补基因[20]。因此,这种标记只能在对特定菌株进行基因组编辑之后才能使用。特别的是,糖类互补标记不需要对基因组进行编辑,而是通过将乳酸菌自身不能发酵的糖作为单一碳源并表达其互补基因以维持菌株的生长和质粒的稳定性[21]。在各类互补标记中,丙氨酸消旋酶使用最为广泛,该基因可以催化L-丙氨酸与D-丙氨酸的相互转化,而D-丙氨酸是细菌肽聚糖合成和脂质酸代谢中的关键底物[22]。II型猪圆环病毒的衣壳蛋白[23]、壳聚糖酶[24]、治疗蛋白P8[25]以及草酸盐脱羧酶[22]等重组蛋白都已在含丙氨酸消旋酶互补标记的乳酸菌中成功表达。除此之外,Yin Sheng等[26]将植物乳杆菌的胆盐水解酶作为互补标记,将脱氧胆酸钠作为选择胁迫来源添加到培养基中以筛选转化子,结果显示重组菌株在生长50 代后质粒丢失率仅为0.1%。由于胃肠道环境中存在多种胆盐,该互补标记可以作为乳酸菌递送载体构建中的一种选择,但需要考虑胆盐水解酶的过量表达是否存在潜在的健康威胁。
1.3 复制机制
独立的复制系统是在生产过程中维持基于质粒编码蛋白表达系统的基本要求之一。乳酸菌中存在两种常见的质粒复制机制,分别为滚动循环复制(rollingcircle replication,RCR)和θ复制。RCR需要复制起始蛋白(replication initiation protein,Rep)、双链起源(double-strand origin,DSO)和单链起源(single-strand origin,SSO)这3 种遗传元件,而θ复制需要Rep、复制起源和宿主编码的聚合酶[27]。RCR型质粒通常体积较小并具有多个拷贝,其复制通过质粒编码的Rep与DSO的特异性结合而启动并产生单链DNA复制中间体,然后启动SSO滞后链合成,转化为双链DNA[28]。θ复制型质粒的复制子种类多样,质粒的DNA合成可以是单向或双向,并且可以从多个位点开始,与RCR质粒相比,由于其不存在中间复制体,θ复制型质粒的结构和分离稳定性都较高,适合作为大型DNA片段的载体[29]。近年来,乳酸菌载体中使用较多的几种复制子分别是RCR型的pWV01、pSH71以及θ复制型的pCI305、pMB1和pAMβ1[27]。例如,基于高拷贝数pSH71重复子开发的pNZ系列载体和诱导表达型的pSIP系列载体已广泛用于乳酸菌中[30]。目前,对于乳酸菌质粒复制子和穿梭载体的开发仍在进行中。Eom等[31]对明串珠菌CB2567的θ复制型质粒pCB42进行表征并构建大肠杆菌和乳酸菌的穿梭载体,在植物乳杆菌中成功表达报告蛋白β-半乳糖苷酶,可以作为乳酸菌蛋白表达和递送的工具。
2 生物活性物质的表达形式
生物活性物质在乳酸菌中的表达形式主要有3 种:在细胞质中表达、分泌表达以及通过表面展示技术锚定在乳酸菌的细胞膜或者细胞壁上。不同的表达形式会影响功能蛋白或肽段的作用效果,但目前哪种表达形式效果最佳仍没有定论,需要在具体的研究中综合考虑。
2.1 胞内表达
在传统的细胞内表达策略中,重组蛋白在细胞质中积累并需要通过外部机械作用或化学方法将其释放,这些程序可能导致蛋白质失活并使下游纯化过程复杂化。一些研究表明,乳酸菌递送载体在肠道中经各类消化酶、抗菌肽、噬菌体处理或与其他细菌竞争后可被裂解并释放细胞内生产的异源蛋白[32]。例如,罗伊氏乳杆菌VPL1014的前噬菌体在胃肠道运输过程中被激活,促使细菌裂解并释放胞内积累的瘦素蛋白[33]。Grangette等[34]使用具有细胞壁生物合成缺陷(丙氨酸消旋酶基因突变)的重组乳酸菌递送胞内抗原后发现,其免疫原性较野生菌株更强,这也证明了细胞裂解递送策略的可行性。但这种方法需要考虑胞内蛋白的生产浓度以及可溶性,并且很多异源蛋白对宿主具有毒性,无法在胞内大量积累[35]。
2.2 分泌表达
乳酸菌具有一个高效的分泌表达系统,分泌蛋白可与机体细胞相互作用并发挥治疗效果。分泌表达策略需要在目标蛋白N端起始位置加入信号肽(signal peptide,SP)序列,其可以将相应的蛋白质或多肽引导至细胞质膜并分泌到外部环境。SP通常具有保守的三区结构,分别是带正电荷的氨基末端N区、中央的疏水核心H区和包含信号肽酶识别位点的极性羧基末端结构域C区[36]。基于深度递归神经网络和隐马尔科夫模型开发的网站SignalP常用于预测SP的切割位点和跨膜螺旋[37]。由于不同SP在膜转运过程中的输送效率不同,其与靶蛋白组合后mRNA转录本的结构稳定性也不同,因此筛选靶蛋白的最佳SP序列是提高分泌效率的关键步骤[38-39]。
目前,来自乳酸乳球菌分泌蛋白Usp45的SP是乳酸菌中利用最广泛的SP之一,其他较为常见的还有来自化脓性链球菌M6蛋白和短乳杆菌S层蛋白的SP[40]。研究发现天然SP与异源SP相似或具有更高的分泌效率[41]。Mathiesen等[42]基于植物乳杆菌的全基因组序列测试了76 种假定的内源SP功能特性,发现82%的SP具有分泌信号的作用。Chen等[43]选择来自植物乳杆菌的155 种预测SP和来自乳酸片球菌的110 种预测SP,通过双重复子策略和DNA组装技术构建穿梭载体并建立高通量细胞文库,成功鉴定了12 种植物乳杆菌SP和8 种乳酸片球菌SP。这些SP丰富了构建乳酸菌分泌表达载体的工具箱。表1中所示为来源于不同宿主的SP在分泌异源蛋白质中的应用情况。

表1 使用不同来源的SP分泌表达功能蛋白Table 1 Secretory expression of functional proteins using signal peptides from different sources
2.3 表面展示
活性分子分泌后完全暴露于体内恶劣的胃肠道环境与各种蛋白水解酶中,而乳酸菌的单细胞膜和相对较厚的细胞壁为靶蛋白锚定在细胞表面从而降低暴露程度提供了机会。许多研究均表明乳酸菌的表面展示技术可以提高异源蛋白质的产量和作用效果,特别是在递送抗原时能够更好地诱导特定的系统性免疫反应和黏膜毒性细胞免疫反应[51]。当靶蛋白从细胞内易位到胞外后可以通过多种方式锚定在细胞表面,如可以使用脂蛋白锚或使用分选酶通过LPXTG基序共价结合到细胞表面,也可以通过结合结构域进行非共价连接[52]。使用不同的锚定元件会使靶蛋白的亚细胞定位发生变化。由于嵌入细胞表面的程度可能会影响蛋白的作用效果,研究人员需要根据靶蛋白预期暴露程度选择不同的锚定元件[53-54]。
脂蛋白锚的N端SP末尾存在脂质盒基序,脂蛋白易位后SP被脂盒特异性信号肽酶SPase II切割,脂蛋白将共价结合到细胞膜的磷脂双分子层[52]。Zadravec等[55]评价了来自乳酸乳球菌的碱性膜蛋白A(basic membrane protein A,BmpA)作为脂蛋白锚的能力。作为显示IgG结构域的锚点,BmpA蛋白在其C末端被截断并由小到大产生了9 个变体,其在截断44 个残基后信号最强,随着蛋白分子的逐步缩短,表面展示能力逐步降低,这表明融合蛋白中脂蛋白锚本身的长度在易位和结合过程中十分重要。LPXTG基序的蛋白含有C端细胞壁分选信号,其序列为亮氨酸(L)、脯氨酸(P)、X(任何氨基酸)、苏氨酸(T)和甘氨酸(G),当N端SP通过分泌途径转运到细胞外时,其带电尾部的疏水区域仍固定在细胞膜上,分选酶在甘氨酸和苏氨酸残基之间切割使蛋白解离并共价结合至细胞壁[56-57]。已有研究对比了脂蛋白锚和LPXTG锚对靶蛋白的作用效果。Kuczkowska等[58]利用来自植物乳杆菌的脂蛋白锚Lp_1261和LPXTG锚Lp_2578成功展示了结核分枝杆菌的AgE6抗原,并证明了其在黏膜免疫疫苗中的应用潜力;此外,Kuczkowska等通过比较两种锚点的亚细胞定位与免疫原性的关系,发现使用脂蛋白锚的融合蛋白嵌入了细胞壁内部,并在鼻内和口服黏膜递送中均引起更强的特异性免疫应答,而使用LPXTG锚点后荧光显示在细胞壁表面[58]。
非共价锚定策略不仅可以选择乳酸菌作为重组蛋白表达的宿主,含有非共价锚定结构域的融合蛋白还可以在大肠杆菌等表达菌株中生产并纯化,然后反式锚定到野生型乳酸菌菌株中,其过程如图1所示[59]。非共价的表面显示系统需要为靶蛋白选择合适的细胞壁锚定基序。Pfam数据库中已描述了几种可以与细菌肽聚糖结合的细胞壁结构域。这些结构域的长度在20~200 个氨基酸残基之间,可含有多个重复序列,并且可以位于融合蛋白的中心、N端或C端[60]。LysM赖氨酸基序的氨基酸残基数为42~65,多以重复序列的方式出现,可特异性非共价结合到肽聚糖的N-乙酰葡萄糖残基上,是最为常见的一种细胞壁结合域[61]。来自发酵乳杆菌温带噬菌体φPYB5的内溶素Lyb5蛋白C末端的3 个假定LysM重复基序与靶蛋白融合后可与嗜热链球菌、植物乳杆菌、乳酸乳球菌等多种乳酸菌表面结合,具有作为新型锚点的潜力[62]。另外,SH3结构域多发现于厚壁菌门的细菌中,有多个亚型且不同亚型的结构域与细胞壁结合的靶点有所不同,如SH3_5可结合肽聚糖的五聚糖肽桥,而SH3_6与肽聚糖的交联茎肽发生相互作用[63]。其他推定的结构域如ChW结构域、WXL结构域、CPL-7结合域等在乳酸菌表面展示中的报道较少。Plavec等[64]筛选了来自乳酸菌与其噬菌体的LysM、CW_1、Cpl-7、WxL、SH3和ChW等15 个结构域的结合效率,其中ChW结合域显示出良好的锚定适用性。更多潜在的细胞壁结构域还有待研究者开发。
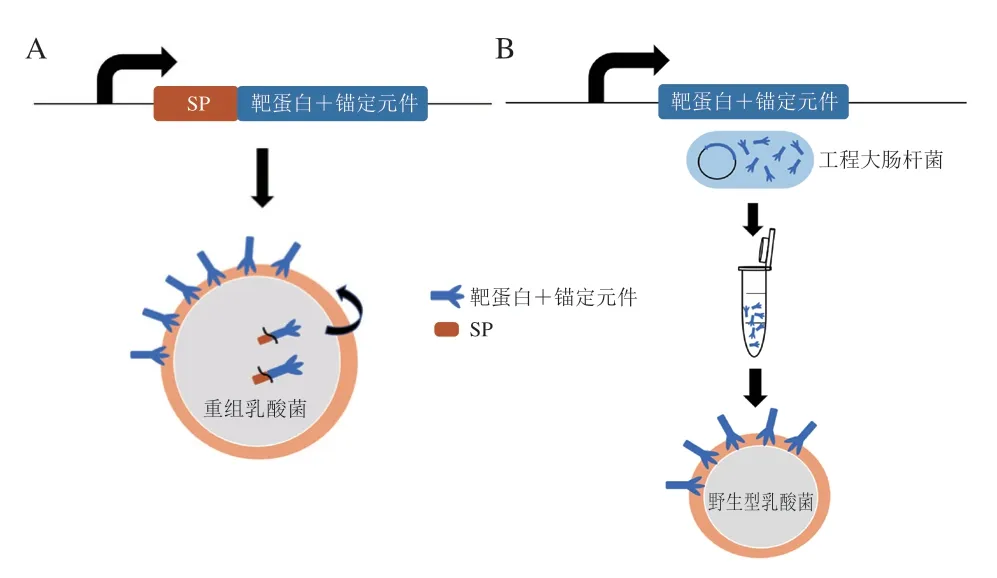
图1 常见乳酸菌表面工程(A)与反式乳酸菌表面工程(B)的区别Fig.1 Difference between common lactic acid bacterial surface engineering (A) and trans lactic acid bacteria surface engineering (B)
3 乳酸菌呈递系统在各类疾病中的应用
3.1 黏膜感染
由于黏膜表面不断暴露于病原体和抗原,许多感染因子或抗原可以通过黏膜穿透身体并感染呼吸道和胃肠道,从而导致高发病率和疾病风险[65]。口服或鼻内接种基于乳酸菌的疫苗是控制黏膜感染的一种有前途的方法,乳酸菌可以在免疫原性和反应原性之间取得理想的平衡,通过在血液和黏膜部位诱导强烈的体液和细胞免疫反应以有效地实现免疫激活[66]。乳酸菌的黏膜疫苗可以避免抗原降解并促进其在胃肠道的摄取,刺激适应性免疫反应,而口服抗原在许多研究中只能观察到耐受性免疫反应[67]。但这些重组乳酸菌疫苗的有益效果根据产生的抗原、使用的载体菌株和所针对的不同传染病而存在较大差异。表2罗列了近年来基于乳酸菌载体开发的针对不同病原体的黏膜免疫疫苗。
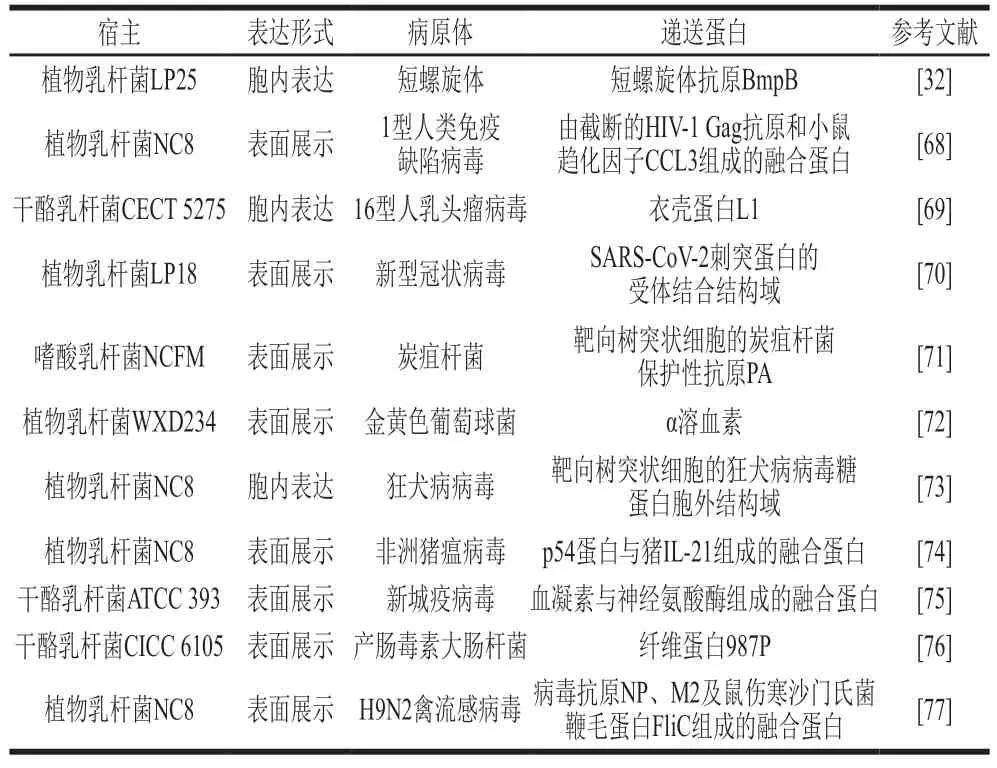
表2 乳酸菌黏膜免疫疫苗Table 2 Mucosal immunization vaccines based on lactic acid bacteria
随着乳酸菌疫苗平台的持续开发,增强疫苗的保护性免疫原性已成为一个关键挑战。黏膜免疫诱导位点组成黏膜相关淋巴网状组织网络并向黏膜效应器部位提供连续的记忆B细胞和T细胞,需要各种策略提高乳酸菌载体将抗原递送到免疫诱导位点的效率[78]。树突状细胞是研究最为广泛的抗原递送靶标,其在细胞表面和内部具有专门的模式识别受体,在捕获、处理和呈递抗原方面起核心作用[79]。树突状细胞能够与B细胞和T细胞相互作用,调节先天性和适应性免疫反应,介导B细胞的IgA类切换,sIgA、Th1和细胞毒性淋巴细胞诱导增加并诱导整合素α4β7的分泌[80]。乳酸菌疫苗的靶向性主要通过特异性树突状细胞结合肽与抗原的融合表达实现,而树突状细胞结合肽的筛选则是通过噬菌体表面显示技术在体外进行[81]。多项研究证明乳酸菌疫苗中树突状细胞结合肽的存在可以增加体内sIgA和血清IgG并引起潜在的免疫增强作用,但其效率会受到树突状细胞肽自身靶向性、抗原刺激水平及乳酸菌呈递抗原的方式影响[82-83]。微折叠细胞(M细胞)是黏膜相关淋巴组织特化的上皮细胞,它们缺乏黏液分泌,具有稀疏的糖萼、高内吞活性且其基底外侧区室与局部单核吞噬细胞和淋巴细胞相邻[84]。肠道相关淋巴组织是M细胞富集区域,可采样和摄取抗原并将其输送到潜在的免疫系统,因而也成为靶标的主要区域[85]。与上述方法相似的策略是开发基于M细胞的靶向配体,如具有环状构象的靶向肽CKS9,其不仅能够与抗原融合表达,也可与细胞因子如IL-6融合表达充当免疫佐剂以增强黏膜免疫反应[32,86]。Zhang Fudong等[87]将M细胞靶向配体Co1耦合到口蹄疫病毒的多抗原表位TB1上构建重组乳酸乳球菌疫苗,可调节特异性T淋巴细胞增殖反应,而TB1-Co1的组合相比TB1可诱导更强的黏膜和体液免疫反应,其中体液免疫占主导地位。呼肠孤病毒蛋白σ1与M细胞表面糖蛋白2的特异性分子FIMH蛋白等配体在其他细菌载体中也有涉及[88],后续可研究其在乳酸菌疫苗中的应用。
3.2 炎症性肠病
由于乳酸菌已被证明能够调控肠道的微生态平衡,开发表达治疗分子的重组乳酸菌并递送到肠道已成为作为针对炎症性肠病的替代疗法[89]。炎症性肠病(inflammatory bowel disease,IBD)主要包括克罗恩病和溃疡性结肠炎,克罗恩病会引起透壁炎症,且伴随有脓肿、瘘管等并发症,而溃疡性结肠炎的特征是结肠的黏膜炎症[90]。溃疡性结肠炎和克罗恩病共同的炎症和组织损伤症状使抗炎细胞因子如IL-10、IL-27和IL-35等成为目标治疗蛋白,其中最早投入研究的是IL-10[91-92]。事实上,分泌IL-10的重组乳酸菌已用于开展治疗克罗恩病的临床试验,但由于分泌于胃肠道内的IL-10浓度较低,临床试验结果并不理想[2]。因此,一些研究将目标转移到其他抗炎细胞因子,以期其发挥免疫抑制作用并诱导机体自身生产IL-10。Hanson等[93]使用乳酸乳球菌递送免疫抑制细胞因子IL-27治疗结肠炎,小肠结肠炎的T细胞转移模型中IL-27二聚体减轻了结肠和小肠的病理变化并降低了结肠中促炎细胞因子基因的表达,其治疗效果依赖于T细胞分泌的IL-10。在此基础上,McLean等[94]发现分泌表达IL-27的重组乳酸乳球菌LL-IL-27在急性结肠炎中改善了黏膜溃疡,显著降低了促炎细胞因子蛋白表达水平并使结肠黏膜中性粒细胞浸润减少。Wang Jianyong等[95]使用乳酸乳球菌递送小鼠IL-35预防硫酸葡聚糖诱导的小鼠结肠炎,小鼠结肠组织病理学变化得到显著缓解,固有层中Th17与Treg细胞比例降低,结肠组织和血清中细胞因子IL-10水平增加。此外,Aubry等[96]构建产生胸腺基质淋巴细胞生成素(thymic stromal lymphopoietin,TSLP)的乳酸乳球菌菌株LL-TSLP,该物质是一种多效的细胞生长因子,LL-TSLP的治疗通过在结肠炎早期阶段诱导Treg增殖延缓了疾病活动指数的增加。
除表达抗炎蛋白外,其他治疗策略还包括递送中和促炎因子的抗体、干扰炎症信号通路传导等[97]。例如,丝氨酸蛋白酶抑制剂Elafin和分泌性白细胞蛋白酶抑制剂,在通过重组乳球菌给药时均表现出较IL-10和转化生长因子β两种抗炎细胞因子更好的保护作用[98]。Plavec等[99]在乳酸乳球菌表面成功展示了IL-23受体拮抗剂REX蛋白,其可以与IL-23R-IgG嵌合体相互作用并抑制促炎级联反应中细胞因子IL-17A的分泌,具有作为IBD治疗分子的潜力。
3.3 糖尿病
1型糖尿病(type 1 diabetes mellitus,T1DM)和2型糖尿病(type 2 diabetes mellitus,T2DM)是临床上最常见的两种糖尿病分型,重组乳酸菌已被认为是糖尿病现有疗法的潜在替代方案。T1DM是一种内分泌疾病,通常是由于自身免疫性遭到破坏且胰腺β细胞停止产生胰岛素[100]。Mao Ruifeng等[101]通过抗原特异性疗法设计表达的单链胰岛素SCI-59类似物具有在3T3-L1脂肪细胞表面结合和激活胰岛素受体的能力,通过乳酸菌载体口服递送后可以增强非肥胖糖尿病(non-obese diabetes,NOD)小鼠的葡萄糖耐量,显著减轻胰岛炎症并恢复小鼠的胰岛素分泌能力。Cook等[102]将胰岛素原和IL-10在乳酸乳球菌中共表达并口服递送,结合低剂量抗CD3治疗成功恢复了NOD小鼠的葡萄糖稳态。特别的是,Lang Junchao等[103]将中性粒细胞胞外陷阱作为T1DM胰腺早期病理性损伤的靶标,使用重组乳球菌分泌葡萄球菌核酸酶靶向干预,有效调节NOD小鼠的血糖水平并延缓T1DM的发展。T2DM表现的高血糖水平症状主要由慢性炎症引起的胰腺β细胞损伤后胰岛素分泌不足引起[104]。同样,目前已开发了多种针对T2DM的重组乳酸菌。例如,口服分泌胰高血糖素样肽-1(glucagon like peptide-1,GLP-1)的重组植物乳杆菌7 周后,自发型T2DM模型猴的空腹血糖浓度可以降至正常水平[105]。Exendin-4作为一种GLP-1的受体激动剂,也被认为是T2DM的良好治疗药物[106]。Zeng Zhu等[107]开发了基于乳酸菌NICE系统的Exendin-4肽原位口服递送系统,该递送系统显著增强了INS-1细胞的胰岛素分泌并激活了PI3K/AKT信号通路,具有良好的应用潜力。
3.4 癌症
癌症是一种以异常细胞不受控制增殖为特征的疾病,这些异常细胞具有侵袭性并且能够从原发部位扩散到机体健康组织[108]。肿瘤微环境的一个重要特征是缺氧。乳酸菌作为一种兼性厌氧细菌,具有靶向缺氧区域的能力,同时其益生特性规避了其他减毒菌株逆转或突变的风险[109]。
使用重组乳酸菌预防或治疗癌症有许多种策略,通过免疫调节防治肿瘤最为常见。16型人乳头瘤病毒多见于宫颈癌的早期病变组织,其抗原靶标E6、E7已由乳酸菌成功表达并于近期投入临床试验[110]。细胞毒性T淋巴细胞相关抗原4是一种免疫检查点分子,在T细胞上表达并抑制肿瘤微环境中的抗肿瘤免疫,其单链可变抗体已在乳酸乳球菌载体中表达并证明具有生物活性,有望作为一种癌症治疗方案[111]。另外一种常见策略是通过细胞毒性蛋白攻击肿瘤细胞以产生抗肿瘤作用。P8蛋白是一种由鼠李糖乳杆菌分泌的治疗性蛋白,在先前的研究中,研究人员证明P8可以特异性易位于肿瘤细胞的细胞质基质,通过p53-p21信号通路介导肿瘤细胞G2期阻滞,发挥抗增殖活性[112]。Chung等[25]使用戊糖片球菌作为载体分泌治疗蛋白P8治疗结直肠癌,当口服工程细菌后,小鼠的结肠癌细胞异种移植模型与化学诱导模型中的肿瘤生长均被显著抑制。其他相关的重组蛋白,如肿瘤坏死因子相关的细胞凋亡诱导配体[113]、肿瘤转移抑制肽Kiss-1[114]等,均已通过乳酸菌载体成功表达并在体外细胞实验中证明具有特异性肿瘤杀伤性,还需进一步研究它们在体内实验中的作用效果。
3.5 其他
除以上几种常见疾病外,重组乳酸菌可以利用口服耐受机制,预防或治疗多种自身免疫性疾病以及过敏症状。口服耐受性通常指通过口服途径预先给予抗原,通过特异性抑制抗原的细胞和体液免疫反应以防止超敏反应[115]。研究表明,通过重组乳酸菌持续递送热休克蛋白65——一种可诱导T细胞的高免疫原性抗原,可以防止或减轻小鼠类风湿性关节炎、脑脊髓炎等多种自身免疫疾病的发生或发展[116-118]。在上述实验中均观察到IL-10水平的升高与干扰素γ的降低。Kasarełło等[119]通过重组乳酸乳球菌递送髓鞘蛋白的脑源性抗原片段,减少了实验性脑脊髓炎大鼠的组织病理学变化,可以作为口服耐受多发性硬化症的一种替代策略。同样,在过敏性疾病的治疗中,经重组乳酸菌递送的桦树花粉、雪松花粉、尘螨、牛奶等过敏原均可抑制小鼠特异性IgE反应,有效减轻过敏症状[120]。
4 结语
近年来,随着对乳酸菌益生特性机制研究的不断深入以及遗传工具箱的扩展,乳酸菌成为活体细菌疗法的理想底盘。但相较于模式菌株乳酸乳球菌,片球菌、链球菌、乳杆菌等菌株的基因组与表型具有高度的多样性,仍需要投入大量精力开发其遗传操作工具与基因表达系统。并且,由于乳酸菌影响宿主免疫系统的机制具有菌株特异性,受宿主与微生物之间的复杂相互作用影响,不同菌株的效应分子与宿主机体的免疫反应机理仍需阐明,这将决定该宿主菌株的适用性。
乳酸菌作为活性分子的递送载体在动物模型中显示出高功效。然而,在这些乳酸菌载体进入临床转化之前需要确保其符合各种健康监管机构制定的指导方针,如抗生素耐药基因不能出现在工程菌株中以防止基因转移带来的健康问题[121]。基于CRISPR的基因组编辑技术为包括乳酸菌在内的下一代细胞工厂开辟了道路。正如之前有关大肠杆菌的报道[122]一样,未来利用乳酸菌也可构建复杂的遗传逻辑电路,通过感知和响应环境信号提高生物治疗分子的作用效果。

