植物乳杆菌L15对过度运动引起大鼠骨骼肌损伤的改善作用
贾前生,左 峰
(1.黑龙江八一农垦大学体育教研部,黑龙江 大庆 163319;2.黑龙江八一农垦大学食品学院,黑龙江 大庆 163319)
骨骼肌是人体最大的器官之一,约占人体质量的40%~50%[1-2]。骨骼肌对维持全身能量平衡和日常活动起到重要的作用。骨骼肌具有较高的再生能力,骨骼肌内的分子信号通路可以促进成肌细胞的活化、增殖和分化[3]。适度体育活动对人体有多方面的有益作用,对骨骼肌的有益作用主要包括增加线粒体的功能、参与代谢途径酶的活性和糖原在肌肉中的储存。然而,过度运动会增加肌肉对氧气和营养物质的需求,此外,长期恶化的肠道血液灌注已被证明可引起暂时性缺血,导致黏膜功能障碍及肠通透性增加[4]。研究表明,职业运动员的过度运动可能会破坏肠道菌群的稳态[5],引起条件致病菌的丰度增加,如胃链球菌、葡萄球菌、嗜酸链球菌、酸胺球菌等,抗炎细菌的丰度减少,如拟杆菌、粪杆菌等[6]。肠屏障通透性增加会导致条件致病菌和其产生的毒素进入血液循环,引起氧化应激升高和炎症反应的加剧,从而造成分解代谢的加剧,肌肉功能的恶化[7]。因此,从肠-肌轴角度,维持肠道菌群平衡对缓解过度运动引起的肌肉损伤至关重要。
益生菌是一种定植于肠道对宿主健康有益的活的微生物[8]。大量研究表明,益生菌具有多种生物学效应,如提高胰岛素敏感性、诱导癌细胞凋亡、抗高血压、降胆固醇、抗炎、抗菌和抗氧化等[9-12]。近年来,越来越多的研究表明益生菌具有调节肠道菌群的作用,进而通过肠-肌轴改善肌肉质量[13]。在动物水平上,Ünsal等研究表明益生菌产品VSL#3可以改善游泳训练引起的大鼠肌肉氧化应激的状态[14]。Chen Yimin等研究表明补充植物乳杆菌TWK10可以提高运动能力,增加肌肉质量[15]。Storelli等研究表明植物乳杆菌可以提高肌肉合成代谢[16]。在人体水平上,Huang等研究发现植物乳杆菌PS128可以通过调节肠道菌群提高铁人三项运动员的抗氧化能力和抗炎能力[17]。Jäger等研究发现嗜热链球菌P4和短双歧杆菌BR03可以缓解炎症状态并增强肌肉训练适应[18]。
前期研究表明植物乳杆菌L15具有改善炎症反应和氧化应激的作用[19],因此,本研究进一步探讨植物乳杆菌L15对过度运动引起的大鼠骨骼肌损伤的作用。首先研究植物乳杆菌L15对大鼠体质量、肠道通透性、骨骼肌中脂多糖(lipopolysaccharide,LPS)含量的影响;随后检测抗氧化相关指标及核转录因子红系2相关因子2(nuclear factor-erythroid 2-related factor 2,Nrf2)信号通路相关基因表达水平的变化;最后检测细胞因子及核因子(nuclear factor,NF)-κB信号通路相关基因表达水平的变化,进而系统地评价植物乳杆菌L15改善过度运动引起的大鼠骨骼肌损伤的作用,为开发缓解过度运动引起的肌肉损伤的保健品和药品提供理论依据。
1 材料与方法
1.1 动物、材料与试剂
48 只SPF级雄性SD大鼠(体质量180~220 g)购自北京维通利华实验动物技术有限公司,使用许可证号:SYXK(京)2022-0052。
植物乳杆菌L15分离自甘肃省传统牦牛酸奶,由东北农业大学食品学院惠赠。
超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、总抗氧化能力(total antioxidant capacity,T-AOC)、丙二醛(malondialdehyde,MDA)、D-乳酸试剂盒及白细胞介素(interleukin,IL)-6、IL-1β、IL-10和肿瘤坏死因子(tumor necrosis factor,TNF)-α试剂盒 南京建成生物有限公司;LPS试剂盒 上海泽叶生物科技有限公司;二胺氧化酶试剂盒 上海臻科生物科技有限公司;RNA提取试剂盒 天根生化科技(北京)有限公司;实时荧光定量聚合酶链式反应(quantitative realtime polymerase chain reaction,qPCR)试剂盒 普洛麦格(北京)生物技术有限公司;其他试剂均为分析纯,购于上海国药集团。
1.2 仪器与设备
DHP-9272型电热恒温培养箱 上海一恒科技有限公司;LDZF-50KB-II立式蒸汽灭菌器 上海申安医疗器械厂;TGL-16G离心机 上海安亭科技仪器厂;超低温冰箱 青岛海尔集团;Model 680型酶标仪 美国Beckman公司;7500 qPCR仪 美国Applied Biosystems公司。
1.3 方法
1.3.1 动物分组与饲养
48 只SPF级雄性SD大鼠自由饮食和饮水,饲养室温为(22±2)℃,相对湿度为(45±5)%,明暗交替12 h,经过1 周的适应性饲养,随机分为4 组(每组12 只):安静对照组、运动对照组、安静给菌组和运动给菌组。每天训练前30 min灌胃1 次,其中安静给药组和运动给药组每天灌胃0.2 mL 3×108CFU的植物乳杆菌L15;安静对照组和运动对照组灌胃等体积生理盐水,每天1 次,连续灌胃6 周。运动对照组和运动给菌组按照Bedford方案进行运动训练[20-21],跑台运动速率为19.3 m/min,跑台坡度为5°,大鼠保持此强度运动至力竭,每天训练1 次,6 d/周,共训练6 周,期间记录各组大鼠体质量增加量。动物实验按照黑龙江八一农垦大学科学技术伦理委员会相关要求执行。
1.3.2 样品收集
取血后,静置2 h,以3 000×g离心20 min,收集血清,置于-80 ℃冰箱中保存,用于后续实验。在无菌环境下,解剖大鼠,取大鼠双侧比目鱼肌,清洗后置于冻存管中并立即保存在-80 ℃冰箱中,用于后续实验。
1.3.3 股外侧肌病理学观察
取大鼠股外侧肌组织,体积分数4%甲醛溶液固定组织,石蜡包埋切片,经二甲苯脱蜡后染色,用于股外侧肌病理评估,光学显微镜下观察大鼠股外侧肌组织病理学变化。
1.3.4 肠道通透性指标测定
针对大鼠血清样本,采用酶联免疫吸附试剂盒检测D-乳酸和二胺氧化酶水平。
1.3.5 大鼠骨骼肌中LPS水平的测定
针对大鼠骨骼肌样本,采用ELISA试剂盒测定大鼠骨骼肌中LPS水平。
1.3.6 大鼠骨骼肌组织抗氧化相关指标的测定
针对大鼠骨骼肌样本,按照试剂盒检测方法检测SOD、GSH-Px、T-AOC、MDA水平。
1.3.7 大鼠骨骼肌组织中细胞因子水平的测定
参照Shi Jialu等[22]的方法测定大鼠骨骼肌组织中细胞因子水平,将骨骼肌组织匀浆并在4 ℃下离心10 min获得上清液,使用酶联免疫吸附试剂盒测定上清液中TNF-α、IL-1β、IL-6和IL-10的质量浓度。
1.3.8 大鼠相关基因mRNA表达水平的测定
从-80 ℃冰箱中取出大鼠骨骼肌,提取RNA,使用GoScriptTMReverse Transcription Mix试剂盒按照说明书进行逆转录获得cDNA。依照GoTaq®qPCR Master Mix试剂盒按照说明书,利用7500 qPCR系统进行qPCR,具体引物设计见表1,使用管家基因(β-actin)进行归一化,数据采用2-ΔΔCt方法分析。

表1 qPCR引物序列的设计Table 1 Primer sequences used for quantitative real-time polymerase chain reaction (qPCR)
1.4 数据统计与分析
实验结果采用平均值±标准差表示,并采用SPSS 17.0统计软件对过度运动与益生菌间的交互效应进行双因素方差检验,并采用Duncan方法分析数据的差异显著性。P<0.05为差异显著,采用Graph pad软件绘图。
2 结果与分析
2.1 植物乳杆菌L15对大鼠体质量增加量的影响
如图1所示,双因素方差分析结果显示过度运动对体质量增加具有主效应(P<0.05),植物乳杆菌L15对体质量增加主效应不显著(P>0.05),且二者无交互效应(P>0.05);6 周跑台运动后,相比于安静对照组,运动对照组大鼠的体质量增加量显著下降(P<0.05),在大鼠过度运动期间补充植物乳杆菌L15,与运动对照组相比,运动给菌组大鼠的体质量增加量显著增加(P<0.05)。这表明植物乳杆菌L15可以提高体质量。
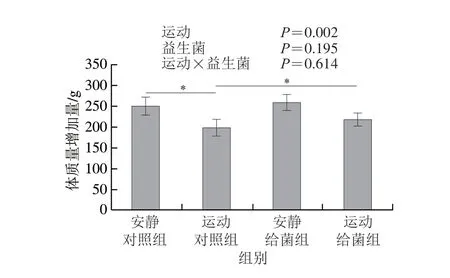
图1 植物乳杆菌L15对大鼠体质量增加量的影响Fig.1 Effect of L.plantarum L15 supplementation on body mass gain of rats
2.2 植物乳杆菌L15对大鼠股外侧肌组织病理学的影响
从图2可观察到,安静对照组和安静给菌组肌细胞多个细胞核位于细胞边缘,细胞之间排列紧密,肌束间间隙未见增大,肌纤维形态正常,未见溶解、断裂;组织内未见坏死、水肿、炎症、出血等病理性变化,形态结构正常。运动对照组部分肌纤维断裂、溶解,肌纤维间间隙明显增大,组织细胞排列轻度疏松,部分肌纤维间隙内可见大量炎性细胞弥漫性浸润,这表明过度运动引起骨骼肌损伤,模型构建成功。运动给菌组视野中可见少量肌纤维断裂、溶解,肌纤维间隙轻度增大,组织排列轻度疏松,部分肌纤维间隙可见炎性细胞弥散性浸润,组织内未见出血、水肿等病理性改变,与运动对照组相比,组织病理学变化明显减轻。这表明植物乳杆菌L15可以改善过度运动引起的大鼠股外侧肌组织病理学变化。
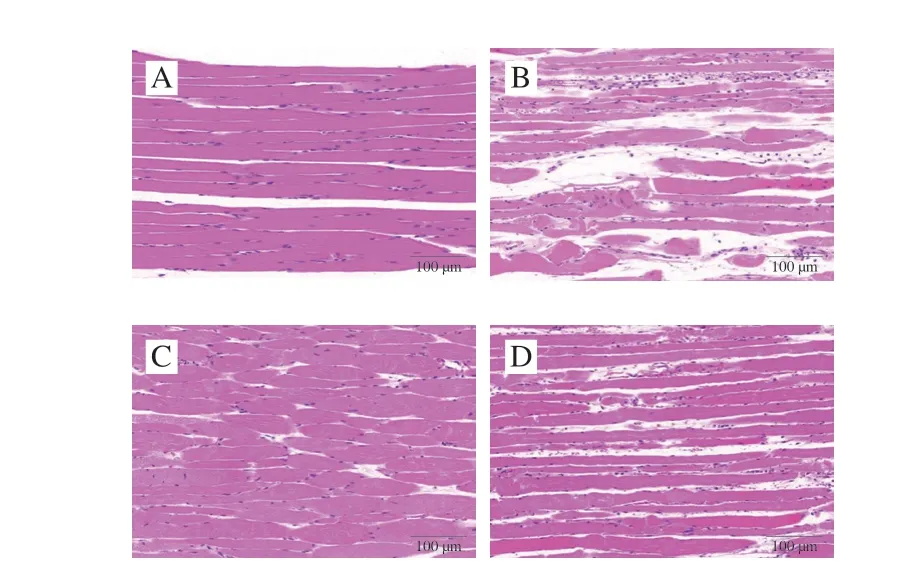
图2 大鼠股外侧肌组织病理学观察结果Fig.2 Histopathologic images of vastus lateralis muscle of rats in different groups
2.3 植物乳杆菌L15对大鼠肠道通透性的影响
如图3A所示,过度运动和植物乳杆菌L15对血清中D-乳酸含量均具有主效应(P<0.05),且二者间存在交互效应(P<0.05);6 周跑台运动后,相比于安静对照组,运动对照组大鼠血清中D-乳酸浓度极显著上升(P<0.01);在大鼠过度运动期间补充植物乳杆菌L15,与运动对照组相比,运动给菌组大鼠血清中D-乳酸浓度极显著降低(P<0.01)。如图3B所示,过度运动对血清中二胺氧化酶活力具有主效应(P<0.05),植物乳杆菌L15对二胺氧化酶活力主效应不显著(P>0.05),且二者无交互效应(P>0.05);6 周跑台运动后,相比于安静对照组,运动对照组大鼠血清中二胺氧化酶活力显著上升(P<0.05);在大鼠过度运动期间补充植物乳杆菌L15,与运动对照组相比,运动给菌组大鼠血清中二胺氧化酶活力降低,但差异不显著(P>0.05)。这表明植物乳杆菌L15可以通过降低肠道通透性进而缓解骨骼肌损伤。
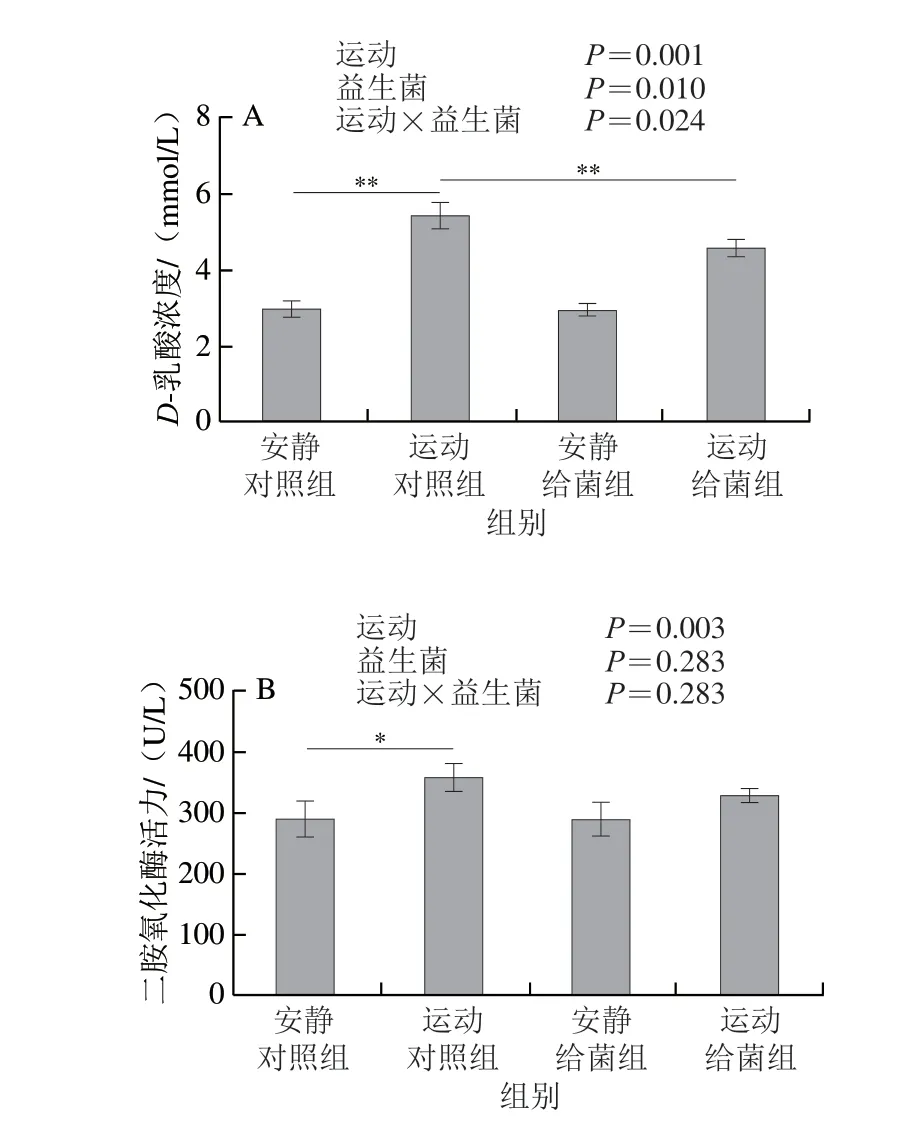
图3 植物乳杆菌L15对大鼠肠道通透性相关指标的影响Fig.3 Effect of L.plantarum L15 supplementation on indicators of intestinal permeability in rats
2.4 植物乳杆菌L15对大鼠骨骼肌中LPS水平的影响
如图4所示,过度运动和植物乳杆菌L15对骨骼肌中LPS水平均具有主效应(P<0.05),且二者间存在交互效应(P<0.05);6 周跑台运动后,相比于安静对照组,运动对照组大鼠骨骼肌中LPS水平极显著上升(P<0.01),在大鼠过度运动期间补充植物乳杆菌L15,与运动对照组相比,运动给菌组大鼠骨骼肌中LPS水平极显著降低(P<0.01)。以上结果表明植物乳杆菌L15可以通过降低LPS水平缓解骨骼肌损伤。
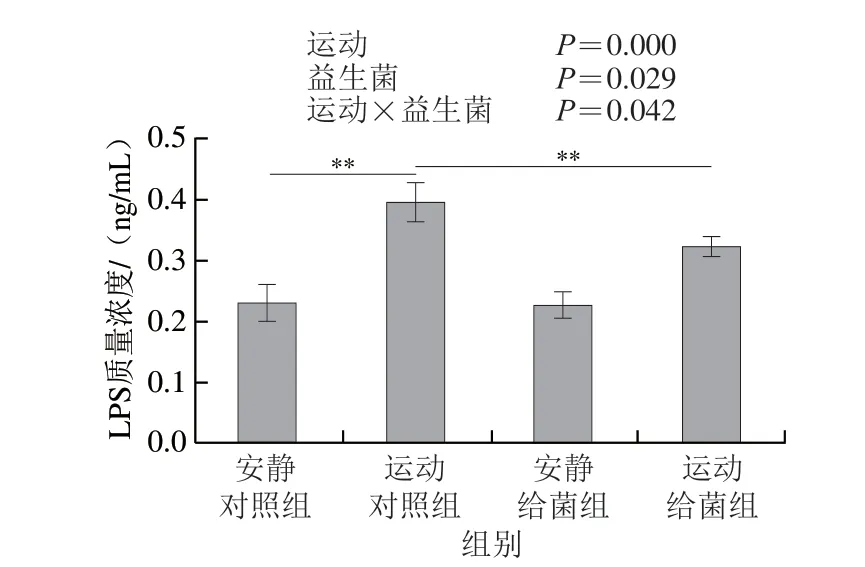
图4 植物乳杆菌L15对大鼠骨骼肌中LPS水平的影响Fig.4 Effect of L.plantarum L15 supplementation on LPS content in skeletal muscle of rats
2.5 植物乳杆菌L15对大鼠骨骼肌氧化应激指标的影响
如图5所示,过度运动对SOD活力、GSH-Px活力、T-AOC和MDA水平具有主效应(P<0.01),植物乳杆菌L15对SOD活力、GSH-Px活力和MDA水平主效应不显著(P>0.05),而对T-AOC具有主效应(P<0.05)。6 周跑台运动后,相比于安静对照组,运动对照组大鼠骨骼肌中SOD活力、GSH-Px活力和T-AOC极显著下降(P<0.01);在大鼠过度运动期间补充植物乳杆菌L15,与运动对照组相比,运动给菌组大鼠骨骼肌中SOD活力、GSH-Px活力和T-AOC显著或极显著增加(P<0.05、P<0.01)。6 周跑台运动后,相比于安静对照组,运动对照组大鼠骨骼肌中MDA水平显著上升(P<0.05),在大鼠过度运动期间补充植物乳杆菌L15,与运动对照组相比,运动给菌组大鼠骨骼肌中MDA水平显著下降(P<0.05)。以上结果表明植物乳杆菌L15可以通过改善抗氧化指标缓解骨骼肌损伤。
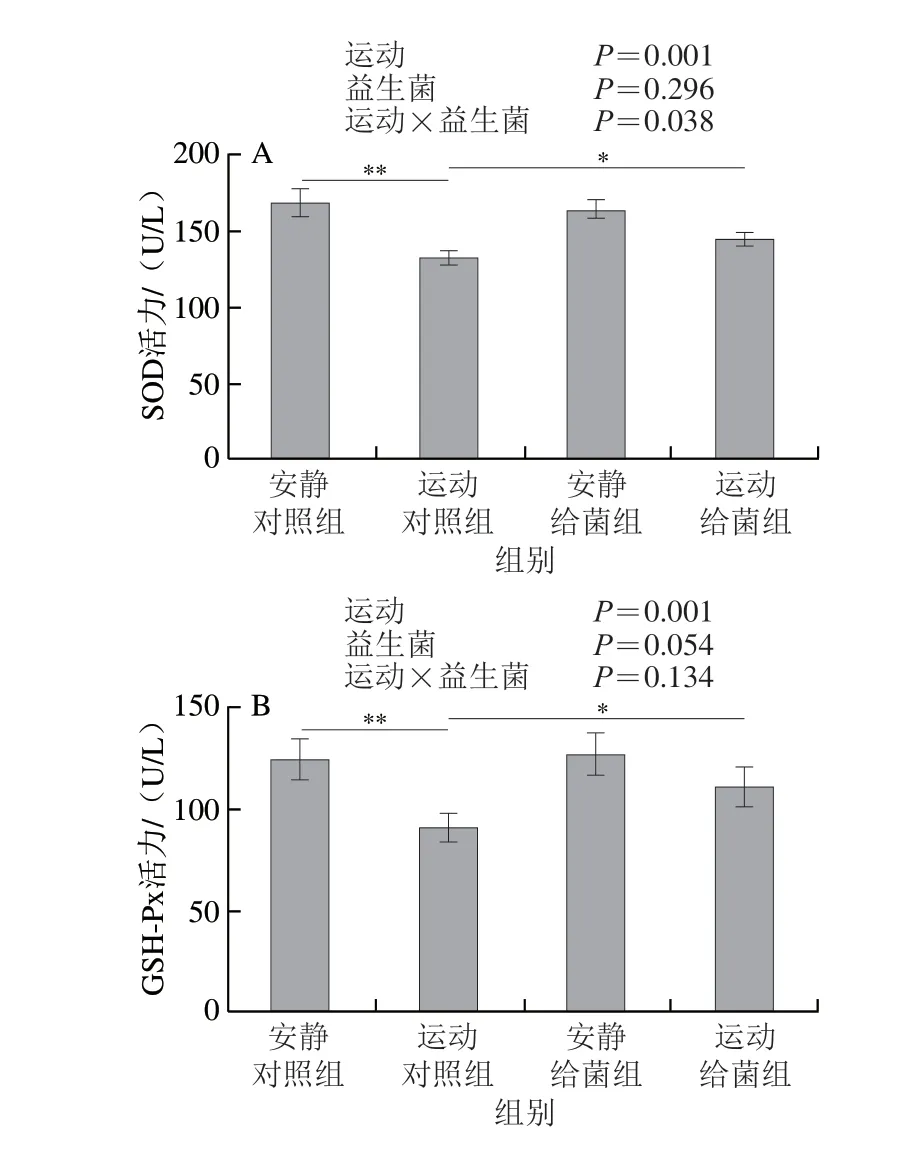
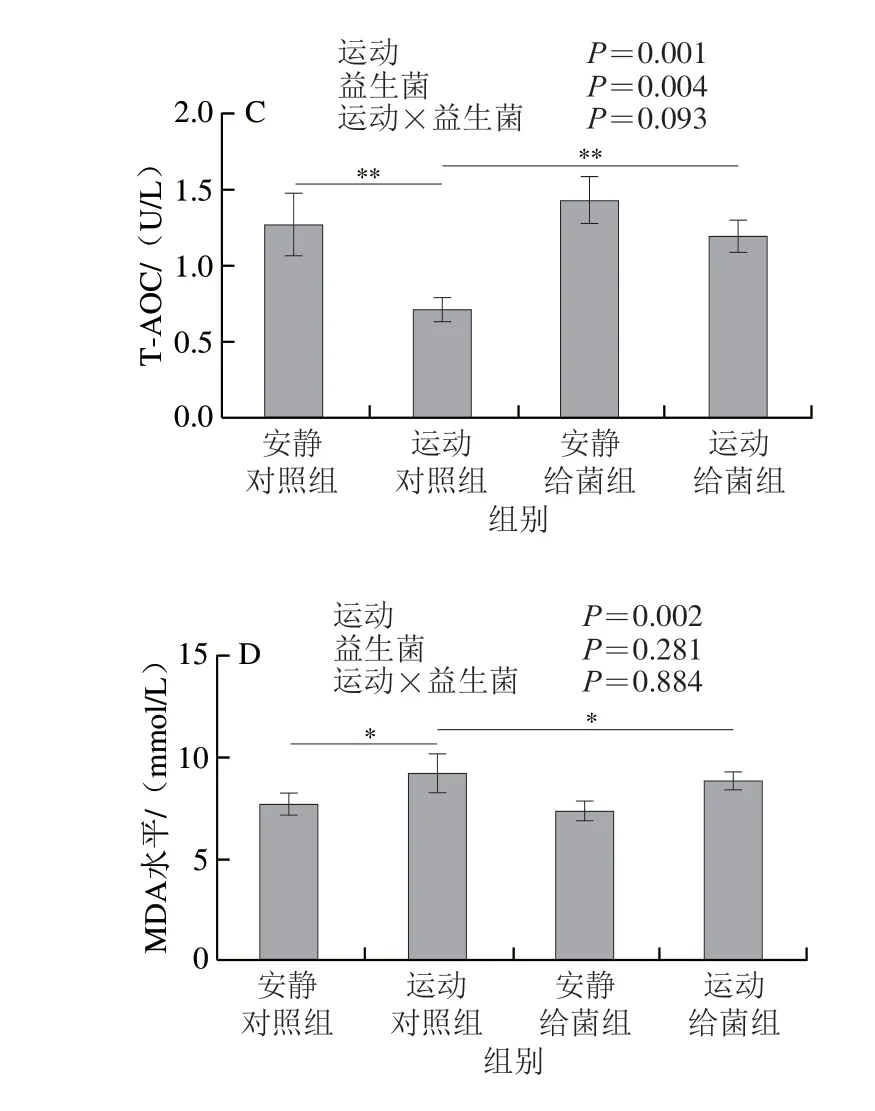
图5 植物乳杆菌L15对大鼠骨骼肌氧化应激指标的影响Fig.5 Effect of L.plantarum L15 supplementation on indicators of oxidative stress in skeletal muscle of rats
2.6 植物乳杆菌L15对大鼠Nrf2信号通路相关基因表达的影响
如图6所示,双因素方差分析显示过度运动和植物乳杆菌L15对骨骼肌中Nrf2、HO-1和NQO1表达水平均具有主效应(P<0.05),二者之间不存在交互效应(P>0.05);6 周跑台运动后,相比于安静对照组,运动对照组大鼠骨骼肌中Nrf2、HO-1和NQO1的表达水平均显著下降(P<0.01);在大鼠过度运动期间补充植物乳杆菌L15,与运动对照组相比,运动给菌组大鼠骨骼肌中Nrf2、HO-1和NQO1的表达水平显著或极显著上升(P<0.05、P<0.01)。以上结果表明植物乳杆菌L15可以通过调节Nrf2信号通路相关基因的mRNA表达水平进而缓解骨骼肌氧化应激。
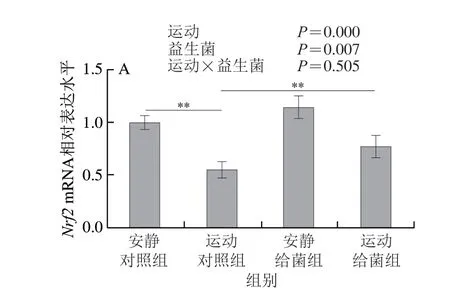
图6 植物乳杆菌L15对大鼠骨骼肌Nrf2信号通路相关基因表达水平的影响Fig.6 Effect of L.plantarum L15 supplementation on mRNA expression levels of genes related to Nrf2 signaling pathway in skeletal muscle of rats
2.7 植物乳杆菌L15对大鼠骨骼肌炎症细胞因子的影响
如图7所示,过度运动对骨骼肌中TNF-α、IL-1β、IL-6和IL-10水平均具有主效应(P<0.05),植物乳杆菌L15对骨骼肌中TNF-α和IL-6水平主效应显著(P<0.05),而对IL-1β和IL-10水平主效应不显著(P>0.05)。6 周跑台运动后,相比于安静对照组,运动对照组大鼠骨骼肌中TNF-α、IL-1β和IL-6水平极显著上升(P<0.01);在大鼠过度运动期间补充植物乳杆菌L15,与运动对照组相比,运动给菌组大鼠骨骼肌中TNF-α、IL-1β和IL-6水平显著或极显著降低(P<0.05、P<0.01)。6 周跑台运动后,相比于安静对照组,运动对照组大鼠骨骼肌中IL-10水平极显著下降(P<0.01),在大鼠过度运动期间补充植物乳杆菌L15,与运动对照组相比,运动给菌组大鼠骨骼肌中IL-10水平显著增加(P<0.05)。以上结果表明植物乳杆菌L15可以通过调节炎症细胞因子缓解骨骼肌炎症。
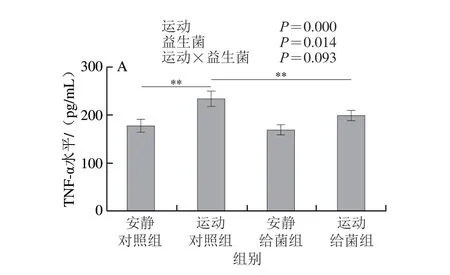
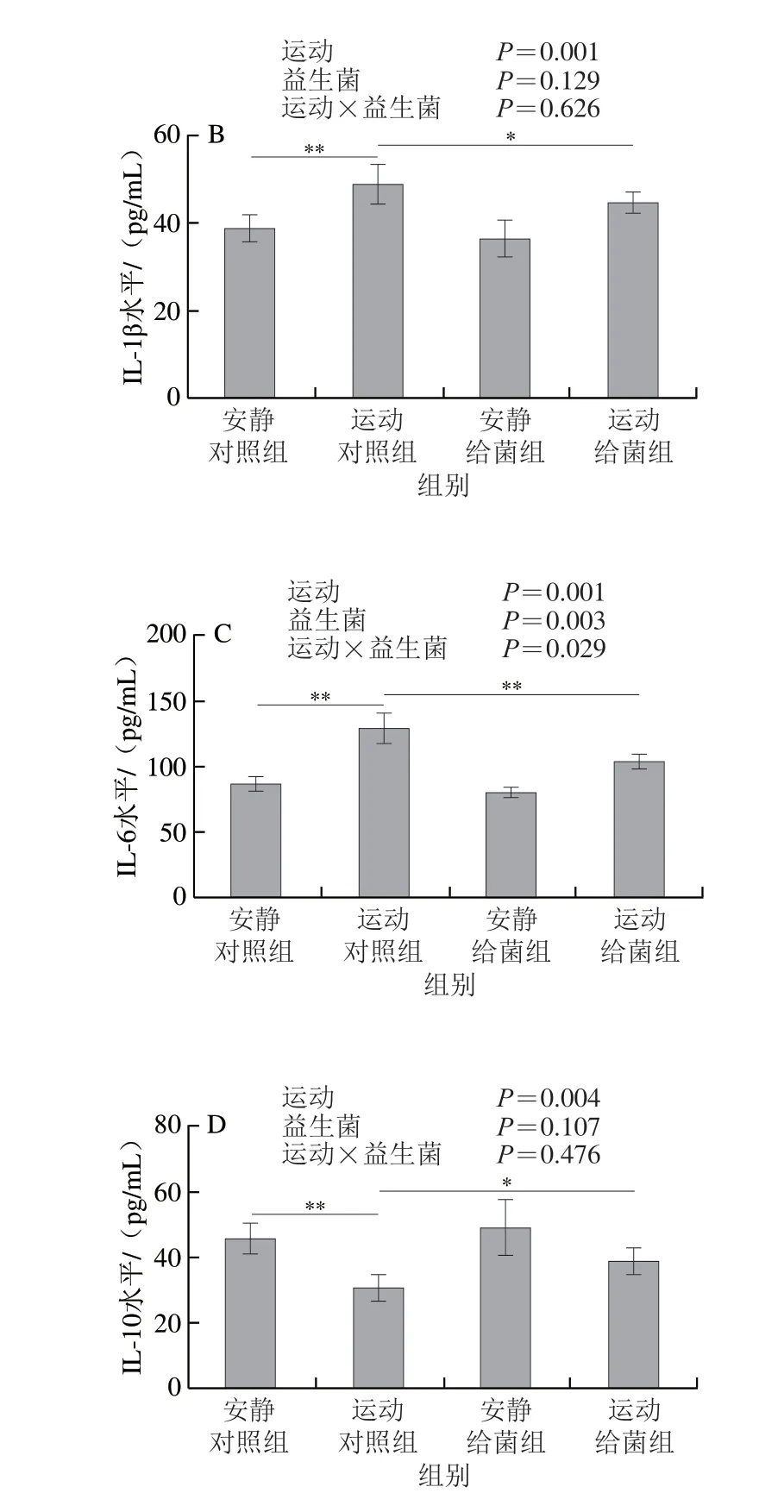
图7 植物乳杆菌L15对大鼠骨骼肌细胞因子水平的影响Fig.7 Effect of L.plantarum L15 supplementation on cytokine levels in skeletal muscle of rats
2.8 植物乳杆菌L15对大鼠NF-κB信号通路相关基因表达的影响
如图8所示,过度运动对骨骼肌中TLR4、MyD88和NF-κB表达水平具有主效应(P<0.05),植物乳杆菌L15对骨骼肌中TLR4表达水平主效应不显著(P>0.05),而对骨骼肌中MyD88和NF-κB表达水平主效应极显著(P<0.01)。6 周跑台运动后,相比于安静对照组,运动对照组大鼠骨骼肌中TLR4、MyD88和NF-κB表达水平极显著上调(P<0.01);在大鼠过度运动期间补充植物乳杆菌L15,与运动对照组相比,运动给菌组大鼠骨骼肌中TLR4、MyD88和NF-κB表达水平均极显著下调(P<0.01)。以上结果表明植物乳杆菌L15可以通过调节TLR4/MyD88/NF-κB信号通路相关基因的mRNA表达水平进而缓解骨骼肌炎症。
3 讨论
肠道屏障受损时,D-乳酸作为细菌发酵的代谢产物通过受损肠黏膜会进入血液中,二胺氧化酶是肠黏膜上层绒毛细胞浆中具有高度活性的细胞内酶,其活性可以反映肠黏膜上皮损伤的程度[23-24]。因此,本研究通过检测D-乳酸和二胺氧化酶活力,判断肠黏膜修复及评估肠道通透性改变情况。夏亚丽研究发现混合益生菌(乳双歧杆菌V9、乳双歧杆菌M8、鼠李糖乳杆菌M9、干酪乳杆菌Zhang、植物乳杆菌P-8)可以改善肠道屏障[25],这表明植物乳杆菌L15可以通过降低肠道通透性进而缓解骨骼肌损伤。LPS从革兰氏阴性菌细胞壁释放到肠道中进入机体循环,可以导致骨骼肌发生炎症反应[26-27]。Lim等研究表明清酒乳杆菌OK67可以抑制产LPS的肠道菌群以及诱导结肠紧密连接蛋白表达进而缓解高脂饮食引起的肝脏损伤[28]。
研究表明,LPS可以通过调节Nrf2信号通路进而引起骨骼肌发生氧化应激[29]。MDA不仅是脂质过氧化产物,而且是体内氧化应激的可靠生物标志物[30]。SOD是清除超氧阴离子的关键酶,可以将超氧阴离子催化成过氧化氢,后者进一步转化成水[31]。T-AOC是衡量生物体的综合抗氧化能力的指标[32]。研究表明益生菌体内和体外均具有一定抗氧化能力,并可能通过多种机制减少全身氧化应激[33]。Yi Ruokun等研究表明植物乳杆菌CQPC02可以缓解疲劳运动引起的氧化应激[34]。Huang等报道植物乳杆菌PS128可以改善高强度耐力训练引起的氧化应激[35]。Nrf2在细胞核外与细胞浆蛋白伴侣分子解离,并转运至细胞核内,进入细胞核后与抗氧化反应元件结合,诱导下游各个II相解毒酶类和抗氧化酶类基因的表达,其中包括HO-1、NQO1合成途径中的限速酶等[36-38],从而缓解机体的氧化应激[39]。近年来,大量的研究均表明乳酸菌可通过调节Nrf2信号通路来缓解氧化应激损伤。Gao Dawei等通过流式细胞术检测发现植物乳杆菌FC22可以通过提高Nrf2的表达量来缓解高脂饮食诱导的小鼠肝脏氧化损伤[40]。Yang Xin等利用qPCR检测发现植物乳杆菌JM113可以通过提高Nrf2和HO-1基因表达水平来缓解脱氧雪腐镰刀菌烯醇引起的雏鸡氧化损伤[41]。Lin Xiangna等研究表明植物乳杆菌AR501可以通过上调Nrf2及其下游通路基因的表达改善D-半乳糖诱导的小鼠氧化应激状态[42]。本研究发现植物乳杆菌L15可以通过调控Nrf2及其下游通路基因的表达缓解过度运动引起的大鼠骨骼肌氧化应激损伤。
研究表明LPS可以引起骨骼肌发生炎症反应[43]。TNF-α是一种关键的促炎因子,可与多种细胞因子协同作用,进一步诱导体内炎症介质的释放。过量的IL-1β可促进其他炎症因子的表达。IL-6是一种促炎因子,在炎症反应和免疫调节过程中发挥重要作用。IL-10是一种抗炎因子,可抑制促炎因子的释放,减少炎症反应[44]。Lee等研究表明植物乳杆菌HY7715可以改善骨骼肌质量,降低肌肉炎症[45]。Bindels等发现恢复特定的乳酸菌水平可以减轻肌肉炎症和降低肌肉萎缩标记物水平[46]。Jäger等研究发现嗜热链球菌P4和短双歧杆菌BR03可以缓解炎症状态并增强肌肉训练适应[18]。研究表明急性运动可以激活大鼠骨骼肌NF-κB信号通路[47]。NF-κB是重要的信号通路之一,与炎症发生密切相关[48-49]。在免疫及炎症反应等多个生理及病理学过程中起到重要的调控的作用[50]。Wang Ning等研究表明Toll样受体4(Toll-like receptors 4,TLR4)由LPS触发,前者与慢性炎症相关[51],当受到LPS刺激后,LPS与受体TLR4结合,活化髓样分化因子88(myeloid differentiation factor 88,MyD88)依赖途径,促进核因子κB抑制因子(NF-kappa B inhibitor,IκB)降解,将功能亚基(P65)从复合物中释放出来并进入细胞核,随后功能亚基(P65)有序地调控促炎细胞因子等转录和翻译过程,进而引发炎症[52]。Yu Peng等研究表明植物乳杆菌L15可以通过调节NF-κB信号通路缓解LPS引起的溃疡性结肠炎[19]。Dong Jiahuan等研究表明植物乳杆菌KLDS1.0386可以通过调节NF-κB信号通路缓解LPS引起的肝脏炎症反应[53]。本研究发现植物乳杆菌L15可以通过调控NF-κB信号相关通路基因的表达缓解过度运动引起的大鼠骨骼肌炎症反应。
4 结论
植物乳杆菌L15可以改善过度运动引起的大鼠股外侧肌组织病理学变化,通过降低血清中D-乳酸和二胺氧化酶水平改善过度运动大鼠的肠道通透性,降低骨骼肌中LPS的水平,通过下调Nrf2及其下游基因的mRNA表达水平提高SOD、GSH-Px、T-AOC水平和降低MDA水平,通过下调TLR4、MyD88和NF-κB的mRNA表达水平降低促炎细胞因子(IL-6、IL-1β和TNF-α)和提高抗炎细胞因子(IL-10)的水平。

