芜菁酸性多糖结构及对脂多糖诱导肺损伤小鼠的保护作用
卡地尔亚·库尔班,阿吉然姆·阿布拉,陈卓尔,米合热尼沙·阿木热江,海力茜·陶尔大洪,*,杨 飞,2,*
(1.新疆医科大学药学院,新疆 乌鲁木齐 830011;2.新疆维吾尔自治区分析测试研究院,新疆 乌鲁木齐 830011)
急性肺损伤(acute lung injury,ALI)是一种由COVID-19[1]、脓毒血症[2]、PM2.5[3]、输血[4]、肺癌放化疗[5]等多种因素导致的高发病率、高病死率危重病[6]。其特征为炎症介质的大量释放导致中性粒细胞聚集并过度激活机体免疫系统,形成“细胞因子风暴”,最终导致肺组织严重损伤甚至引发多个器官的损伤及衰竭[7]。
近年来,核转录因子-κB/NOD样受体3(nuclear factor kappa B/NOD-like receptor 3,NF-κB/NLRP3)信号通路在炎症相关疾病中的作用机制成为研究热点,此通路的激活或抑制可调控肺损伤的发生过程[8]。NLRP3炎性小体的启动过程由模式识别受体信号通路触发,例如Toll样受体4(Toll-like receptor 4,TLR4)或肿瘤坏死因子(tumor necrosis factor,TNF)信号通路激活,随后通过NF-κB依赖通路介导NLRP3、白细胞介素-1β(interleukin-1β,IL-1β)、IL-18的转录激活,促进炎症和损伤的发生[9]。
芜菁(Brassica rapaL.)为新疆、西藏等高海拔地区普遍种植的一种药食同源植物[10]。芜菁为十字花科芸薹属草本植物[11],肉质块根为其主要食用与药用部位[12-13]。《本草纲目》记载“芜菁,味辛、苦、平,无毒。塞北、河西种者。能下能利小便,明目解毒,其效甚伟”[14]。芜菁含有多糖[15]、蛋白质[16]、多酚[17]、挥发油[18]等多种活性成分。研究发现芜菁多糖具有免疫调节[19]、抗衰老[20]、抗氧化[21]等多种生理活性,但缺乏其干预呼吸系统疾病、炎症性疾病相关报道。本研究旨在探讨芜菁酸性多糖(Brassica rapaL.acidic polysaccharide-1,BRAP-1)的理化性质、结构和组成,及其对脂多糖(lipopolysaccharide,LPS)诱导的急性肺损伤的保护作用和相关机制,以期为芜菁多糖药理活性研究及作为肺损伤保健食品、治疗药物提供理论参考。
1 材料与方法
1.1 动物、材料与试剂
健康SPF级BALB/c小鼠,雄性,4~6 周龄(体质量(20±2)g),购自新疆医科大学动物实验中心,使用许可证号:SYXK(新)2018-0003;饲养环境:温度为20~25 ℃,相对湿度为40%~60%,12 h光照12 h黑暗,垫料、饮用水经高压灭菌处理,自由进食、定时更换垫料。
芜菁采收于新疆柯坪县,经北京大学药学院张英涛副教授鉴定为十字花科芸薹属植物芜菁的干燥块茎。
LPS 美国Sigma公司;小鼠TNF-α、IL-6、IL-10、干扰素-γ(interferon-γ,IFN-γ)酶联免疫吸附检测试剂盒 上海江莱生物科技有限公司;Prime Script RT reagent Kit with gDNA Eraser逆转录试剂盒、TB Green Premix ExTaqII扩增试剂盒 日本TAKARA公司;BCA蛋白质量浓度测定试剂盒 美国Thermo Fisher公司。
1.2 仪器与设备
5424R离心机 德国Eppendorf公司;F50型酶标仪瑞士Tecan公司;Eclipse E100显微镜 日本Nikon公司;7500实时荧光定量聚合酶链反应(quantitative realtime polymerase chain reaction,qPCR)仪 美国Applied Biosystems公司;傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FT-IR)仪 美国热电公司;1200高效凝胶渗透色谱系统、气相色谱-质谱联用(gas chromatography-mass spectrometry,GC-MS)仪 美国Agilent公司。
1.3 方法
1.3.1 BRAP-1制备
根据课题组前期研究方法,通过水提醇沉法获得芜菁总多糖,再经DEAE-650M阴离子交换柱、Sepharose 6B琼脂糖凝胶柱、Sephacryl S-300葡聚糖凝胶色谱柱分离纯化后得到分子质量均一、高纯度芜菁酸性均一多糖BRAP-1[22]。
1.3.2 BRAP-1化学组成分析
采用苯酚硫酸法测定总糖质量分数,标准曲线方程为y=0.000 8x+0.005 0(R2=0.999 3);采用间羟基联苯法测定样品糖醛酸质量分数,标准曲线方程为y=0.000 8x+0.023 0(R2=0.999 5);考马斯亮蓝蛋白分析法测定蛋白质量分数,标准曲线方程为y=0.001 0x+0.169 3(R2=0.998 6)[22]。
1.3.3 BRAP-1表观分子质量测定
配制不同分子质量(1、5、1 2、5 0、8 0、150、270、410、670、2 000 kDa)的Dextran T标准品溶液及BRAP-1多糖溶液,进行高效凝胶渗透色谱分析。检测参数:进样量10 μL,PL aquagel-OH MIXED-H色谱柱(7.5 mm×300 mm,8 μm),示差折光检测器,流动相为0.1 mol/L硝酸钠溶液,柱温35 ℃,流速0.6 mL/min。以标准品保留时间为横坐标,分子质量的对数为纵坐标绘制标准曲线,得到回归方程y=-0.652x+13.330(R2=0.998 2),将BRAP-1保留时间代入方程计算表观分子质量。
1.3.4 BRAP-1的FT-IR分析
溴化钾粉末与冷冻干燥的BRAP-1粉末以质量比1∶100混合,研磨后压片,进行FT-IR分析。扫描范围4 000~400 cm-1。
1.3.5 BRAP-1单糖组成分析
以肌醇为溶剂配制7 种单糖混合标准溶液(0.1 μg/μL)和BRAP-1多糖溶液(0.2 μg/μL)。三氟乙酸水解2 h,N2吹干溶剂,甲醇洗涤3 次后利用醋酸酐和1-甲基咪唑进行乙酰化处理,收集备用。GC-MS检测条件:HP-5MS色谱柱(30.0 m×0.25 mm,0.25 μm),载气He,柱升温条件:160 ℃保持1 min,2 ℃/min升温至190 ℃,再以0.4 ℃/min升温至280 ℃,保持5 min,检测器温度280 ℃。根据标准品保留时间确定样品单糖组成,通过样品单糖峰的峰面积之比计算单糖物质的量比。
1.3.6 动物分组及给药
将40 只BALB/c小鼠随机分成5 组,每组8 只,分别为正常组,模型组,BRAP-1低、中、高剂量组。各组给药剂量根据小鼠体质量计算。实验连续给药10 d,期间正常组、模型组灌胃0.5 mL/d生理盐水。BRAP-1低、中、高剂量组分别灌胃50、100、200 mg/(kgmb·d)的BRAP-1。末次给药2 h后用质量分数4%水合氯醛麻醉小鼠,正常组气管滴注无菌磷酸盐缓冲液(phosphate buffered saline,PBS),模型组及BRAP-1给药组气管滴注LPS(5 mg/kgmb)。模型建立24 h后,小鼠眼眶采集血液,立即收集脏器,称质量后于-80 ℃冻存备用。
1.3.7 肺湿质量/干质量比值测定
1.3.8 肺泡灌洗液总细胞数、蛋白质量浓度测定
取完整的肺组织,手术线结扎左肺,将留置针置入气管中用棉线结扎固定,进行肺泡灌洗。取0.5 mL冰上预冷无菌PBS沿总支气管流入肺,此操作过程中可观察到小鼠右肺部变大,轻轻按揉5 次并抽回,重复3 次。3 000×g离心15 min后收集上清液,采用BCA法检测小鼠肺泡灌洗液中总蛋白质量浓度,操作严格按试剂盒说明书进行,沉淀用PBS重悬后用显微镜进行总细胞计数。
1.3.9 肺组织病理学观察
利用质量分数10%甲醛固定液固定肺组织,经脱水、透明、石蜡包埋后切片,厚度约5 μm,再经烤片、脱蜡、透明、脱水,进行苏木精-伊红(hematoxylineosin,HE)染色,中性树胶封片,晾干,光学显微镜下观察肺组织病理学变化。
1.3.10 血清细胞因子水平测定
采集的血液样品置于4 ℃保存2 h,1 000×g离心20 min后取上清液,分装,放置于-80 ℃冰箱,防止重复冻融。按照试剂盒说明书测定血清TNF-α、IL-6、IL-10、IFN-γ质量浓度。
1.3.11 NF-κB/NLRP3通路关键基因表达水平测定
所谓的解释,就是说明某种现象何以如此。语用学的研究目的之一就是解释语言形式何以如此。在Givón(1979:3-4)认为语言学的解释需要涉及下面一个或多个“自然解释性参数”:命题内容、话语语用学、语言处理器、认知结构、世界观语用学、个体发生学的发展、历时演变和种系发生学的进化。这些参数就是我们称之为外部解释的参数。语体与命题内容、话语语用学、认知结构等参数密切相关,那么语体研究能为语言学提供什么样的解释?这是本文试图回答的问题。
取肺组织适量,放入装有TRIzol的预冷研磨管进行组织研磨,提取总RNA后测定浓度和纯度。按照试剂盒说明书进行逆转录。按表1设计PCR引物。实时荧光定量PCR程序为:95 ℃预变性30 s;95 ℃变性5 s;60 ℃退火/延伸34 s,40 个循环。以GAPDH为内参基因,用2-ΔΔCt法计算肿瘤坏死因子受体(tumor necrosis factor receptor,TNFR)、TLR4、p65、NLRP3、IL-1β相对表达量。

表1 PCR引物序列Table 1 Primer sequences used for PCR
1.4 数据处理与分析
所有数据均采用SPSS 26软件进行分析,结果用平均值±标准差表示。组间差异采用单因素方差分析,以P<0.05为差异具有统计学意义。
2 结果与分析
2.1 BRAP-1理化性质、结构和组成分析
2.1.1 BRAP-1化学组成和表观分子质量
根据总糖、糖醛酸、蛋白标准曲线方程计算得到BRAP-1总糖质量分数为56.7%,糖醛酸质量分数为13.1%,蛋白质量分数为8.9%。
如图1所示,BRAP-1高效凝胶渗透色谱图呈对称单峰,说明其分子质量均一,将BRAP-1保留时间(14.64 min)代入标准曲线方程得到分子质量为6 080 Da。

图1 BRAP-1高效凝胶渗透色谱图Fig.1 High performance gel permeation chromatogram of BRAP-1
2.1.2 BRAP-1的FT-IR分析结果
BRAP-1样品在3 376 cm-1处的较宽吸收峰是糖残基—OH的伸缩振动峰,2 930 cm-1处为C—H伸缩振动峰(图2),是多糖的特征吸收峰[23]。1 628 cm-1处为糖醛酸羧基伸缩振动峰,证明BRAP-1是含有糖醛酸结构的酸性多糖[24]。位于1 403 cm-1的吸收峰为多糖分子中多个C—H弯曲振动吸收峰[25]。1 031 cm-1处的吸收峰为吡喃环C—O伸缩振动峰[26],结合900~800 cm-1处吸收峰可知样品含β-吡喃糖[27]。综上所述,BRAP-1具有多糖结构特征,并含有β-吡喃糖、糖醛酸结构,为典型的酸性多糖。
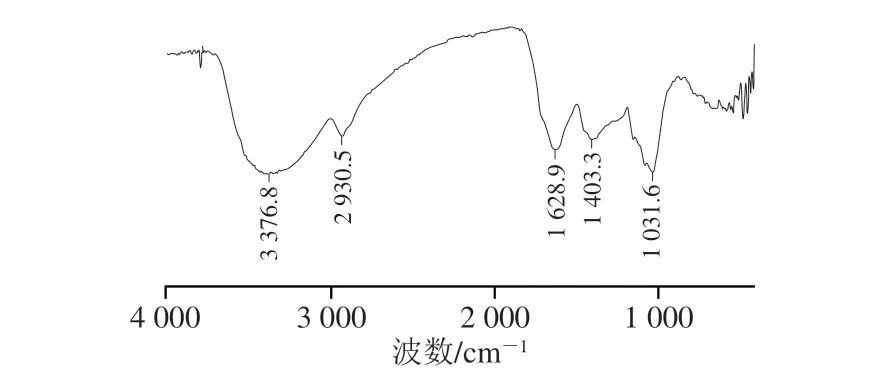
图2 BRAP-1 FT-IR谱图Fig.2 FT-IR spectrum of BRAP-1
2.1.3 BRAP-1单糖组成
经酸水解和乙酰化后BRAP-1单糖组成的GC-MS图如图3所示。根据对照品峰及样品峰保留时间可知,BRAP-1主要由葡萄糖、半乳糖、阿拉伯糖组成,根据3 种单糖峰面积得到BRAP-1单糖物质的量比为n(葡萄糖)∶n(半乳糖)∶n(阿拉伯糖)=4.53∶2.20∶2.07。
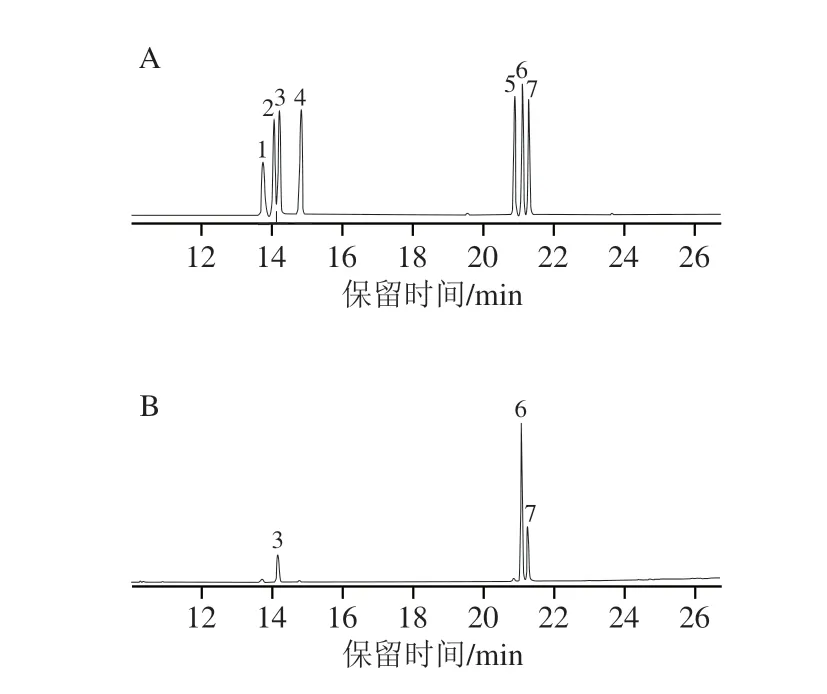
图3 BRAP-1单糖组成GC-MS谱图Fig.3 GC-MS chromatograms showing the monosaccharide composition of BRAP-1
2.2 BRAP-1对LPS诱导ALI小鼠肺湿质量/干质量比值的影响
如图4所示,与正常组相比,模型组小鼠肺湿质量/干质量比值高度显著升高(P<0.001),表明LPS气管滴注后诱导了小鼠肺组织损伤,引起组织水肿。与模型组相比,BRAP-1低、中、高剂量组小鼠肺湿质量/干质量比值呈剂量依赖性降低(P<0.001),说明BRAP-1可缓解小鼠肺组织水肿症状。
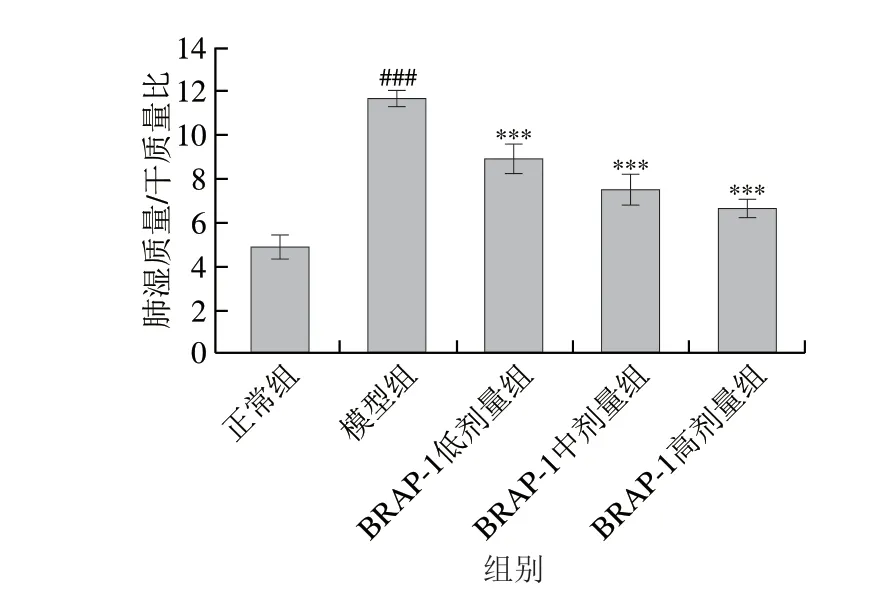
图4 BRAP-1对LPS诱导ALI小鼠肺湿质量/干质量比值的影响Fig.4 Effect of BRAP-1 on the wet/dry mass ratio of lung in LPSinduced ALI mice
2.3 BRAP-1对LPS诱导ALI小鼠肺泡灌洗液蛋白质量浓度、总细胞数的影响
如图5 所示,与正常组相比,模型组小鼠肺泡灌洗液中蛋白质量浓度、总细胞数高度显著升高(P<0.001),提示LPS诱导使小鼠肺组织细胞膜通透性改变、组织蛋白渗漏、大量炎性细胞渗出并弥散于损伤的肺组织间隙。与模型组相比,BRAP-1低、中、高剂量组肺泡灌洗液蛋白质量浓度呈剂量依赖性降低(P<0.001)。虽然BRAP-1组肺泡灌洗液总细胞数也呈剂量依赖性减少,但与模型组相比,仅中、高剂量组有显著性差异(P<0.01、P<0.001),综上,BRAP-1对LPS诱导ALI小鼠肺组织蛋白渗漏、通透性改变、炎性渗出程度有一定的缓解作用。

图5 BRAP-1对LPS诱导ALI小鼠肺泡灌洗液蛋白质量浓度(A)、总细胞数(B)的影响Fig.5 Effect of BRAP-1 on the protein concentration (A) and total cell count (B) of alveolar lavage fluid in LPS-induced ALI mice
2.4 BRAP-1对LPS诱导ALI小鼠肺组织损伤病理变化的影响
如图6所示,正常组小鼠肺组织结构正常、形态规则、肺泡腔清晰,肺泡及间质无明显充血、炎症细胞浸润;模型组小鼠肺组织出现结构紊乱、形态不规则、肺泡间隔增厚,肺泡及间质明显充血、炎症细胞浸润等肺损伤特征,提示肺损伤模型建立成功。与模型组相比,BRAP-1各剂量组小鼠肺组织结构形态较为规则,肺泡间隔增厚、肺泡及间质充血等情况减轻,肺泡腔内炎症细胞浸润减少,肺损伤明显改善。
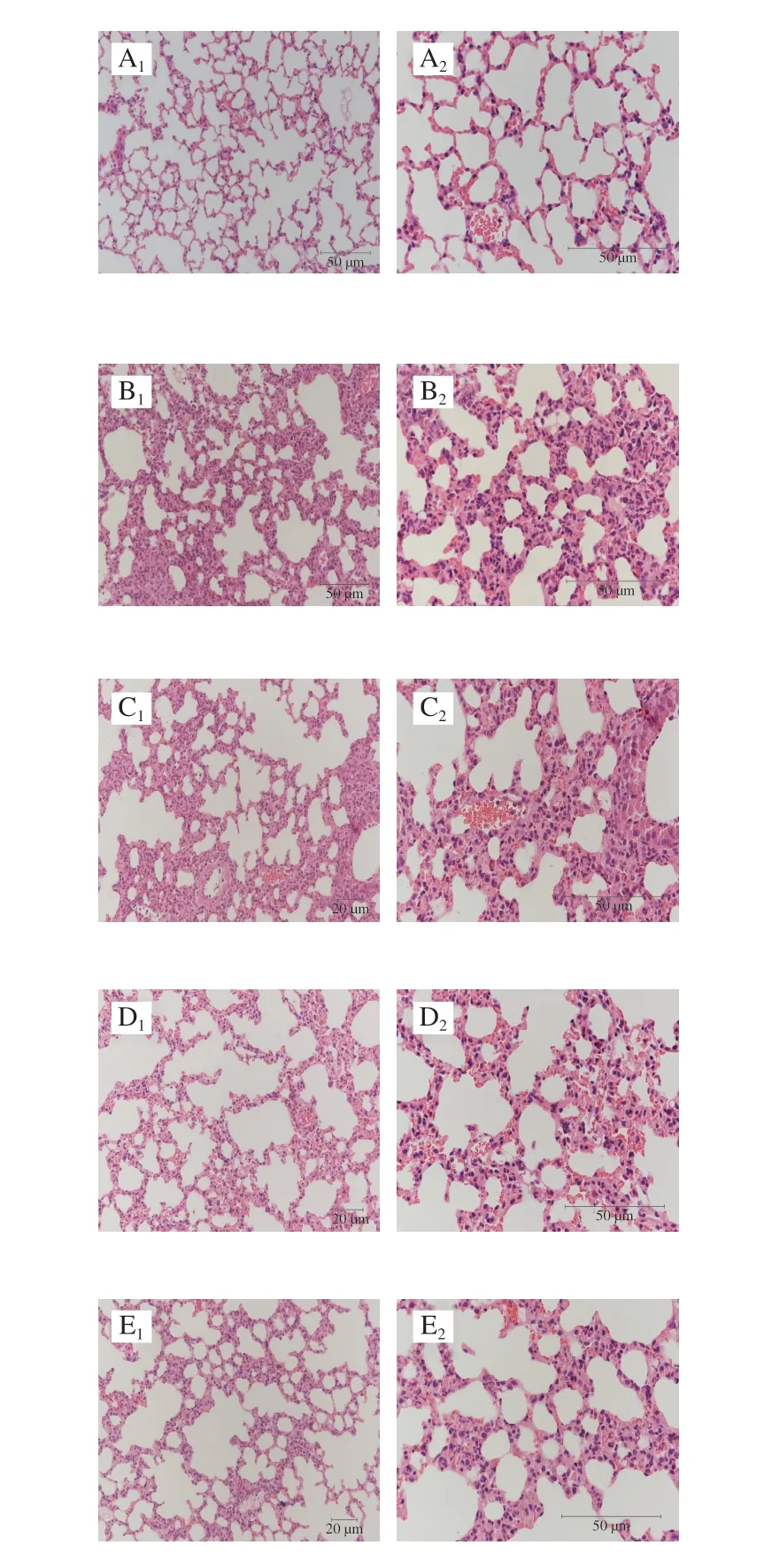
图6 小鼠肺组织HE染色图Fig.6 Images of HE stained lung tissue sections from mice
2.5 BRAP-1对LPS诱导ALI小鼠免疫因子水平的影响
如图7 所示,与正常组相比,模型组小鼠血清TNF-α、IL-6、IL-10、IFN-γ质量浓度高度显著升高(P<0.001),提示LPS诱导肺损伤可过度激活免疫系统,导致大量细胞因子释放并聚集于小鼠肺部,进一步加重肺损伤。低、中、高剂量BRAP-1可剂量依赖性降低小鼠血清中TNF-α、IL-6、IL-10、IFN-γ的含量,与模型组相比均有统计学差异(P<0.05、P<0.001)。根据小鼠血清免疫因子水平变化情况可知,BRAP-1对过度激活的免疫系统有明显的调节作用,说明其对小鼠肺损伤的保护作用是通过调节受损肺组织抗炎-促炎免疫调节失衡来实现。
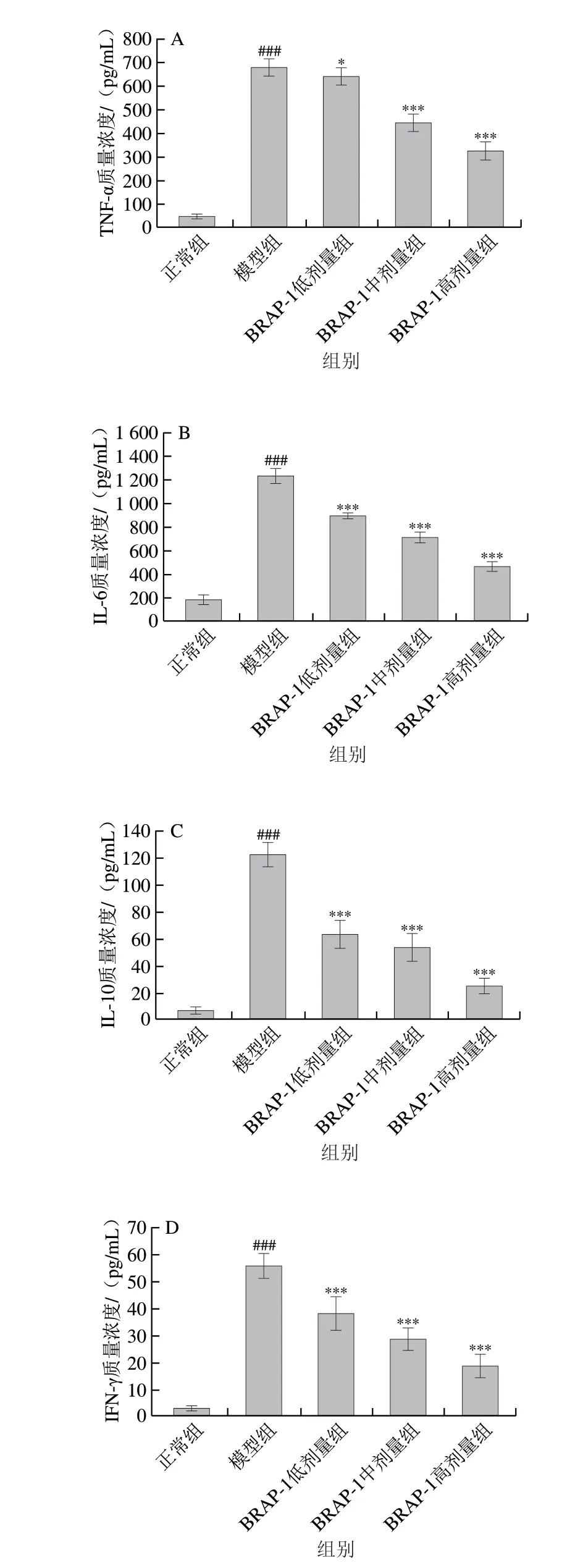
图7 BRAP-1对LPS诱导ALI小鼠血清TNF-α(A)、IL-6(B)、IL-10(C)、IFN-γ质量浓度(D)的影响Fig.7 Effect of BRAP-1 on serum TNF-α (A),IL-6 (B),IL-10 (C) and IFN-γ (D) concentrations in LPS-induced ALI mice
2.6 BRAP-1对LPS诱导ALI小鼠NF-κB/NLRP3通路关键基因表达的影响
如图8所示,与正常组相比,模型组小鼠肺组织中TNFR、TLR4、p65、IL-1β、NLRP3mRNA相对表达水平均高度显著升高(P<0.001),表明LPS诱导的肺损伤可激活NF-κB/NLRP3通路,导致NLRP3炎性小体的过度表达,并进一步活化机体免疫系统,促进细胞因子的释放加重肺损伤。与模型组相比,BRAP-1组小鼠肺组织中TNFR、TLR4、p65、IL-1β、NLRP3mRNA相对表达水平不同程度降低,提示BRAP-1可通过下调NF-κB/NLRP3通路关键基因转录水平调节炎症因子的产生与释放。
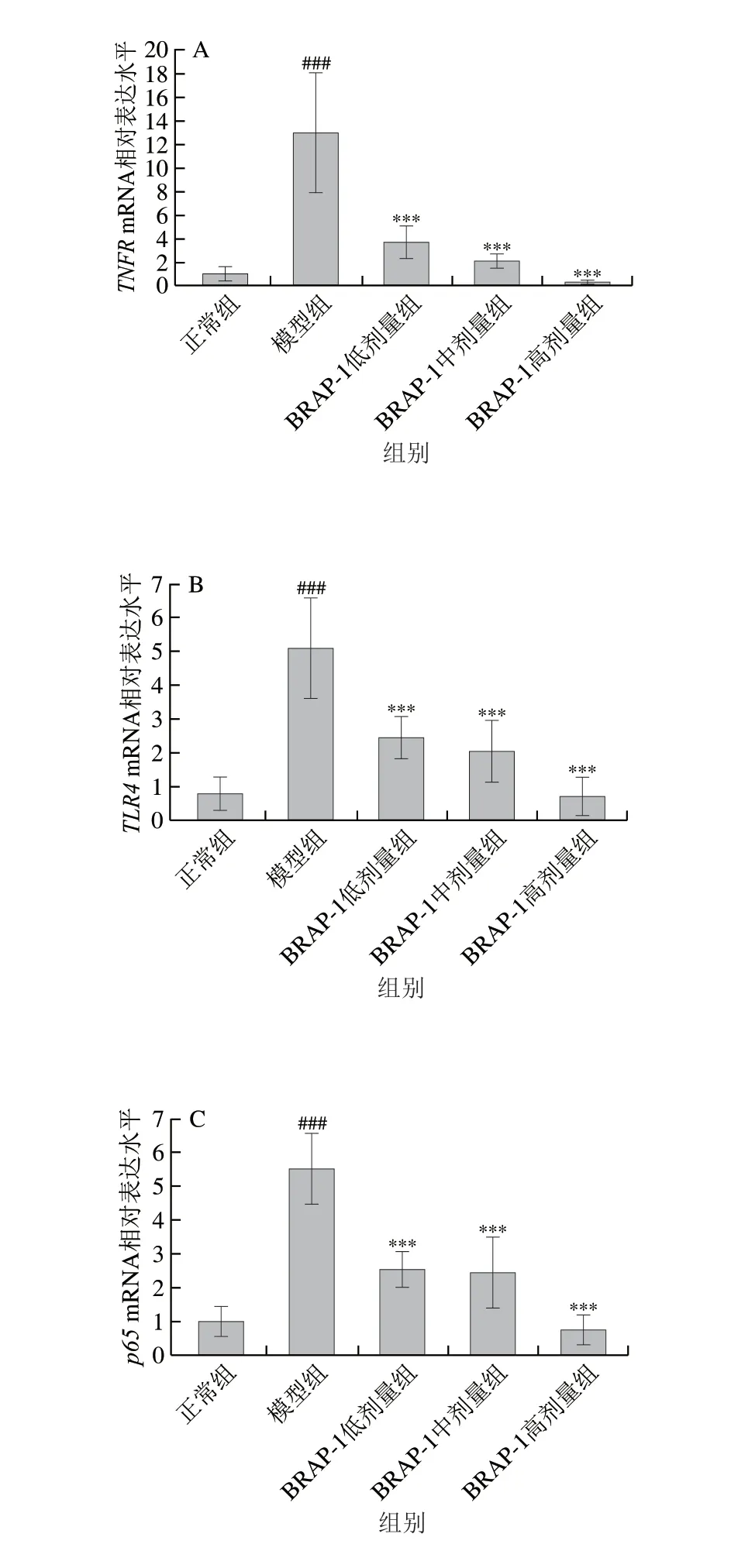
图8 BRAP-1对LPS诱导ALI小鼠肺组织TNFR(A)、TLR4(B)、p65(C)、NLRP3(D)、IL-1β(E)mRNA表达水平的影响Fig.8 Effect of BRAP-1 on the mRNA expression levels of TNFR (A),TLR4 (B),p65 (C),NLRP3 (D) and IL-1β (E) in the lung tissue of LPS-induced ALI mice
3 讨论
本实验对BRAP-1化学组成、分子质量、结构及单糖组成进行分析,发现其总糖、糖醛酸、蛋白质量分数分别为56.7%、13.1%、8.9%,表观分子质量为6 080 Da,并具有β-吡喃糖、糖醛酸结构,主要由葡萄糖、半乳糖、阿拉伯糖组成,单糖物质的量比为4.53∶2.20∶2.07,上述结果可为其肺损伤保护作用研究提供基础支撑。
LPS是革兰氏阴性菌细胞壁的主要生物活性成分[28],长期以来被广泛用于肺损伤动物模型的诱导,病理模型症状与临床症状吻合度较高。因此,本实验采用LPS气管滴注法建立小鼠ALI模型。已有大量研究证实肺湿质量/干质量比值、肺泡灌洗液蛋白质量浓度、总细胞数及组织切片是肺损伤重要病理指标,其变化可提示肺组织水肿、细胞膜通透性、蛋白渗漏、炎性渗出及组织病变程度。本实验结果显示,与肺损伤模型组相比,BRAP-1给药组小鼠肺湿质量/干质量比值、肺泡灌洗液蛋白质量浓度、总细胞数均高度显著降低(P<0.001),HE染色切片中肺组织形态均有所改善,肺损伤程度明显减弱,提示BRAP-1对LPS引起的肺损伤具有保护作用。
研究发现致病物质(如LPS、COVID-19)感染肺部时导致机体TNF、IL、IFN等细胞因子和趋化因子等炎症介质大量释放,且释放水平与疾病严重程度密切相关[29-30]。机体产生的炎症反应是一种防御性机制,释放细胞因子以建立正常的免疫反应,然而过多细胞因子释放导致的“细胞因子风暴”会急剧加重感染症状,甚至导致死亡[31]。本研究发现,BRAP-1能明显抑制肺损伤小鼠血清中TNF-α、IL-6、IL-10、IFN-γ质量浓度,说明BRAP-1能够调节受损肺组织抗炎-促炎免疫平衡、改善免疫因子过度释放状态,对小鼠的炎症反应有显著调节作用。
进一步研究作用机制发现,BRAP-1对炎症相关疾病中的关键通路NF-κB/NLRP3具有调节作用。BRAP-1给药组小鼠肺组织中,与启动此通路相关的两种关键受体——TLR4和TNFR的mRNA表达量降低。与此同时,NLRP3炎性小体及其上游NF-κB p65和下游关键细胞因子IL-1β的基因mRNA表达量均显著降低。提示BRAP-1可调控NF-κB/NLRP3通路相关因子转录水平。
综上所述,BRAP-1对小鼠肺损伤有保护作用。其机制为,一方面调节受损肺组织抗炎-促炎免疫调节平衡,从而减轻肺组织损伤;另一方面,可能通过下调NF-κB/NLRP3通路相关因子转录水平抑制炎症因子的产生与释放。然而,BRAP-1三维空间结构及其对小鼠肺损伤保护作用的分子结构关联还需进一步的研究与探讨。

