局限期前列腺癌高剂量率近距离治疗联合外照射的效果分析
郭威 孙云川 鲁洪岭 尹晓明 何新颖 张一然 范奎
前列腺癌(prostate cancer,PCa)发病率逐年增高[1]。提高外照射总剂量可使PCa患者生存获益[2,3],而PCa患者接受高剂量外照射治疗后晚期不良反应偏重。相比外照射,高剂量率近距离放疗(high-dose rate brachytherapy,HDR-BT)可使放疗剂量提升。PCa α/β值较小[接近1.4(0.9~2.2)Gy]且周围正常组织α/β值为3~10 Gy,应用HDR-BT固有剂量不均性分布特点,实现剂量重建,在保证肿瘤组织治疗剂量提升同时降低周围组织受量[4]。目前,在欧美国家HDR-BT联合外照射治疗局限期PCa技术较为成熟,本科室行HDR-BT联合外照射治疗局限期PCa患者,以期更全面的了解该技术的疗效和不良反应。
1 资料与方法
1.1 一般资料 选择我科2015年1月至2019年1月收治局限期PCa患者23例,患者治疗前均经前列腺穿刺活检病理证实为PCa,初始诊断为T2b3例,初始诊断为T2c2例,其余18例初始诊断为T3a,均行胸部X线片或CT、腹部和盆腔CT或MRI及全身骨扫描检查排除转移病灶。8例患者前列腺体积>60 ml。根据美国国立综合癌症网络(NCCN)[5]对PCa的危险程度分级,中危PCa 4例,高危PCa 19例。见表1。
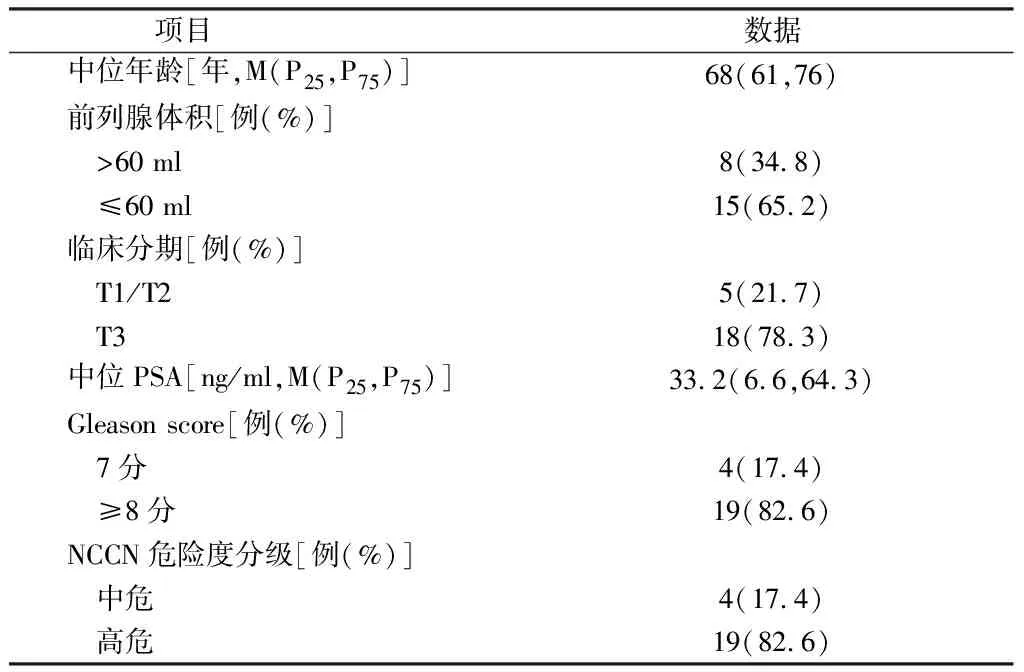
表1 患者一般临床资料 n=23
1.2 方法
1.2.1 内分泌治疗:所有患者在放疗期间及治疗后根据PCa的危险程度分级即刻给予不同时间的完全性雄激素阻断治疗(中危组6个月,高危组2~3年)。患者均采取持续内分泌治疗。
1.2.2 外照射:所有患者外照射前CT定位需排空直肠充盈膀胱,取仰卧位,热塑膜固定。根据北美放射肿瘤协作组(RTOG)PCa勾画共识进行前列腺CTV勾画。采用6 MV X射线适形调强放疗技术。放疗区域为前列腺及精囊区和盆腔淋巴结区,照射剂量45~50 Gy/25 f,1.8~2.0 Gy/次,5次/周,5周为1个疗程。HDR-BT为外照射治疗后的辅助增量治疗。
1.2.3 HDR-BT:对患者进行骶管麻醉,患者取截石位,使用直肠超声(美国TERASON T3000)引导经会阴插入中空施源插植针,平均10根插植针,每根针间隔7~10 mm,而2/3的插植针位于腺体外周带,针尖位于或超过前列腺根部。插植针距尿道≥5 mm,距前列腺精囊>5 mm控制直肠剂量。插植针进针获得满意位置后,获取治疗计划图像,勾画靶区和危及器官,剂量排布过程中不断地根据插植针的实际位置进行实时调整和更新,补偿由于器官变形和移动所导致的误差,保证前列腺所受剂量的适形覆盖。在放射治疗进行之前,整个前列腺需要重新成像,插植针和尿道的位置被TRUS系统捕获,然后计算出最终的治疗方案。采用192Ir放射源进行HDR-BT治疗,制定单次剂量6 Gy覆盖90%肿瘤靶区的放疗计划,共插植3次,每次插植间隔3 d,计算机根据处方剂量自动计算出每个驻留位的驻留时间。肿瘤靶区与危及器官计算剂量体积时均转换为等效生物剂量,优化放疗计划。计划制定后实施后装放射治疗,治疗结束后屏住呼吸拔出插植针,随后复查超声确认有无发生出血等并发症。结束后予以留院观察24 h。见图1。

图1 PCa;HDR-BT治疗过程;A HDR-BT进针过程制定HDR-BT计划;B DVH参数图
1.3 随访 治疗后前3个月每个月进行复查,之后改为每3个月复查1次,2年后每半年复查1次,5年后每1年复查1次。随访期间主要监测血清PSA水平。若随访期间出现疾病进展,则根据实际情况缩短复查时间,必要时复查胸、腹、盆腔CT或MRI及全身骨扫描等检查明确是否出现局限性或远处转移。生化复发定义为PSA值下降至最低点后又升高>2.0 ng/ml[6]。急性治疗相关不良反应评价参照CTCAE v4.0标准,晚期治疗相关不良反应采用RTOG标准,放疗结束后3个月以上发生的放疗相关不良反应被定义为晚期不良反应。
1.4 统计学分析 应用SPSS 17.0统计软件,计数资料采用χ2检验,不符合正态分布的计量资料以M(P25,P75)表示,采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 随访情况 截止2021年1月,中位随访时间35个月(14~56个月),随访率100%。
2.2 疗效评价
2.2.1 联合治疗后监测血清PSA值,最低值为0~4.20 ng/ml,中位数为0.01 ng/ml,除2例最低血清PSA>2 ng/ml,其余患者最低值均<2 ng/ml。随访期间出现生化复发4例,出现远处转移2例(治疗后22个月及28个月)。死亡2例,死于PCa复发1例,死于心血管意外1例。见表2。

表2 4例生化复发患者一般资料
2.2.2 治疗后总体无生化进展生存率(bPFS)为82.6%(19/23),无远处转移生存率(DDFS)为91.3%(21/23),总生存率(OS)为91.3%(21/23),疾病特异性生存率(CSS)为95.6%(22/23)。总体3年bPFS、DDFS、OS及CSS分别为85.5%、89.3%、92.9%及92.9%。见图2。
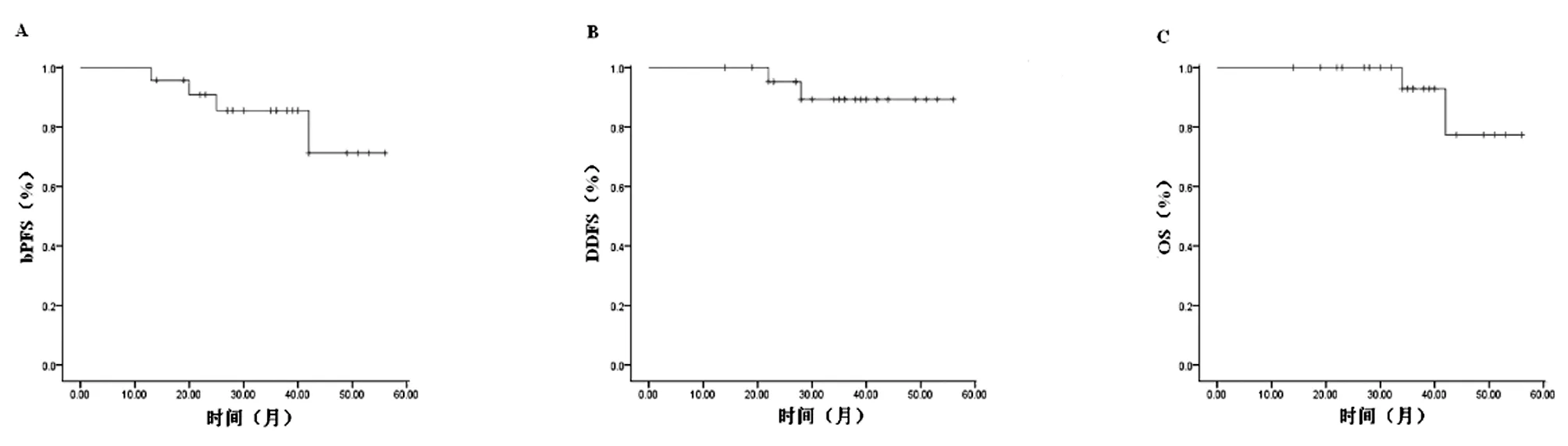
图2 总体PCa患者预后生存分析;A 3年bPFS;B 3年DDFS; 3年OS
2.3 随访 共18例(78.2%)患者出现不同程度的下尿路刺激症状,主要表现为尿急、尿频、尿痛及轻度急迫性尿失禁,治疗后1~4周时最严重,此后逐渐缓解,对症治疗后3个月内逐步恢复到治疗前水平。治疗后1例患者出现轻度放射性直肠炎症状,表现为肛门直肠部酸痛,治疗后1个月内自行缓解,无直肠瘘和尿瘘等严重治疗相关不良反应的发生。所有患者无严重晚期胃肠及泌尿系统不良反应发生。初治时前列腺体积>60 ml的部分患者直肠及泌尿系统不良反应未见明显增加(P>0.05)。见表3。
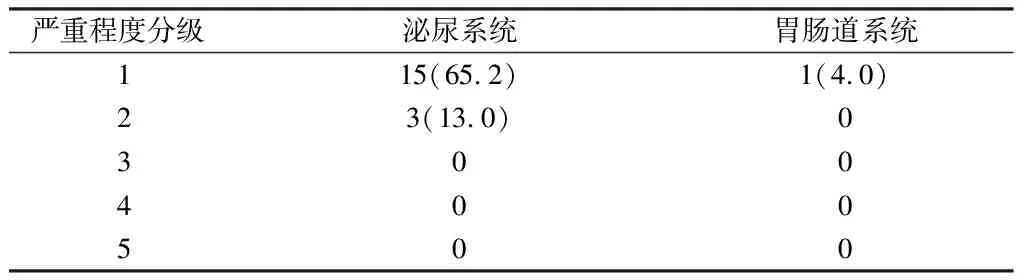
表3 治疗相关急性不良反应情况 n=18,例(%)
3 讨论
目前,局限期PCa的治疗包括主动观察监测、根治性手术、外照射治疗和近距离放射治疗。主要根据医师经验或患者对不同治疗方案所致不良反应的接受程度选择不同的治疗方案。其中PCa近距离放射治疗因其创伤小及良好的预后,已成为PCa标准治疗方法之一[7]。与外照射相比,其不良反应较少,被患者易于接受[8]。ABS指南推荐对局限期PCa可采用近距离放射治疗,其中低危PCa可采取单纯近距离放射治疗,中危PCa则需要结合患者具体情况决定是否加用外照射和内分泌治疗,高危PCa推荐联合应用近距离放射治疗、外照射及内分泌治疗[9]。
相比外照射治疗,近距离放疗可使放疗剂量更大提升。20世纪80年代经直肠超声检查技术的出现为低剂量率(low-dose rate,LDR)粒子植入[10]和HDR-BT[8]提供了可靠手段。在过去的几十年中,HDR-BT向着低分割次数和高单次剂量的方向发展[11]。目前技术成熟的医学中心可在2 h内完成麻醉下植入和治疗。
根据ABS指南推荐:前列腺腺体体积>60 ml是PCa近距离治疗的相对禁忌,但部分研究提示增大的前列腺也可行近距离治疗[12]。本研究所有患者确诊PCa后即开始接受内分泌治疗,其原因是部分患者前列腺体积>60 ml,短疗程内分泌治疗(3~6个月)可使前列腺腺体体积缩小27%~50%[13]。而目前欧美国家HDR-BT通常使用14~18根插植针[14],而本研究平均使用10根插植针,可能原因是欧美国家患者前列腺体积较东亚国家患者偏大,且本研究放疗期间内分泌治疗及外照射使前列腺体积明显缩小。
对于中高危局限期PCa行HDR-BT联合外照射及内分泌治疗,国外已有不少文献报道。一项研究显示,实验组生化控制率明显高于对照组,3年生化控制率分别为86%和53%[15]。Yaxley等[16]研究共入组507例中高危局限期PCa患者,中位随访10.3年,中危PCa患者10年无生化失败生存率为87%,而高危患者仅为57%。Vigneault等[17]研究832例局限期PCa患者接受HDR-BT联合外照射治疗,10年无生化失败生存率为92.5%,当BED为250~260 Gy时,超87%的PCa患者5年PSA<0.2 ng/ml。Martinez等[11]研究提示BED是生存率最重要的影响因素。而Galalae等[18]研究结果更为突出,尽管治疗方案BED为423 Gy,但其中高危患者10年无生化失败生存率仅为65%。分析原因可能是其研究的剂量分布不均造成,后者仅前列腺外周带接受了处方剂量,而前列腺中央带的单次剂量<9 Gy,远低于前列腺优势病变区域剂量。本结果与相关研究报道的联合治疗结果相比,总体治疗效果相当,无生化失败结果稍偏低可能与本组患者治疗前PSA水平偏高及高危患者偏多相关。
HDR-BT联合外照射治疗PCa是可耐受的。治疗相关不良反应主要表现为:直肠疼痛,便血,肠炎等(胃肠道系统)和尿路狭窄,尿频,血尿,尿失禁,尿潴留,尿路梗阻,勃起障碍等(泌尿系统)。目前有关外照射联合HDR-BT的危及器官限量未达成共识,GEC-ESTRO推荐以EQD2等效剂量作为限制条件(包括外照射):直肠D 2 cm3≤75 Gy,尿道:D 0.1 cm3≤120 Gy,D 10≤120 Gy,D 30≤105 Gy[19]。联合治疗晚期3级泌尿系统不良反应≤5%。尽管有报道显示尿路狭窄发生率高达30%[16],但大部分发生在尿道球部,该区域对单次高剂量模式极为敏感,在制定治疗计划时尽量避免。而CT引导下多次进针也可导致尿路狭窄高发。手术操作过程中应注意前列腺尖部,严格剂量限制,及时纠正插植针位移,可将治疗后尿路狭窄发生率降至<5%,将晚期胃肠3级不良反应降低至<3%[16]。目前部分回顾性研究显示对于大体积(>60 ml)PCa患者,联合治疗不会增加胃肠及泌尿系统不良反应[20],但该结论仍需Ⅲ期临床研究进一步验证。一项研究分析了联合治疗中HDR-BT的DVH相关参数,发现出现2~3级泌尿系统急性不良反应患者的尿道V30-V150值明显高于0~1级患者,其尿道D 10及D 20值也明显偏高,而插植针数量与急性泌尿系统不良反应严重程度无明显关联[21]。因此,HDR-BT在制定放疗计划时应尽量压低尿道剂量,避免严重不良反应发生。
综上所述,局限期PCaHDR-BT联合外照射安全可行的治疗方案,潜在优势巨大,但尚需扩充研究数据进一步研究。

