柚皮素对胰腺癌细胞PANC-1增殖和凋亡的影响
夏莹 王世全 路伟
胰腺癌是目前死亡率较高,生存期较短的恶性肿瘤之一。胰腺癌在我国属于高发性疾病,发病率为7/10万,然而胰腺癌的发病率仍逐年上升[1]。胰腺癌早期症状不明显,有症状出现时多为中晚期,加之胰腺所处的位置关系,治疗效果一直不佳。胰腺癌的5年生存率非常低,大约在5%[2]。近年来由于治疗技术的发展,对胰腺癌的治疗取得了一定的效果,但胰腺癌5年生存率仍是癌症中最低的。因此,寻找新的治疗药物及方法对提升胰腺癌患者生存率有重要意义。从天然药物中筛选治疗胰腺癌的有效成分是目前重要的研究方向,柚皮素(Naringenin,NA)分子量为272,是一种天然黄酮类化合物,具有多种生物活性和药理作用。有研究发现,NA可以抑制肝癌、胃癌、乳腺癌等[3],有文献报道NA可以抑制胰腺癌细胞的浸润[4],但对胰腺细胞增殖和凋亡是否有影响,以及可能的机制需要进一步验证。糖原合成酶激酶-3β(GSK-3β) 是一种在进化上非常保守的丝氨酸/苏氨酸激酶。GSK-3β能调节细胞分化、增殖、存活和凋亡[5]。胰腺癌细胞中高表达GSK-3β[6]。因此,本实验探讨NA对人胰腺细胞PANC-1细胞活力、增值及凋亡的影响,以及GSK-3β在其中的作用,为临床应用提供实验数据。
1 材料与方法
1.1 材料 PANC-1 细胞(西京医院消化病医院保存),胎牛血清(澳大利亚),NA(sigma,美国),96孔板及24孔板(Costar,美国);总蛋白提取试剂盒,BCA蛋白定量试剂盒(康维试剂,中国);CCK 8试剂盒(七星,中国);兔源Ki-67、Cleaved caspase-3、GSK-3β、p-GSK-3β 和GAPDH一抗(abcam,英国);HRP标记的山羊抗兔二抗(GenTex,美国);Annexin VFITC凋亡检测试剂盒(四季青生物,中国)。
1.2 方法
1.2.1 细胞培养:PANC-1细胞用含有10%胎牛血清的RPMI-1640培养基在37℃、CO2体积分数为5%的恒温培养基中培养,第3天进行传代培养。
1.2.2 慢病毒转染:根据上海吉凯生物公司慢病毒手册,在1 ml培养液中加入6 mg/ml 聚凝胺1 μl,在含有聚凝胺的培养液中加入对照慢病毒(上海吉凯生物,货号:GIDV0210639)或GSK-3β过表达慢病毒(上海吉凯生物,货号:GIDV0210640);转染12 h后更换为正常培养基,72 h后通过倒置荧光显微镜观察细胞GFP的表达,并分析病毒转染效率,然后冻存备用。
1.2.3 药物配制:用微量二甲基亚砜将NA全部溶解,使得NA的浓度为100 μmol/ml,然后将液体作为原液储存于-20℃冰箱中,用前用含有10%胎牛血清的RPMI-1640培养液将储存液稀释到实验所需浓度。
1.2.4 实验分组:将PANC-1细胞分为0 μmol/L、50 μmol/L、100 μmol/L、200 μmol/L和400 μmol/L组,分别用0 μmol/L、50 μmol/L、100 μmol/L、200 μmol/L和400 μmol/L的NA处理PANC-1细胞,进行后续检测。
1.2.5 CCK-8检测细胞活性:5组细胞分别在24 h、48 h和72 h,每个浓度4个复孔,每孔中加入10 μl的CCK 8试剂。37℃继续温育4 h后酶标仪450 nm 测定细胞活性。
1.2.6 细胞计数:在0 μmol/L组、50 μmol/L组、100 μmol/L组、200 μmol/L组和400 μmol/L组,每组4孔,培养48 h后,胰酶消化,收集细胞,细胞计数仪计数,计算细胞增值倍数。
1.2.7 蛋白印迹法(Western blot)检测蛋白表达:RIPA裂解液提取各组细胞蛋白,每组4孔,BCA定量试剂盒检测蛋白浓度。取20 μg蛋白进行聚丙稀酰胺凝胶电泳,按湿转法将电泳产物转移到PVDF膜。5%的胎牛血清白蛋白常温封闭1 h,分别加入一抗Ki-67、GSK-3β、p-GSK-3β、Cleaved caspase-1和GAPDH,4℃孵育过夜;辣根过氧化物酶标记的二抗室温孵育2 h,TBST洗膜3次,滴加发光液(Milipore,货号:wbklso500)凝胶成像仪采集图像。
1.2.8 RT-PCR GSK-3β引物序列为:上游5’-AGTGGTGAGAAGAAAGATGAG-3’,下游3’-TGACATAAATCACAGGGAG-5’,具体操作步骤按照SYBR定量荧光PCR试剂盒进行操作。
1.2.9 流式细胞仪Annexin V-PI双染检测细胞凋亡:使用0 μmol/L、100 μmol/L、200 μmol/L、400 μmol/L、control virus和GSK-3β,培养48 h后,使用胰酶消化,在4℃离心机中1 000 r/min离心10 min,收集细胞;然后加入100 μl Binding Buffer重悬细胞并加入5 μl Annexin V-FITC 和5 μl PI,混匀;室温避光孵育15 min,流式细胞检测。
2 结果
2.1 NA对PANC-1细胞活力的影响 CCK-8检测NA对胰腺癌PANC-1细胞的活力的影响,结果显示100~400 μmol/L的NA均对PANC-1细胞的活力有抑制作用,随着浓素的增加抑制作用越来越明显,且100~200 μmol/L时抑制率变化最大(P<0.05),在200 μmol/L时抑制效果最明显;当NA浓度从200 μmol/L增加至400 μmol/L时,NA对PANC-1细胞的抑制作用未发生明显变化(P>0.05)。同一浓度随时间的延长抑制效果越明显,48 h时抑制效果最好(P<0.05),72 h的抑制效果与48 h无差异(P>0.05)。表明NA对PANC-1细胞活力的抑制作用在100~200 μmol/L时存在明显浓度依赖性,浓度越大抑制作用越强;且NA对PANC-1细胞活力的抑制作用在0~48 h时存在时间依赖性,时间越长,抑制越明显。见表1。

表1 NA对细胞活性的影响 n=4,%,
2.2 NA对PANC-1细胞增值的影响 根据以上预实验结果,选择浓度为0、100、200、400 μmol/L 的NA对PANC-1细胞作用48 h,观察细胞增值倍数和细胞增殖相关蛋白Ki-67的表达量。
2.2.1 与0 μmol/L组比较,100 μmol/L组、200 μmol/L组和400 μmol/L组PANC-1细胞的增殖倍数明线降低(P<0.05);与100 μmol/L组比较,200 μmol/L组和400 μmol/L组PANC-1细胞的增殖倍数进一步降低(P<0.05),200 μmol/L组和400 μmol/L组PANC-1细胞增殖倍数差异无统计学意义(P>0.05)。见表2。

表2 NA对细胞增值的影响 n=4,
2.2.2 免疫荧光法检测ki-67阳性细胞数量,Westeerm blot 法检测Ki-67 蛋白表达水平,结果显示:与0 μmol/L组比较,100 μmol/L组、200 μmol/L组和400 μmol组ki-67阳性细胞数量和Ki-67蛋白表达水平降低(P<0.05);与100 μmol/L组相比较,200 μmol/L组和400 μmol/L组ki-67阳性细胞数量和Ki-67蛋白的表达水平进一步降低(P<0.05),200 μmol/L组和400 μmol/L组表达无明显变化(P>0.05)。见图1,表3。
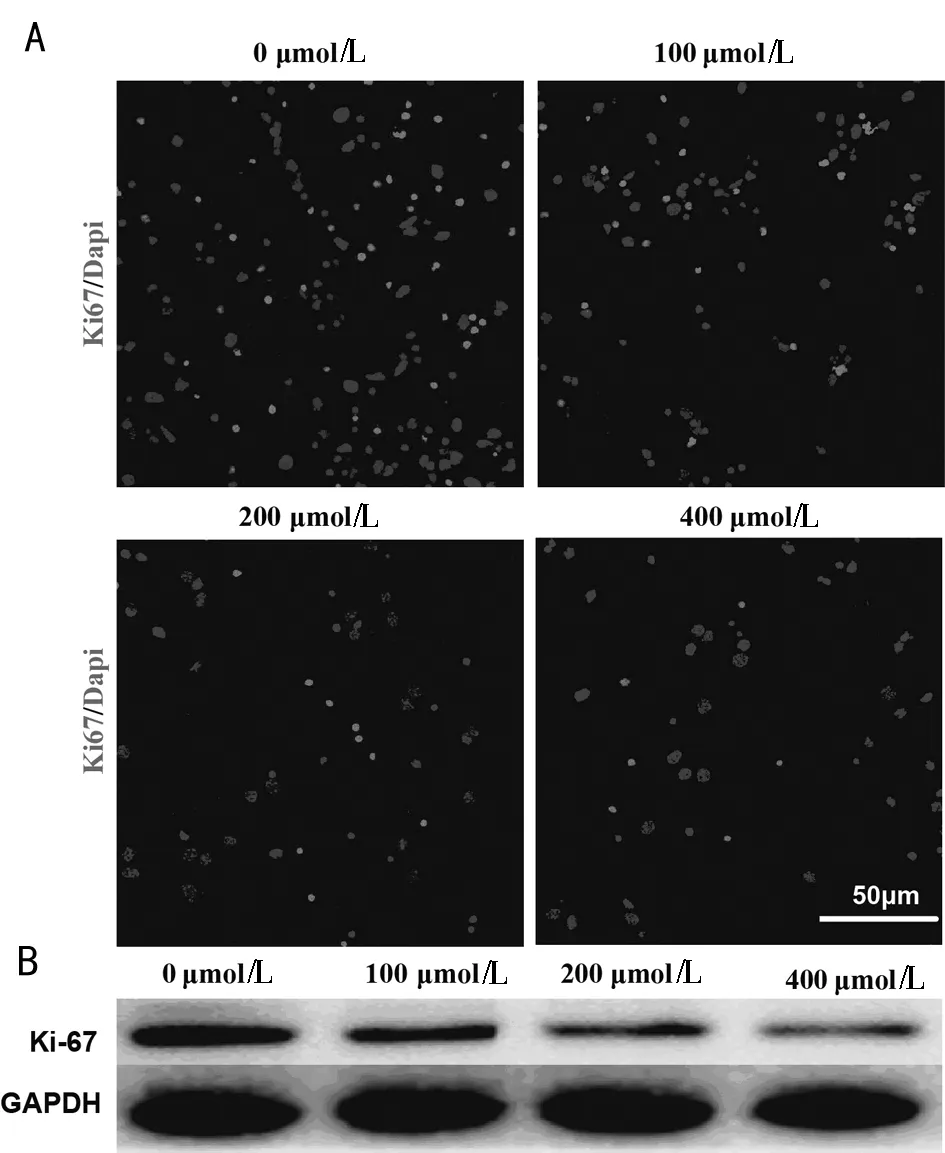
图1 NA对Ki-67阳性细胞数量及Ki-67表达水平的影响;A ki-67代表;B PANC-1细胞Ki-67相对表达量

表3 NA对Ki-67阳性细胞数及表达量的影响 n=4,
2.3 NA对PANC-1细胞凋亡的影响 流式细胞技术测定0、100、200、400 μmol/L 的NA对PANC-1细胞作用48 h用各组细胞凋亡百分比。结果显示:与0 μmol/L组相比较,100 μmol/L组、200 μmol/L组和400 μmol/L组细胞凋亡百分比增加(P<0.05);与100 μmol/L组比较,200 μmol/L组和400 μmol/L组细胞凋亡百分比进一步增加(P<0.05),200 μmol/L组和400 μmol/L组无显著变化(P>0.05)。Westerm blot法检测Cleaved caspae-3的含量,结果显示:100 μmol/L组、200 μmol/L组和400 μmol/L组Cleaved caspase-3的含量增加,且均与0 μmol/L比较有统计学意义(P<0.05);与100 μmol/L组比较,200 μmol/L组和400 μmol/L组Cleaved caspase-3的含量增加(P<0.05),200 μmol/L组和400 μmol/L组间无差异(P>0.05)。见表4,图2。

图2 流式细胞术检测不同组PANC-1细胞凋亡及cleaved caspase-3表达水平; A 流式细胞仪检测各组细胞凋亡比例分布;B PANC-1细胞中Cleaved caspase-3相对表达量

表4 NA对PANC-1细胞细胞凋亡的影响 n=4,
2.4 NA对PANC-1细胞GSK-3β含量及活性的影响 Westerm blot方检测GSK-3β和p-GSK-3β的表达水平,RT-PCR检测GSK-3β mRNA的表达水平,结果显示:与0 μmol/L组比较,100 μmol/L组、200 μmol/L组和400 μmol/L组GSK-3β、p-GSK-3β和GSK-3β mRNA的表达水平降低(P<0.05);与100 μmol/L组比较,200 μmol/L组和400 μmol/L组GSK-3β、p-GSK-3β和GSK-3βmRNA的表达水平进一步降低(P<0.05),200 μmol/L组和400 μmol/L组间表达无明显变化(P>0.05)。见图3,表5。
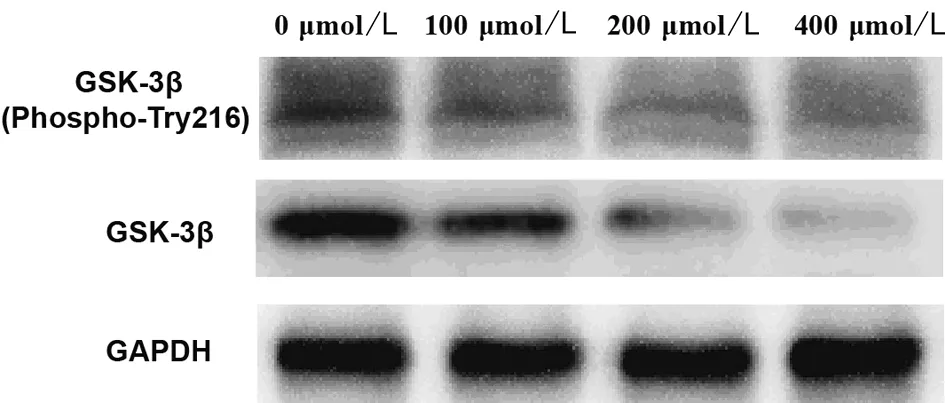
图3 PANC-1细胞中p-GSK-3β和GSK-3β的表达水平

表5 NA对PANC-1细胞GSK-3β的影响n=4,
2.5 过表达GSK-3β对NA抑制PANC-1细胞增殖和促进细胞凋亡的影响 根据以上结果,选择200 μmol/L/L NA进行以下实验,进一步验证GSK-3β在NA促进PANC-1凋亡中的作用。结果显示:与control virus比较,过表达PANC-1细胞中的GSK-3β可以部分逆转NA对PANC-1细胞的作用,表现为Ki-67阳性细胞百分比增加(P<0.05);Ki-67蛋白表达量增加(P<0.05),细胞凋亡百分比降低(P<0.05);Cleaved caspase-3表达水平下降(P<0.05)。见图4,表6。

图4 过表达GSK-3β对NA作用的影响;A PANC-1细胞中Ki-67和Cleaved caspase-3的表达水平;B 流失细胞术检测不同组PANC-1细胞凋亡;C ki-67典型代表

表6 过表达GSK-3β对NA作用的影响 n=4,
3 讨论
胰腺癌症状不明确、诊断手段有限,胰腺癌的5年生存率非常低。造成的主要原因是胰腺癌细胞的多重耐药性。联合用药是解决耐药性的主要方法,然而联合用药可以增加药物毒性及不良反应。中药单体是从中药材中提取出的天然化合物,具有安全性高、毒性低的特点。其分子结构清晰,生物活性好,药理作用相对明显,且研究证实中药单体在抗肿瘤细胞耐药性方面发挥着重要作用[7]。NA是从中药中提取的一种天然有机化合物,分子式为C15H12O5,具有多种生物学功效[8]。NA具有抗胃癌、肺癌、肝癌、前列腺癌和乳腺癌的作用。主要分子机制包括抑制MMP-2、MMP-9、磷酸化AKT、MAPKs/AP-1以及Ikks/IκB/NF-κB等;激活caspase-3、PARP以及DR5等[9]。有研究证实NA可以通过TGF-B1/Smad3通路抑制胰腺癌细胞的迁移[10]。本实验表明,100~400 μmol/L的NA均可降低PANC-1细胞的活力,抑制增殖,同时促进胰腺癌细胞凋亡的作用,在100~200 μmol/L有浓度依耐性,在200~400 μmol/L没有浓度依耐性。相同浓度下,48 h的抑制率比24 h强,表明NA的作用具有时间依耐性;而在同一浓度下48 h的抑制率和72 h间无明显差异。导致这种NA作用时间和浓度特点可能和NA在细胞的转运方式是ATP依赖的被动转运方式有关。
在有氧或无氧条件下,癌细胞比正常细胞代谢更多的糖并转化为乳酸,为大分子的合成提供物质基础,也可以促进肿瘤细胞对周围正常组织的侵袭。糖原合成酶激酶-3(GSK-3)是一种在进化上非常保守的丝氨酸/苏氨酸激酶,大约有100个已知靶点,不仅参与调控糖代谢还参与调控多种细胞途径,包括正常细胞的内环境稳态,也可以促进肿瘤的发展、侵袭和转移[11]。GSK-3有两种亚型:GSK-3α和GSK-3β。两种亚型在组织中的分布不同,GSK-3α在神经系统、卵巢和皮肤中低表达,而在网织红细胞和阑尾中高表达。GSK-3β在网织红细胞、淋巴结和胰腺组织中低表达,而在NK细胞和骨髓粒细胞中高表达。有文献证实GSK-3β在胰腺癌的发展过程中表达量逐渐增加,并在肿瘤侵袭和对化疗耐受方面发挥重要作用[12]。GSK-3β通过自身磷酸化来调控其活性,在216和279位点酪氨酸磷酸化可以增加其活性。在胰腺癌细胞种216位点酪氨酸磷酸化水平增高。GSK-3β可以促进STAT3的磷酸化从而增加NFATc2-STAT3复合物,调控细胞增殖相关基因表达促进癌细胞增殖[13]。GSK-3β抑制剂可以降低GLI1组织G1到S期的转换抑制胰腺癌细胞增殖。GSK-3β不但促进胰腺癌细胞增殖外,还可以通过磷酸化MDM2抑制细胞凋亡[14]。本实验证实NA可以降低GSK-3β的蛋白含量和mRNA表达水平,同时可以降低216位点磷酸化GSK-3β的表达,说明NA不但降低胰腺癌细胞PANC-1种GSK-3β的含量也降低GSK-3β的活性。进一步用慢病毒过表达PANC-1细胞中GSK-3β,发现NA对PANC-1细胞增殖和凋亡的影响减弱。
综上所述,NA通过降低GSK-3β的表达及活性抑制PANC-1细胞增殖,促进凋亡。

