ACTR调控IGF-1R对肝癌细胞生长的影响
刘文鹏 曹经琳 赵鑫 窦剑 马路园 赵彩彦
肝细胞癌(hepatocellular carcinoma,HCC)是肝脏最常见的恶性肿瘤,流行病学调查研究显示,其发病率位于所有肿瘤中的第五位,肿瘤致死性疾病中的第三位,并且具有一定的性别差异,于男性中排名第三位,女性中排名第八位[1,2]。HCC发病隐匿、生长速度快、恶性程度高,常伴有血管侵犯、肝内及肝外转移、治疗后复发等,临床预后较差,其5年生存率仅为3%~25%,严重危害人类的健康[3,4]。甲状腺激素受体和视黄醛激活因子(activator of thyroid and retinoid receptor,ACTR, also known as SRC-3/AIB1/NCoA3), 其编码的蛋白是一种类固醇激素受体的转录辅激活因子,为细胞核激素受体共激活剂P160家族的成员之一,被定义为原癌基因,通过与核激素受体和其他转录因子作用而发挥生物学功能[5,6]。有研究证实,ACTR在大约68%的肝癌中呈高表达,并可以在体内外促进肝细胞癌的进展[7-9]。胰岛素样生长因子及其受体(insulin-like growth factors, IGFs)是能量代谢和生长的关键调控因子,现在越来越多的学者也发现,IGFs及其调节的信号转导网络在肿瘤的发生发展过程中也发挥了关键的作用,可以调控细胞增殖、分化、凋亡、血管生成等过程,成为肿瘤研究的热点。IGFs受体系统由多种受体组成,其中IGF-1R介导了其大多数的生物学作用[10,11]。现阶段的研究仍未完全阐明HCC的发病机制,因此,探究肝癌发生发展的分子机制,发现调控肝癌发生发展过程中的新分子、新机制将为肝癌的诊断和治疗提供重要的理论依据和分子靶标,具有重要的科研及临床意义。本研究采用免疫共沉淀、细胞免疫荧光共定位、Western blot及qRT-PCR、细胞生长测定等方法探究ACTR与IGF-1R二者之间的相互作用,及对肝癌细胞生长的影响和意义。
1 材料与方法
1.1 材料 人肝癌细胞系HepG2,HEK293T,美国ATCC;兔抗ACTR多克隆抗体、兔抗β-actin多克隆抗体,Santa Cruz Biotechnology;兔抗IGF-1R多克隆抗体、兔抗Myc、Flag多克隆抗体、DAPI,美国Cell Signaling Technology公司; Myc-IGF-1R、Flag-ACTR质粒,SinoBiological公司;质粒提取试剂盒,Promega公司;RNA提取分离试剂盒、miRNA cDNA第一链合成试剂盒、荧光定量PCR预混试剂盒,北京天根生化科技有限公司;Cell Counting Kit-8试剂盒,Dojindo公司;Lipofectamine 2000、Lipofectamine RNAiMAX 赛默飞公司。
1.2 方法
1.2.1 细胞培养与转染:细胞系常规培养于含10%胎牛血清的DMEM培养液中,37℃,5%二氧化碳。取对数生长期的细胞,按照实验分组,根据说明书要求配置转染溶液,应用Lipofectamine 2000 用于质粒转染,Lipofectamine RNAiMAX 用于siRNAs转染细胞。
1.2.2 免疫共沉淀:外源性免疫共沉淀,收集转染后细胞,裂解缓冲液处理30 min(含有50 mmol/L Tris pH 值8.0, 500 mmol/L NaCl, 0.5% Nonidet P-40, 1 mmol/L DTT,蛋白酶抑制剂),超声碎裂细胞后,加入抗Flag琼脂糖珠子,置于4℃过夜充分结合,裂解缓冲液洗涤,SDS洗脱,行Western blot检测。内源性免疫共沉淀,直接收集细胞,用IGF-1R行交联结合,余步骤同外源性免疫共沉淀。
1.2.3 免疫荧光行ACTR、IGF-1R细胞内共定位:取培养好的细胞,PBS洗涤后4%多聚甲醛固定30 min,PBS洗涤,0.5%Triton-100+1%NGS于冰上裂解并固定10 min,1%NGS+PBS封闭,加一抗并置于4℃孵育2 h,1%NGS洗涤3遍,后续步骤避光操作,加二抗孵育1 h,PBS洗涤3遍,DAPI染色,PBS洗涤3遍,封片,于显微镜下观察。
1.2.4 qRT-PCR检测细胞中IGF-1R mRNA表达:实验分为3组:阴性对照组、ACTR敲低组、ACTR敲低并回转组。利用RNA提取分离试剂盒,根据说明书,提取细胞中总RNA,进行逆转录后,再行PCR扩增。反应程序:预变性95℃,15 min。三步法反应94℃,15 s;55℃,30 s;72℃,30 s;进行40个循环,于每个循环的第三步72℃,30 s收集荧光信号。熔解曲线,60℃,5 s收集信号,至95℃,每一步增加0.5℃。结束。引物序列:IGF-1R:正向5’-GAGGAGATGGAGCCTGGCTTC-3’,反向5’-GTGTCTGTCGGGCAGTGGCAG-3’。β-actin:正向5’-ATCACCATTGGCAATGAGCG-3’,反向5’-TTGAAGGTAGTTTCGTGGAT-3’。
1.2.5 CCK8法测定细胞生长:实验分为4组:阴性对照组,转染ACTR组,敲低IGF-1R组,敲低IGF-1R+转染ACTR组。转染前1 d接种细胞,当细胞融合度达到70%转染; 48 h后胰蛋白酶消化,加入适量DMEM培养基吹打混匀,配制成单细胞悬液;取10 μl单细胞悬液,应用细胞计数器计数浓度;将细胞稀释至合适浓度,分别接种于96孔板,每孔3 000个细胞,设置复孔,周围孔内加入PBS缓冲液作为保护孔;置于37℃,5%的CO2培养箱中常规培养;按照说明书,配制实验溶液,将CCK-8试剂与DMEM培养基按照1∶9比例配制,吸弃96孔板中培养基,每孔加入100 μl配置好的CCK-8,1 h后于波长450 nm测定样品OD值;于每日同一时间测定OD值。
1.2.6 Western blot技术检测蛋白表达量:收集细胞,RIPA裂解细胞,利用煮沸方法制备蛋白样品,SDS-PAGE电泳,转膜,牛奶封闭膜上蛋白的非特异性抗原后,加入一抗,4℃孵育过夜,TBST洗膜,再用二抗37℃孵育1 h,TBST洗膜,加化学发光试剂避光显影。
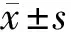
2 结果
2.1 外源性免疫共沉淀 质粒转染细胞后,细胞内表达的ACTR与IGF-1R存在相互作用。见图1、2。
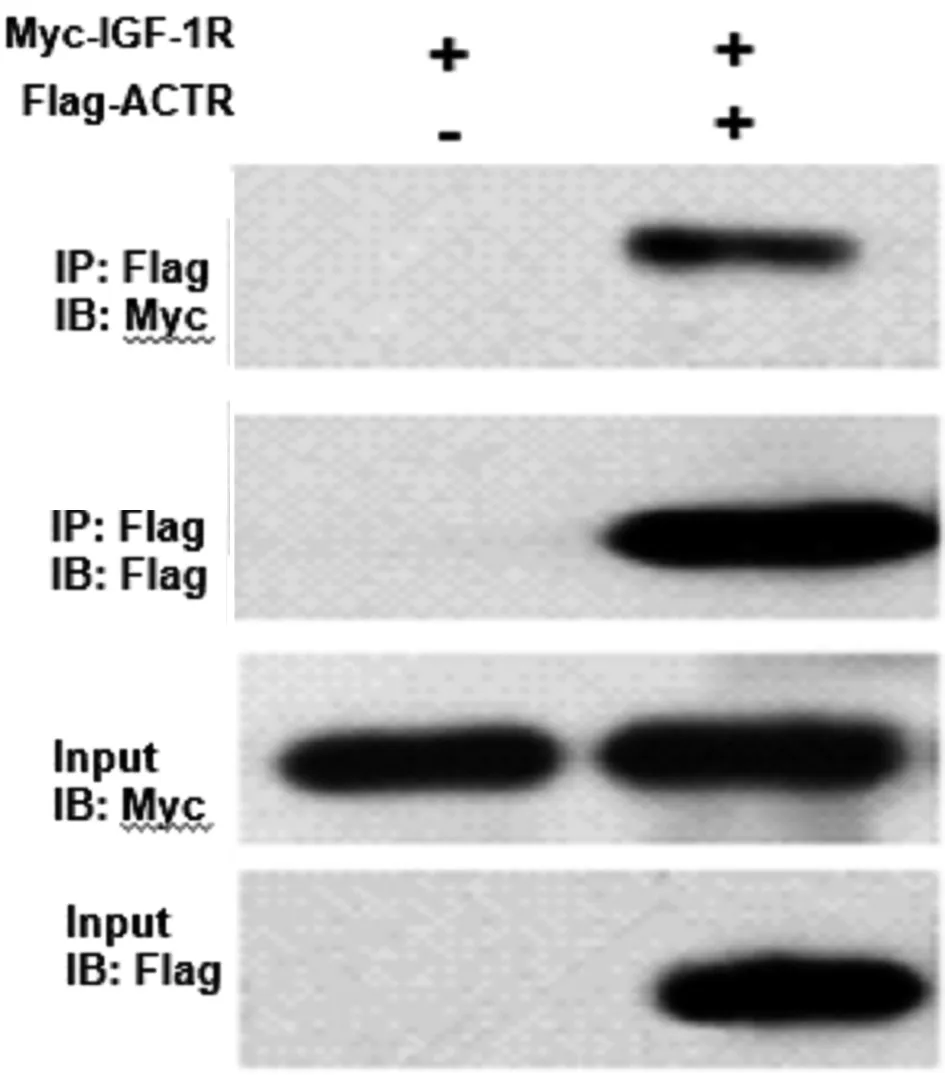
图1 外源性免疫共沉淀检测ACTR和IGF-1R之间相互作用
2.2 内源性免疫共沉淀 肝癌HepG2细胞系内ACTR与IGF-1R之间存在相互作用。见图2。
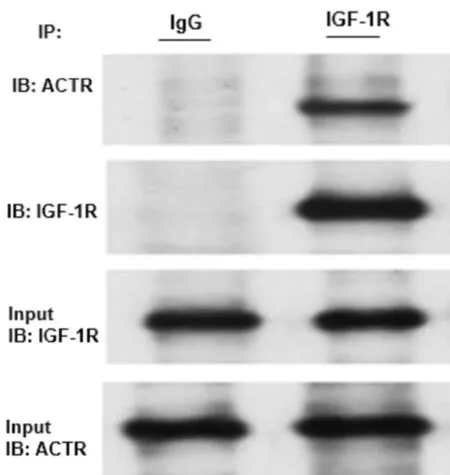
图2 内源性免疫共沉淀检测ACTR和IGF-1R之间相互作用
2.3 细胞免疫荧光检测 肝癌HepG2细胞系内,ACTR与IGF-1R在细胞内存在共定位。见图3。
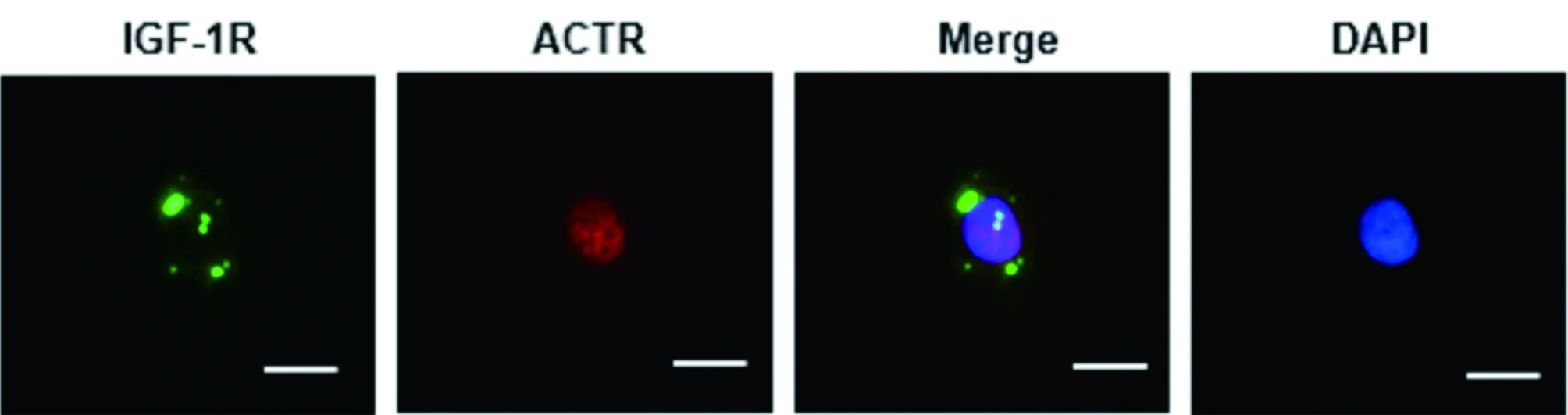
图3 免疫荧光检测ACTR和IGF-1R细胞内共定位
2.4 ACTR抑制IGF-1R mRNA表达 qRT-PCR技术检测IGF-1R mRNA表达水平,敲低ACTR后,IGF-1R mRNA表达水平为(0.54±0.09),较对照组(1.00±0.04)明显降低,差异有统计学意义(P<0.05);回转ACTR后IGF-1R mRNA表达水平可恢复为(1.26±0.10),与对照组比较差异无统计学意义(P>0.05)。见表1。

表1 ACTR对IGF-1R mRNA表达水平的影响
2.5 ACTR抑制IGF-1R蛋白表达 Western blot技术检测细胞中IGF-1R、ACTR目标蛋白的表达,与对照组相比,敲低ACTR后IGF-1R表达降低,差异有统计学意义(P<0.05),而回转ACTR后IGF-1R表达可恢复。见图4。

图4 ACTR对IGF-1R 蛋白表达水平的影响
2.6 ACTR通过IGF-1R调控肝癌细胞的生长作用 CCK8法测定细胞生长并绘制曲线。与IGF-1R Wild type+Empty Vector组相比,转染并过表达ACTR组能够促进肝癌细胞的生长,差异有统计学意义(P<0.05);与IGF-1R Wild type+Empty Vector组相比,敲低IGF-1R可抑制肝癌细胞的生长,差异有统计学意义(P<0.05);与敲低IGF-1R组相比,敲低IGF-1R+转染ACTR组促生长作用减弱,差异无统计学意义(P>0.05),即敲低IGF-1R后ACTR的促细胞生长作用减弱。见图5,表2。

表2 ACTR调控IGF-1R对肝癌细胞生长的影响
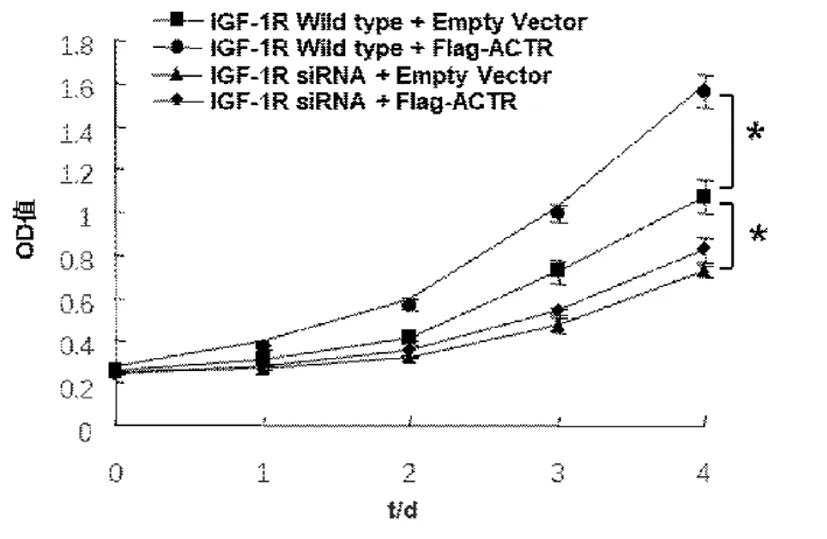
图5 ACTR调控IGF-1R对肝癌细胞生长的影响(*P<0.05)
3 讨论
肝细胞癌是全世界范围内病死率居高不下的恶性肿瘤之一,也是我国较常见且高发的恶性肿瘤,严重危害着人们的健康,因此如何早期诊断HCC,进行有效的预防和治疗具有重大意义[12]。外科手术彻底切除肿瘤病灶是治疗肝癌的最有效的手段,但大多数肝癌患者均伴有不同程度的肝纤维化、肝硬化等,发病隐匿,发现时已经处于晚期,仅有15%~30%的患者可以获得临床根治性手术切除,但是,即便手术顺利切除,其复发率也很高,约为75%[13]。肝脏移植是治疗终末期肝病及肝癌的一种有效手段,但受制于有限的肝源,只有极少数的患者可以得到及时救治,具有一定的限制性[14]。放化疗、介入治疗、分子靶向治疗也为肝癌的治疗提供了新的思路和方法,但由于肝癌发病隐匿,恶性程度高,复发及转移率高等因素,严重影响了治疗的疗效及预后生存[15,16]。肝癌的发生是一个复杂的过程,如癌基因的激活、抑癌基因的失活、基因表达的调控、信号转导通路的改变、细胞代谢方式的转变等,从而使得癌细胞具备了异常增殖的特性,所以探索肝癌发生发展的分子机制,寻找新的分子靶点,筛选早期诊断及靶向的分子标记物,针对性的各种基因治疗及生物治疗方法,逐步成为肝癌研究的热点[17,18]。
ACTR是一种比较明确的癌基因,在许多肿瘤中呈现过表达的状态,比如乳腺癌、肝癌、胃癌、前列腺癌等,ACTR参与了肿瘤的发生及发展过程,不同的研究者对其详细的机制进行了深入的研究[19,20]。Liu等[21]研究证实,肝癌中HBx蛋白可以促使ACTR更加稳定,并且二者可以协同作用促进肝癌细胞的增殖和侵袭。下调ACTR的表达可以通过PI3K/Akt信号通路阻断细胞周期,进而抑制肝癌细胞的增殖。ACTR和细胞内糖代谢密切相关,例如有氧糖酵解途径的关键酶PFKFB4可以使ACTR 857位丝氨酸磷酸化,从而激活其转录活性促进乳腺癌的进展。ACTR与肿瘤耐药相关,研究发现,ACTR可以促进Warburg效应,从而导致索拉菲尼耐药[22-24]。ACTR作用机制如此复杂,有无其他新的信号通路呢,我们通过研究证实,ACTR可以与IGF-1R发生相互作用,调控IGF-1R的表达。
IGF-1R是定位于细胞膜表面的异四聚体结构跨膜蛋白,由细胞外的2个α亚基和跨膜的2个β亚基所构成,具有酪氨酸激酶活性,当配体与IGF-1R结合时,引起β亚基激酶结构域的活化,导致受体及其底物的丝氨酸磷酸化,激发细胞内的复杂信号网络转导[25]。IGF-1R广泛的存在于生物体内各类细胞中,在多种肿瘤细胞表达上调,例如肝癌、肾细胞癌、卵巢癌等,其可以通过caspase依赖的线粒体通路促进肝癌细胞的凋亡,可通过PI3K/AKT、MAPK/ERK等信号通路调控肿瘤的发生和进展[26,27]。可见抑制IGF-1R的功能可能成为治疗肿瘤的一个潜在靶点,现在已有致力于靶向IGF-1R的药物研究,并且已经在进行早期临床实验。本研究发现,下调ACTR可以抑制IGF-1R的表达。ACTR本身可以促进肝癌细胞的增殖,当敲低IGF-1R后,ACTR的促生长作用减弱,说明ACTR是通过IGF-1R发挥作用的。但是其下游通过何种机制调控肝癌的发生发展,仍有待于进一步的研究。
综上所述,ACTR与IGF-1R之间存在相互的作用,IGF-1R介导了ACTR促进肝癌细胞生长的过程,ACTR/IGF-1R轴在肝癌细胞的生长中发挥了必要的作用,有可能成为治疗肝癌的靶点之一,为肝癌的防治提供新的思路。

