血清炎症因子水平与帕金森病伴疼痛的相关性研究
邵秋悦, 李则衡, 牛学斌, 滕 幸, 呼彪彪, 徐传英, 崔桂云, 昝 坤
帕金森病(Parkinson disease,PD)是继阿尔茨海默病之后的第二大常见的神经退行性疾病。除了运动症状外,PD的非运动症状如认知障碍、焦虑抑郁、自主神经功能障碍和慢性疼痛等也受到越来越多的关注。疼痛在PD患者中的患病率为40%~85%[1],这种致残性的非运动症状不仅给患者及家属带来了巨大的痛苦,而且给社会造成极大的负担。
PD的病理特征是在残留的神经元细胞质中出现嗜酸性包涵体,即路易小体,α-突触核蛋白是形成路易小体的重要成分,错误折叠的α-突触核蛋白激活小胶质细胞释放炎症因子,导致炎症应激和神经元死亡[2]。在PD患者出现临床症状时,约60%的黑质神经元和80%的纹状体多巴胺已经退化和耗尽,对PD患者的尸检调查中,发现黑质中有活化的小胶质细胞和免疫反应[3],因此表明,神经炎症是影响PD发病的重要因素。PD疼痛的机制尚不明确,近些年的研究发现,疼痛阈值的降低、痛觉传导通路神经递质功能的紊乱、神经炎症等均可能参与了疼痛的发生[4,5]。临床上PD患者脑脊液获取困难,而PD患者的外周血中促炎细胞因子水平升高[6],进一步证实了PD与外周炎症之间的联系。
炎症因子在PD动物模型中已被广泛研究,然而,目前国内外关于炎症因子和PD伴疼痛的临床研究较少,因此,迫切需要了解炎性因子对PD伴疼痛的影响。本研究旨在研究血清炎症因子水平和PD伴疼痛的相关性,为PD伴疼痛寻找可能的生物标志物。
1 资料与方法
1.1 研究对象 选取2021年5月-2022年3月期间于徐州医科大学附属医院神经内科帕金森病中心住院且符合入排标准的帕金森病患者90例(PD组)。纳入标准:均符合2015年国际运动障碍协会(Movement Disorder Society,MDS)制定的PD诊断标准。排除标准:(1)其他锥体外系疾病,如MSA(多系统萎缩);(2)中枢神经系统疾病,如急性脑梗死、脑出血和脑炎;(3)服用非甾体类抗炎药和糖皮质激素等影响免疫功能的药物;(4)严重的肝肾疾病和其他可能影响外周血炎症因子的免疫系统疾病;(5)不能配合完成研究的患者。此外,选择同期在我院健康体检中心体检的88例年龄和性别匹配的健康人作为健康对照组(HC组)。本研究由徐州医科大学附属医院伦理委员会批准(XYFY2021-KL243-01)。
1.2 研究方法 收集所有受试者的一般资料,包括年龄、性别、吸烟、饮酒、高血压、糖尿病、受教育年限、病程等,采用统一帕金森病评定量表的第三部分(Unified Parkinson Disease Rating Scale Ⅲ,UPDRS-Ⅲ)和Hoehn-Yahr(H-Y分期)评估PD患者运动功能和疾病严重程度,并完善国王帕金森病疼痛量表(King’s Parkinson’s Disease Pain Scale,KPPS)的评估,根据KPPS量表的评分,我们进一步将PD患者分为PD不伴疼痛组(nPDP组)和PD伴疼痛组(PDP组)。所有患者均于入院后空腹采集静脉血5 ml,采用12项细胞因子检测试剂盒检测白细胞介素-1β(IL-1β)、白细胞介素-2(IL-2)、白细胞介素-4(IL-4)、白细胞介素-5(IL-5)、白细胞介素-6(IL-6)、白细胞介素-8(IL-8)、白细胞介-10(IL-10)、白细胞介素-12p70(IL-12p70)、白细胞介素-17(IL-17)、干扰素-α(IFN-α)、干扰素-γ(IFN-γ)和肿瘤坏死因子-α(TNF-α)水平。该项目采用的是基于荧光微球技术的免疫“双抗体夹心”方法,检测试剂盒由瑞斯凯尔公司提供。
2 结 果
2.1 PD组和HC组一般资料及血清炎症因子水平的比较 PD组和HC组在年龄、性别、吸烟、饮酒、高血压、糖尿病和受教育年限方面没有显著差异。PD组血清IL-1β、IL-6、IL-17水平均显著高于HC组,差异有统计学意义(P<0.01)。两组间其他炎症因子水平差异无统计学意义(见表1、图1)。

图1 HC组与PD组血清IL-1β、IL-6、IL-17水平比较**P<0.01

表1 HC组和PD组一般资料及血清炎症因子的比较
2.2 nPDP组和PDP组的组间资料比较 进一步对PD组患者进行亚组分析,发现nPDP组和PDP组组间年龄、性别、吸烟、饮酒、高血压、糖尿病、受教育年限、病程、H-Y分期、血清IL-6、IL-17水平均没有统计学差异。UPDRS-Ⅲ评分(P=0.020)和IL-1β(P<0.001)差异有统计学意义,与nPDP组相比,PDP组的UPDRS-Ⅲ评分更高,血清IL-1β水平更高(见表2、图2)。

***P<0.001。

表2 nPDP组和PDP组临床特征及血清IL-1β、IL-6、IL-17水平比较
2.3 PD患者血清IL-1β、IL-6、IL-17与临床特征的相关性分析 采用Spearman相关性分析发现,PD患者血清IL-1β水平与KPPS评分呈正相关(r=0.371,P<0.001),与年龄、性别、病程、受教育年限、H-Y分期、UPDRS-Ⅲ评分均无相关性。血清IL-6水平与年龄呈正相关(r=0.231,P=0.002),与性别、病程、受教育年限、H-Y分期、UPDRS-Ⅲ评分、KPPS评分均无相关性。血清IL-17水平与年龄、性别、病程、受教育年限、H-Y分期、UPDRS-Ⅲ评分、KPPS评分均无相关性(见表3、图3)。
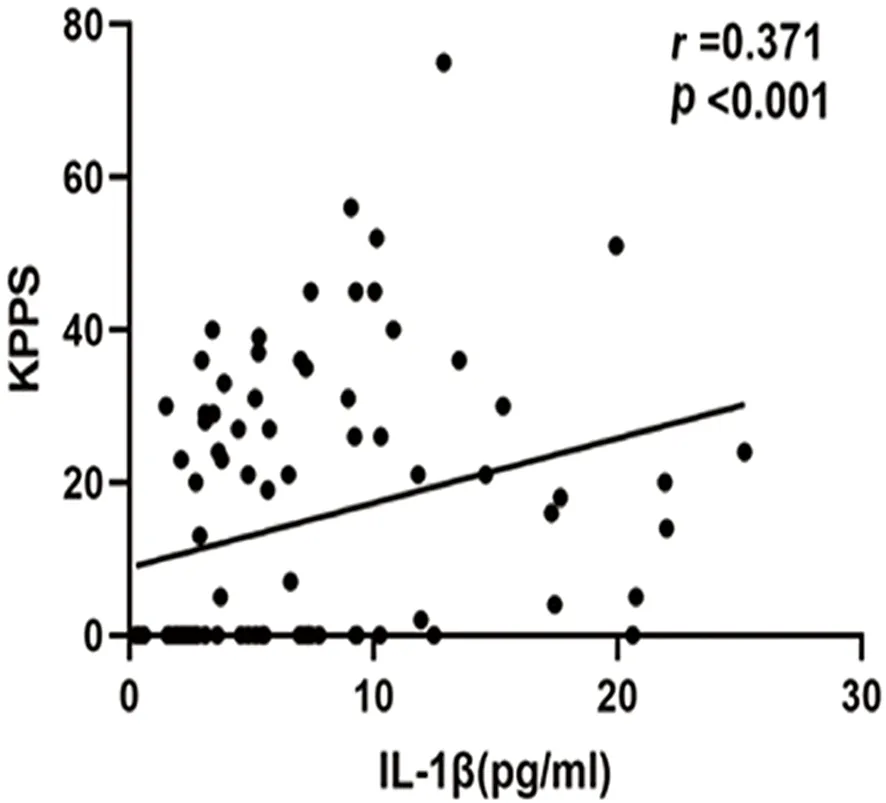
图3 PD组血清IL-1β水平与KPPS评分的相关性散点图
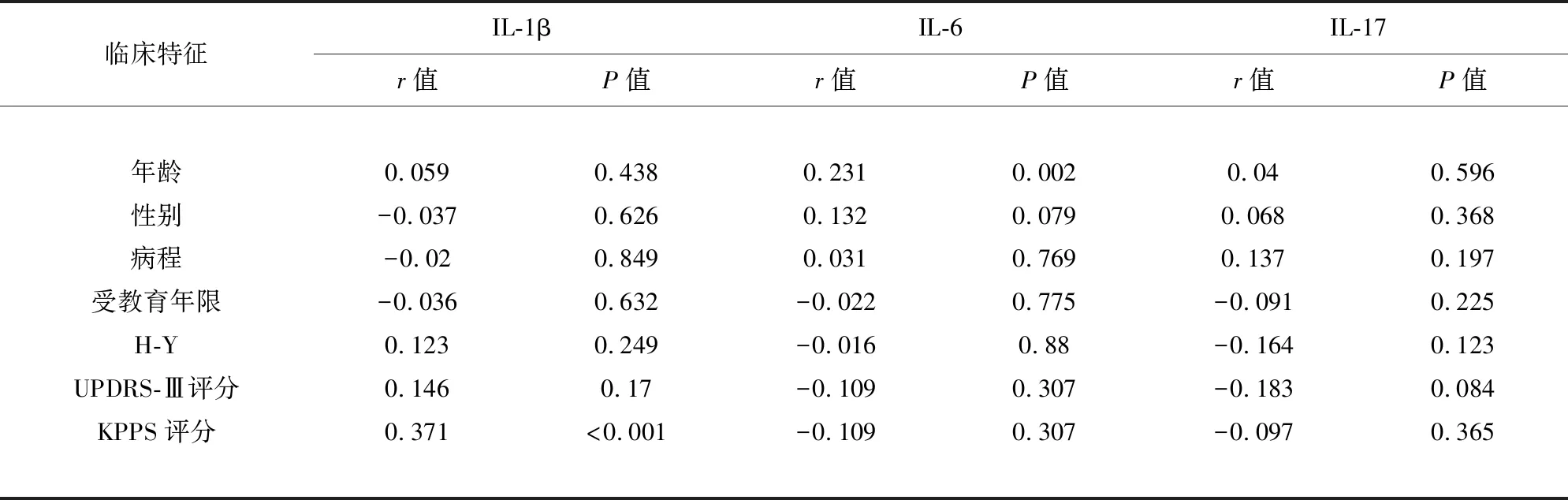
表3 PD患者血清IL-1β、IL-6、IL-17与临床特征的相关性
2.4 PD患者发生疼痛影响因素的Logistic回归分析 以是否存在疼痛症状为因变量(是=1,没有=0),先将各指标进行单因素Logistic回归分析,结果显示,UPDRS-Ⅲ评分、IL-1β是 PD 伴疼痛的影响因素(P<0.05)。继续行多因素Logistic 逐步回归分析显示,UPDRS-Ⅲ评分较高、血清IL-1β水平较高是PD伴疼痛的危险因素(P<0.05)(见表4)。
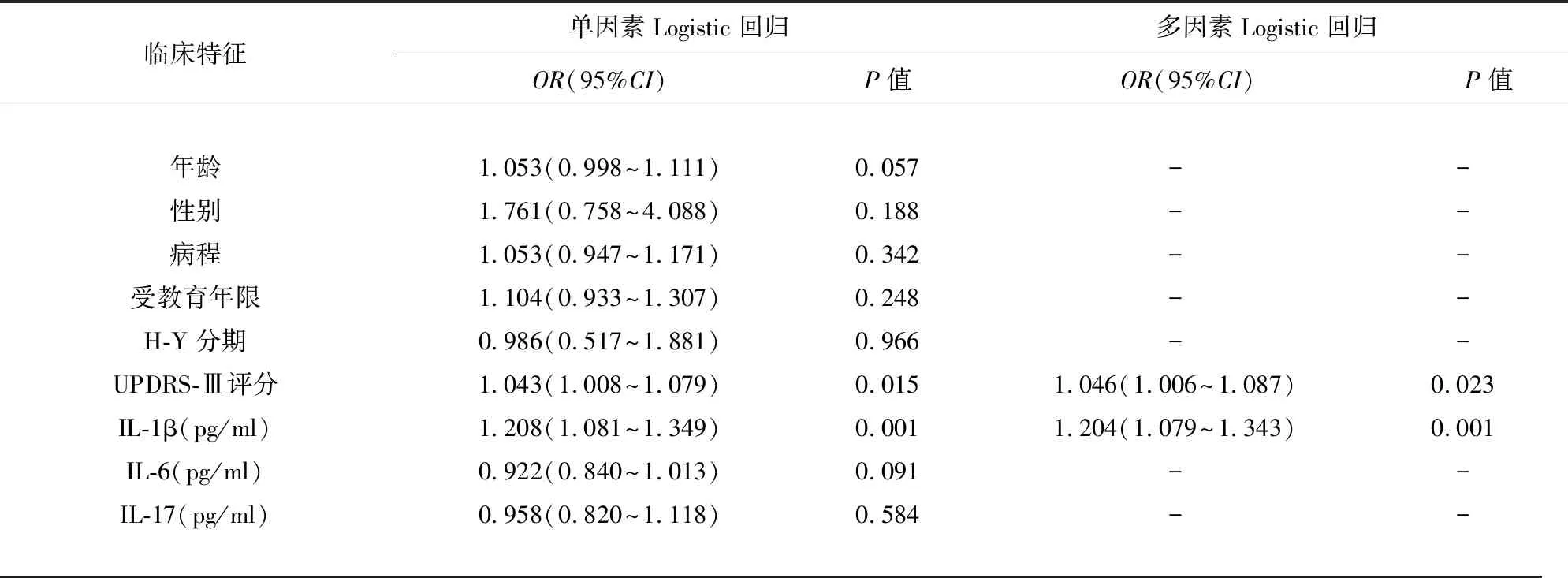
表4 血清IL-1β水平与PD伴疼痛的二元Logistic回归分析
2.5 血清IL-1β诊断PD伴疼痛的ROC曲线 进一步分析了血清IL-1β对PD伴疼痛的诊断效能,我们绘制ROC曲线,结果显示,血清IL-1β诊断PD伴疼痛的曲线下面积(AUC) 0.741,95%CI0.640~0.842,P<0.001。血清IL-1β诊断PD伴疼痛的最佳截断值为2.815(pg/ml),灵敏度为93.6%,特异度为44.2%(见图4)。

图4 血清IL-1β诊断PDP的ROC曲线
3 讨 论
疼痛是PD的一种常见的非运动症状,对患者的生活质量有很大的影响,甚至比运动症状影响更大[7]。一个患者可能有几种不同类型的疼痛症状,导致对疼痛的诊断和治疗受限。因此,迫切需要了解PD相关疼痛的病理生理机制,寻找可能的生物标志物,这对于PD相关疼痛的治疗,改善患者生活质量有着至关重要的作用。
本研究在比较PD组和HC组血清炎症因子水平时发现,与HC组相比,PD组血清IL-1β、IL-6、IL-17水平更高,这与Green等的研究结果一致[8,9]。既往PD动物模型研究表明,α-突触核蛋白过度表达发生在多巴胺能神经元变性、死亡以前,会引发黑质纹状体中小胶质细胞的激活,造成炎症因子水平增加[3]。IL-1β是IL-1家族的一员,由活化的单核巨噬细胞产生,目前研究已经证实,IL-1β在PD患者中通过谷氨酸兴奋性毒性引发炎症级联反应,并直接导致神经元死亡[10]。IL-6是调节免疫细胞分化和成熟的促炎因子,参与中枢神经系统疾病的病理生理过程[11]。IL-17是一种由Th17细胞产生的关键促炎因子,与炎症的发病机制有关。RORγT是促进 Th17 细胞分化并产生 IL-17的关键转录因子,IL-1β通过IRF4通路刺激RORγT的产生,IL-6可通过信号转导gp130的酪氨酸残基诱导STAT3激活,STAT3可以诱导RORγt的表达,因此IL-1β和IL-6可以促进IL-17的产生[12]。外周过度的免疫炎症反应导致血脑屏障受损,免疫细胞和炎症因子渗入大脑,小胶质细胞、星形胶质细胞激活,并释放其他炎症介质,有助于增强神经炎症,介导神经退行性疾病的发生和进展[13]。由于PD患者在临床中脑脊液获取困难,而外周与神经炎症存在一定关系,所以我们选择研究外周炎症在PD中的作用。
目前PD相关疼痛的机制并不明确,主要包括以下几种:第一,PD伴疼痛患者可能存在基底节功能障碍,基底神经节可以整合传入的伤害性信息,在疼痛回避和伤害行为中起到积极作用。基底节多巴胺能神经元失去神经支配会导致PD疼痛的调控系统功能障碍[14]。第二,PD伴疼痛患者神经递质水平下降,多巴胺是调节疼痛感知的关键神经递质,参与了岛叶皮质介导的镇痛作用。多巴胺水平下降会使患者疼痛阈值下降,进而导致疼痛[15,16]。第三,神经免疫。目前已有研究表明丘脑底核是调节疼痛处理和感知的基底神经节回路的有效通路点[17]。Park等的研究发现PD疼痛模型小鼠丘脑底核可见小胶质细胞的激活[18],胶质细胞异常激活后,释放与疼痛相关的炎症介质,引起神经免疫性炎症,从而参与疼痛的调控[19]。
我们研究PD组血清IL-1β水平与疼痛的关系发现,PDP组血清IL-1β水平高于nPDP组,血清IL-1β与KPPS量表评分呈正相关,PDP患者血清IL-1β的高表达表明IL-1β可能参与了PD相关疼痛的病理生理过程。IL-1β是一种促炎细胞因子,目前研究证实其在持续慢性疼痛状态中升高[20]。IL-1β是疼痛通路中USP5和Cav3.2通道相互作用上调的上游触发因子[21]。之前的一些研究表明炎症组织部位的疼痛敏感性增强是由于免疫细胞局部释放痛觉感受器敏化剂,包括前列腺素E2和神经生长因子等。IL-1β不仅可以诱导痛觉感受器敏化剂的合成,还可以快速激活痛觉感受器以产生动作电位并诱导疼痛超敏反应。IL-1β 可以通过作用于辣椒素受体(TRPV1)直接敏化痛觉感受器,也可以通过提高前列腺素合成间接敏化痛觉感受器诱发疼痛。TRPV1与人体痛觉的产生密切相关,可以调节 Ca2+内流,触发神经末梢释放神经肽类和兴奋性氨基酸,最终引起大脑皮质痛觉的形成。IL-1β还能以p38丝裂原激活蛋白激酶(p38 MAP激酶)依赖的方式起作用,通过缓解抗河豚毒素电压门控钠通道的静息缓慢失活来增加痛觉感受器的兴奋性[22]。此外,IL-1β可以刺激环氧化酶COX-2的表达[23],而COX-2的抑制是非甾体抗炎药(NSAIDs)镇痛作用的基础。本研究通过二元Logistic回归分析显示,血清IL-1β水平较高是PD伴疼痛的危险因素。绘制ROC曲线显示,血清IL-1β诊断PD伴疼痛的曲线下面积(AUC)为 0.741,即血清IL-1β对PD伴疼痛诊断具有一定的价值,可能成为诊断PD伴疼痛的生物学标志物。
目前,国内外鲜有血清IL-1β与PD伴疼痛相关研究的报道。本研究的局限之处在于:样本量较少,而且我们的研究是横断面研究,不能够说明血清IL-1β和PD伴疼痛的因果关系,未来的研究应进一步增加样本量,并进行纵向研究,以提高我们的研究结果的可信度,为PD相关疼痛的病理生理机制和诊断治疗提供重要线索。

