RNA干扰疗法降低脂蛋白a的临床研究进展
张小芳 张冬颖
(重庆医科大学附属第一医院心血管内科,重庆 400000)
强化降低低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)可有效控制心血管疾病(cardiovascular disease,CVD)的发生发展[1-2]。但部分患者LDL-C达到目标水平后,心血管残余风险仍存在[3-6]。AIM-HIGH试验[7]发现,在烟酸治疗组中,即使LDL-C<1.69 mmol/L,脂蛋白a [lipoprotein(a),Lp(a)]>125 nmol/L的患者仍有89%心血管事件风险。因此,寻求新的途径降低CVD残余风险具有重要意义。
Lp(a)是CVD的一个重要遗传致病危险因素[4-6]。Lp(a)在肝脏中合成,由LDL-C样颗粒连接到载脂蛋白(a)[apolipoprotein (a),apo(a)]和载脂蛋白B100(apolipoprotein B100,ApoB100)组成[8]。Lp(a)水平主要由遗传因素决定,受生活方式或生理因素影响小[9-11]。Lp(a)生理意义尚不明确,但它可通过导致泡沫细胞形成、增加黏附分子表达、诱导多种促炎效应等机制[12]介导CVD的发生发展[13-16]。遗传学表明,Lp(a)每降低125 nmol/L,CVD风险可能降低20%[17]。降低Lp(a)水平是目前心血管领域的新方向。
现有的降脂疗法中,他汀类药物不能降低Lp(a)水平[6,18],烟酸和前蛋白转化酶枯草溶菌素9 (proprotein convertase subtilisin/kexin type 9,PCSK9)抑制剂使Lp(a)水平降低20%~30%[19-20];血浆置换虽被证实可降低Lp(a)水平60%~80%[21-22],但由于耗时长、费用高、患者接受度差,难以广泛应用;雌激素与孕激素替代治疗也可使Lp(a)水平降低15%~20%[23],但雌激素会增加乳腺癌、脑卒中等风险,通常不作为绝经期女性抗动脉粥样硬化的首选。因此,寻找新型降低Lp(a)水平的药物尤为重要。
RNA干扰(RNA interference,RNAi)疗法是降低Lp(a)水平的新型治疗方法[24],通过小干扰RNA (small interfering RNA,siRNA)或反义寡核苷酸(antisense oligonucleotides,ASO)与靶mRNA序列特异部位结合并降解靶mRNA,沉默与Lp (a)合成、转运和吸收相关蛋白基因的表达,最终降低血液Lp (a)水平[25-27]。本文就RNAi药物降低Lp (a)的临床研究进行综述。
1 RNAi降低Lp(a)的策略
RNAi可通过以下两种策略降低Lp(a)水平:(1)siRNA或ASO与apo(a) mRNA结合,沉默apo(a)相关基因表达,导致Lp(a)合成减少;(2)siRNA或ASO与ApoB100 mRNA结合,抑制ApoB100的翻译,减少Lp(a)合成[26-27]。相关治疗策略研究进展详见表1。
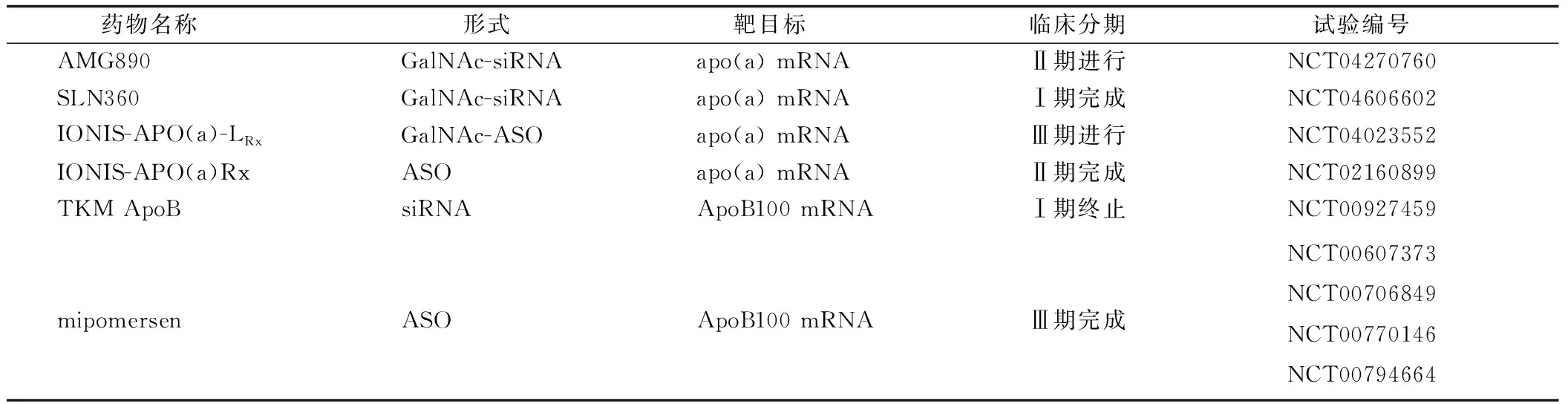
表1 RNAi降低Lp(a)临床研究现状
2 RNAi降低Lp(a)的临床研究进展
2.1 apo(a) mRNA的RNAi靶向药物
2.1.1 siRNA类药物
AMG890(即olpasiran)可能是降低Lp(a)的有效药物之一。该药Ⅰ期临床试验[28]共纳入64例血浆Lp(a)浓度≥70 nmol/L的参与者,并对其分别单次皮下注射3、9、30、75 或 225 mg AMG890或等剂量安慰剂,平均随访225 d。结果显示,接受AMG890组患者血浆Lp(a)水平呈剂量依赖反应方式降低;接受9 mg或更高剂量AMG890注射患者,体内低Lp(a)状态可持续数月;给药后第43~71天,Lp(a)水平较基线降低71%~97%,达到最大程度抑制,而后逐渐恢复至基线水平,随访结束时AMG890组Lp(a)水平仍远低于安慰剂组。随访期间,AMG890组除1例受试者出现注射部位反应外,无严重不良事件。为进一步评估多次给药在受试者中的药效、安全性及耐受性,Koren等于2020年启动AMG890的Ⅱ期临床试验,该试验拟纳入240例Lp(a)>150 nmol/L的冠心病患者,将受试者随机分配到4种AMG890剂量组(每12周10 mg、每12周75 mg、每12周225 mg或每24周225 mg)和等剂量安慰剂组,预计在给药后36~48周评估AMG890对Lp(a)升高患者的疗效、安全性及耐受性(NCT04270760)。
AMG890Ⅰ期临床试验提示,AMG890降低Lp(a)疗效好、持续时间长、副作用少。但该药I期临床试验样本量小,采用单次给药方式,随访时间较短,且采用安慰剂作对照,因此无法证明AMG890的长期疗效及优效性。AMG890Ⅱ期临床试验纳入动脉粥样硬化性心血管疾病(atherosclerotic cardiovascular disease,ASCVD) 患者,显著扩增样本量,采用多次给药方式,有可能进一步证实该药降低Lp(a)的临床有效性和心血管获益,但该研究纳入人种较为单一(88.3%为白种人),试验结果是否存在地域或种族差异,仍需进一步研究深入探索。
SLN360也是有效降低Lp(a)水平的潜能药物之一。SLN360的Ⅰ期临床试验[29]共纳入美国、英国和澳大利亚的32例血浆Lp(a)≥150 nmol/L的非急性冠脉综合征患者。受试者在单次皮下注射30、100、300和600 mg SLN360 30~60 d后,血浆Lp(a)浓度比较基线分别下降10%、46%、86%和96%;单次给药后,SLN360降低Lp(a)效果至少持续150 d;随访期间未发现相关严重不良事件。Ⅰ期临床试验结果提示SLN360具有良好疗效、安全性及耐受性,但样本量小、随访时间短、给药方式单一,故结果有待大样本、前瞻性、多中心、长随访时间、多种给药方式研究进一步佐证。
目前,两个靶向apo(a) mRNA的siRNA类RNAi药物在降低Lp(a)疗效、安全性及耐受性方面均较好,但仍需进一步研究证实。未来纳入不同年龄、不同ASCVD风险、不同种族的患者,对随访时间、给药方式等进一步优化后,设计以烟酸等降脂药为对照组的大样本随机对照试验(randomized controlled trial,RCT)研究,以进一步明确靶向apo(a) mRNA的siRNA类RNAi药物的疗效、优效性及安全性。
2.1.2 ASO类药物
apo(a) mRNA的ASO类靶向药物[IONIS-APO(a)Rx及IONIS-APO(a)-LRx]在降低Lp(a)水平方面具有较好疗效,但相较于靶向apo(a) mRNA的siRNA类药物,ASO类药物注射部位反应发生率可能更高。
IONIS-APO(a)Rx是第一代针对apo(a) mRNA的ASO类RNAi药物,降低Lp(a)疗效好,注射部位反应为最常见安全问题。该药Ⅰ期临床试验[30]中,单次皮下注射50、100、200或400 mg IONIS-APO(a)Rx 4周后,受试者Lp(a)浓度未降低;每次皮下注射100、200或300 mg IONIS-APO(a)Rx,注射6次后,受试者血浆Lp(a)水平较基线降低39.6%~77.8%。轻度注射部位反应为IONIS-APO(a)Rx最常见不良事件。IONIS-APO(a)Rx Ⅱ期临床试验[27]在全球13个中心进行,将纳入的84例Lp(a)≥125 nmol/L非ASCVD受试者分为两个队列(队列A:125 nmol/L≤Lp(a)<437 nmol/L;队列B:Lp(a)≥437 nmol/L),并随机分配接受每周注射一次IONIS-APO(a)Rx(100、200和300 mg,每种剂量4周)和等剂量安慰剂,持续12周。结果显示,队列A中试验组平均Lp(a)水平较基线降低66.8%,队列B中试验组平均Lp(a)水平降低71.6%;试验组12%的参与者出现注射部位反应,尚未发现其他安全问题。
IONIS-APO(a)Rx Ⅰ、Ⅱ期临床试验结果显示IONIS-APO(a)Rx能有效降低Lp(a)水平,但注射部位反应发生率高。因此,为降低IONIS-APO(a)Rx的不良反应,推出了IONIS-APO(a)Rx与N-乙酰半乳糖胺(简称GalNAc,可与肝细胞上表达的去唾液酸糖蛋白受体特异性结合,具有高肝脏选择性)的聚合物[IONIS-APO(a)-LRx][31-32]。
相较于IONIS-APO(a)Rx,IONIS-APO(a)-LRx(也称TQJ230或Pelacarsen)降低Lp(a)疗效及安全性更好。IONIS-APO(a)-LRxⅠ期临床试验[27]共纳入58例Lp(a)≥75 nmol/L的志愿者,结果显示,给药30 d后,IONIS-APO(a)-LRx组患者Lp(a)浓度呈剂量依赖性降低;与安慰剂组相比,10 mg IONIS-APO(a)-LRx组患者平均Lp(a)水平降低66%,20 mg组平均降低80%,40 mg组平均降低92%。IONIS-APO(a)-LRx药效约为IONIS-APO(a)Rx的30倍,且该药物未发现注射部位反应[27]。IONIS-APO(a)-LRx的Ⅱ期临床试验[33]共纳入286例Lp(a)≥150 nmol/L的CVD患者。结果提示,给药6个月后,IONIS-APO(a)-LRx组Lp(a)水平较基线均降低,且呈剂量依赖性:每4周20 mg组降低35%,每4周40 mg组降低56%,每2周20 mg组降低58%,每4周60 mg组降低72%,每周20 mg组降低80%。其中,每周20 mg IONIS-APO(a)-LRx组,98%的患者Lp(a)水平可控制为低于125 nmol/L。研究期间,除27%IONIS-APO(a)-LRx受试者出现轻微注射部位反应(如红斑)外,未发现其他相关安全问题。
IONIS-APO(a)-LRxⅠ期及Ⅱ期临床试验提示该药可能是一种新型、可耐受、有效降低Lp(a)水平的药物,但尚不确定IONIS-APO(a)-LRx对Lp(a)的作用是否会转化为临床获益。2019年,IONIS-APO(a)-LRxⅢ期临床试验(多中心、随机、双盲、安慰剂对照试验)正式启动(NCT04023552),该研究拟纳入8 221例来自美国、丹麦、加拿大、荷兰和德国的ASCVD(包括心肌梗死、缺血性卒中、有临床症状的外周动脉性疾病)且Lp(a)≥175 nmol/L患者。所有患者将随机接受每月80 mg IONIS-APO(a)-LRx(该特定剂量未在Ⅱ期临床试验中测验,但它代表每周20 mg方案的累积剂量)或安慰剂,计划随访4年,以评估IONIS-APO(a)-LRx是否可降低此研究人群主要不良心血管事件(major adverse cardiovascular events,MACE)风险。
综上,靶向apo(a) mRNA的siRNA及ASO类RNAi药物均可有效降低Lp(a)水平,相较于siRNA类药物,ASO类药物局部注射反应发生率可能更高。值得注意的是,靶向apo(a) mRNA的RNAi类药物相关研究均为小样本研究,纳入人群均为西方国家人群,均采用安慰剂为对照,缺乏大样本、多中心以烟酸或PCSK9抑制剂为对照的RCT研究,故无法除外地域、种族、年龄等对试验结果的影响,也无法证明相较于烟酸或PCSK9抑制剂类降脂药,靶向apo(a) mRNA的RNAi药物具有优效性或非劣效性。且目前尚无研究证明,靶向apo(a) mRNA的RNAi类药物对Lp(a)的获益可转化为心血管获益。
2.2 ApoB100 mRNA的RNAi靶向药物
2.2.1 siRNA类药物
靶向ApoB100的siRNA药物可能不是治疗血脂异常的合适方法。PRO-040201(一种靶向ApoB100 mRNA的siRNA类药物)的安慰剂对照、单盲Ⅰ期临床试验[34]将23例LDL-C≥4.14 mmol/L的参与者随机分配到单剂量递增组和安慰剂组。拟在给药后29 d评估PRO-040201在高胆固醇血症受试者中的安全性、耐受性、药代动力学和药效学。随访期间,试验组ApoB100和LDL-C水平降低,但受试者出现免疫系统激活,最终导致试验被迫终止。动物实验也提示,高剂量ApoB100 siRNA可使肝酶浓度升高[35-36]。因此,即便靶向ApoB100 mRNA的siRNA类药物可能会降低ApoB100和LDL-C水平,但其伴随的严重不良反应使得该药可能不是治疗血脂异常的最佳方法。
2.2.2 ASO类药物
靶向ApoB100 mRNA的ASO类RNAi药物副作用严重,临床应用存在争议。mipomersen是一种主要与ApoB100 mRNA结合发挥其作用的RNAi-ASO类药物[37]。一项纳入382例高胆固醇血症患者(包括纯合子家族高胆固醇血症、杂合子家族高胆固醇血症合并冠状动脉疾病、严重高胆固醇血症及冠心病高风险的高胆固醇血症)的meta分析[38-41]显示,200 mg mipomersen组患者血浆Lp(a)水平较基线降低26.4%。另一项meta分析[42]显示,mipomersen治疗组患者ApoB和Lp(a)分别较基线降低33.27%和26.34%;mipomersen治疗与注射部位反应(OR=14.15)、流感样症状(OR=2.07)、丙氨酸氨基转移酶水平升高>3倍正常上限(OR=11.21)相关。一项替代给药研究[43]显示,每周1次200 mg和每周3次70 mg mipomersen给药方案均可降低患者含ApoB100的脂蛋白水平;与每周1次给药方案相比,每周3次的给药方案可降低流感样症状的发生频率,但其他副作用仍频繁发生,且注射部位反应发生频率更高。因此,虽然2013年mipomersen已被美国食品和药物管理局批准用于家族性高胆固醇血症(familial hypercholesterolemia,FH)患者,但因其副作用(其中最严重的是肝损伤)被欧洲药品管理局拒绝上市。
综上,尽管mipomersen 在治疗杂合子FH方面具有较好疗效,但因严重副作用未被批准上市。目前,PCSK9 抑制剂alirocumab和evolocumab在治疗杂合子FH方面具有更好疗效、更高安全性[44]。相较于靶向apo(a) mRNA的RNAi类药物,靶向ApoB100 mRNA的RNAi 类药物疗效更差、副作用更多,这使其更难成为降低Lp(a)的可发展药物。
3 RNAi降低Lp(a)的心血管获益
虽然大量研究表明,降低Lp(a)水平可能使CVD风险降低[5,13,45-48],但RNAi降低Lp(a)的心血管获益尚无定论。一项在FH人群中进行的小样本回顾性研究[49]发现,mipomersen治疗前24个月内,61.5%受试者共发生146次MACE;mipomersen治疗后24.4个月内,9.6%受试者共发生13次MACE。该研究提示mipomersen有可能降低FH患者心血管事件发生率,但无法确定MACE获益是否由mipomersen降低Lp(a)水平介导。IONIS-APO(a)-LRx的Ⅲ期临床试验或许可回答这一问题[33]。
4 总结与展望
apo(a) mRNA的siRNA及ASO类靶向药物均可降低Lp(a)水平,或许为未来降低Lp(a)的新型降脂药。相较于apo(a) mRNA的siRNA类RNAi靶向药物,apo(a) mRNA的ASO类RNAi靶向药物局部注射反应发生率可能更高。ApoB100 mRNA的RNAi靶向药物因其肝损害、免疫系统激活等副作用,可能不是降低Lp(a)的最佳基因疗法。目前缺乏RNAi的大型RCT或真实世界研究,且RNAi的心血管获益证据不足,未来仍需更多研究深入探索该类药物的确切疗效、安全性及心血管获益。