慢性心力衰竭并发肌少症和心脏恶病质的诊治进展
高亮 芦颜美
(新疆医科大学第一附属医院心脏起搏电生理科,新疆 乌鲁木齐 830054 )
慢性心力衰竭(chronic heart failure,CHF)是各种心血管疾病的终末阶段,是目前所有心血管领域里治疗难度最大、风险最高的疾病。CHF可引发肌少症和心脏恶病质的发生和发展。目前,肌少症被认为是肌肉质量减少及功能丧失,CHF患者肌少症的患病率为32%(95%CI23%~41%)。心脏恶病质是一种更复杂的多因素综合征,与CHF患者的不良预后相关。据估计,在心力衰竭患者中,心脏恶病质每年的死亡率为20%~30%,18个月的死亡率为50%[1-2]。
一方面,CHF的病理生理变化会引起肌肉质量、结构和功能的改变,从而引发并加重肌少症,肌少症所涉及的大多数机制在恶病质的发生和发展中也起作用,并且被放大最终导致恶病质,肌少症是恶病质的重要组成部分,它通常先于恶病质发生,也可预测心力衰竭的不良结果;另一方面,肌少症和心脏恶病质都可表现为肌萎缩,并与CHF的病程相互影响,使彼此的进程及结局复杂化。随着全球老龄化,上述两种综合征给个人和社会带来了沉重的负担。近年,对这两种综合征的认识取得了一定进展,现归纳CHF中二者的发病机制和治疗新进展。
1 肌少症和心脏恶病质的病理生理机制
1.1 神经-激素系统激活
CHF的低心输出量、低血压以及低组织灌注,导致神经-激素系统激活。Lena等[3]的研究发现,恶病质的发生与交感神经系统激活密切相关。体外试验[4]也证实,儿茶酚胺可诱导炎症细胞激活,产生细胞因子,促进恶病质的发生。此外,心源性恶病质患者的血浆血管紧张素Ⅱ(angiotensinⅡ,AngⅡ)浓度增加可导致骨骼肌萎缩,AngⅡ通过多种机制诱导肌肉萎缩[5-6]:激活NADPH氧化酶以增加氧化应激;减少胰岛素样生长因子-1(insulin-like growth factor-1,IGF-1)和增加细胞因子信号转导以促进蛋白质分解;改变下丘脑中的食欲/厌食神经肽表达来降低食欲;抑制卫星细胞功能和肌肉再生。
1.2 免疫激活
CHF会引发机体产生一系列免疫反应并诱导肌肉减少,就免疫激活起源,目前主要的假说[7]有:“肌肉假说”,即衰竭心肌本身是细胞因子产生的主要来源,心肌细胞内产生的促炎细胞因子可加快衰竭心脏重构。研究[8]显示,血浆肿瘤坏死因子-α(tumor necrosis factor,TNF-α)的经心脏浓度梯度与左心室舒张末期容积指数和左室射血分数之间显著相关,提示TNF-α在左心室重塑中起潜在作用。“内毒素假说”提出,CHF中循环失代偿导致细菌内毒素(脂多糖)释放,从而激活循环免疫。第三种假说,由于组织缺氧引起心肌外细胞因子释放可能是CHF患者免疫激活的主要刺激因素。第四种假说,CHF相关的免疫激活是长期神经激素过度激活和交感神经系统过度刺激的结果。除此之外,免疫激活过程中涉及包括TNF-α、白细胞介素(interleukin,IL)-1及IL-6在内的诸多细胞因子,其中,TNF-α作为心力衰竭预后标志物、心源性恶病质的独立预测因子,它可通过几乎所有有核细胞表达的受体发挥其生物学作用,从而维持消瘦过程。
1.3 蛋白质合成-分解代谢失衡
CHF肌肉减少的主要原因是蛋白质合成-降解代谢失衡(见图1)。其中,蛋白质合成代谢的IGF-1信号转导途径中的细胞内钝化是肌肉萎缩过程的重要组成部分,一项纳入了27例心力衰竭相关收缩或舒张功能障碍患者的研究表明,患者血浆总IGF-1水平显著降低,但游离IGF-1水平显著高于健康对照组[9],提示生长激素/IGF-1轴的变化可能会影响肌少症中的合成-分解代谢平衡;同时,蛋白质降解途径在肌肉萎缩的过程中发挥更重要的生物学作用,分解代谢途径通过刺激肌肉环指蛋白1(muscle ring finger protein 1,MuRF1)的表达激活3个主要的蛋白质降解系统:泛素-蛋白酶体系统(ubiquitin-proteasome system,UPS)、自噬-溶酶体系统和凋亡系统。其中,UPS的激活是蛋白质降解的主要机制[10]。E3泛素蛋白连接酶是UPS泛素化的限速酶,其代表因子为MuRF1和Atrogin1,其中,MuRF1的表达是由活性氧和炎性细胞因子诱导的,MuRF1蛋白表达的升高可能导致蛋白降解增加。
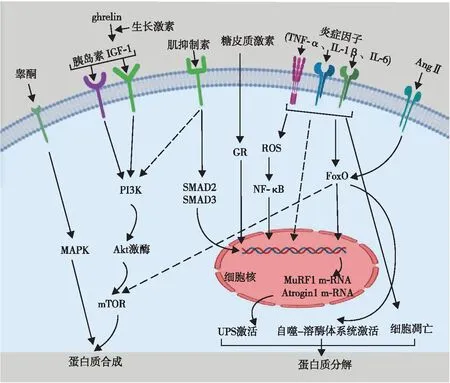
注:ghrelin,促生长激素释放素;MAPK,促分裂原活化的蛋白激酶;PI3K,磷脂酰肌醇3激酶;Akt激酶,蛋白激酶B;mTOR,哺乳动物雷帕霉素靶蛋白;SMAD,转化生长因子蛋白家族;GR,糖皮质激素受体;ROS,活性氧;FoxO,叉头框蛋白O。
1.4 肌肉结构的变化
骨骼肌由不同的纤维类型构成:Ⅰ型(慢速)肌纤维具有高线粒体密度、高肌红蛋白水平和大量毛细血管,因此Ⅰ型肌纤维具有高氧化能力;Ⅱ型(快速)肌纤维具有高水平的ATP酶和肌酸激酶活性,以及高水平的无氧糖酵解能力。研究已证实,两种不同的肌纤维会随着运动等外部刺激而发生变化。CHF患者体内的一系列病理生理反应会导致肌肉功能损害及质量减少,涉及的主要机制包括[7,11-12]:(1)Ⅱ型(快速)肌纤维的优先丢失、萎缩及运动单位的重塑,CHF患者体内肌纤维比例整体转变,进而表现为较慢的Ⅰ型(慢速)肌纤维;(2)肌肉蛋白质组改变出现的氧化应激和线粒体功能障碍可能导致肌纤维退化,同时出现代谢障碍;(3)兴奋-收缩耦联反应的变化,包括调节肌质网释放和再摄取Ca2+的机制、跨桥附着和分离速度的变化。
1.5 营养不良及肠道微循环改变
CHF患者体内的促炎细胞因子升高,进而出现的一系列消化道炎症反应使得机体肠壁增厚,细菌生长增加,吸收功能明显障碍。肠道屏障功能破坏和肠道菌群组成改变可能导致心力衰竭患者微生物衍生代谢物的异常产生和吸收,因此,Kamo等[13]将CHF患者的营养不良归因于肠道微循环受损。同时,心力衰竭患者往往合并肝肾功能损害,尤其肝淤血可引发低蛋白血症,加重肠道淤血。
1.6 自噬和细胞凋亡
自噬可能在极端条件下为肌肉细胞提供替代能源,营养缺乏是骨骼肌中自噬的有效激活条件,并主要通过AMP活化蛋白激酶信号转导系统发挥生物学作用。有研究[14]表明,生肌调节因子的耗竭与肌肉生长抑制素水平的变化无关,证明受损的自噬是加重肌肉萎缩的主要机制之一。因此,有望通过适当诱导或准确调节自噬过程或通过自噬改善线粒体相关功能以维持骨骼肌质量。细胞凋亡是肌肉萎缩的另一种分子机制,在骨骼肌中,凋亡级联反应产生的凋亡信号会激活UPS,可诱导肌肉蛋白降解,进一步加重肌纤维萎缩。
1.7 氧化应激
CHF患者体内低心输出量、内皮功能障碍和骨骼肌供氧减少等均可干扰肌细胞生理兴奋-收缩耦联反应引起氧化应激,进而加快肌肉萎缩。CHF患者中,随着呼吸链功能弱化和抗氧化细胞防御受损,活性氧的产生会明显增加。Potes等[14]研究指出,肌少症可能由活性氧触发,活性氧可导致线粒体功能障碍,加速骨骼肌损伤和变性,导致肌肉萎缩。
2 肌少症和心脏恶病质的诊断标准
2010年,欧洲老年人肌少症工作组通过肌肉质量、肌肉力量以及肌肉功能将肌少症分成不同的亚组。Krysztofiak等[15]将心脏恶病质量化为12个月内体重减轻(考虑体液失衡)>5%(或体重指数<20 kg/m2),伴随肌肉力量下降、疲劳、厌食、体重指数和血液生物标志物异常。2017年,von Haehling等又补充了低肌肉质量、低握力、低步态速度等评估指标[7,16]。《老年人肌少症防控干预中国专家共识(2023)》[17]建议,诊断肌少症要结合肌肉质量、肌肉力量及躯体功能共同评估,其中肌肉质量下降是核心元素。共识推荐使用握力和步速作为评估诊断的核心指标,男性握力<28 kg、女性握力<18 kg考虑为肌肉力量下降,而6分钟步速测量的诊断界值为<1.0 m/s。
当前,已有多种方法用于定量评估肌肉质量减少[17]:双能X射线吸收法放射暴露量低,短时间内可重复测定四肢骨骼肌含量,是测量肌肉质量的金标准;剪切波弹性成像能实时动态地对特定肌群进行针对性测量;骨骼肌超声已被证实可通过检测疾病过程中肌肉的变化来预测疾病预后;另外,CT、磁共振成像、人体成分分析、生物电阻抗分析和肌肉活检等技术也可用于相应检测。
3 肌少症和心脏恶病质的治疗措施
3.1 基础药物治疗
长期以来,在CHF的治疗中,血管紧张素转化酶抑制剂、血管紧张素Ⅱ受体阻滞剂、β受体阻滞剂和醛固酮拮抗剂是心力衰竭药物治疗的基石,它们不仅可缓解临床症状,还可减轻心室肌的恶性重构并降低长期死亡率[18]。血管紧张素转化酶抑制剂已被证明通过多种生物学途径对肌少症发挥有益作用,它们可改善线粒体功能,升高IGF-1水平,增强胰岛素敏感性,并促进骨骼肌的葡萄糖摄取;醛固酮受体拮抗剂可通过减少骨骼肌细胞凋亡、改善血管内皮功能和增强肌肉收缩力来延缓肌少症的进展;β受体阻滞剂可逆转CHF患者交感神经系统的神经体液作用,并诱导CHF患者心室逆向重塑,从而改善心功能和运动能力。
3.2 激素治疗
近年来,使用激素治疗CHF患者肌肉减少的临床及实验证据基础有所改善。有随机对照试验[7,12]表明,睾酮替代疗法可改善中重度CHF老年患者的肌肉性能、运动能力和胰岛素抵抗。但考虑到其可能存在的各种副作用,选择性雄激素受体调节剂在理论上被认为是一种更好的治疗策略。生长激素、甲状腺激素、胰岛素作为体内重要的内分泌调节剂,具有多种生物学功能,其替代疗法被认为可通过多种机制预防肌肉减少[19-20],但临床疗效尚未得到证实。
3.3 靶向药物治疗
对于拮抗肌肉减少的治疗,众多靶向药物已在基础研究领域崭露头角。近期最引人注目的有MuRF1抑制剂,MuRF1是一种环型E3连接酶,主要负责骨骼肌分解代谢状态下发生的粗细丝的协调分解。虽然许多研究已证明MuRF1在分解代谢状态下骨骼肌萎缩的发展中起主要作用,但在心脏中,对MuRF1突变体的分析强调了其有益的心脏保护作用。Willis等[21]通过实验证明,对敲除MuRF1的小鼠,阿霉素诱导的心肌萎缩具有抵抗性。因此,MuRF1抑制剂有望成为治疗CHF患者肌肉减少的靶向治疗药物[22]。哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)是细胞生长的重要调节因子。在基因敲除小鼠模型中的研究表明,mTOR活性对体内过氧化物酶体激活受体介导的调节机制至关重要,缺乏激酶活性的突变体mTOR会诱发并抑制产后哺乳动物雷帕霉素复合物的信号转导,证明了mTOR突变对肌肉代谢的破坏作用。因此,mTOR及其化合物的蛋白激酶靶点也是肌少症的潜在治疗靶点。此外,肌肉生长因子的负调节剂主要与激活素ⅡB受体结合,肌抑素基因的敲除会导致小鼠肌肉质量显著增加,所以生长分化因子-15目前是治疗老年心力衰竭患者肌肉萎缩的热门方向[23]。有实验[24]证明,下丘脑黑皮质素在调节食欲、保持体重方面发挥重要作用,其代表药物外周黑皮质素-4受体拮抗剂亦有望成为治疗恶病质的候选药物。
3.4 运动训练与营养支持
运动训练是一种非药理学、有效、低成本、安全的治疗方法,《老年人肌少症防控干预中国专家共识(2023)》[17]建议,应对所有确诊为肌少症且无运动训练禁忌证的年龄≥60岁老年人进行科学的运动训练。推荐有氧训练、抗阻训练、平衡训练及祖国传统体育项目等训练方式有机结合,同时运动干预应联合营养干预。蛋白质是合成代谢和分解代谢平衡方面最重要的成分,蛋白质的推荐摄入量为1.2~1.5 g·kg-1·d-1;对于接受规范心力衰竭药物治疗的患者,可考虑补充不饱和脂肪酸以降低死亡风险和心血管住院风险;可结合患者血清25-羟维生素D3的浓度指导个体化的维生素D补充。另外,针对老年肌少症患者进行营养风险的筛查有着重要意义[17]。
3.5 辅助技术
辅助技术指用于维持或改善患者肌肉功能的设备或系统。尤其是因身体残疾而缺乏锻炼的老年心力衰竭患者可接受辅助技术治疗。一项对104例老年人进行了辅助技术与常规护理对比的随机对照试验[25]发现,18个月后,与对照组相比,干预组(接受了一系列助行器和卫生辅助设备)的肌肉功能下降减少(平均下降分别为4%和11%,P=0.01)。故辅助技术未来可被期望用于CHF患者。
4 展望
CHF患者若伴有肌少症和心脏恶病质,可导致生活质量严重下降和死亡率增加,预后极差。但由于受种族、年龄和性别的影响,肌少症和心脏恶病质的诊断一直以来并无统一的标准。最重要的是,迄今为止仍缺乏有效的治疗策略。因此,未来期望肌少症及恶病质的诊断评估标准可进一步明确,同时期待精准的生物标志物用于二者的分期和预后判断。