免疫磁珠结合显色平板快速检测婴儿配方奶粉中阪崎克罗诺杆菌
王磊,张洁,张文馨,崔晓雅
(天津市食品安全检测技术研究院,天津 300308)
克罗诺杆菌属(Cronobacter spp.),原名为阪崎肠杆菌(Enterobacter sakazakii),2008 年被重新命名划分为克罗诺杆菌属,目前共包括7 个种,是一种革兰氏阴性无芽胞杆菌,有鞭毛,兼性厌氧,广泛存在于自然环境中。阪崎克罗诺杆菌(Cronobacter sakazakii)是该菌属中最主要的一种条件致病菌,其具有一定的耐热和耐干燥性,可以在水分含量较低的环境中长时间存活,极易在加工生产过程中对婴儿配方奶粉造成污染,继而造成新生儿和婴幼儿的严重感染[1-3]。为应对此类风险,我国在现行食品安全国家标准中,对克罗诺杆菌属的限量进行了严格的规定,同时对相应的检验方法也作出了要求。传统的检验方法较为复杂,包括增菌、分离、纯化、鉴定等步骤,检验周期过长的问题限制了其在实时快速监测领域中的应用。
免疫磁珠分离技术基于抗原抗体反应及磁力学原理,可以将目标微生物从成分复杂的样品基质中分离出来并保持其生物活性,具有缩短检测时间、提高检出率等优势。该项技术现已被应用于金黄色葡萄球菌、霍乱弧菌、副溶血性弧菌等多种细菌的检测中,与实时荧光聚合酶链反应、酶联免疫吸附、量子点荧光标记等其它分析手段的联合研究也取得了良好的进展[4-7]。目前用于检测致病性大肠埃希氏菌、沙门氏菌、单增李斯特氏菌等致病菌的免疫磁珠已经实现商品化,但大多数为国外进口产品[8],价格较高,不易于普及,因此国产高质量的致病菌免疫磁珠生产工艺亟待发展。对于该技术在检测阪崎克罗诺杆菌方面的应用,重点则在于突破增菌等前处理环节耗时长和实际样品污染水平低的问题[9-10],因此制备高特异性免疫磁珠和选择合适的后续技术与之相匹配,成为了需要解决的核心关键点。
本研究利用阪崎克罗诺杆菌颗粒抗原免疫新西兰大耳兔,获得特异性多克隆抗体,将抗体纯化后,与经过活化的纳米级羧基磁珠偶联结合,制备免疫磁珠,并对其制备工艺进行优化。以此为基础,对免疫磁珠的选择性捕获能力进行研究,改进传统前处理方式,选用显色培养基作为后续分离材料,开发出免疫磁珠-显色平板检测方法,对其实际应用效果进行评价。以期建立一种高特异性、高灵敏度的检测方法,实现对婴儿配方食品中阪崎克罗诺杆菌的快速定量分析,同时为免疫磁珠技术结合其它检测技术的应用提供参考。
1 材料与方法
1.1 材料与试剂
婴儿配方奶粉:市售;新西兰大耳兔:山东艾莱克生物科技有限公司;Affimag PSC 磁性微球(羧基修饰,0.1~0.5 μm):天津市倍思乐色谱技术开发中心;阪崎克罗诺杆菌(Cronobacter sakazakii)ATCC29544、金黄色葡萄球菌(Staphylococcus aureus)ATCC6538、铜绿假单胞菌(Pseudomonas aeruginosa)ATCC9027、单核细胞增生增李斯特氏菌(Listeria monocytogenes)ATCC19115:美国模式菌种收集中心;鼠伤寒沙门氏菌(Salmonella Typhimurium)CMCC(B)50115、大肠埃希氏菌(Escherichia coli)CMCC(B)44103:中国医学细菌保藏管理中心。
缓冲蛋白胨水(buffered peptone water,BPW)、阪崎肠杆菌显色培养基、营养琼脂:北京陆桥技术股份有限公司;N-羟基琥珀酰亚胺(N-hydroxysuccinimide,NHS)、吗啉乙磺酸一水合物[2-(N-morpholino)ethanesulfonic acid monohydrate,MES]、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐 [1-ethyl-3-(3-dimethyllaminopropyl)carbodiimide hydrochloride,EDC]、牛血清蛋白(bovine serum albumin,BSA)、二喹啉甲酸(bicinchoninic acid,BCA)蛋白浓度测定试剂盒:北京索莱宝科技有限公司;无水磷酸氢二钠、磷酸二氢钾(均为分析纯):国药集团化学试剂有限公司。
1.2 仪器与设备
GNP-9270 型隔水式恒温培养箱:上海精宏实验设备有限公司;MaxQ 6000 制冷型摇床、Multiskan GO全波长酶标仪:美国Thermo 公司;WGZ-2-XJ 型细菌浊度计:上海昕瑞仪器仪表有限公司;Dynabeads MX Mixer 磁珠混合仪:Life Technologies 公司;Centrifuge 5417R 台式离心机:Eppendorf 公司;明澈-D 24 UV 型超纯水机:美国Millipore 公司。
1.3 方法
1.3.1 多克隆抗体的制备
将阪崎克罗诺杆菌颗粒性抗原与佐剂按照体积比1∶1 混合,免疫剂量为106CFU/只。采用耳缘静脉注射方式,每隔21 d 对4 只健康雌性新西兰大耳兔(3~5 kg 左右)进行免疫,连续4 次,最后1 次免疫完成后进行颈动脉采血,将所得血液立即注入无菌锥形瓶中,4 ℃过夜,次日4 ℃、5 000 r/min 离心30 min 获得抗血清。将抗血清加入辛酸和硫酸铵进行粗纯化[11],采取Protein A/G 亲和层析柱法[12]进行二次纯化,制得纯化后的抗体,-20 ℃保存备用。
1.3.2 免疫磁珠的制备与偶联条件优化
取1 mg 羧基修饰磁性微球至离心管,用500 μL MES 吐温溶液(0.01 mol/L,pH6.0,0.05%吐温-20)洗涤3 次。之后分别加入100 μL 的5 mg/mL EDC 和NHS溶液,振荡保持磁珠悬浮,37 ℃活化45 min,磁分离后去除上清液。最后加入500 μL MES 吐温溶液重新悬浮并洗涤2 次,去除上清液。
将1 mg 已活化的磁珠与500 μg 多克隆抗体混合,用MES 溶液(0.01 mol/L、pH6.0)调节总体积至500 μL,37 ℃振荡反应,期间保持磁珠悬浮,经不同反应时间(0.5、1.0、1.5、2.0、2.5、3.0 h)后,磁分离并回收上清液,采用BCA 蛋白测试盒测定上清液中剩余抗体含量,根据公式(1)计算偶联率,确定磁珠与抗体的最佳偶联时间。按以上方法,改变温度(4、15、25、37、42、45 ℃),反应至合适时间,确定最佳偶联温度;改变抗体添加量(50、100、150、200、250、300、350、400 μg),与磁珠在合适温度和时间下反应,根据公式(2)计算偶联量,确定抗体最佳添加量,所有试验设置3 个平行。
式中:R 为偶联率,%;Ca为偶联后上清液抗体浓度,mg/mL;Cb为偶联前添加抗体浓度,mg/mL。
式中:Mc为偶联量,μg;M 为抗体添加量,μg;R 为偶联率,%。
磁珠偶联后用500 μL MES 溶液洗涤2 次,加入1 mL 0.04 mol/L 含1%BSA 的硼酸盐吐温溶液(pH 9.0,0.05%吐温-20),重悬磁珠,37 ℃振荡封闭45 min。最后将磁珠洗涤后,加入200 μL 磷酸盐吐温溶液(0.01 mol/L,pH7.4,0.05%吐温-20),重悬磁珠,4 ℃保存[13-16]。
1.3.3 免疫磁珠敏感性的评价
利用比浊法调整阪崎克罗诺杆菌菌液浓度为1010、109、108、107、106、105、104、103CFU/mL,各取100 μL分别与0.4 mg 的免疫磁珠混合于1.5 mL 无菌离心管中,BPW 定容至1 mL;常温振荡反应45 min,磁分离3 min,弃上清液,加入0.5 mL 磷酸盐缓冲液(0.01 mol/L,pH7.4)洗涤磁珠3 次,再加入1 mL 缓冲液振荡重悬磁珠;将磁珠重悬液稀释至合适梯度后,取100 μL 涂布于阪崎克罗诺杆菌显色平板36 ℃、24 h 培养计数,每个免疫磁珠添加量设置3 个平行,并以不添加免疫磁珠的菌液为空白对照,根据公式(3)计算捕获率。
式中:E 为捕获率,%;N 为磁珠重悬液菌落总数,CFU/mL;N0为空白对照液菌落总数,CFU/mL。
1.3.4 免疫磁珠特异性的评价
将阪崎克罗诺杆菌、大肠埃希氏菌、鼠伤寒沙门氏菌、铜绿假单胞菌、单增李斯特氏菌、金黄色葡萄球菌菌株于营养肉汤36 ℃培养过夜,比浊法调整菌浓度至106~107CFU/mL,按1.3.3 的方法操作,与免疫磁珠进行混合反应,磁珠重悬液涂布营养琼脂平板36 ℃、48 h 培养,计算捕获率。
1.3.5 免疫磁珠-显色平板检测方法的建立及对婴儿配方奶粉的应用
取100 g 市售婴儿配方奶粉(阪崎克罗诺杆菌阴性)加入到900 mL 缓冲蛋白胨水中,模拟样品实际污染情况,接种1 mL 稀释至相同数量级浓度的阪崎克罗诺杆菌、大肠杆菌、鼠伤寒沙门氏菌、铜绿假单胞菌、单增李斯特氏菌、金黄色葡萄球菌混合菌液,使样品目标菌及背景菌浓度为102、103、104CFU/g;取0.4 mg 免疫磁珠与1 mL 模拟样品液均匀混合,按1.3.3 操作,最终将免疫磁珠完全涂布显色平板,培养并计算捕获率。每个菌浓度设置3 个平行,以不添加免疫磁珠的样品液为空白对照。
2 结果与分析
2.1 磁珠与抗体偶联条件优化
2.1.1 偶联时间对偶联量的影响
图1 为偶联时间对活化磁珠与抗体偶联量的影响。

图1 偶联时间对偶联效果的影响Fig.1 Influence of coupling time on coupling effect
用BCA 法蛋白测试盒检测上清液中剩余抗体的含量,因为吸光度与蛋白质浓度成正比[17],所以用吸光度表征抗体含量,剩余抗体含量越低,则偶联效果越好。由图1 可知,偶联时间在0.5~1.5 h 内,上清液剩余抗体量递减迅速,当超过2.0 h 后,上清液抗体量趋向稳定,说明结合到磁珠表面的抗体量在2.0 h 左右达到饱和。因此,选择2.0 h 作为活化磁珠与抗体的偶联时间。
2.1.2 偶联温度对偶联量的影响
图2 为偶联温度对活化磁珠与抗体偶联量的影响。

图2 偶联温度对偶联效果的影响Fig.2 Influence of coupling temperature on coupling effect
由图2 可知,在偶联温度为4~15 ℃时,活化磁珠与抗体之间的偶联反应受到抑制,吸光度变化不明显,且观察到磁珠不易分散,甚至产生颗粒状沉淀的情况,不利于原料的充分利用。在偶联温度为15~37 ℃时,吸光度明显降低,表明偶联到磁珠上的抗体量开始增加。当偶联温度超过37 ℃,吸光度再次趋向稳定,表明偶联温度高于37 ℃时可有效促进抗体在磁珠表面的结合,达成最佳反应效果,从节能角度考虑,选择37 ℃作为偶联的最适温度,同时37 ℃时抗体能保持较好活性,制得的免疫磁珠在溶液中分散性良好。
2.1.3 抗体添加量对偶联率和偶联量的影响
图3 和图4 为抗体添加量对偶联率和偶联量的影响。
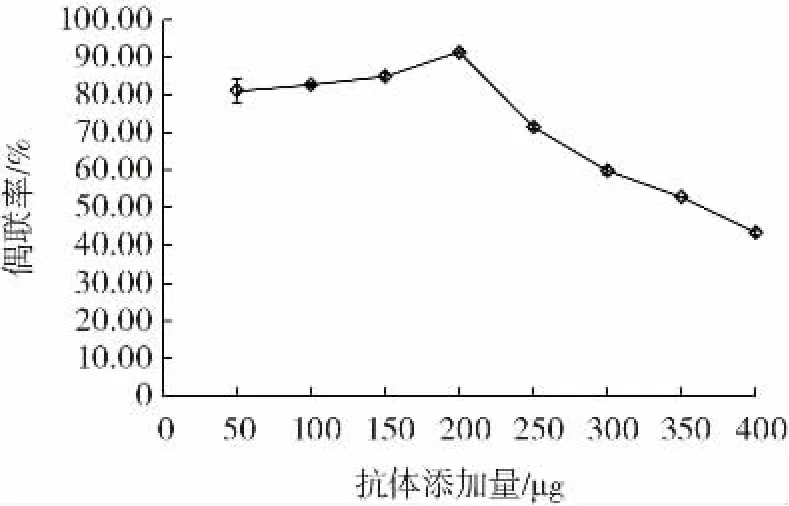
图3 抗体添加量与偶联率的关系Fig.3 Relationship between the dosage of antibody and the coupling efficiency

图4 抗体添加量与实际偶联量的关系Fig.4 Relationship between the dosage of antibody and the actual coupling amount
由图3 和图4 可知,当抗体添加量在50~200 μg时,每毫克活化磁珠偶联上的抗体量逐渐增加,当抗体添加量大于200 μg 时,磁珠和抗体的偶联率不再上升,并开始下降,此时1 mg 磁珠实际结合的抗体量为182.77 μg,且随着抗体量的增加而稳定在200 μg 左右,不再明显增加或减少,说明1 mg 磁珠与200 μg 抗体偶联已接近饱和状态。对于单位质量的磁珠,其表面的活性基团有限,在抗体添加到一定程度后,磁珠表面所偶联的数量已达到最大值,偶联量不会继续增加,再加入过多的抗体则造成浪费[18],所以选取200 μg作为偶联1 mg 磁珠的最佳抗体添加量。
2.2 免疫磁珠敏感性评价
图5 为不同菌浓度下免疫磁珠对阪崎克罗诺杆菌的捕获率。
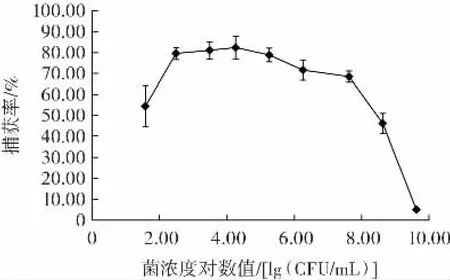
图5 菌浓度与捕获率的关系Fig.5 Relationship between bacterial concentration and capture efficiency
由图5 可知,当菌浓度对数值为1.58(菌浓度为38 CFU/mL)时,菌体捕获率较低,仅为54.4%,但免疫磁珠仍能有效分离出目标菌,这可能是由于目标菌在磁珠清洗和吸取过程中有所损失。当菌浓度对数值为2.49~7.63(菌浓度为3.12×102~4.24×107CFU/mL)时,免疫磁珠对阪崎克罗诺杆菌的捕获率为68.4%~82.4%,且捕获效果稳定。当菌浓度对数值大于7.63(菌浓度为4.24×107CFU/mL)时,实际捕获量达到饱和,捕获率开始急剧下降,结果显示在1 mL 纯培养体系中,免疫磁珠有效捕获目标菌的菌浓度范围为102~107CFU/mL,表明免疫磁珠对阪崎克罗诺杆菌具有良好的灵敏度。
2.3 免疫磁珠特异性评价
图6 为免疫磁珠和阪崎克罗诺杆菌及各种非目标菌的交叉反应情况。

图6 免疫磁珠与各菌种的交叉反应情况Fig.6 Cross-reaction of immunomagnetic beads with various bacteria
在菌浓度为106CFU/mL 的条件下,对免疫磁珠的抗干扰性能进行测定。由图6 可知,免疫磁珠对鼠伤寒沙门氏菌、铜绿假单胞菌、单增李斯特氏菌交叉反应率均低于5%;同时和大肠埃希氏菌、金黄色葡萄球菌存在一定的交叉反应,交叉反应率低于10%,此类和非目标菌较低的干扰反应,可进一步通过其它手段排除影响;而相同条件下,免疫磁珠对于目标菌的有效捕获率高达78.8%,具有明显的优势性,表明其针对阪崎克罗诺杆菌的特异性良好。
2.4 免疫磁珠-显色平板检测方法的建立及应用分析
为更好的覆盖到微量目标菌,设计保留了样品接种量、稀释液[19]等传统方法框架,并且以制备的高敏感性和特异性免疫磁珠为主体,直接利用富集分离技术代替国标方法的增菌培养过程。考虑到捕获过程中与其他背景菌可能产生的交叉反应,采用了选择性较好且结果直观的阪崎肠杆菌显色培养基[20]作为后续分离目标菌菌落的载体,从而建立了免疫磁珠-显色平板检测方法,以达到有效区分和抑制其他菌株生长并提高检出率的目的。
在日常检测中,婴儿配方奶粉中微生物及阪崎克罗诺杆菌的污染水平较低,所以人工污染样品使其目标菌及背景菌浓度达到102、103、104CFU/g,模拟实际样品的检测情况。
表1 为免疫磁珠分别在1 mL 目标菌纯培养体系和模拟样品体系中对阪崎克罗诺杆菌的捕获效果比较。

表1 不同样品基质中免疫磁珠捕获效果的比较Table 1 Comparison of the capture effect of immunomagnetic beads in different sample matrices
由表1 可知,当奶粉中添加的阪崎克罗诺杆菌浓度为104~105CFU/g 时,免疫磁珠的捕获率为66.2%,与纯培养条件下相比,出现了较大幅度的降低;阪崎克罗诺杆菌浓度为102~104CFU/g 时,样品体系中的捕获率下降幅度较小,维持在70%左右;免疫磁珠在不同基质中的捕获效果存在一定差距,说明其特异性捕获能力在一定程度上,受到了奶粉样品基质和背景杂菌因素的干扰影响,但其捕获率仍在有效范围内。
3 结论
本研究在筛选免疫磁珠的最适反应温度、反应时间和抗体添加量时发现,反应在30~45 ℃时偶联2.0 h即可完成,表明制备工艺对控制温度要求并不苛刻,其实际偶联率大于90%,偶联量大于180 μg/mg 磁珠,对抗体的利用程度较高,制备工艺简便。在检测方面,免疫磁珠具有良好的敏感性,对阪崎克罗诺杆菌的有效捕获浓度范围为102~107CFU/mL,检测范围较为宽泛,有利于在低污染量样品中使用;此外,所制备的磁珠在交叉反应试验中表现出较强的特异性,对目标菌捕获率高达78.8%,而对其它常见细菌的反应率低于10%。当以免疫磁珠-显色平板检测方法处理模拟污染样品时,在复杂的背景和基质条件下,可直接捕获收集目标菌,在102~105CFU/g 的菌浓度范围内,免疫磁珠捕获率为65%以上,方法中样品前处理用时仅需1~2 h,相比GB 4789.40—2016《食品安全国家标准食品微生物学检验克罗诺杆菌属(阪崎肠杆菌)检验》中的18 h+24 h 两次增菌步骤,缩短了该项目的检测周期。综上,本研究建立的检测方法对于快速实时监控婴儿配方食品中阪崎克罗诺杆菌具有重要的应用价值。

