腺苷酸活化蛋白激酶在哈萨克族食管鳞癌组织中的表达及意义
刘瑞雪,张力为
(新疆医科大学第一附属医院胸外科,新疆 乌鲁木齐 830054)
食管癌是食管上皮来源的恶性肿瘤。据2020年世界卫生组织统计,食管癌居世界恶性肿瘤发病率第6位,死亡率第8 位,由于种族、遗传和生活环境等因素影响,发展中国家的食管癌发病率高于发达国家,中国一直是食管癌发病率最高的国家之一[1-2]。据我国流行病学调查,中国食管癌90%以上是食管鳞癌,新疆是我国食管癌的高发区之一,而当地哈萨克族食管癌的发病率相较同地区的汉族等其他民族,发病率显得尤其高(68.8/10万)[3]。尽管目前对新疆地区食管癌高发人群开展了大量研究,但其主要致病因素尚未明确,发病机制更需要进一步探究。关于食管癌脂代谢相关分子改变的研究更是少见。
本课题组前期通过对哈萨克族食管鳞癌组织的转录组测序研究和生物信息学分析,发现与食管鳞癌进展相关的小分子代谢物和差异表达基因中,脂肪酸代谢途径相关代谢物和能量代谢效应分子腺苷酸活化蛋白激酶(adenosine 5'-monophosphate-activated protein kinase,AMPK)表现出显著的相关性[4]。AMPK 是哺乳动物组织中细胞代谢和能量稳态的调节器。研究表明,AMPK 活化后促进丙二酰基转移酶(N-malonyl transferase,ACC)磷酸化,使其活性降低,减少丙二酰辅酶A 合成,而丙二酰辅酶A 既是脂肪酸合成的底物,又是脂肪酸β-氧化的关键酶CPT-1 的别构抑制剂,因此,丙二酰辅酶A合成减少可以增强CPT-1的活性,促进脂肪酸氧化[5-6]。这些研究提示,哈萨克族食管鳞癌细胞可能利用代谢性信号传导分子及转录因子微调脂肪合成和脂肪分解以满足快速增殖的肿瘤细胞对脂质的需求。本研究通过免疫组织化学方法评估AMPK 在新疆哈萨克族食管鳞癌中的表达及其与临床病理特征和预后的关系,接着通过液相色谱质谱联动技术,探索AMPK 通过介导脂质代谢重编程调控食管鳞癌进展的情况。
1 材料与方法
1.1 一般资料
本文回顾性地收集2010年1月—2018年12月在新疆医科大学第一附属医院胸外科行食管鳞癌根治性切除术的65 例哈萨克族患者。纳入标准:①临床资料(性别、年龄、分化程度、T分期、N分期和TNM分级)完整的哈萨克族食管鳞癌患者,患者的病理分期依据2009 年国际抗癌联盟(International Cancer Control,UICC)食管癌TNM分期系统(第7版);②术前未进行任何可能影响基因改变的治疗;③由本院病理科两位副主任医师共同确定为原发性食管鳞状细胞癌的患者,且确定癌旁组织(离食管癌组织≥5 cm)为无癌正常组织。排除标准:①围术期死亡患者(术后1月因严重术后并发症死亡患者);②既往有其他恶性肿瘤病史患者。纳入65例研究对象均采用电话随访方式,随访截止日期为2022 年12 月31 日。收集入组患者的组织蜡块和新鲜组织标本进行免疫组织化学和实时荧光定量PCR(quantitative real-time PCR,qPCR)检测。研究实行之前,本研究得到新疆医科大学第一附属医院伦理委员会批准(K202304-10)。
1.2 细胞及主要试剂
食管鳞癌细胞系(KYSE150、TE-1)购自武汉普诺赛生物科技有限公司,正常食管细胞系(SHEE)由新疆医科大学第一附属医院卢晓梅教授课题组馈赠。细胞均培育在加有双抗(青霉素、链霉素)含10%胎牛血清的RPMI-1640培养液中,细胞孵育在温度37 ℃、CO2体积分数5%、湿度90%的培养箱中。胎牛血清为上海睿铂赛生物科技公司产品,RPMI-1640培养液购自美国海克隆公司,青霉素和链霉素、0.25%EDTA胰酶消化液均购于上海碧云天生物技术公司。SDS-PAGE凝胶制备试剂盒、BCA蛋白定量试剂盒、蛋白上样缓冲液购自北京索莱宝公司。Revert Aid First Strand cDNA Synthesis Kit、miScript SYBR Green PCR Kit均购自TaKaRa 公司。RNA 提取试剂TRIzol 购自Invitrogen 公司。兔抗AMPK 单克隆抗体购自德国CST公司,山羊抗兔IgG 购自北京中杉金桥生物公司。AMPK和GAPDH引物在上海生工生物科技有限公司合成。引物序列如表1。
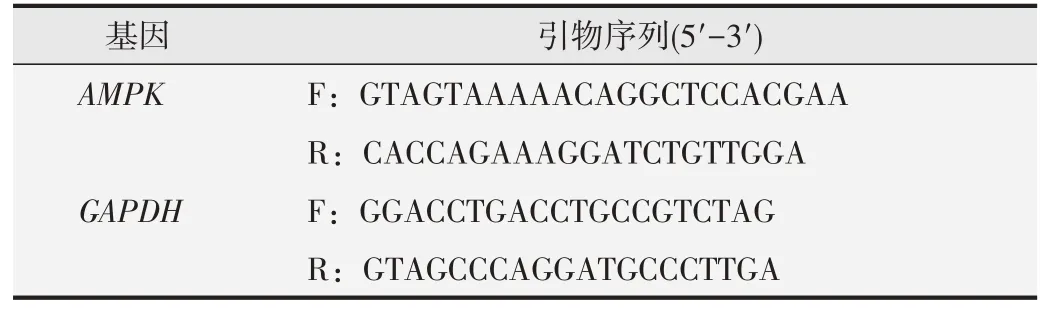
表1 PCR引物序列
1.3 方 法
1.3.1 qPCR 检测腺苷酸活化蛋白激酶mRNA 表达将31 对哈萨克族食管鳞癌组织和癌旁组织切成50 g,采用Trizol 裂解组织,用氯仿和异丙醇提取总RNA,分光光度计测定其纯度。然后以提取的RNA 为模板,按Revert Aid First Strand cDNA Synthesis Kit 逆转录试剂盒说明书反转录得到的cDNA,在实时定量PCR仪(Thermo 7500)上进行PCR扩增。PCR扩增反应体积为20 μL,反应条件:95 ℃、2 min;95 ℃、15 s,58 ℃、34 s,40个循环;所有步骤均按照试剂盒说明书进行。以GAPDH 为参照,用2-ΔΔCT方法计算mRNA的相对表达水平。检测重复3次。
1.3.2 免疫组织化学检测腺苷酸活化蛋白激酶蛋白表达对65例哈萨克族食管鳞癌组织及配对癌旁组织进行免疫组织化学染色,观察AMPK 蛋白表达水平,所有组织标本石蜡切片均由本院病理科提供,石蜡组织切片常规60 ℃烤片60 min,依次进行二甲苯脱蜡、梯度酒精水化、3%H2O2封闭内源性过氧化物酶、枸橼酸盐修复缓冲液中高火修复组织15 min,冷却,PBS洗3遍,每次5 min。一抗AMPK(1∶400 稀释)4 ℃孵育避光过夜;PBS 冲洗,山羊抗兔IgG 室温孵育1 h;PBS冲洗3 遍。DAB 显色、苏木素复染、分化、封片、观察、拍照。
1.3.3 免疫组化染色结果的评分染色结果的评分标准:经过两位病理科副主任医师在50倍视野下根据染色面积和强度评估染色程度。每一张图取5 个视野,按阳性细胞百分比分4 个等级:[0,25%)为0 分;[25%,50%)为1 分;[50%,75%)为2 分;[75%,100%]为3 分。组织染色强度分为4 个等级:未着色0分;浅棕色1分;棕色2分;深棕色3分。结果按照阳性细胞百分比评分×染色强度评分,0~2 分为低表达,3~8分为高表达。
1.3.4 Western blot法检测腺苷酸活化蛋白激酶蛋白表达按照碧云天蛋白裂解液试剂说明书提取KYSE150、TE-1及SHEE细胞的总蛋白,根据BCA蛋白浓度测量试剂说明书测定细胞样本的蛋白浓度,然后根据不同浓度进行定量上样(每孔上样量40 μg),在10% SDS-PAGE 恒压电泳法分离所有目的蛋白(60 V、30 min,120 V、90 min),然后恒流条件下(200 mA)湿法转膜将蛋白转移至PVDF膜上,取出条带洗膜10~15 min,室温条件下5%牛奶在摇床上均匀封闭1 h,TBST 洗膜3 遍。然后孵育目的蛋白一抗4℃过夜,所用一抗为兔抗人AMPK(1:400 稀释),β-action(1∶5 000稀释),接着TBST洗膜3遍(每遍5 min),加山羊抗兔IgG 的二抗(1∶5 000 稀释),室温孵育1 h,TBST充分洗掉背景后,用增强ECL底物发光法曝光蛋白条带成像。以β-action 作为内参,通过ImageJ 软件分析蛋白条带。以目的蛋白条带的灰度值和内参蛋白条带灰度值的比值大小计算蛋白相对表达水平。
1.3.5 慢病毒感染稳定敲低腺苷酸活化蛋白激酶细胞均在RPMI-1640培养基中培养,细胞汇合度为80%~90%时进行常规传代。当6孔板中KYSE150处于对数生长期时,使用慢病毒载体感染。慢病毒载体构建于上海汉恒科技有限公司,3 个敲低序列如下:shAMPK-1,GTTGCCTACCATCTCATAATA;shAMPK-2,GTGACCTCACTTGACTCTTCT;shAMPK-3,GTA GCTGTGAAGATACTCAAT。首先,用无血清RPMI-1640 在6 孔板中对细胞株进行感染。以MOI 值为20、20、15感染KYSE150细胞。操作均根据试剂盒说明书在37 ℃下用6 μg/mL 的Polybrene 混合物进行感染48 h。然后取出培养液,换上含10%胎牛血清的完全培养基。连续培养6~8 d,2 mg/mL 嘌呤霉素筛选,从而得到稳定转染的细胞。通过Western blot 方法验证AMPK敲低的效果。因为干扰序列LV-shRNA-AMPK3敲低AMPK 效果最好,因此后续实验采用此序列进行敲低AMPK,统一命名为shRNA-AMPK,并将干扰组细胞命名为实验组细胞,未处理组细胞命名为对照组细胞。
1.3.6 超高效液相色谱-质谱法进行脂质定性定量分析将实验组和对照组细胞,去除完全培养基,用预冷的PBS 溶液迅速清洗细胞。随后去除PBS 溶液,加入1 mL胰酶,消化至细胞呈球状;然后加入1 mL完全培养基,轻轻吹打,终止消化。然后快速计数,取1×107个细胞。离心机-20 ℃预冷,在4 ℃、2 500 g条件下离心5 min。去除上清,迅速放入液氮速冻30 s,然后放-80 ℃保存。寄送(干冰保存)到上海阿趣生物科技有限公司。
1.4 统计分析
采用SPSS 22.0 软件和GraphPad Prism 9.3.1 软件进行统计分析和作图,数据采用±s表示,组间比较采用χ2检验;AMPK 的表达与临床病理参数的关系采用Spearman 相关分析法;总体生存预后分析采用Kaplan-Meier 曲线表示;各指标间的相关性分析采用单因素和多因素Cox 比例风险回归分析。以P<0.05 为差异有统计学意义。
2 结 果
2.1 AMPK在哈萨克族食管鳞癌组织中高表达
通过qPCR评估哈萨克族ESCC肿瘤组织和癌旁正常组织中AMPK mRNA的表达,结果提示食管鳞癌组织中的AMPK mRNA 表达水平高于癌旁正常组织(P<0.01,图1A)。接着,对65 例哈萨克族食管鳞癌组织及配对正常组织进行免疫组织化学分析,结果显示在食管鳞癌组织中的阳性表达率(58.46%,38/65)高于癌旁正常食管组织(30.77%,20/65)(χ2=10.086,P<0.01,图2)。AMPK 的蛋白表达水平与患者临床病理特征的关系提示,AMPK 的表达与年龄(P=0.045)、分化程度(P=0.006)有关(表2)。单因素Cox 回归分析结果提示AMPK阳性表达(P=0.01)和淋巴结转移(P=0.003)可能是影响患者总生存期的因素。多因素Cox 回归分析AMPK 阳性表达是影响患者总生存期的独立危险因素(表3)。Kaplan-Meier 生存曲线分析结果提示,AMPK高表达与ESCC 患者较短的OS 有关(P<0.05,见图3)。总之,上述数据表明,AMPK 在哈萨克族食管鳞癌中表达上调,其上调与ESCC的发生发展相关。
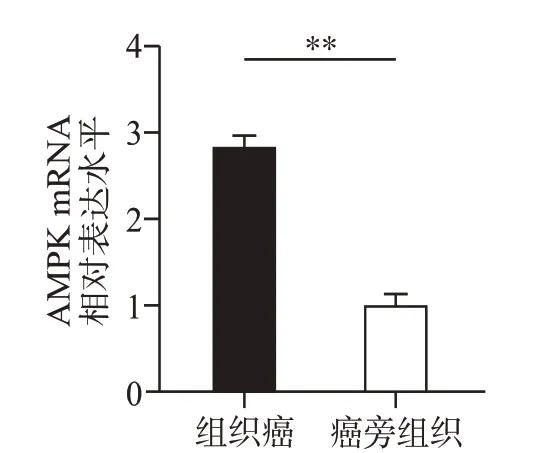
图1 荧光定量PCR法检测哈萨克族患者食管鳞癌组织中AMPK mRNA表达水平

图2 免疫组织化学方法检测AMPK 蛋白的表达
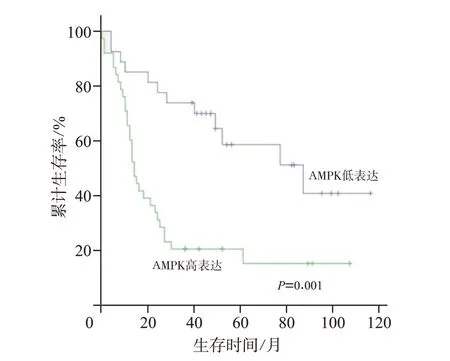
图3 AMPK 蛋白不同表达水平的哈萨克族ESCC 患者的Kaplan-Meier生存分析
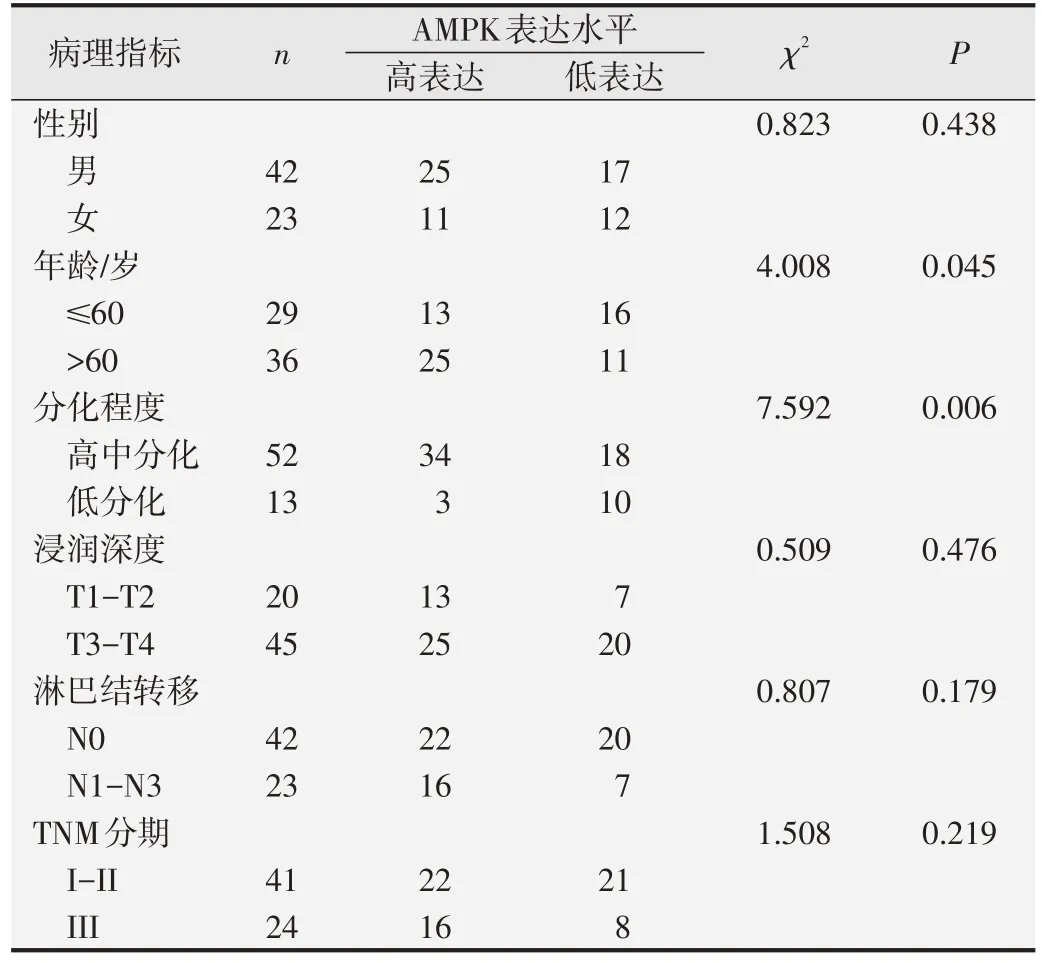
表2 食管鳞癌组织中AMPK 蛋白表达水平与患者临床病理指标之间的关系
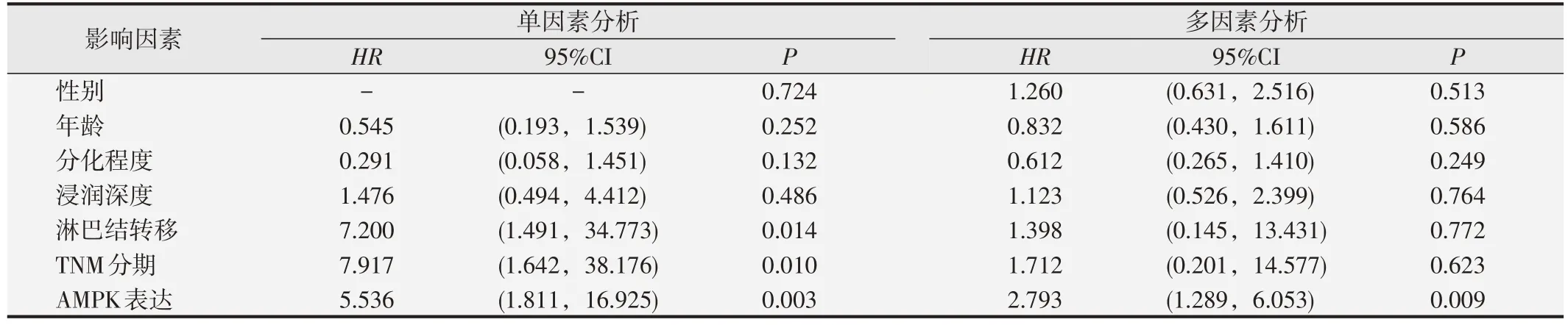
表3 食管鳞癌患者不良预后影响因素的Cox回归分析
2.2 AMPK基因敲低诱导的脂质代谢变化
为了了解AMPK 在ESCC 细胞中是否参与调节哈萨克族食管鳞癌脂肪代谢重编程,我们评估AMPK 在食管癌细胞系和食管正常细胞(KYSE150、TE-1、SHEE)中的表达水平,结果提示相较于食管上皮正常细胞,AMPK 的蛋白表达水平在KYSE150 和TE-1 中明显高表达,且在KYSE150 尤为明显(图4A、C)。因此,我们选择慢病毒感染方式在KYSE150细胞系中敲低AMPK,筛选出敲低最明显的shRNA-AMPK3(图4B、D)。为了识别AMPK 改变可能导致细胞脂质代谢的关键因素,我们针对AMPK敲低的KYSE150细胞及相应的对照组采用超高效液相色谱-质谱法进行脂质定性定量分析。结果发现不同脂质等级中脂质含量及变化趋势不同。6个样本共鉴定出10种脂质亚类,由脂肪酸类(7.88%)、甘油脂类(60.77%)、甘油鞘脂类(21.35%)、鞘脂类(9.62%)和固醇脂类(0.38%)组成。与未处理组比较,AMPK 敲低组食管癌细胞脂质代谢发生明显变化,共发现76 个差异脂质代谢物,其中37个上调,29 个下调(图5A、B)。接着我们对差异代谢物进行层次聚类分析,观察到甘油三酯(TAG)的上调及鞘磷脂(SM)、甘油二酯(DAG)和磷脂酰乙醇胺(PE)的下调(图5C)。同时我们对差异代谢物的定量值进行相关系数计算,结果提示甘油三酯与其他脂质之间存在着更明显的负相关关系(图5D)。
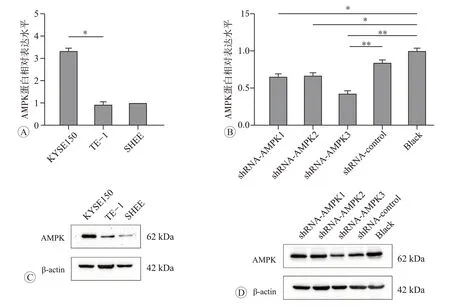
图4 Western blot检测KYSE150、TE-1、SHEE细胞中AMPK蛋白的表达情况和在KYSE150细胞中慢病毒敲低AMPK的效率
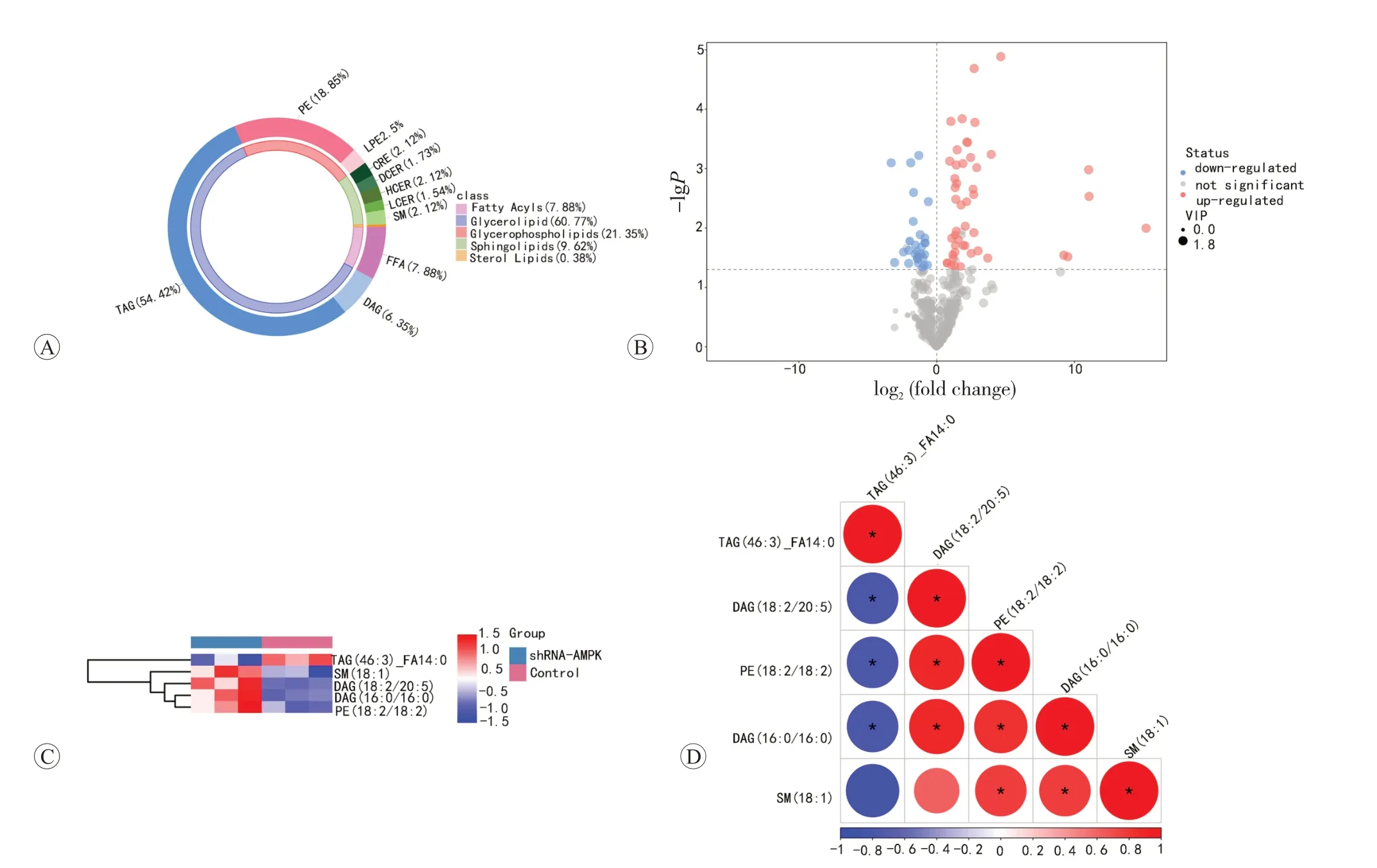
图5 超高效液相色谱-质谱法分析AMPK基因敲低诱导的脂质代谢变化
3 讨 论
糖酵解是肿瘤细胞中能量产生的主要途径,其葡萄糖摄取和糖酵解能力维持在较高的水平,以增强其在应激条件下的增殖和存活能力[7]。AMPK是一种丝氨酸/苏氨酸蛋白激酶,是细胞的能量传感器。传统观点认为AMPK 是肿瘤抑制因子,高表达AMPK 可抑制肿瘤细胞的生长,对肿瘤治疗相关药物研究也主要集中于激活AMPK 的药物。然而,近期AMPK 被证明在外部压力及内环境应激下促进肿瘤的生存[8]。AMPK在肿瘤中的作用及促癌或抑癌角色仍存在争议。有研究表明,食管鳞癌组织中AMPK 蛋白阳性表达率与正常食管黏膜组织比较,差异无统计学意义;不同临床病理特征的食管鳞癌组织中AMPK 蛋白阳性表达率差异亦无统计学意义[9]。本研究结果却提示AMPK 在哈萨克族食管鳞癌中高表达,且AMPK 的表达水平与年龄、肿瘤分化程度相关。多因素分析结果显示,AMPK 的表达是新疆哈萨克族食管鳞癌患者预后的危险因素。结合新疆地区食管癌的流行病学特点及AMPK 的差异表达,其可能对哈萨克族食管癌的进展有特殊影响。
在哺乳动物中,AMPK 被认为通过直接磷酸化蛋白质或调节肝脏、脂肪和肌肉等特定组织中的基因转录来调节脂质代谢[10]。有研究发现AMPK 活性与羟甲基戊二酰辅酶A 还原酶(HMGCR)和乙酰辅酶A 羧化酶(ACC)有关,这两种酶都是胆固醇和脂肪酸合成的关键调节因子[11]。肿瘤研究中提示AMPK 可能参与调控脂质代谢重编程。在肺癌中,溶瘤腺病毒Ad-apoptin以AMPK 为靶点,通过AMPK/ACC 途径,抑制肿瘤脂代谢促进细胞凋亡[12]。在乳腺癌的研究中指出,AMPK参与赖氨酸酶去甲基化5b介导的EMT和脂质代谢重编程[13-14]。脂质的准确鉴定和绝对定量对全面研究脂质代谢具有重要意义。我们针对AMPK 敲低后的食管鳞癌细胞KYSE150 进行了液相色谱质谱-脂质靶向定量分析,相较于空白对照组,AMPK 敲低组细胞内甘油三酯的含量明显降低;差异代谢物相关性分析结果显示甘油三酯的一种类型TAG(46∶3)_FA14∶0与甘油二酯、磷脂酰乙醇胺、鞘磷脂明显的负相关。细胞中脂肪酸合成活跃,甘油三酯被合成储存在脂滴中,脂滴的数量和细胞内葡萄糖的浓度密切相关[15]。结果提示AMPK 可能参与食管鳞癌中的脂质代谢重编程,在食管癌的进展中扮演重要角色。Qu等[16]在肾细胞癌的研究中指出,抑制AMPK 可以促进GATA3 上调,通过诱导脂质积累,促进肿瘤细胞增殖。目前在食管鳞癌研究中指出,AMPK 可以与SIRT1 协同作用调节脂质代谢[17],但具体机制尚未阐明。
目前AMPK 在食管鳞癌脂质代谢重编程中的研究较少,同时新疆哈萨克族又是食管鳞癌高发民族,结合本研究AMPK 在哈萨克族食管鳞癌中的表达特点,值得我们进一步深究。

