FeCl3改性活性炭的制备、表征与吸附性能研究
林德鑫,衣雪松
(海南大学 生态与环境学院/海南省农林环境过程与生态调控重点实验室,海口 570228)
工业化进程的加速,对染料的需求日益增强。据统计,每年约有700万t的染料废水未经处理直接排放,对水环境、水生态、水资源带来了巨大的危害,并严重危害着人类的健康[1]。为解决这一问题,科学家采用混凝、电化学、光催化、膜过滤、生物以及吸附等多种方法对水中的染料进行了去除研究[2]。然而,这些方法普遍存在各自的技术弱点,如膜过滤成本高,生物处理效率低,电化学处理能耗大[3-4]等,因此,开发环保、廉价、高效的染料废水处理技术势在必行[4]。活性炭具有比表面积大和孔隙结构复杂,能有效去除色度、臭味物质、部分离子和大多数有机物质[5-7],但普通活性炭的吸附效率偏低,再生困难,制约了其工业化应用[8],一般需要对其进行改性处理。金属离子改性是一种常用的活性炭改性方法,它具有简单、廉价且能显著提高吸附能力的特点[9-10]。通常,人们会通过将金属离子、金属螯合物等负载到普通活性炭,制备出结构更加优良、官能团更丰富的新型吸附剂。有研究表明[11],通过金属离子修饰后的活性炭对去除水中碘、磷酸盐和硝酸盐等污染物较普通活性炭优势明显,但利用FeCl3对活性炭进行修饰,用于染料废水中亚甲基蓝的去除研究尚未见类似报道。因此,本研究以海南省大量存在的农业废弃物槟榔残枝和污水厂废弃污泥为原料,制备出了普通活性炭,并通过对其利用FeCl3的负载修饰,大大提升了吸附性能,实现了对废水中亚甲基蓝的高效去除。本研究通过对活性炭修饰FeCl3前后的表面形貌、官能团种类和比表面积等的差异分析,吸附等温线模拟,吸附动力学和吸附热力学参数求取等,考察了亚甲基蓝在两种活性炭上的吸附特性,探讨了其吸附机理,本研究的目的是通过利用对FeCl3普通活性炭进行功能化修饰,实现活性炭的化学改性,优化活性炭的理化性质,提高其吸附能力,为染料废水中污染物的高效去除提供科学依据。
1 材料与方法
1.1 活性炭的制备污泥来源于海口市白沙门污水处理厂的剩余污泥(Municipal sludge, MS),槟榔来源于琼中县槟榔残枝(Betel nut, BN)。对上述材料进行清水洗涤,置于(105± 5)℃烘箱中干燥24 h,将干燥后的槟榔和污泥按质量比1∶1混合;破碎后过0.15 mm筛,即得槟榔和污泥混合物;将该材料置于2.0 mol·L-1H3PO4溶液中浸泡24 h,再次置于105 ℃的烘箱干燥12 h。此后,在惰性气氛 (N2) 的管式炉中,以30 ℃·min-1的升温速率升温至600 ℃,热解60 min。待自然冷却至室温后,利用1 mol·L-1的HCl溶液浸泡,并用蒸馏水清洗至中性。最后将上述样品置于105 ℃烘箱中干燥12 h,即可制得粉末活性炭(activated carbon,AC)。
将所得粉末AC加入100 mL0.5 mol·L-1FeCl3溶液的锥形瓶中,封口后放置恒温水浴摇床中以180 r·min-1的振荡速率在60 ℃下振荡24 h,过滤后在105 ℃的烘箱中烘干。最后置于氮氛围的管式炉中,于300 ℃下热解60 min,可得FeCl3修饰的活性炭,(FeCl3-loaded activated carbon,FAC)。
1.2 实验仪器与试剂FTIR-ATR光谱仪(日本岛津),Verios G4 UC场发射扫描电子显微镜(SEM,Thermoscientific, 美国),比表面积分析仪(ASAP 2 460,Micromeritics,美国),X射线光电子能谱仪(AXIS SUPRA,日本岛津)。亚甲基蓝(Methylene blue,MB,国药集团化学试剂有限公司),FeCl3、HCl、NaOH、H3PO4(AR,广州化学试剂公司)。
1.3 活性炭的表征与方法官能团采用衰减全反射率(ATR)法由傅里叶红外光谱仪(FTIR-ATR)测定,光谱分辨率为8 cm-1,扫描范围约400~4 000 cm-1。活性炭的形态结构用场发射扫描电子显微镜(SEM)观察,采用溅射技术喷金。活性炭表面元素用X射线光电子能谱(XPS)测定。比表面积利用物理吸附分析仪分析,载气为N2,分析池的温度为77K。测试前,样品在300 ℃的真空下脱气21 h,以消除孔隙中吸附的任何水分和气体分子。亚甲基蓝值(MB)按国标法(GB/T 12 496.8—2015)测定。
1.4 FAC吸附实验取0.15 g的AC和FAC放入50 mL亚甲基蓝水溶液(250 mg·L-1)中振荡24 h,测定溶液中亚甲基蓝的浓度,所有吸附实验平行进行3次,以获得平均报告值。根据式(1)和式(2)计算染料吸附在吸附剂上的量Qe(mg·g-1) 和吸附效率 (AE,%) :
式中,C0:溶液中亚甲基蓝的初始浓度,mg·L-1;Ce:平衡时刻亚甲基蓝的浓度,mg·L-1;V:溶液体积,L;M:吸附剂质量,g;Qe:吸附在吸附剂上的亚甲基蓝量,mg·g-1;AE为MB的吸附效率,%。
采用拟一级和拟二级动力学模型对吸附过程进行动力学研究。一级 (3) 和二级 (4) Lagergren模型的公式分别如下:
式中,Qe:平衡时吸附在活性炭上的MB量,mg·g-1;Qt:初始时间点吸附在活性炭上的MB量,mg·g-1;t:吸附时间, min;k1:一级速率常数,1·min-1;k2:二级速率常数,g·(mg·min)-1。
采用2种不同的Langmuir和Freundlich等温线模型拟合吸附平衡等温线。Langmuir (5) 和Freundlich (6) 等温模型的公式分别如下:
式中,Qe:溶液中的平衡染料浓度,mg·L-1;在Langmuir模型中,Qm:最大单分子层吸附容量,mg·g-1;a:朗缪尔常数,L·mg-1;KF:Freundlich常数, mg·g-1;1/n:Freundlich吸附强度参数。
温度对吸附的影响可以用热力学参数阐明吸附过程,热力学参数的值由公式计算得到:
式中,ΔG:标准吉布斯自由能,(kJ·mol-1) ,ΔG< 0,反应自发;ΔS[J·(K·mol)-1]:熵变,J·(K·mol)-1;ΔH:焓变,(kJ·mol-1) ;T:溶液温度, K;Kd:平衡系数;R:气体常数,8.314 J·(mol·K)-1。
2 结果与分析
2.1 活性炭的形态结构表征
2.1.1 活性炭的表面形态AC和FAC的表面形貌如图1所示。 AC的形貌结构较为简单和平滑,有一定量的孔隙结构。究其原因,可能是共热解过程以及活化剂的影响下,加速了混合原材料的腐蚀以及结构化而产生的[4]。与AC相比,FAC的表面粗糙、不规则,孔隙结构复杂,孔隙数量增多,表明Fe3+的添加,一方面促使活性炭的结构发生了重组,同时Fe3+与AC表面官能团发生化学反应而修饰其上,使其结构更为复杂,而粗糙的表面结构和多孔性有利于亚甲基蓝在活性炭中的扩散[12]。

图1 AC (a) 和FAC (b) 的SEM 图
2.1.2 活性炭的比表面积及孔隙分布分析采用氮气吸附/解吸等温线计算样品的比表面积。FAC样品的氮气吸附/解吸等温线的详细分析如图2所示。FAC的迟滞回线位于相对压力0.5~1.0范围内,出现的窄缝状曲线被分类为H4型,可能是氮气引起活性炭中毛细管凝结,且该现象缓慢增加,表明FAC有中孔结构的存在[13]。如图2-b所示,孔径在6 ~ 50 nm处出现一个宽峰,说明FAC的孔径大多小于50 nm。AC和FAC的化学结构和理化性能见表1。相比于AC,FAC的比表面积、总孔体积、微孔体积和孔径结构都有一定的增加,为亚甲基蓝提供了更多的吸附位点[14]。Fe3+的添加破坏活性炭的孔隙结构,使其获得更大的比表面积。Fe3+主要沉积在大中孔内,使孔径结构发生变化,且中微孔数量增多[5]。

表1 AC和FAC的多孔结构参数
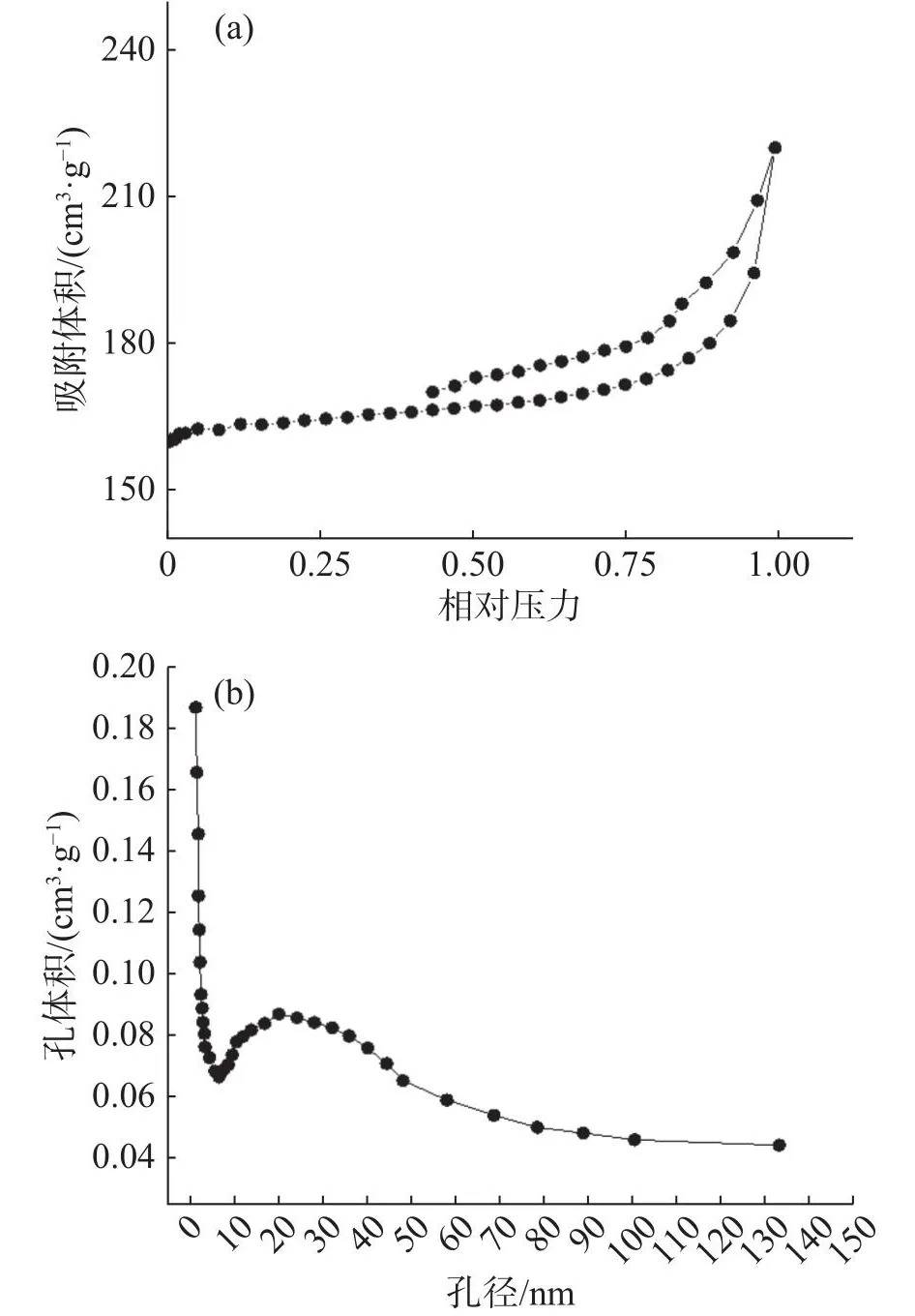
图2 FAC的N2吸附-脱附曲线 (a) 及孔径分布曲线 (b)
2.2 活性炭的光谱表征
2.2.1 表面官能团分析Fe3+使活性炭表面化学性质和孔结构发生变化,与此同时污染物在改性活性炭上的吸附容量也发生了重大的变化[15]。通过红外光谱技术 (FT-IR) 确认两种吸附剂表面的官能团,并分析2种活性炭表面化学性质的差异,所得结果如图3所示。FT-IR光谱显示活性炭在3 000~3 700 cm-1处具有宽吸收峰,其归因于-OH基团或醛,表明AC表面存在一些羟基。1 624 cm-1处的特征峰对应于芳香族的C=C官能团或者酮和酰胺中的C=O官能团的伸缩振动。特征峰值出现在1 405 cm-1处,表明存在羧酸根(O=C-O)的伸缩振动。1 018 cm-1处的特征峰对应于C-O官能团的伸缩振动。

图3 AC和FAC的FT-IR 图谱[16]
通过Fe3+负载后,FeCl3-活性炭(FAC)的红外光谱结果与AC有着明显的差异,如图3所示[16]。其中,1 645 cm-1和1 377 cm-1、1 034cm-1范围的峰强度明显减小,1 624 cm-1、1 405 cm-1和1 018 cm-1的特征峰向1 645 cm-1、1 377 cm-1和1 034 cm-1偏移。这可能是负载的Fe3+与活性炭上的官能团(- OH,-C=O和- COOH)产生络合作用,导致吸光度下降,并形成 -(COO)n-Fe,-(CO)n-Fe和- On- Fe等含铁产物[7]。此外,FeCl3-活性炭(FAC)在约471 cm-1处出现了1条新的吸附峰,该处存在Fe-O和FeOOH拉伸振动带,这是Fe3+修饰活性炭的典型基团[17]。这些结果表明Fe3+附着在活性炭表面和孔结构,提供更多的吸附位点,有利于吸附大量的污染物[9]。
2.2.2 X射线光电子能谱分析活性炭表面是否含有铁元素,可以通过X射线光电子能谱进一步分析判别[16](图4)。 在X- 射线光电子能谱全谱(图4-a)中,与AC相比,在705~730 eV的FAC上出现了Fe 2p的光谱峰,而AC则没有出现这个光谱峰,表明FAC 上有铁元素的存在;从图4-b可以明显看出FAC在710 eV处出现了Fe 2p的光谱峰,AC则没有明显的光谱峰,这同样可以推知三价铁离子已经成功固载到活性炭上[10]。
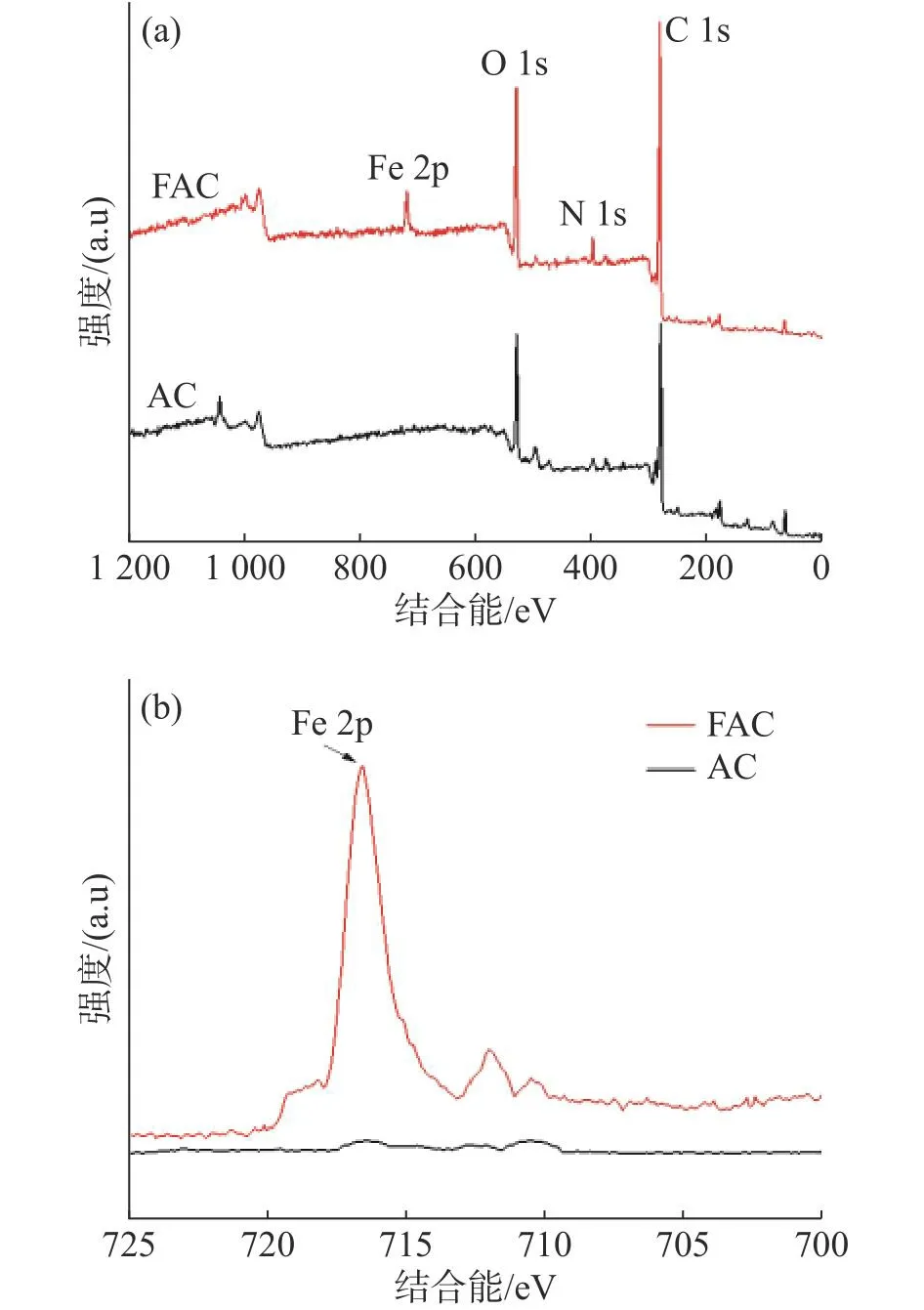
图4 AC和FAC的XPS谱图
2.3 操作因素对吸附的影响机制
2.3.1 pH对吸附性能的影响如图5所示,研究溶液的pH值对MB 吸附容量的影响。pH值的变化会影响AC表面的净电荷和吸附能力。在pH值为7.0时,MB对AC和FAC的吸附值分别为54.48和75.27 mg·g-1。当pH值为 4.0 时,MB对AC和FAC的吸附值分别降至45.32和59.56 mg·g-1。当pH值为10时,MB 对AC和FAC的吸附值分别为64.63和96.72 mg·g-1,FAC吸附性能明显高于AC。究其原因,可能是在酸性pH条件下,AC表面带有正电荷会与阳离子MB之间产生相互排斥,进而阻碍吸附过程,而在碱性条件下会发生静电相互作用。这些相互影响会促进或阻碍吸附过程[18]。
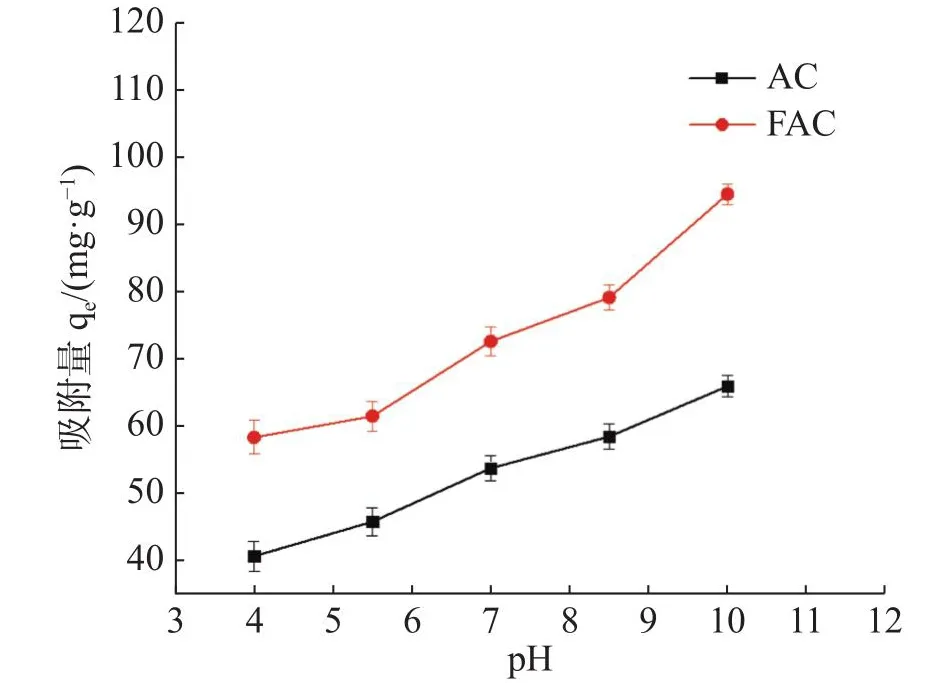
图5 溶液的pH对AC和FAC吸附MB的影响
2.4 吸附实验
2.4.1 吸附动力学吸附动力学主要用于研究吸附速率随时间的变化[18]。在25 ℃下,AC和FAC对MB的吸附动力学曲线如图6所示。活性炭的吸附量随时间增加而增加,到达24 h吸附趋于平衡;在360 min内,AC和FAC的吸附量分别为 86.95 mg·g-1和208.09 mg·g-1,吸附速率分别为34.78%和83.2%。
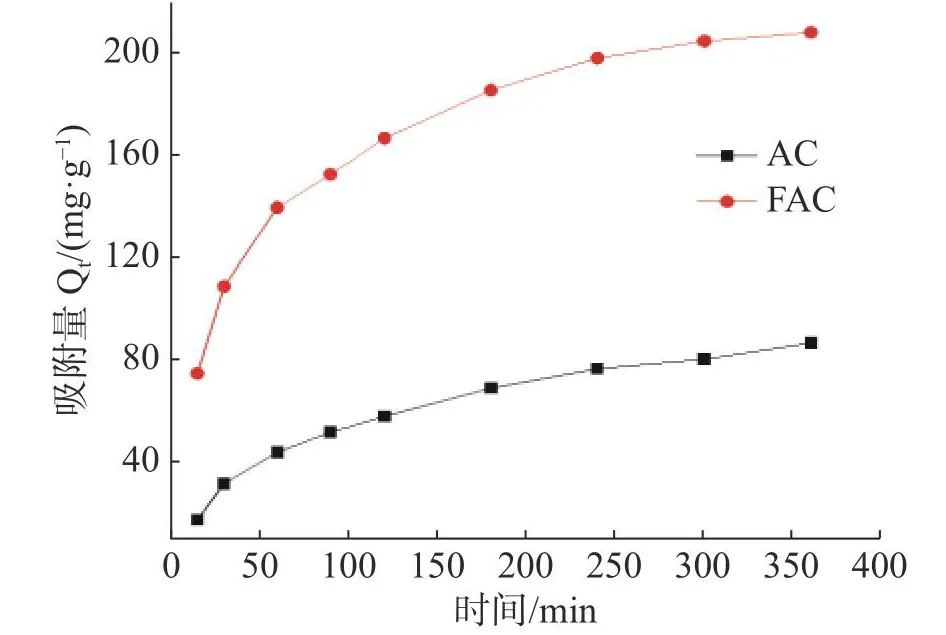
图6 AC和FAC的吸附动力学曲线
为了进一步认识吸附动力学特征,笔者采用2种动力学模型来拟合MB在AC和FAC上的吸附过程[19]。通过线性拟合,得出这些模型的参数和相关系数 (R2),如表2所示。二阶动力模型对AC和FAC的吸附过程拟合较好,相关系数R2>0.99,表明吸附速率与污染物浓度成正比。而FAC的K值为 0.000 16 g·(mg·min)-1,显示出良好的吸附效率。如表2所示,FAC的吸附平衡量为215.10 mg·g-1与360 min的实测值208.09 mg·g-1相近。
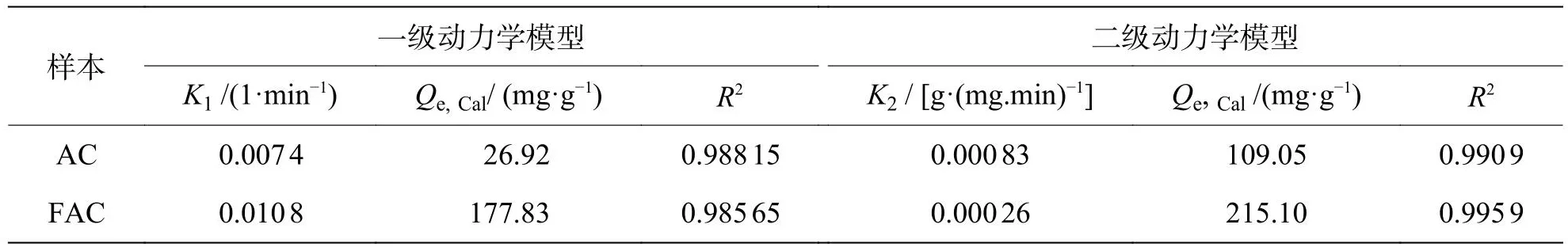
表2 MB在AC和FAC上的吸附过程的一级和二级动力学参数
2.4.2 吸附等温线采用吸附等温线模型对MB在活性炭上的吸附平衡过程进行数据拟合。吸附等温模型的研究对吸附平衡数据的分析具有重要意义,其结果提供了吸附剂活性位点上可能发生的吸附现象的信息[20]。维持温度不变的情况下,吸附质与液体中物质分子达到平衡浓度时的关系既是吸附等温线。在25 ℃条件下AC和FAC上的吸附等温线如图7所示。应用Langmuir模型对AC和FAC样品的吸附结果如表3所示。制备的2种活性炭与Langmuir等温线的实验值具有极好的相关系数(R2> 0.99),而且高于Freundlich模型。2种材料吸附MB的拟合曲线与Langmuir吸附等温线高度吻合,这表明该染料试剂在2种材料上的吸附是一个复杂的过程,主要以均匀的表面和单层吸附去描述活性炭吸附过程,而没有考虑吸附质分子之间的相互作用。FAC在该温度下的最大吸附容量 (341.1 mg·g-1) 明显高于AC(123.22 mg·g-1),表明FAC比AC具有更好的 MB吸附能力。FeCl3的改性可能会增加活性炭表面的吸附位点数量,导致2种活性炭的Langmuir等温线常数a显著不同。
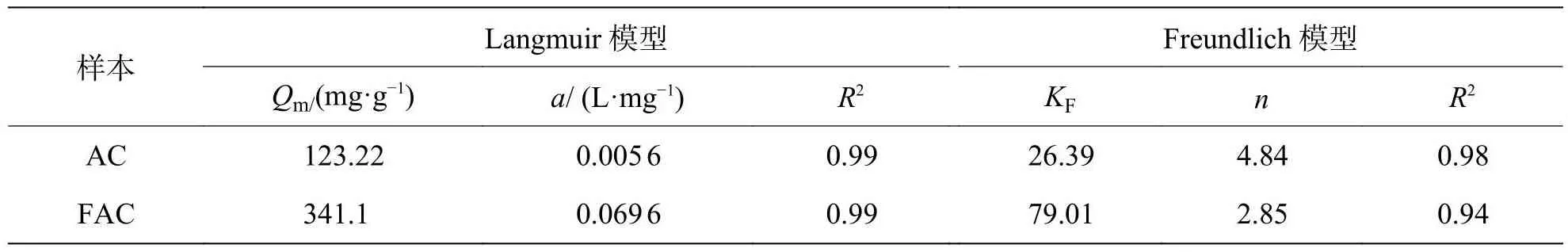
表3 Langmuir和Freundlich等温线模型的参数
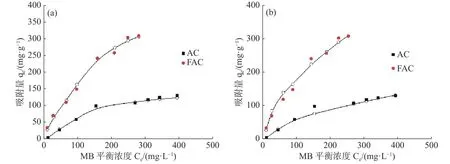
图7 25 ℃条件下AC和FAC的Langmuir (a) 和Freundlich (b) 吸附等温线
2.4.3 吸附热力学如表4所示,AC和FAC的ΔG值均为负值,表明吸附质在溶液中转移到吸附剂表面是自发的过程[17]。而AC和FAC的ΔH值均为正值 (AC和FAC分别为20.05和73.33 kJ·mol-1),表明为吸热吸附过程,ΔG随温度的变化趋势证明了这一点。随着温度的升高ΔG值也随之增大,说明随着温度的升高,AC和FAC对MB的吸附能力更强。此外,AC和FAC对该吸附过程的ΔS值分别为45.41和202.01 J· (mol· K)-1,表明MB分子在活性炭上的吸附是吸热的,且在吸附过程中的随机性增加。
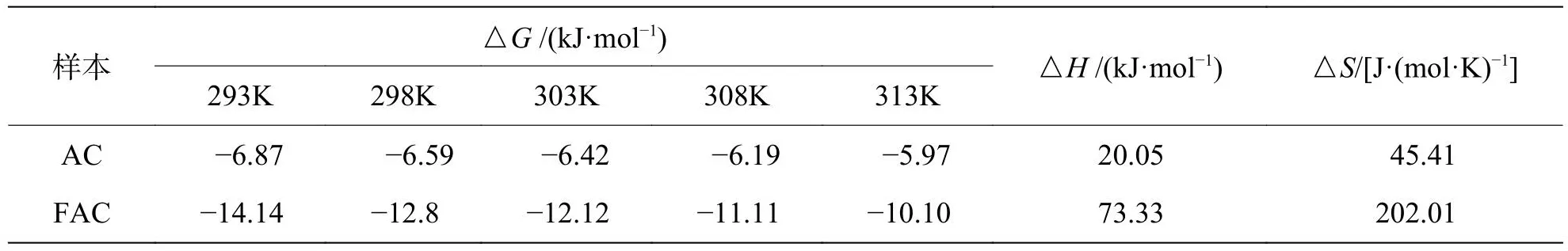
表4 AC和FAC吸附MB的热力学参数
3 讨 论
活性炭是一种优质的污染物吸附剂,其中影响活性炭去除污染物的重要因素有比表面积、孔径以及表面官能团等特性[21]。根据活性炭的表面形貌观察得知,FAC的孔径和表面结构发生了显著变化,表面更加粗糙、不规则,孔隙数量增多,吸附位点增加。这可能是Fe3+的添加促使活性炭的结构发生了重组,同时Fe3+进入到活性炭的孔隙内部,导致碳壁氧化,孔径增大以及孔隙率增加。因此,FAC粗糙的表面结构、多孔特性,以及足够的吸附位点,有利于大量的MB分子在FAC中的扩散。此外,Fe3+改性后活性炭的表面积、孔体积以及孔径都有一定程度的增加。
根据FTIR光谱表明,通过活性炭表面的-OH官能团与MB的N原子形成氢键[19],以及C-O官能团与MB的芳环之间的π-π键相互作用,来促进MB的吸附[13]。从图3可以明显看出,活性炭在3 000~3700 cm-1处具有宽吸收峰,表明在FAC表面上存在-OH;而在1 018 cm-1处的吸收峰出现,表明FAC拥有C-O官能团。这些O-H和C-O官能团通过氢键相互作用和π-π键相互作用将MB分子转移到其表面上[22]。
此外,FAC的吸附机制也受到静电相互作用的影响[4,6]。MB分子在水溶液中呈现正电状态。当pH处于 较低状态,水溶液中的H+浓度相对较高,H+会与FAC 表面的-OH形成 OH2+,使得FAC呈现正电状态,会与阳离子MB之间产生相互排斥,进而阻碍吸附过程;并且 H+也会与阳离子MB出现竞争吸附。随着pH值的不断上升,H+含量不断下降,在碱性条件下,FAC会与MB分子发生静电相互作用。因此,MB在FAC上的吸附机理主要是比表面积和孔结构、氢键相互作用和π-π键相互作用,以及在碱性条件下的静电相互作用。
4 结 论
利用剩余污泥和槟榔残枝为材料制备出AC,并通过将FeCl3修饰其上,形成新型强吸附性能的FAC。研究发现经Fe3+修饰后的FAC,较AC的比表面积、总孔体积、表面粗糙度等均有一定的提高。活性炭的MB吸附量随pH值的增加而升高,且当pH值高于7时,吸附容量提高显著。AC和FAC对MB的吸附过程均符合Langmuir等温吸附模型 (R2> 0.99),AC和FAC的饱和吸附量分别为123.22和340.1 mg·g-1。AC和FAC对亚甲基蓝的吸附过程均符合二级吸附动力学模型,相关系数R2都高达0.99。AC和FAC的吸附热力学参数ΔH值 (分别为20.05和73.33 kJ·mol-1)均为正值,且ΔH分别为45.41和73.33 J·(mol·K)-1,表明该吸附过程均为自发的吸热过程。鉴于FAC的制备方法简单,原料易得,因此认为,FAC可以作为一种有应用前景的废水处理吸附剂。

